Перейти к:
Дисгликемия при COVID-19 и сахарном диабете 2 типа: особенности гликемического профиля у госпитализированных пациентов и роль стероид-индуцированных нарушений
https://doi.org/10.14341/probl12840
Аннотация
ОБОСНОВАНИЕ. В литературе недостаточно данных относительно подтвержденных результатами непрерывного мониторирования глюкозы (НМГ) особенностей дисгликемии у госпитализированных больных COVID-19 ссопутствующим сахарным диабетом 2 типа (СД2).
ЦЕЛЬ. Изучить особенности гликемического профиля госпитализированных больных COVID-19 и сопутствующим СД2 по данным НМГ, оценить значение стероидной терапии в генезе дисгликемии.
МАТЕРИАЛЫ И МЕТОДЫ. Обследован 21 пациент с COVID-19 и СД2 (основная группа), а также 21 пациент с СД2 без COVID-19 (контрольная группа) с помощью профессионального 4–7-дневного НМГ. Также сравнили две подгруппы больных с COVID-19 и СД2: 1) пациенты, получавшие системные глюкокортикостероиды (ГКС) во время проведения НМГ и 2) пациенты, которым НМГ проводилось после отмены ГКС.
РЕЗУЛЬТАТЫ. В группе больных COVID-19и СД2 по сравнению с контролем отмечался меньший процент времени гликемии в целевом диапазоне (32,7±20,40vs48,0±15,60%; р=0,026), были повышены показатели средней гликемии (p<0,05), но не различались доли больных с эпизодами гипогликемий (33,3% vs 38,1%; р=0,75). При этом больные, получавшие дексаметазон во время НМГ, характеризовались более высокой гипергликемией и отсутствием эпизодов гипогликемий. У больных, которым НМГ проводилась после отмены дексаметазона, гипергликемия была менее выраженной, но у 60% из них выявлялись эпизоды гипогликемии, часто — ночные, клинически значимые и не выявленные рутинными методами.
ЗАКЛЮЧЕНИЕ. Больные COVID-19 и СД2 отличаются выраженнойустойчивой гипергликемией, однако третьиз нихимеютэпизоды гипогликемии. Во время терапии дексаметазоном отмечается наиболее выраженная гипергликемия, безэпизодов гипогликемии. У больных, которым НМГ проводилось после отмены дексаметазона, гипергликемия менее выражена, но у 60% из них выявляются эпизоды гипогликемии, часто — ночные, клинически значимые и не диагностированные рутинными методами.Было бы целесообразно рекомендовать как минимум 5–6-кратное исследование уровня глюкозы крови (с обязательной ее оценкой в ночное время) даже стабильным больным с сочетанной патологиейпосле окончания лечения ГКС.
Ключевые слова
Для цитирования:
Стронгин Л.Г., Некрасова Т.А., Беликина Д.В., Корнева К.Г., Петров А.В. Дисгликемия при COVID-19 и сахарном диабете 2 типа: особенности гликемического профиля у госпитализированных пациентов и роль стероид-индуцированных нарушений. Проблемы Эндокринологии. 2022;68(2):56-65. https://doi.org/10.14341/probl12840
For citation:
Strongin L.G., Nekrasova T.A., Belikina D.V., Korneva K.G., Petrov A.V. Dysglycemia in COVID-19 and Type 2 Diabetes Mellitus: Peculiarities of the Glycemic Profile in Hospitalized Patients and the Role of Steroid-Induced Disorders. Problems of Endocrinology. 2022;68(2):56-65. (In Russ.) https://doi.org/10.14341/probl12840
ОБОСНОВАНИЕ
Сахарный диабет (СД) считается одним из самых частых и клинически значимых коморбидных состояний у больных COVID-19, среди которых он выявляется в 15% случаев [1] и ассоциируется с более чем двукратным увеличением риска тяжелого течения болезни [2][3].
Развитие COVID-19 на фоне СД ведет к нарастанию выраженности дисгликемии, имеющей самостоятельное негативное влияние на прогноз [3–8], что справедливо в отношении как гипер [4][6][7], так и гипогликемии [5][8][9].
Усугубление гипергликемии при сочетанной патологии объясняют комплексом факторов [10–13], включая изначально худший метаболический статус с хроническим нарушением углеводного обмена, ожирением и связанным с ними низкоинтенсивным воспалением, увеличение инсулинорезистентности из-за активации воспаления при инфицировании, непосредственное повреждение β-клеток вирусом SARS-CoV2. В свою очередь, гипергликемия ведет к ухудшению иммунной защиты от инфекций [14], сопряжена с недостаточной эффективностью патогенетической терапии COVID-19 (в том числе, биологической) [15], ассоциируется с рисками электролитных нарушений, дегидратации и гиперосмолярных состояний [3], что суммарно увеличивает ее негативное влияние на прогноз.
Гипогликемия потенциально не менее опасна, особенно с учетом обусловленного ею повышения активности катехоламинов с увеличением риска аритмий и миокардиальных повреждений [3], и так характерных для COVID-19 [16–18]. Условия, способствующие возникновению гипогликемии, достаточно часто складываются при ведении больных с сочетанием COVID-19 и СД: с одной стороны, пациентам нередко требуется интенсификация инсулинотерапии, с другой — возможны нарушения режима питания, особенно в тяжелых случаях. Однако в настоящее время мало исследований, где оценивались бы частота, последствия и провоцирующие факторы гипогликемии в условиях COVID-19 в реальной клинической практике.
Особой ситуацией являются инициация, проведение и окончание терапии глюкокортикостероидами (ГКС), что подразумевает колебания степени инсулинорезистентности и дополнительный риск усугубления дисгликемии, в первую очередь стероид-индуцированной гипергликемии. Сейчас разрабатываются подходы к ее профилактике и лечению при COVID-19, однако имеющиеся инструкции в значительной степени базируются на экспертном мнении специалистов; при этом недостаток посвященных данной проблеме научных исследований подчеркивается, в том числе, авторами упомянутых рекомендаций [19].
Очевидно, что текущая клиническая ситуация требует дальнейшего изучения распространенности, характерных особенностей и триггеров нарастания дисгликемии у больных с сочетанием COVID-19 и СД, в том числе при лечении системными ГКС.
Поставленная задача предполагает тщательный и длительный контроль уровня глюкозы в биологических жидкостях, для чего может быть применена технология непрерывного мониторирования гликемии (НМГ). Отметим, что в условиях пандемии технологии НМГ оказались очень востребованы, но больше в плане удаленной оценки гликемии при СД (что важно при карантинных ограничениях) либо в качестве альтернативы традиционным частым заборам крови у тяжелых больных COVID-19 в отделении интенсивной терапии (ОРИТ) [20–25].
В то же время не хватает подтвержденных результатами НМГ научных данных относительно особенностей дисгликемии у госпитализированных больных COVID-19 и сопутствующим СД, которые получают стандартную терапию (в том числе, ГКС) в условиях общего отделения инфекционного стационара.
ЦЕЛЬ ИССЛЕДОВАНИЯ
С учетом указанных предпосылок, была определена цель настоящего исследования: изучить особенности гликемического профиля у госпитализированных больных с COVID-19 и сопутствующим сахарным диабетом 2 типа (СД2) по данным НМГи значение стероидной терапии в генезе дисгликемии.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения. Государственное бюджетное учреждение здравоохранения Нижегородской области«Городская клиническая больница №13 Автозаводского района города Нижнего Новгорода».
Время исследования. Набор пациентов осуществлялся в период с июня 2020г. по февраль 2021 г.
Изучаемые популяции (одна или несколько)
В исследовании участвовали две популяции больных: 1) больные с COVID-19 и сопутствующим СД2 типа (основная группа) и 2) больные с СД2 типа без COVID-19 (группа сравнения).
Основная группа. Критерии включения в основную группу: 1) наличие COVID-19, подтвержденного результатами ПЦР, 2) госпитализация в общее отделение на базе многопрофильного стационара, перепрофилированного в инфекционный госпиталь для лечения больных COVID-19, 3) наличие сопутствующегоСД2 типа. Критерием исключения был отказ от участия в исследовании и/или от проведения НМГ.
Группа сравнения. Критерии включения в контрольную группу: 1) наличие СД2, 2) госпитализация в эндокринологическое отделение многопрофильного стационара для подбора оптимальной сахароснижающей терапии. Критерием исключения был отказ от участия в исследовании и/или от проведения НМГ.
Способ формирования выборки из изучаемой популяции (или нескольких выборок из нескольких изучаемых популяций)
Основная группа формировалась путем сплошного включения наблюдений: в нее последовательно попадали все больные с COVID-19 и СД2, получавшие стационарное лечение в перепрофилированном в инфекционный стационар эндокринологическом отделении, которые соответствовали критериям включения и не имели критериев исключения из исследования.
Контрольная группа была сформирована методом подбора пар к наблюдениям первой выборки. Она была подобрана из числа больных СД2 типа, проходивших НМГ в условиях того же отделения и с применением того же оборудования, но вне периода его перепрофилирования в инфекционный стационар. При формировании пар учитывались пол, возрастная декада и округленный до единиц уровень гликированного гемоглобина (HbA1c).
Дизайн исследования
Проведено одноцентровое открытое динамическое проспективное сравнительное двухвыборочное исследование, в ходе которого сравнивались результаты НМГ пациентов с СД2, имевших и не имевших COVID-19.Кроме того, на втором этапе работы сравнили две подгруппы больных с COVID-19 и СД2: 1) пациенты, получавшие системные ГКС во время проведения НМГ и 2) пациенты, которым НМГ проводилось после отмены ГКС.
Описание медицинского вмешательства (для интервенционных исследований)
Всем больным выполнили профессиональное 4–7-дневное НМГ. Применявшаяся технология не позволяла оценить уровень глюкозы в режиме реального времени и провести дополнительные коррекционные мероприятия, но давала возможность ретроспективно выявить нарушения гликемического контроля в условиях рутинной терапии. НМГ стартовало на 1–18-й день пребывания в стационаре (в среднем 7,5±7,30 суток госпитализации).
Методы
При определении критериев включения диагноз COVID-19 ставился на основании: 1) положительных результатов ПЦР, 2) наличия вирусного пневмонита клинически и по результатам компьютерной томографии (КТ). Диагноз СД2 у госпитализированных пациентов с COVID-19 должен был быть подтвержден комплексом факторов, включая повышение уровня HbA1с при госпитализации, гликемический профиль пациента при поступлении и в динамике (в том числе, после окончания терапии ГКС), а также наличие данного заболевания в анамнезе у части больных.
Всем участникам исследования проводилось профессиональное НМГ в слепом режиме с помощью системы постоянного мониторинга i-PRO-2, разработанной компанией Medtronic. По НМГ оценивали средние показатели гликемии (днем, ночью, за 24 ч, в 3-часовых интервалах в течение суток), продолжительность (% времени) сохранения гликемии в целевом диапазоне, выше и ниже него. При этом целевыми считали показатели гликемии в пределах 6–10 ммоль/л, которые признаются оптимальными для сочетания COVID-19 и СД отечественными и иностранными экспертами [19][26]. Гипогликемию 1 и 2-го уровня диагностировали в соответствии с международными рекомендациями [27]. Определяли наличие, время возникновения, продолжительность гипогликемии, оценивали процент времени сохранения гликемии в диапазоне <3,9 ммоль/л. Определяли вариабельность гликемии по коэффициентам вариации, стандартному отклонению и показателю средней амплитуды колебаний гликемии (meanamplitudeofglycemicexcursions, или MAGE).
Проводились измерения уровня глюкозы на стационарном анализаторе, кратность которых определялась конкретной клинической ситуацией. Уровень НbА1с определяли при поступлении пациента в стационар на приборе NycoCardReaderII.
Статистический анализ
При статистической обработке применяли пакеты программ Statistica 8.0 и MedCalc. Для сравнения количественных данных в двух независимых выборках использовали критерий Манна-Уитни, качественных данных — Хи-квадрат и Фишера, для оценки корреляционных связей — критерий Спирмена. При описании выборок использовали среднее ± квадратическое отклонение (М±S). Различия считали достоверными при р≤0,05.
Этическая экспертиза
Проведение исследования было одобрено ЛЭКГБУЗ НО «Городская клиническая больница №13 Автозаводского района города Нижнего Новгорода» 06 июня 2020 года (протокол № 07/20).
РЕЗУЛЬТАТЫ
Описание выборок
За время исследования в основную и контрольную группу было включено по 21 больному.
Больные основной (COVID-19 в сочетании с СД2) и контрольной групп (СД2) ожидаемо не различались по полу (мужчин — по 7 (33,3%) в каждой группе; р=1,00), возрасту (64,3±8,50 и 62,3±5,96 года; р=0,333), уровню НbА1с (9,8±2,09 и 9,6±1,82%; р=0,670), а также по индексу массы тела (30,7±5,15 и 29,2±5,83 кг/м2; р=0,131). В обеих группах оказалось одинаковое число пациентов со стажем СД более 5 лет (по 16 человек, или по 76,2%; р=1,00). Основная и контрольная группы не различались по частоте выявления таких осложнений СД, как нефропатия (10 (47,6%) и 11 (52,4%); р=0,762), ретинопатия (7 (33,3%) и 11 (52,4%); р=0,213) и полинейропатия (16 (76,2%) и 11 (52,4%); р=0,110). Также группы были сопоставимы по распространенности наиболее значимых коморбидных состояний, включая артериальную гипертензию (17 (80,95%) и 16 (76,2%); р=0,714), ишемическую болезнь сердца (по 7 (33,3%) человек;р=1,00), острое нарушение мозгового кровообращения в анамнезе (по 1 (4,8%) больному; р=1,00), хроническую обструктивную болезнь легких (по 1 (4,8%) пациенту; р=1,00), заболевания желудочно-кишечного тракта (10 (47,6%) и 8 (38,1%) соответственно; р=0,533). Обе группы были сопоставимы по характеру сахароснижающей терапии, проводимой до госпитализации; в том числе инсулинотерапию исходно получали 13 (61,9%) больных в основной группеи 16 (76,2%) — в контрольной (р=0,317).Все пациенты основной и контрольной группы во время проведения НМГ находились на инсулинотерапии; ее базис-болюсный вариант был использован у 18 человек в каждой группе (по 85,7%). Из них базис-болюсную инсулинотерапию по схеме «инсулин средней продолжительности действия (НПХ) 2–3 раза в день + инсулин короткого действия перед завтраком, обедом и ужином» получали 13 (61,9%) человек в основной группе и 12 (57,1%) — в контрольной (р=0,76). Базис-болюсный режим по схеме «аналог инсулина длительного действия 1–2 раза в день + аналог инсулина ультракороткого действия перед завтраком, обедом и ужином» был использован соответственно у 5 (23,8%) и 6 (28,6%) пациентов (р=0,73). Оставшиеся получали инсулин средней продолжительности действия двукратно в сочетании с коррекционным введением инсулина короткого действия при необходимости. Средние суточные дозировки базального инсулина на момент проведения НМГ в основной и в контрольной группах наблюдения составили соответственно 28,6±12,26 Ед и 29,8±14,06 Ед (р=0,83), инсулина короткого действия — 37,4±18,43 Ед и 34,8±18,61 Ед (р=0,66). Больные основной группы получали терапию COVID-19 согласно актуальным на момент госпитализации стандартам; в том числе, всем пациентам назначались ГКС (у 10 из них данная терапия к моменту НМГ уже завершилась).
Нежелательных явлений в ходе исследования у пациентов основной и контрольной группы не наблюдалось.
На втором этапе работы сравнили две подгруппы больных с COVID-19 и СД2: 1) пациенты, получавшие системные ГКС во время проведения НМГ, и 2) пациенты, которым НМГ проводилось после отмены ГКС.
Анализ клинического материала показал, что из 21 больного основной группы ГКС на момент проведения НМГ получали 11 человек (10 — дексаметазон и 1 — метилпреднизолон), тогда как оставшиеся 10 завершили гормональную терапию за 1–5 дней до старта НМГ. Учитывая разницу в фармакокинетике применявшихся ГКС, на данном этапе работы было решено не включать в статистический анализ показатели НМГ единственного пациента, получавшего метилпреднизолон.
В итоге больные были разделены на две подгруппы: обследованные с помощью НМГ: 1) во время лечения дексаметазоном либо 2) после его отмены, с численностью по 10 пациентов в каждой; день старта НМГ в подгруппах 1 и 2 соответствовал в среднем 1,4±0,70 и 13,1±5,85 суткам госпитализации. Все вошедшие в подгруппу 1 получали дексаметазон в дозе 8–16 мг/сут внутривенно, в утренние часы.
Особенности гликемического профиля у пациентов с COVID-19 и сопутствующим СД2, госпитализированных в общее инфекционное отделение.
Результаты сравнительного анализа показателей гликемии у больных с СД2 типа, имеющих и не имеющих COVID-19, представлены в табл. 1.
Таблица 1. Показатели непрерывного мониторирования глюкозы у больных СД2 типа с и без COVID-19
Table 1. Indicators of continuous glucose monitoring in patients with type 2 diabetes with and without COVID-19
Признак | СД и COVID-19 | СД без COVID-19 | р |
Средняя гликемия днем ммоль/л | 12,0±2,77 | 10,0±1,81 | 0,012 |
Средняя гликемия ночью ммоль/л | 9,8±3,61 | 8,1±1,67 | 0,039 |
Средняя гликемия 24 ч ммоль/л | 11,2±2,93 | 9,4±1,80 | 0,023 |
% времени в целевом диапазоне (6-10 ммоль/л) | 32,7±20,40 | 48,0±15,60 | 0,026 |
% времени выше целевого диапазона (6-10 ммоль/л) | 55,7±28,30 | 36,3±19,40 | 0,024 |
% времени ниже целевого диапазона (6-10 ммоль/л) | 11,6±17,46 | 19,3±17,00 | 0,035 |
Станд. отклонение днем ммоль/л | 3,4±1,30 | 3,0±1,01 | 0,32 |
Станд. отклонение ночью ммоль/л | 2,8±2,63 | 2,2±0,72 | 0,80 |
Станд. отклонение 24 ч ммоль/л | 3,4±1,05 | 2,9±0,92 | 0,24 |
Коэфф. вариабельности днем % | 29,2±10,60 | 29,5±12,22 | 0,88 |
Коэфф. вариабельности ночью % | 26,8±13,97 | 27,1±9,69 | 0,60 |
Коэфф. вариабельности 24 ч % | 31,4±10,01 | 32,4±10,29 | 0,86 |
Индекс MAGE ммоль/л | 7,8±2,72 | 7,0±2,08 | 0,47 |
Доля пациентов с эпизодами гипогликемий, абс/% | 7 (33,3%) | 8 (38,1%) | 0,75 |
% времени ниже 3,9 ммоль/л | 2,25±4,35 | 5,4±6,36 | 0,16 |
Основополагающим отличием больных с COVID-19 от контроля стала значимо большая гликемия в любое время суток, при существенном удлинении продолжительности ее пребывания в диапазоне выше целевого, за счет укорочения нахождения в целевом диапазоне, а также в интервале ниже целевых значений (p<0,05 по всем перечисленным параметрам).
Все показатели НМГ, характеризующие вариабельность гликемии, не показали межгрупповых различий (p>0,05 для стандартных отклонений и коэффициентов вариации днем, ночью и в течение суток, а также параметра MAGE).
Эпизоды гипогликемии выявлялись более чем у трети больных в каждой из групп наблюдения (р=0,75). Подробнее условия, способствовавшие развитию эпизодов гипогликемии на фоне сочетанной патологии, будут рассмотрены ниже.
Факторы, взаимосвязанные с нарастанием гипергликемии у больных с сочетанием COVID-19 и СД2
Для выявления факторов, которые взаимосвязаны с нарастанием гипергликемии у больных с сочетанием COVID-19 и СД2, был проведен корреляционный анализ (табл. 2). Представленные в таблице данные подтверждают прямые корреляционные взаимосвязи между параметрами НМГ, характеризующими выраженность и стойкость гипергликемии, с одной стороны, и показателями тяжести COVID-19 и СД2, с другой стороны. Также обращают внимание прямые корреляционные взаимосвязи между степенью гипергликемии и проводимой терапией ГКС.
Таблица 2. Статистически значимые корреляции некоторых показателей НМГ с клиническими характеристиками пациентов в группе больных с СД2 и COVID-19
Table 2. Statistically significant correlations of some LMWH parameters with clinical characteristics of patients in the group of patients with DM2 and COVID-19
Показатель | R | p |
% времени выше целевого диапазона 6-10 ммоль/л | ||
Ожирение | 0,48 | 0,029 |
% пораж. легких по КТ исходно | 0,44 | 0,039 |
Сатурация О2 при поступлении | -0,48 | 0,029 |
HbA1c при поступлении | 0,65 | 0,003 |
Прием дексаметазона | 0,47 | 0,030 |
% времени в целевом диапазоне 6-10 ммоль/л | ||
% пораж. легких по КТ исходно | -0,59 | 0,008 |
Сатурация О2 при поступлении | 0,48 | 0,029 |
HbA1c при поступлении | -0,56 | 0,013 |
D-димер при поступлении | -0,51 | 0,021 |
Прием дексаметазона | -0,46 | 0,036 |
Средняя гликемия 24 ч | ||
Ожирение | 0,57 | 0,010 |
% пораж. легких по КТ исходно | 0,53 | 0,018 |
HbA1c при поступлении | 0,51 | 0,021 |
Прием дексаметазона | 0,45 | 0,038 |
Особенности гликемического профиля пациентов с COVID-19 и СД2, которым НМГ проводилась во время и после отмены терапии дексаметазоном
Далее были проанализированы особенности гликемического профиля пациентов с COVID-19 и СД2, которым НМГ проводилась во время и после отмены терапии дексаметазоном (табл. 3).
Таблица 3. Показатели непрерывного мониторирования глюкозы у больных СД с COVID-19, получающих и завершивших терапию дексаметазоном
Table 3. Indicators of continuous glucose monitoring in diabetic patients with COVID-19 receiving and completing dexamethasone therapy
Признак | После терапии дексаметазоном | Во время терапии дексаметазоном | р |
Средняя гликемия днем ммоль/л | 10,3±2,28 | 13,3±2,65 | 0,017 |
Средняя гликемия ночью ммоль/л | 7,8±2,14 | 11,2±4,17 | 0,034 |
Средняя гликемия 24 ч ммоль/л | 9,4±2,08 | 12,5±3,03 | 0,019 |
% времени в целевом диапазоне (6-10 ммоль/л) | 37,0±20,84 | 28,7±20,19 | 0,66 |
% времени выше целевого диапазона (6-10 ммоль/л) | 41,7±27,71 | 65,8±26,44 | 0,085 |
% времени ниже целевого диапазона (6-10 ммоль/л) | 21,6±21,38 | 5,3±10,15 | 0,053 |
Станд. отклонение 24 ч ммоль/л | 3,2±1,19 | 3,4±0,96 | 0,54 |
Коэффициент вариабельности сутки, % | 35,0±10,54 | 28,6±9,12 | 0,11 |
Индекс MAGE ммоль/л | 7,8±2,85 | 7,6±2,75 | 1,0 |
Доля пациентов с гипогликемиями, абс./% | 6 (60) | 0 (0) | 0,000 |
Ср. max гликемия ммоль/л | 15,8±3,68 | 20,9±2,09 | 0,005 |
Ср. min гликемия ммоль/л | 4,4±2,39 | 7,3±3,49 | 0,008 |
Пациенты, получавшие дексаметазон на момент НМГ, характеризовались большей гликемией в разное время суток, тенденциями к увеличению % времени ее нахождения выше целевого диапазона и к укорочению времени в интервале ниже оптимальных значений, при полном отсутствии зафиксированных эпизодов гипогликемии.
У пациентов, завершивших лечение дексаметазоном, сохранялись проявления гипергликемии (особенно в дневное время, когда средняя концентрация глюкозы выходила за верхнюю границу целевого диапазона). Однако выраженность гипергликемических нарушений по ряду показателей оказалась значимо меньшей, чем у лиц, получавших ГКС на момент НМГ. Кроме того, у 60% больных, завершивших лечение ГКС, выявлялись эпизоды гипогликемии по результатам НМГ, которые чаще всего не были диагностированы при рутинной контроле гликемии с помощью стационарного анализатора (имелся лишь один случай выявления легкой гипогликемии днем).
Особенности гликемических профилей в подгруппах больных с сочетанной патологией, получавших и завершивших лечение дексаметазоном, наглядно представлены на рисунке 1 (приводится оценка по средним уровням гликемии в 3-часовых интервалах на протяжении суток).
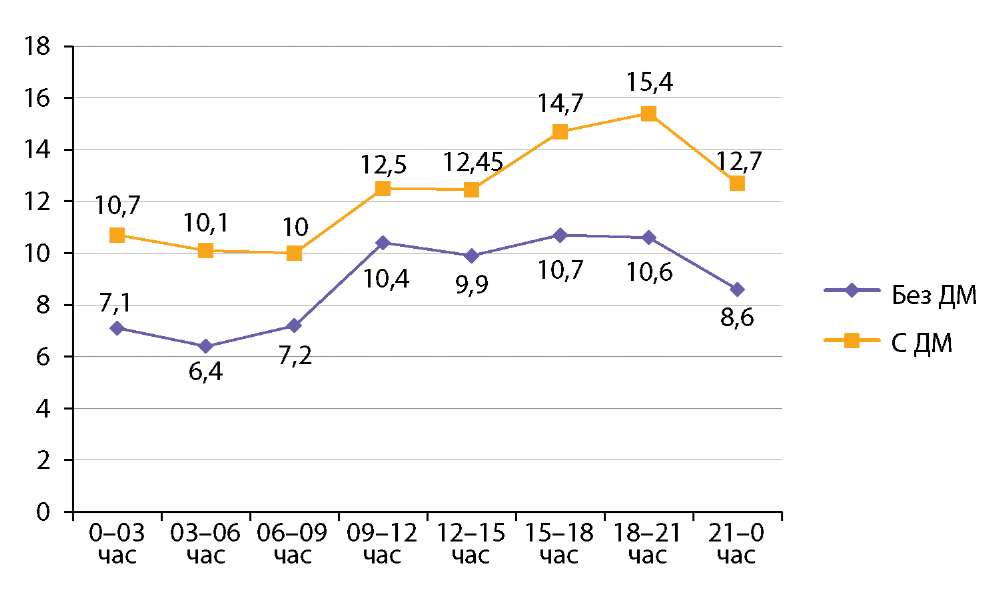
Рисунок 1. Показатели гликемии у больных с СД и COVID-19, у которых НМГ было проведено во время и после отмены лечения дексаметазоном (по средним уровням гликемии в 3-часовых интервалах на протяжении суток).
Figure 1. Glycemic parameters in patients with DM and COVID-19 who underwent LMWH during and after discontinuation of dexamethasone treatment (mean glycemic levels at 3-hour intervals throughout the day).
Примечание: p0–3 ч=0,004; p3–6 ч=0,001; p6–9 ч=0,012; p9–12 ч=0,123; p12–15 ч=0,063; p15–18 ч=0,007; p18–21ч=0,009; p21-0 ч=0,011. ДМ — дексаметазон
Особенности и условия возникновения эпизодов гипогликемии у пациентов с сочетанием COVID-19 и СД2
Эпизоды гипогликемии по результатам НМГ были выявлены у 7 из 21 пациента с сочетанной патологией (33,3%), что составляет треть обследованных и говорит о достаточно широкой распространенности гипогликемии в основной группе. При этом 6 (28,6%) больных имели эпизоды гипогликемии 2 уровня, со снижением концентрации глюкозы ниже 3 ммоль/л (у 4 ее минимальный уровень достиг 2,8 ммоль/л, у 2 — 2,7 ммоль/л). Преобладающими были ночные эпизоды гипогликемии, которые выявлялись у 6 пациентов (28,6% всех лиц с сочетанием COVID-19 и СД2).
Среди пациентов, находившиеся на терапии дексаметазоном на момент НМГ, эпизодов гипогликемии зафиксировано не было. У пациентки, получавшей метилпреднизолон, имелось 2 дневных эпизода гипогликемии (один из них — 2 уровня). Таким образом, чаще всего гипогликемия возникала у пациентов, которые завершили лечение ГКС до старта НМГ.
ОБСУЖДЕНИЕ
Репрезентативность выборок
Набор участников проводился только в ГБУЗ НО «Городская клиническая больница №13 Автозаводского района города Нижнего Новгорода», что ограничивает репрезентативность полученной выборки.
Сопоставление с другими публикациями
Больные основной и контрольной групп на момент поступления в стационар характеризовались одинаковой степенью декомпенсации СД, судя по значениям HbA1c (см. «Описание выборок»). Соответственно, более выраженная и стойкая гипергликемия в основной группе является изменением, которое обусловлено наличием COVID-19, и представляет собой характерную черту сочетанной патологии.
Даже в условиях стационара и проводимой инсулинотерапии, уровень гликемии у больных основной группы оставался в целевом диапазоне всего лишь на протяжении одной трети времени наблюдения (32,7±20,40%, см. табл. 1), что значительно ниже рекомендованных значений [28] и косвенно подтверждает сложность коррекции гипергликемии при СД2 и COVID-19, а также может способствовать ухудшению прогноза [14][15].
Высокая и стойкая гипергликемия у больных с сочетанием COVID-19 и СД2четко ассоциируется с худшей компенсацией СД на догоспитальном этапе (по HbA1c) и с большей тяжестью COVID-19 (по результатам КТ и показателям сатурации кислорода при поступлении, см. табл. 2).
Из применявшихся для лечения COVID-19 препаратов, только текущая терапия дексаметазоном обнаруживала достоверные корреляционные взаимосвязи с параметрами НМГ (прямые — со степенью гипергликемии и временем нахождения гликемии в диапазоне выше целевых значений, обратную — со временем ее пребывания в целевом интервале).
Нельзя исключить и роль ожирения в поддержании гипергликемии при COVID-19 м СД2, на что указывают прямые корреляционные взаимосвязи между его наличием и такими показателями НМГ, как средняя гликемия за 24 часа и процентвремени ее нахождения в диапазоне выше целевого.
Также обращает внимание обратная взаимосвязь доливремени нахождения гликемии в целевом диапазоне с уровнем D-димера в начале госпитализации, что может говорить об ассоциации дисгликемии с тромбогенными нарушениями и, возможно, об общности некоторых патогенетических звеньев формирования коагуляционных нарушений при COVID-19 и при СД2.
Несмотря на значимо большую выраженность и длительность гипергликемии, в основной группе имелась парадоксально высокая и близкая к контролю доля пациентов с эпизодами гипогликемии (33,3 vs 38,1%; р=0,75). Неожиданным было и отсутствие отличий от контроля по среднему проценту времени нахождения в зоне гипогликемии <3,9 ммоль/л (р=0,16) (невзирая на более короткое время пребывания гликемии ниже порога в 6 ммоль/л (р=0,035), и при сходной вариабельности (p>0,05 по всем параметрам, см. табл.1)).
Согласно дальнейшему анализу оказалась важной связь гипогликемии с особенностями проводимой терапии COVID-19 на момент НМГ, что, прежде всего, касается применения ГКС. В этом плане, основная группа больных с сочетанной патологией может быть условно подразделена на 3 подгруппы: 1) находившиеся на терапии дексаметазоном во время НМГ (n=10), 2) завершившие лечение дексаметазоном на момент проведения НМГ (n=10), 3) получающие метилпреднизолон в период исследования НМГ (n=1).
Как уже отмечалось, у пациентов, находившиеся на терапии дексаметазоном на момент НМГ, эпизодов гипогликемии зафиксировано не было. Основной проблемой с точки зрения гликемического контроля у них являлась выраженная склонность к гипергликемии, со значительным сокращением времени нахождения гликемии в целевом диапазоне. Все эти больные были недавно госпитализированными, клинически и лабораторно имели признаки острой воспалительной реакции (что предполагает выброс в кровь провоспалительных цитокинов и их негативное воздействие на чувствительность тканей к инсулину [1][3][5]). Вероятно, по этой причине, несмотря на многократный контроль гликемии в течение суток и, при необходимости, коррекцию инсулинотерапии, показатели НМГ у них оказались далеки от оптимальных.
У пациентов, завершивших лечение дексаметазоном, сохранялись проявления гипергликемии (особенно в дневное время, когда средняя концентрация глюкозы выходила за верхнюю границу целевого диапазона). Однако выраженность гипергликемических нарушений по ряду показателей оказалась значимо меньшей, чем у лиц, получавших ГКС на момент НМГ. Данные различия могут объясняться как снижением активности воспаления (отчасти, и за счет эффективного лечения COVID-19, включая предшествующее использование ГКС), так и изменениями терапии (окончание приема ГКС, оптимизация сахароснижающей терапии в ходе госпитализации). Наиболее же радикальным отличием подгруппы пациентов, завершивших лечение дексаметазоном, явилось именно наличие эпизодов гипогликемии, которые возникали у 6 (60%) больных. Следует уточнить, что в основной группе наблюдения (n=21) выявлялось 7 больных с гипогликемией; из них 6 завершили лечение дексаметазоном, а 1 получал метилпреднизолон на момент проведения НМГ (его данные на текущем этапе работы не учитывали).
Одним из факторов, способствующих гипогликемии после отмены ГКС, могло стать неадекватное снижение дозы инсулина. В соответствии с локальной клинической практикой, в течение трехдневного периода после отмены ГКС осуществлялся обязательный контроль гликемии натощак, до и после каждого приема пищи, а такжеперед сном. На основании полученного гликемического профиля в индивидуальном порядке проводилась титрация доз инсулина (как базального, так и короткого действия). С учетом наших данных, в указанный период времени была бы также целесообразной и оценка ночной гликемии, для оптимизации процесса титрации.
Согласно инструкции, дексаметазон является препаратом длительного действия, с продолжительностью биологического периода полувыведения до 36–54 ч. Считается, что его прямое воздействие на уровень гликемии может быть значимым в течение примерно 48 ч [3]. Этот факт отчасти объясняет стабильно большие показатели гликемии на протяжении суток в группе получавших дексаметазон; межгрупповые различия средних уровней гликемии утрачивали статистическую значимость только в интервалах 9–12 и 12–15 ч (что соответствовало времени очередной инфузии ГКС). При этом не следует забывать, что на снижение гликемии пациентов, завершивших лечение ГКС, безусловно, влияло не только отсутствие гипергликемического эффекта дексаметазона, но и достигнутое на фоне предшествующей терапии уменьшение активности воспаления, а также эффекты инсулинотерапии.
У пациентки, получавшей метилпреднизолон, имелось 2 дневных эпизода гипогликемии (один из них — 2 уровня), которые возникли в разные дни, но приблизительно в один временной период, примерно соответствующий окончанию действия препарата. В таблетированной форме метилпреднизолон имеет период полувыведения в диапазоне от 1,8 до 5,2 ч. При его приеме утром можно ожидать значительного снижения концентрации препарата в крови уже во второй половине дня (что и соответствовало времени появления зафиксированных у больной эпизодов гипогликемии). Хотя речь идет о единичном наблюдении, данная клиническая ситуация позволяет рекомендовать более частое исследование глюкозы крови у больных, получающих ГКС с небольшим периодом полувыведения; при этом конкретное время для контроля гликемии должно определяться с учетом фармакокинетики ГКС.
В подгруппе лиц, у которых НМГ была проведена после отмены дексаметазона, гипогликемия выявлялась у 6 человек из 10 (в 60% случаев), причем все эти больные имели ночные эпизоды гипогликемии, а половина из них — также и дневные. У большинства пациентов (5 из 6 с гипогликемией) она достигала 2 уровня. Также намного превышал рекомендованные значения и процент времени сохранения гипогликемических нарушений по НМГ (10,1±5,93%).
Полученные данные позволяют предположить, что у лиц с сочетанной патологией эпизоды гипогликемии, особенно ночной, являются серьезной проблемой, нередко возникающей в условиях отмены ГКС.
При этом в ходе ретроспективного сопоставления данных «слепого» НМГ с результатами рутинной оценки глюкозы крови стационарным анализатором было установлено, что чаще всего в реальной клинической практике эпизоды гипогликемии остаются не диагностированными (имелся лишь один случай выявления легкой гипогликемии днем). Следует отметить, что к моменту окончания терапии дексаметазоном, клиническое состояние всех больных с сочетанной патологией стабилизировалось. При этом рутинные исследования гликемии проводились реже и, как правило, выявляли лишь умеренную гипергликемию в пределах или выше целевого диапазона. В результате у лечащего врача не появлялось настороженности в отношении возможной гипогликемии. В том числе не проводился и контроль гликемии ночью. По-видимому, было бы целесообразно рекомендовать как минимум 5–6-кратное исследование уровня глюкозы крови (с обязательной ее оценкой в ночное время) даже стабильным больным с сочетанной патологией, на стационарном этапе, после окончания лечения дексаметазоном.
Клиническая значимость результатов
Полученные в нашем исследовании результаты позволили уточнить особенности гликемического профиля пациентов с COVID-19 и СД2, получить новые данные о распространенности и характере дисгликемических нарушений во время и после окончания терапии ГКС у госпитализированных больных с сочетанной патологией.
Ограничения исследования
Выборки пациентов были сформированы на базе одного центра, в связи с чем могут неполно отражать спектр и тяжесть дисгликемических нарушений у пациентов с COVID-19 и СД2, госпитализированных в общее отделение инфекционного госпиталя.
Направления дальнейших исследований
В дальнейшем планируется проведение проспективного исследования на базе нескольких клинических центров для выявления предикторов риска серьезных дисгликемических нарушений (в том числе клинически значимых эпизодов гипогликемии) у госпитализированных больных с COVID-19 и СД2, а также для разработки мер по их профилактике.
ЗАКЛЮЧЕНИЕ
Больные COVID-19 и СД2 отличаются более выраженной, устойчивой и трудно корректируемой гипергликемией, вследствие чего время нахождения уровня глюкозы в целевом диапазоне у них не превышает одной трети длительности НМГ.
Согласно корреляционному анализу, степень гипергликемии возрастает по мере утяжеления протекания COVID-19, при худшей компенсации СД на догоспитальном этапе, наличии ожирения, а также на фоне приема ГКС. Время нахождения гликемии в целевом диапазоне обратно связано с уровнем D-димера, что не исключает ассоциации дисгликемии с тромбогенными нарушениями.
У трети больных COVID-19 и СД2 имелись эпизоды гипогликемии. При этом более чем у четверти пациентов с сочетанной патологией они возникали в ночное время, были клинически значимыми и достигали второго уровня по данным НМГ.
На состояние гликемического контроля влиял статус пациента по отношению к приему ГКС. Лица, получавшие дексаметазон, были склонны к более выраженной гипергликемии, со значительным сокращением времени нахождения глюкозы в целевом диапазоне, но при отсутствии гипогликемии. У больных, которым НМГ проводилась после отмены дексаметазона, гипергликемия была менее выраженной, но у 60% из них выявлялись эпизоды гипогликемии, часто — ночные и клинически значимые.
В реальной клинической практике эпизоды гипогликемии, которые возникают у пациентов с сочетанной патологией после отмены и/или прекращения действия ГКС, часто остаются не диагностированными. Было бы целесообразно рекомендовать, как минимум, 5–6-кратное исследование уровня глюкозы крови (с обязательной ее оценкой в ночное время) даже стабильным больным с сочетанной патологией, на стационарном этапе, после окончания лечения длительно действующими ГКС.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Стронгин Л.Г. — концепция и дизайн исследования, сбор данных и интерпретация результатов, написание текста рукописи; Некрасова Т.А. — сбор данных, статистический расчет и интерпретация результатов, написание текста рукописи; Беликина Д.В. — сбор данных, статистический расчет и интерпретация результатов, написание текста рукописи; Корнева К.Г. — сбор данных, интерпретация результатов, написание текста рукописи; Петров А.В. — сбор данных, интерпретация результатов, написание текста рукописи. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Hussain S, Baxi H, Chand Jamali M, et al. Burden of diabetes mellitus and its impact on COVID-19 patients: A meta-analysis of real-world evidence. Diabetes MetabSyndrClin Res Rev. 2020;14(6):1595-1602. doi: https://doi.org/10.1016/j.dsx.2020.08.014
2. Wang B, Li R, Lu Z, Huang Y. Does comorbidity increase the risk of patients with COVID-19: evidence from meta-analysis.Aging (Albany NY). 2020;12(7):6049-6057. doi: https://doi.org/10.18632/aging.103000
3. Hasan SS, Kow CS, Bain A, et al.Pharmacotherapeutic considerations for the management of diabetes mellitus among hospitalized COVID-19 patients. Expert OpinPharmacother. 2021;22(2):229-240. doi: https://doi.org/10.1080/14656566.2020.1837114
4. Zhu L, She Z-G, Cheng X, et al. Association of Blood Glucose Control and Outcomes in Patients with COVID-19 and Pre-existing Type 2 Diabetes. CellMetab. 2020;31(6):1068-1077.e3. doi: https://doi.org/10.1016/j.cmet.2020.04.021
5. Pranata R, Henrina J, Raffaello WM, et al. Diabetes and COVID-19: The past, the present, and the future. Metabolism. 2021;121:154814. doi: https://doi.org/10.1016/j.metabol.2021.154814
6. Bode B, Garrett V, Messler J, et al. Glycemic Characteristics and Clinical Outcomes of COVID-19 Patients Hospitalized in the United States.J Diabetes Sci Technol. 2020;14(4):813-821. doi: https://doi.org/10.1177/1932296820924469
7. Wu J., Huang J., Zhu G., et al. Elevation of blood glucose level predicts worse outcomes in hospitalized patients with COVID-19: a retrospective cohort study. BMJ Open Diabetes Res Care.2020;8:1476.doi: https://doi.org/10.1136/bmjdrc-2020-001476
8. Zhang B., Liu S., Zhang L., et al. Admission fasting blood glucose predicts 30-day poor outcome in patients hospitalized for COVID-19 pneumonia. Diabetes ObesMetab.2020;22:1955-1957 doi: https://doi.org/10.1111/dom.14132
9. Zhu B, Jin S, Wu L, et al. J-shaped association between fasting blood glucose levels and COVID-19 severity in patients without diabetes. Diabetes Res ClinPract. 2020;168:108381. doi: https://doi.org/10.1016/j.diabres.2020.108381
10. Hill MA, Mantzoros C, Sowers JR. Commentary: COVID-19 in patients with diabetes. Metabolism. 2020;107:154217. doi: https://doi.org/10.1016/j.metabol.2020.154217
11. Dungan KM, Braithwaite SS, Preiser J-C. Stress hyperglycaemia. Lancet. 2009;373(9677):1798-1807. doi: https://doi.org/10.1016/S0140-6736(09)60553-5
12. Pasquel FJ, Messler J, Booth R, et al. Characteristics of and Mortality Associated With Diabetic Ketoacidosis Among US Patients Hospitalized With or Without COVID-19. JAMANetwOpen. 2021;4(3):e211091. doi: https://doi.org/10.1001/jamanetworkopen.2021.1091
13. Gianchandani R, Esfandiari NH, Ang L, et al. Managing Hyperglycemia in the COVID-19 Inflammatory Storm. Diabetes. 2020;69(10):2048-2053. doi: https://doi.org/10.2337/dbi20-0022
14. Peleg AY, Weerarathna T, McCarthy JS, Davis TME. Common infections in diabetes: pathogenesis, management and relationship to glycaemic control. DiabetesMetabResRev. 2007;23(1):3-13. doi: https://doi.org/10.1002/dmrr.682
15. Marfella R, Paolisso P, Sardu C, et al. Negative impact of hyperglycaemia on tocilizumab therapy in Covid-19 patients. Diabetes Metab. 2020;46(5):403-405. doi: https://doi.org/10.1016/j.diabet.2020.05.005
16. Lippi G, Lavie CJ, Sanchis-Gomar F. Cardiac troponin I in patients with coronavirus disease 2019 (COVID-19): Evidence from a metaanalysis. ProgCardiovasc Dis. 2020;63(3):390-391. doi: https://doi.org/10.1016/j.pcad.2020.03.001
17. Clerkin KJ, Fried JA, Raikhelkar J, et al. COVID-19 and Cardiovascular Disease. Circulation. 2020;141(20):1648-1655. doi: https://doi.org/10.1161/CIRCULATIONAHA.120.046941
18. Shi S, Qin M, Shen B, et al. Association of Cardiac Injury With Mortality in Hospitalized Patients With COVID-19 in Wuhan, China. JAMACardiol. 2020;5(7):802-810. doi: https://doi.org/10.1001/jamacardio.2020.0950
19. Rayman G, Lumb AN, Kennon B, et al. Dexamethasone therapy in COVID‐19 patients: implications and guidance for the management of blood glucose in people with and without diabetes. DiabetMed. 2021;38(1):78-80. doi: https://doi.org/10.1111/dme.14378
20. Ushigome E, Yamazaki M, Hamaguchi M, et al. Usefulness and Safety of Remote Continuous Glucose Monitoring for a Severe COVID-19 Patient with Diabetes. DiabetesTechnolTher. 2021;23(1):78-80. doi: https://doi.org/10.1089/dia.2020.0237
21. U.S. Food and Drug Administration[Internet]. FAQs on home-use blood glucose meters utilized within hospitals during the COVID-19 pandemic. [cited 2020 Apr 23]. Available from: https://www.fda.gov/medical-devices/blood-glucosemonitoring-devices/faqs-home-use-blood-glucose-meters-utilizedwithin-hospitals-during-covid-19-pandemic
22. Sadhu AR, Serrano IA, Xu J, et al. Continuous Glucose Monitoring in Critically Ill Patients With COVID-19: Results of an Emergent Pilot Study. J DiabetesSciTechnol. 2020;14(6):1065-1073. doi: https://doi.org/10.1177/1932296820964264
23. Agarwal S, Mathew J, Davis GM, et al. Continuous Glucose Monitoring in the Intensive Care Unit During the COVID-19 Pandemic. DiabetesCare. 2021;44(3):847-849. doi: https://doi.org/10.2337/dc20-2219
24. Davis GM, Faulds E, Walker T, et al. Remote Continuous Glucose Monitoring With a Computerized Insulin Infusion Protocol for Critically Ill Patients in a COVID-19 Medical ICU: Proof of Concept. DiabetesCare. 2021;44(4):1055-1058. doi: https://doi.org/10.2337/dc20-2085
25. Chow KW, Kelly DJ, Rieff MC, et al. Outcomes and Healthcare Provider Perceptions of Real-Time Continuous Glucose Monitoring (rtCGM) in Patients With Diabetes and COVID-19 Admitted to the ICU. J DiabetesSciTechnol. 2021;15(3):607-614. doi: https://doi.org/10.1177/1932296820985263
26. АнциферовМ.Б., АндрееваА.В., МарковаТ.Н. Организация специализированной медицинской помощи взрослому населению с сахарным диабетом в условиях новой коронавирусной инфекции COVID-19. Методические рекомендации №87.— М.: Департамент здравоохранения города Москвы;2020. — 50 с.
27. Danne T, Nimri R, Battelino T, et al. International Consensus on Use of Continuous Glucose Monitoring. DiabetesCare. 2017;40(12):1631-1640. doi: https://doi.org/10.2337/dc17-1600
28. Battelino T, Danne T, Bergenstal RM, et al. Clinical targets for continuous glucose monitoring data interpretation: recommendations from the international consensus on time in range. Diabetes Care. 2019;42(8):1593-1603. doi: https://doi.org/10.2337/dci19-0028
Об авторах
Л. Г. СтронгинРоссия
Стронгин Леонид Григорьевич, доктор медицинских наук, профессор
Нижний Новгород
eLibrary SPIN: 9641-8130
Т. А. Некрасова
Россия
Некрасова Татьяна Анатольевна, доктор медицинских наук, доцент
603005, Нижний Новгород, пл. Минина и Пожарского, д. 10/1
SPIN: 4439-7479
Д. В. Беликина
Россия
Беликина Дарья Викторовна, ассистент
Нижний Новгород
SPIN-код: 9199-0179
К. Г. Корнева
Россия
Корнева Ксения Георгиевна, кандидат медицинских наук, доцент
Нижний Новгород
SPIN-код: 5945-3266
А. В. Петров
Россия
Петров Александр Владимирович, кандидат медицинских наук, доцент
Нижний Новгород
SPIN-код: 2179-0349
Дополнительные файлы
Рецензия
Для цитирования:
Стронгин Л.Г., Некрасова Т.А., Беликина Д.В., Корнева К.Г., Петров А.В. Дисгликемия при COVID-19 и сахарном диабете 2 типа: особенности гликемического профиля у госпитализированных пациентов и роль стероид-индуцированных нарушений. Проблемы Эндокринологии. 2022;68(2):56-65. https://doi.org/10.14341/probl12840
For citation:
Strongin L.G., Nekrasova T.A., Belikina D.V., Korneva K.G., Petrov A.V. Dysglycemia in COVID-19 and Type 2 Diabetes Mellitus: Peculiarities of the Glycemic Profile in Hospitalized Patients and the Role of Steroid-Induced Disorders. Problems of Endocrinology. 2022;68(2):56-65. (In Russ.) https://doi.org/10.14341/probl12840

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).









































.jpg)


