Перейти к:
Влияние нарушений углеводного обмена на ранние и отдаленные клинические исходы у пациентов с COVID-19 по данным регистров АКТИВ и АКТИВ 2
https://doi.org/10.14341/probl13175
Аннотация
ОБОСНОВАНИЕ. Многочисленные исследования свидетельствуют о высокой встречаемости различных нарушений углеводного обмена (НУО) при новой коронавирусной инфекции (НКИ), утяжеляющих ее течение и приводящих к большей частоте смертельных исходов. Это актуализирует поиск факторов риска неблагоприятных исходов и оценку отдаленных последствий COVID-19 у пациентов с НУО.
ЦЕЛЬ. Изучить взаимосвязь НУО у пациентов с COVID-19 с летальностью, течением инфекции и отдаленными последствиями, а также выявить факторы риска неблагоприятного течения заболевания.
МАТЕРИАЛЫ И МЕТОДЫ. Выполнен ретроспективный анализ данных объединенных многоцентровых неинтервенционных регистров реальной клинической практики АКТИВ и АКТИВ 2, включивший 9290 пациентов с COVID-19 различной степени тяжести, перенесенной в период с 29.06.2020 г. по 29.11.2020 г (АКТИВ) и с 01.10.2020 г. по 30.03.2021 г. (АКТИВ 2). Пациентов разделяли на группы: группа 1 — пациенты без НУО, n=6606, группа 2 — пациенты с впервые выявленной гипергликемией (ВВГ), n=1073, группа 3 — лица с сахарным диабетом 2 типа (СД2) в анамнезе, n=1611. В группах оценивали клинико-лабораторные показатели, наличие сопутствующей патологии и летальность в период инфекции, а также через 12 мес — состояние углеводного обмена пациентов и их самочувствие.
РЕЗУЛЬТАТЫ. Распространенность НУО составила 28,9% случаев, из которых 17,3% — СД2, а 11,6% случаев представлены ВВГ. Летальность пациентов с гипергликемией любого генеза составила 10,6% случаев, что значимо выше по сравнению с пациентами без таковой (3,9%), шансы наступления летального исхода у больных с СД2 увеличивались в 2,48 раза, а в группе пациентов с ВВГ — в 2,04 раза, у пациентов без НУО летальность, напротив, уменьшалась в 2,94 раза. Через 12 мес у пациентов с НУО выявлено значимо большее количество жалоб с преобладанием их у пациентов с СД2. Спустя год после инфекции в группе лиц с ВВГ только 1,7% имели СД2 и получали пероральные сахароснижающие препараты. Разработанная прогностическая модель определения риска развития летального исхода основывается на выявленных предикторах: сопутствующая ишемическая болезнь сердца, инфаркт миокарда или инсульт в анамнезе, более высокая гликемия и старший возраст.
ЗАКЛЮЧЕНИЕ. НУО приводят к ухудшению течения НКИ, большему количеству смертельных исходов. Через год после инфекции у пациентов с СД2 и ВВГ чаще сохраняются жалобы, а ВВГ в большинстве случаев после инфекции нивелируется.
Для цитирования:
Салухов В.В., Арутюнов Г.П., Тарловская Е.И., Батлук Т.И., Башкинов Р.А., Самусь И.В., Мельников Е.С., Трубникова М.А., Арутюнов А.Г. Влияние нарушений углеводного обмена на ранние и отдаленные клинические исходы у пациентов с COVID-19 по данным регистров АКТИВ и АКТИВ 2. Проблемы Эндокринологии. 2023;69(1):36-49. https://doi.org/10.14341/probl13175
For citation:
Salukhov V.V., Arutyunov G.P., Tarlovskaya E.I., Batluk T.I., Bashkinov R.A., Samus I.V., Melnikov E.S., Trubnikova M.A., Arutyunov A.G. The impact of carbohydrate metabolism disorders on the early and long-term clinical outcomes of patients with COVID-19 according to the AKTIV and AKTIV 2 registries. Problems of Endocrinology. 2023;69(1):36-49. https://doi.org/10.14341/probl13175
ОБОСНОВАНИЕ
С конца 2019 г. новая коронавирусная инфекция (НКИ), объявленная Всемирной организацией здравоохранения пандемией, стремительно распространилась по всему миру, определив чрезвычайно высокие заболеваемость и смертность. В большом количестве исследований продемонстрировано, что лица, страдающие хроническими кардиометаболическими заболеваниями, характеризуются более тяжелым течением и неблагоприятным прогнозом в период COVID-19 и в отдаленные сроки после инфекции [1–3].
К числу таких заболеваний, которые могут повлиять на течение и исходы инфекции, вызванной SARS-CoV-2, относится сахарный диабет (СД), представляющий собой часто встречаемую патологию и характеризующийся стабильным ростом распространенности в нашей стране и в мире [4]. Общая численность больных СД в Российской Федерации на 01.01.2022 г. составила 4 871 863, из них с СД 2 типа (СД2) — 92,3% (4,5 млн). Однако если учесть долю недиагностированного СД2 в России, которая в среднем оценивается в 54%, можно заключить, что реальное количество больных должно составлять не менее 10 млн человек (6,9% населения РФ) [5].
Многочисленные исследования показали, что пациенты с COVID-19 и СД в большей степени нуждаются в госпитализации и проведении неинвазивной кислородотерапии, чаще требуют перевода в отделение интенсивной терапии, проведения искусственной вентиляции легких и характеризуются более высокой летальностью по сравнению с больными без нарушений углеводного обмена (НУО) [6][7]. Наряду с этим в реальной клинической практике и по данным публикаций отмечается весьма значительная доля пациентов (~10–60%), у которых в условиях стационара диагностируется впервые выявленная гипергликемия (ВВГ). ВВГ в постковидном периоде может как нивелироваться, так и трансформироваться в СД, причины и патогенез которого еще предстоит исследовать [8–10].
Учитывая высокую распространенность НУО и существующие данные о взаимном влиянии НУО и COVID-19, представляется чрезвычайно важным сфокусироваться на исследованиях, дизайн которых подразумевает оценку не только госпитального этапа лечения, но и отдаленных исходов для улучшения результатов профилактики, лечения и прогноза пациентов. В данной работе представлен анализ фрагмента объединенной когорты регистров АКТИВ и АКТИВ 2, включающих в себя периковидный и постковидный этапы лечения и наблюдения.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Изучить взаимосвязь НУО у пациентов с COVID-19 с летальностью, течением инфекции и отдаленными последствиями, а также выявить факторы риска неблагоприятного течения заболевания.
МАТЕРИАЛЫ И МЕТОДЫ
Регистры АКТИВ и АКТИВ 2 — многоцентровые неинтервенционные регистры реальной клинической практики, которые включали в себя пациентов, перенесших COVID-19 в период с 29.06.2020 г. по 29.11.2020 г. (АКТИВ) и с 01.10.2020 г. по 30.03.2021 г. (АКТИВ 2).
Регистр АКТИВ состоит из двух непересекающихся ветвей — амбулаторной и госпитальной. В обеих ветвях исследования было предусмотрено 6 визитов: визит включения, визит на 7–12-е сутки, визит исхода (выписка/госпитализация/смерть и т.д.) и 3 визита спустя 3, 6 и 12 мес после выписки из стационара. В регистре АКТИВ 2 учитывались данные только госпитализированных пациентов и было предусмотрено 3 визита: визит включения, визит на 7–12-е сутки, визит исхода (выписка/госпитализация/смерть и т.д.).
Раннее были опубликованы дизайн, обоснование и статистический анализ исследований [11]. Нозологический диагноз устанавливался на основании критериев МКБ-10.
Всего в субанализ были включены 6396 пациентов из регистра АКТИВ и 2968 пациентов — из АКТИВ 2. В рамках проводимого субанализа выделены 3 группы пациентов: группа 1 — лица без НУО, которую составили 6606 больных (70,5%); группа 2 — пациенты с ВВГ (включая новые случаи гипергликемии и предсуществующий недиагностированный СД2), в которую вошли 1073 (11,6%) человека; группа 3 — пациенты с СД2 — 1611 (17,3%) человек (табл. 1). Необходимо подчеркнуть, что в группе 2 не представлялось возможным отделить ранее не диагностированный СД2 от новых случаев гипергликемии ввиду наблюдательного характера исследований АКТИВ и АКТИВ 2 и отсутствия данных по уровню гликированного гемоглобина у большинства пациентов. Гипергликемия диагностировалась при уровне глюкозы в плазме венозной крови ≥7,0 ммоль/л [5]. Важно отметить, что из субанализа были исключены несколько случаев СД 1 типа, а также лица, у которых в индивидуальные регистрационные карты не были занесены показатели гликемии, фиксируемые по принципу «если известно».
Средний возраст пациентов составил 59 [ 48; 68] лет, в группе пациентов с ВВГ — 63 [ 55; 71], в группе больных СД2 — 66 [59–73]. Согласно проанализированным данным, умерших пациентов было значимо больше в группе 2 (с ВВГ) — 109 (10,4%) случаев и в группе 3 (с СД2) — 177 (11,2%) случаев по сравнению с группой 1 (без НУО) — 545 (5,8%). Показатели, отражающие тяжесть течения COVID-19, а именно степень поражения легких на компьютерной томографии (КТ) 3–4, сатурация менее 94%, частота дыхательных движений более 22 в минуту, повышение температуры тела ≥38,6°С, чаще встречались в группах 2 и 3. Распространенность таких сопутствующих патологий, как артериальная гипертензия (АГ), фибрилляция предсердий, инсульт в анамнезе, ишемическая болезнь сердца (ИБС), хроническая сердечная недостаточность (ХСН), хроническая болезнь почек, анемия, была также значимо выше в группах 2 и 3 по сравнению с пациентами группы 1, не имеющих НУО, достигая достоверно самой высокой встречаемости в группе 3.
В настоящем субанализе объединенных регистров АКТИВ и АКТИВ 2 представлены результаты исследования пациентов с впервые выявленной и предсуществующей гипергликемией с оценкой влияния НУО на течение и исходы НКИ.
Статистический анализ
Для анализа данных использовалась программа IBM SPSS STATISTICS 26. Проверка на нормальность распределения проводилась с использованием критерия Колмогорова–Смирнова. Для анализа количественных данных с распределением, отличным от нормального, в 3 выборках использовался критерий Краскела–Уоллиса для независимых выборок, для оценки качественных параметров в 2 группах пациентов был применен хи-квадрат Пирсона или точный критерий Фишера в зависимости от минимального предполагаемого числа. Для признаков, имеющих статистически значимые различия, проводились оценка шансов с 95% доверительным интервалом (ДИ), а также определение меры связи между номинальными признаками. При анализе номинальных признаков в 3 группах использовались многопольные таблицы сопряженности с последующим проведением post-hoc анализа. Для сравнения номинальных признаков в 3 связанных совокупностях был применен критерий Кохрена. Методом бинарной логистической регрессии была разработана прогностическая модель для определения риска развития летального исхода в зависимости от возраста, уровня гликемии, наличия инфаркта миокарда (ИМ) и острого нарушения мозгового кровообращения в анамнезе, а также наличия сопутствующей патологии в виде ИБС. Отношение шансов (ОШ) с 95% ДИ для предикторов, оказывающих статистически значимое влияние на исход, было представлено в виде forest plot. Пороговое значение логистической функции Р было определено с помощью метода ROC-кривых.
РЕЗУЛЬТАТЫ
Индекс массы тела (ИМТ) у пациентов в группе с ВВГ (группа 2) и в группе 3 с СД2 был значимо выше, чем в группе 1 (табл. 2). ИМТ менее 30 кг/м2 был в большей степени характерен для пациентов группы 1 — без НУО (р<0,001). Летальность в изучаемых группах имела статистически значимые различия (р<0,001): наибольшее количество смертельных исходов было отмечено в группе 2 (10,4% — 109 человек) и в группе 3 (11,2% — 177 человек), меньше всего умерших было в группе 1 (2,9% — 254 человека). Статистически значимые различия (р<0,001) наблюдались между изучаемыми группами в отношении степени КТ, отражающей объем поражения легких и тяжесть коронавирусной пневмонии. Выявлено, что КТ3 и КТ4 в 1,5–2 раза чаще встречались в группе 2 (183 (20,3%) и 47 (5,2%)) пациентов соответственно и в группе 3 (243 (17,6%) и 76 (5,5%)) пациентов соответственно, в то время как в группе больных без НУО значимо реже встречались КТ3 — у 574 (11,1%) и КТ4 — у 106 (2,0%). Уровень С-реактивного белка ≥50 мг/л, как и значение SpO2≤90%, статистически значимо чаще выявлялись в группе 2 и в группе 3 по сравнению с группой пациентов без НУО. Глюкокортикостероиды (ГКС) в большем количестве случаев назначались в группе 2, чем в остальных группах (р<0,001).
При сравнении летальности в зависимости от ВВГ или наличия СД2 получены статистически значимые различия (р<0,001). Так, шансы наступления летального исхода в группе пациентов с СД2 увеличивались в 2,48 раза (95% ДИ 2,05–3,00), а в группе больных с ВВГ — в 2,04 раза (95% ДИ 1,64–2,55). В то же время у пациентов без НУО (группа 1) по уровню летальности также имелись значимые различия, однако шансы наступления летального исхода у данной когорты, напротив, уменьшались в 2,94 раза (95% ДИ 0,28–0,40), что отражено на рисунке 1.
Особый интерес для изучения представляет когорта пациентов с НКИ среднетяжелого и тяжелого течения с сатурацией менее 93% (табл. 3). Летальность в данной когорте оказалась наиболее высокой и среди групп распределялась следующим образом: у пациентов с ВВГ (группа 2) она составила 21,4%, в группе с СД2 (группа 3) — 20,2%, а в группе 1 — 12,4%, что имело статистически значимые различия (р<0,001). В терапии ГКС больше всего нуждались пациенты с ВВГ — 41 (24,0%), тогда как в других группах данный вид терапии получали менее 14,1% пациентов (р=0,006).
Жалобы, предъявляемые на постгоспитальном этапе, — одна из серьезных причин снижения качества жизни пациентов после перенесенной НКИ и основание, которое позволило медицинскому сообществу сформулировать концепцию постковидного синдрома. В регистре АКТИВ наблюдение за пациентами после выписки проводилось через 3, 6 и 12 мес. За это время наиболее часто пациентов беспокоили: снижение вкуса, кашель, экспекторация мокроты, миалгии, торакалгии, сердцебиение, повышение артериального давления (АД), слабость, диарея, насморк, конъюнктивит, першение в горле, повышение температуры тела (табл. 4). Статистически значимо чаще встречались и дольше сохранялись в группах 2 и 3 жалобы на снижение вкусовых ощущений (робщ<0,001), кашель (робщ<0,001), мокроту (робщ<0,001), миалгии (робщ<0,001), торакалгии (робщ<0,001), сердцебиение (робщ<0,001), повышение АД (робщ<0,001) и слабость (робщ<0,001).
Сахароснижающую терапию в период НКИ получали все пациенты из группы 3 и 87% пациентов из группы 2. В соответствии с существующими подходами большой вклад в управление гипергликемией в период острой инфекции в обеих группах внесла инсулинотерапия [12], однако существенных различий в проводимой терапии не выявлено при тенденции к более широкому применению пероральных сахароснижающих препаратов (ПССП) в группе больных СД2 (табл. 5).
Через 12 мес в группе 2 только 18 человек (1,7%) получали антигипергликемические лекарственные средства, которые были представлены монотерапией ПССП. В группе 3 спустя год наблюдения отмечена трансформация сахароснижающей терапии: уже 72,6% находились на монотерапии ПССП, 18,9% — на двойной комбинированной терапии ПССП и только 8,5% пациентов управляли СД2 приемом базального инсулина ± ПССП.
В ходе исследования была разработана прогностическая модель для определения шанса развития летального исхода в зависимости от возраста, уровня гликемии, наличия ИБС, а также ИМ или инсульта в анамнезе. При проведении однофакторного анализа все вышеуказанные переменные имели статистически значимое влияние на вероятность наступления летального исхода. Важно отметить, что ИМТ>30 кг/м2 и АГ при поправке на другие факторы не оказывали достоверного влияния на смертность и достигали уровня значимости только при ассоциации с вышеперечисленными предикторами.
При проведении многофакторного анализа статистически значимое влияние на вероятность развития летального исхода также оказывали все исследуемые факторы. Характеристики каждого из них представлены в таблице 6.
Наблюдаемая зависимость описывается уравнением (1):
Р = 1 / (1 + e-z) * 100% (1)
z = - 7,95 + 0,06*Xвозраст + 0,12*Xгликемия+ + 0,48*XИМ+0,34*XИБС+0,76*Xинсульт,
где Р — вероятность наступления летального исхода (%); Xвозраст — возраст (лет); Xгликемия — уровень гликемии (ммоль/л); XИМ — наличие ИМ в анамнезе (0 — отсутствует, 1 — имеется); XИБС — наличие ишемической болезни сердца (0 — отсутствует, 1 — имеется); Xинсульт — наличие инсульта в анамнезе (0 — отсутствует, 1 — имеется).
Полученная регрессионная модель является статистически значимой (p<0,001). Исходя из значения коэффициента детерминации Найджелкерка, модель (1) учитывает 18,6% факторов, определяющих вероятность развития летального исхода.
В соответствии со значениями регрессионных коэффициентов, возраст, уровень гликемии, наличие ИМ, ИБС и инсульта в анамнезе имеют прямую связь с вероятностью развития летального исхода. Увеличение возраста на 1 год повышает шансы наступления летального исхода в 1,07 раза (95% ДИ 1,06–1,08), увеличение уровня гликемии на 1 ммоль/л приводит к повышению шансов наступления летального исхода в 1,12 раза (95% ДИ 1,1–1,15), наличие ИМ в анамнезе увеличивает вероятность наступления летального исхода в 1,62 раза (95% ДИ 1,22–2,16), ИБС — в 1,40 раза (95% ДИ 1,12–1,76), инсульта — в 2,14 раза (95% ДИ 1,58–2,90). На рисунке 2 сопоставлены значения ОШ (95% ДИ) наступления летального исхода для изучаемых факторов, вошедших в модель 1.
Пороговое значение логистической функции Р было определено с помощью метода анализа ROC-кривых. Полученная кривая представлена на рисунке 3.
Площадь под ROC-кривой соответствующей взаимосвязи прогноза летального исхода и значения логистической регрессионной функции составила 0,786±0,01 (95% ДИ 0,77–0,81). Значение логистической функции в точке cut-off составило 0,061. Значения функции, равные или превышающие данное значение, соответствовали высокому риску наступления летального исхода. При значениях функции менее 0,061 определялся низкий риск наступления летального исхода. Чувствительность и специфичность модели (1) при данном пороговом значении составили 72,2 и 68,5% соответственно.
Таблица 1. Характеристика пациентов, включенных в регистры АКТИВ и АКТИВ 2
Показатель | Общая когорта n=9290 | Группа 1 (пациенты без НУО) n=6606 | Группа 2 (пациенты с ВВГ) n=1073 | Группа 3 (пациенты с СД2) n=1611 | р1–3 |
Возраст | 59 [48–68] | 58 [46–67] | 63 [55–71] | 66 [59–73] | <0,001* Р1–2<0,001* Р1–3<0,001* Р2–3<0,001* |
Женщины | 4947 (53,2%) | 3477 (52,2%) | 533 (49,7%) | 937 (58,2%) | <0,001* |
Умершие | 545 (5,9%) | 259 (4,0%) | 109 (10,4%) | 177 (11,2%) | <0,001* |
Избыточная масса тела | 2921 (31,4%) | 2135 (39,0%) | 331 (36,5%) | 455 (34,2%) | <0,001* |
Ожирение 1 ст. | 1700 (18,3%) | 1044 (19,1%) | 251 (27,6%) | 405 (30,4%) | |
Ожирение 2 ст. | 667 (7,2%) | 379 (6,9%) | 94 (10,4%) | 194 (14,6%) | |
Ожирение 3 ст. | 296 (3,2%) | 147 (2,7%) | 39 (4,3%) | 110 (83%) | |
КТ1 | 3136 (33,8%) | 2369 (45,5%) | 291 (32,3%) | 476 (34,5%) | <0,001* |
КТ2 | 2563 (27,6%) | 1695 (32,5%) | 344 (38,2%) | 524 (38,0%) | |
КТ3 | 1005 (10,8%) | 579 (11,1%) | 183 (20,3%) | 243 (17,6%) | |
КТ4 | 231 (2,5%) | 108 (2,1%) | 47 (5,2%) | 76 (5,5%) | |
SpO2 75–94% | 2165 (23,3%) | 1334 (29,1%) | 289 (45,2%) | 542 (51,8%) | <0,001* |
SpO2≤75% | 55 (0,6%) | 21 (0,5%) | 16 (2,5%) | 18 (1,7%) | |
ЧДД 22–29 | 2312 (24,9%) | 1448 (22,0%) | 333 (31,4%) | 531 (33,1%) | <0,001* |
ЧДД более 30 | 178 (1,9%) | 79 (1,2%) | 33 (3,1%) | 66 (4,1%) | |
Температура тела 38,6–39,0°С | 1633 (17,6%) | 1114 (16,9%) | 215 (20,2%) | 304 (19,1%) | <0,001* |
Температура тела >39,0°С | 640 (6,9%) | 431 (6,6%) | 106 (10,0%) | 103 (6,5%) | |
АГ | 5289 (56,9%) | 3242 (48,7%) | 701 (65,3%) | 1346 (83,6%) | <0,001* |
Курение | 475 (5,1%) | 369 (5,5%) | 37 (3,4%) | 69 (4,3%) | 0,004* |
ФП | 672 (7,2%) | 387 (5,8%) | 100 (9,3%) | 185 (11,5%) | <0,001* |
ИБС | 2072 (22,3%) | 1195 (18,0%) | 273 (25,4%) | 604 (37,5%) | <0,001* |
ИМ в анамнезе | 592 (6,4%) | 324 (4,9%) | 74 (6,9%) | 194 (12,0%) | <0,001* |
ХСН | 1595 (17,2%) | 888 (13,3%) | 220 (20,5%) | 487 (30,2%) | <0,001* |
Инсульт в анамнезе | 401 (4,3%) | 226 (3,4%) | 49 (4,6%) | 126 (7,8%) | <0,001* |
СД2 | 1611 (17,3%) | 0 | 0 | 1611 (100%) | <0,001* |
ХБП | 716 (7,7%) | 381 (5,7%) | 93 (8,7%) | 242 (15,0%) | <0,001* |
ХОБЛ | 408 (4,4%) | 272 (4,1%) | 49 (4,6%) | 87 (5,4%) | 0,065 |
БА | 321 (3,5%) | 219 (3,3%) | 40 (3,7%) | 62 (3,8%) | 0,467 |
Рак в настоящее время | 536 (5,8%) | 372 (5,6%) | 64 (6,0%) | 100 (6,2%) | 0,595 |
Анемия | 1972 (21,2%) | 1282 (21,1%) | 248 (23,2%) | 442 (28,4%) | <0,001* |
АГ — артериальная гипертензия; БА — бронхиальная астма; ИБС — ишемическая болезнь сердца; ИМ — инфаркт миокарда; КТ — компьютерная томография; СД2 — сахарный диабет 2 типа; ФП — фибрилляция предсердий; ЧДД — частота дыхательных движений; ХБП — хроническая болезнь почек; ХОБЛ — хроническая обструктивная болезнь легких; ХСН — хроническая сердечная недостаточность; SpO2 — сатурация кислорода.
Таблица 2. Сравнительная характеристика пациентов в изучаемых группах в зависимости от наличия или отсутствия определенных признаков
Признак | Группа 1 (пациенты без НУО) n=6606 | Группа 2 (пациенты с ВВГ) n=1073 | Группа 3 (пациенты с СД2) n=1611 | р |
ИМТ | ||||
Ме [Q1–Q3] | 27,1 [ 24,2–30,5] | 28,8 [ 25,6–32,7] | 30,4 [ 27,0–34,6] | <0,001* |
Менее 18,5 | 58 (1,1%) | 7 (0,8%) | 6 (0,5%) | <0,001* |
18,5–24,9 | 1696 (31,2%) | 186 (20,5%) | 162 (12,2%) | |
25–29,9 | 2124 (39,1%) | 331 (36,5%) | 455 (34,2%) | |
30–34,9 | 1035 (19,1%) | 251 (27,6%) | 405 (30,4%) | |
35–39,9 | 376 (6,9%) | 94 (10,4%) | 194 (14,6%) | |
40 и более | 144 (2,7%) | 39 (4,3%) | 110 (8,3%) | |
Летальность | ||||
Живы | 6254 (96,1%) | 944 (89,6%) | 1406 (88,8%) | <0,001* |
Умерли | 254 (3,9%) | 109 (10,4%) | 177 (11,2%) | |
ОШ (95% ДИ) | 0,34 (0,28–0,40) | 2,04 (1,64–2,55) | 2,48 (2,05–3,00) | |
р | <0,001* | <0,001* | <0,001* | |
КТ | ||||
3 | 574 (11,1%) | 183 (20,3%) | 243 (17,6%) | <0,001* |
4 | 106 (2,0%) | 47 (5,2%) | 76 (5,5%) | |
СРБ≥50 мг/л | ||||
Отсутствует | 3796 (77,7%) | 589 (68,0%) | 808 (63,9%) | <0,001* |
Имеется | 1088 (22,3%) | 277 (32,0%) | 456 (36,1%) | |
ГКС | ||||
Не назначены | 5735 (86,8%) | 808 (75,3%) | 1356 (84,2%) | <0,001* |
Назначены | 871 (13,2%) | 265 (24,7%) | 255 (15,8%) | |
Сатурация ≤90% | ||||
Отсутствует | 4298 (94,4%) | 554 (86,1%) | 885 (84,6%) | <0,001* |
Имеется | 253 (5,6%) | 86 (13,4%) | 161 (15,4%) | |
При попарных сравнения между всеми группами р<0,001*.
ИМТ — индекс массы тела; КТ — компьютерная томография; СРБ — С-реактивный белок.
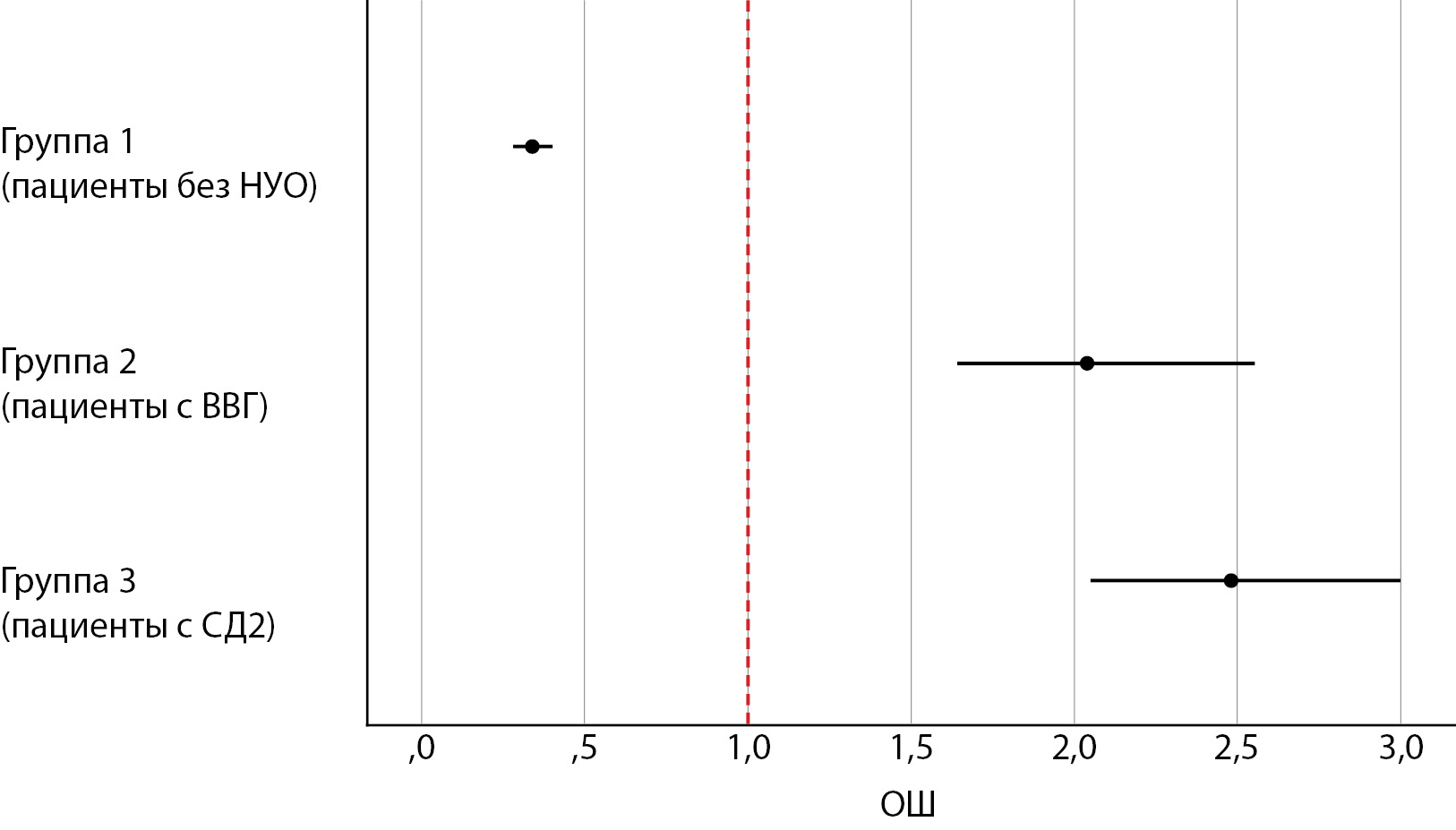
Рисунок 1. ОШ (95% ДИ) наступления летального исхода в зависимости от характера нарушения углеводного обмена.
Таблица 3. Сравнительная характеристика пациентов в изучаемых группах с SpO2<93% в зависимости от летальности и назначения ГКС
Признак | Группа 1 (пациенты без НУО) n=6606 | Группа 2 (пациенты с ВВГ) n=1073 | Группа 3 (пациенты с СД2) n=1611 | р |
Летальность | ||||
Выздоровели | 829 (87,9%) | 173 (78,6%) | 343 (79,8%) | <0,001* |
Умерли | 114 (12,1%) | 47 (21,4%) | 87 (20,2%) | |
ГКС | ||||
Не назначены | 638 (85,9%) | 130 (76,0%) | 319 (86,9%) | 0,006* |
Назначены | 105 (14,1%) | 41 (24,0%) | 48 (13,1%) | |
Таблица 4. Основные жалобы в изучаемых группах на постгоспитальном этапе через 3, 6 и 12 месяцев
Жалоба | Группы пациентов | Этапы наблюдения | р | ||
через 3 мес | через 6 мес | через 12 мес | |||
Снижение/ потеря вкуса | Группа 1 (пациенты без НУО) | 82 (1,2%) | 37 (0,6%) | 15 (0,2%) | <0,001* р3–6<0,001* р3–12<0,001* р6–12=0,006* |
Группа 2 (пациенты с ВВГ) | 20 (1,9%) | 10 (0,932%) | 2 (0,186%) | <0,001* р3–6=0,008* р3–12<0,001* р6–12=0,109 | |
Группа 3 (пациенты с СД2) | 9 (0,559%) | 6 (0,372%) | 4 (0,248%) | 0,895 | |
p (между группами на каждом этапе) | 0,009* | 0,161 | 0,846 | ||
Кашель | Группа 1 (пациенты без НУО) | 209 (3,1%) | 102 (1,5%) | 51 (0,8%) | <0,001* р3–6=0,001 р3–12<0,001* р6–12=0,003* |
Группа 2 (пациенты с ВВГ) | 38 (3,5%) | 15 (1,4%) | 9 (0,839%) | 0,031* р3–6=0,064 р3–12=0,011* р6–12=0,487 | |
Группа 3 (пациенты с СД2) | 55 (3,4%) | 25 (1,6%) | 13 (0,807%) | 0,005* р3–6=0,021* р3–12=0,002* р6–12=0,401 | |
р (между группами на каждом этапе) | 0,066 | 0,752 | 0,643 | ||
Мокрота | Группа 1 (пациенты без НУО) | 47 (0,7%) | 17 (0,3%) | 8 (0,1%) | <0,001* р3–6=0,002* р3–12<0,001* р6–12=0,439 |
Группа 2 (пациенты с ВВГ) | 11 (1,0%) | 5 (0,466%) | 2 (0,186%) | 0,066 | |
Группа 3 (пациенты с СД2) | 9 (0,559%) | 8 (0,497%) | 6 (0,372%) | 0,407 | |
р (между группами на каждом этапе) | 0,288 | 0,104 | 0,029* | ||
Миалгии | Группа 1 (пациенты без НУО) | 80 (1,2%) | 40 (0,6%) | 20 (0,3%) | <0,001* р3–6<0,001* р3–12<0,001* р6–12 =0,312 |
Группа 2 (пациенты с ВВГ) | 17 (1,6%) | 11 (1,0%) | 4 (0,373%) | 0,047* р3–6=0,358 р3–12=0,014* р6–12=0,126 | |
Группа 3 (пациенты с СД2) | 28 (1,7%) | 9 (0,559%) | 13 (0,807%) | 0,296 | |
р (между группами на каждом этапе) | 0,015* | 0,191 | 0,002* | ||
Торакалгии | Группа 1 (пациенты без НУО) | 102 (1,5%) | 56 (0,8%) | 27 (0,4%) | 0,013* р3–6=0,291 р3–12=0,004* р6–12=0,064 |
Группа 2 (пациенты с ВВГ) | 19 (1,8%) | 14 (1,3%) | 4 (0,373%) | 0,025* р3–6=0,373 р3–12=0,008* р6–12=0,075 | |
Группа 3 (пациенты с СД2) | 39 (2,4%) | 33 (2,0%) | 17 (1,1%) | 0,349 | |
р (между группами на каждом этапе) | 0,001* | <0,001* | <0,001* | ||
Сердцебиение | Группа 1 (пациенты без НУО) | 233 (3,5%) | 140 (2,1%) | 62 (0,9%) | <0,001* р3–6<0,001* р3–12<0,001* р6–12=0,012* |
Группа 2 (пациенты с ВВГ) | 47 (4,4%) | 30 (2,8%) | 18 (1,7%) | 0,018* р3–6=0,099 р3–120,005* р6–12=0,239 | |
Группа 3 (пациенты с СД2) | 65 (4,0%) | 25 (1,6%) | 22 (1,4%) | 0,008* р3–6=0,003* р3–12=0,018* р6–12=0,584 | |
р (между группами на каждом этапе) | 0,005* | 0,104 | 0,004* | ||
Повышение АД | Группа 1 (пациенты без НУО) | 425 (6,4%) | 369 (5,5%) | 201 (3,0%) | 0,047* р3–6=0,828 р3–12=0,043* р6–12=0,025* |
Группа 2 (пациенты с ВВГ) | 74 (6,9%) | 64 (6,0%) | 33 (3,1%) | 0,109 | |
Группа 3 (пациенты с СД2) | 126 (7,8%) | 118 (7,3%) | 48 (3,0%) | 0,041* р3–6=0,593 р3–12=0,061 р6–12=0,016* | |
р (между группами на каждом этапе) | <0,001* | <0,001* | 0,381 | ||
Слабость | Группа 1 (пациенты без НУО) | 699 (10,5%) | 412 (6,2%) | 209 (3,1%) | <0,001* р3–6<0,001* р3–12<0,001* р6–12<0,001* |
Группа 2 (пациенты с ВВГ) | 125 (11,6%) | 65 (6,1%) | 32 (3,0%) | <0,001* р3–6<0,001* р3–12<0,001* р6–12=0,017* | |
Группа 3 (пациенты с СД2) | 193 (12,0%) | 136 (8,4%) | 74 (4,6%) | <0,001* р3–6=0,004* р3–12<0,001* р6–12=0,017* | |
р (между группами на каждом этапе) | <0,001* | <0,001* | <0,001* | ||
Диарея | Группа 1 (пациенты без НУО) | 32 (0,5%) | 9 (0,1%) | 8 (0,1202%) | 0,001* р3–6=0,001* р3–12=0,004* р6–12=0,655 |
Группа 2 (пациенты с ВВГ) | 7 (0,652%) | 2 (0,186%) | 2 (0,186%) | 0,607 | |
Группа 3 (пациенты с СД2) | 7 (0,435%) | 3 (0,186%) | 6 (0,372%) | 0,497 | |
р (между группами на каждом этапе) | 0,568 | 0,731 | 0,029* | ||
Насморк | Группа 1 (пациенты без НУО) | 27 (0,4%) | 14 (0,2%) | 6 (0,902%) | 0,037* р3–6=0,136 р3–12=0,011* р6–12=0,286 |
Группа 2 (пациенты с ВВГ) | 5 (0,466%) | 6 (0,559%) | 1 (0,093%) | 0,121 | |
Группа 3 (пациенты с СД2) | 6 (0,372%) | 1 (0,062%) | 3 (0,186%) | 0,549 | |
р (между группами на каждом этапе) | 0,842 | 0,023* | 0,388 | ||
Конъюнктивит | Группа 1 (пациенты без НУО) | 3 (0,045%) | 0 | 2 (0,03%) | 0,368 |
Группа 2 (пациенты с ВВГ) | 0 | 0 | 0 | - | |
Группа 3 (пациенты с СД2) | 2 (0,124%) | 0 | 0 | - | |
р (между группами на каждом этапе) | 0,240 | - | 0,710 | ||
Першение | Группа 1 (пациенты без НУО) | 40 (0,6%) | 17 (0,3%) | 9 (0,135%) | <0,001* р3–6<0,001* р3–12<0,001* р6–12=0,695 |
Группа 2 (пациенты с ВВГ) | 7 (0,652%) | 4 (0,373%) | 1 (0,093%) | 0,325 | |
Группа 3 (пациенты с СД2) | 7 (0,435%) | 0 | 2 (0,124%) | 0,066 | |
р (между группами на каждом этапе) | 0,812 | 0,099 | 0,951 | ||
Повышение температуры тела | Группа 1 (пациенты без НУО) | 51 (0,8%) | 16 (0,2%) | 5 (0,075%) | <0,001* р3–6<0,001* р3–12<0,001* р6–12=0,262 |
Группа 2 (пациенты с ВВГ) | 5 (0,466%) | 3 (0,280%) | 2 (0,186%) | 0,417 | |
Группа 3 (пациенты с СД2) | 4 (0,248%) | 1 (0,062%) | 4 (0,248%) | 0,325 | |
р (между группами на каждом этапе) | 0,146 | 0,405 | 0,069 | ||
Таблица 5. Сахароснижающая терапия у пациентов групп 2 и 3 в период лечения COVID-19
Терапия | Группа 2 (пациенты с ВВГ) n=1073 | Группа 3 (пациенты с СД2) n=1611 | р |
ПССП | 323 (30,1%) | 626 (38,9%) | <0,001* |
Базальная инсулинотерапия ± ПССП | 216 (20,1%) | 368 (22,8%) | 0,096 |
Базис-болюсная инсулинотерапия | 395 (36,8%) | 617 (38,3%) | 0,437 |
Таблица 6. Факторы, оказывающие влияние на риск наступления летального исхода по результатам многофакторного анализа
Предиктор | COR | р | АOR | Р |
Увеличение возраста на 1 год | 1,08 [ 1,07–1,09] | <0,001* | 1,07 [ 1,06–1,08] | <0,001* |
Увеличение уровня гликемии на 1 ммоль/л | 1,14 [ 1,11–1,16] | <0,001* | 1,12 [ 1,1–1,15] | <0,001* |
ИМ в анамнезе | 3,7 [ 2,92–4,69] | <0,001* | 1,62 [ 1,22–2,16] | 0,001* |
ИБС | 3,9 [ 3,28–4,66] | <0,001* | 1,4 [ 1,12–1,76] | 0,004* |
Инсульт в анамнезе | 4,80 [ 3,70 -6,22] | <0,001* | 2,14 [ 1,58–2,90] | <0,001* |
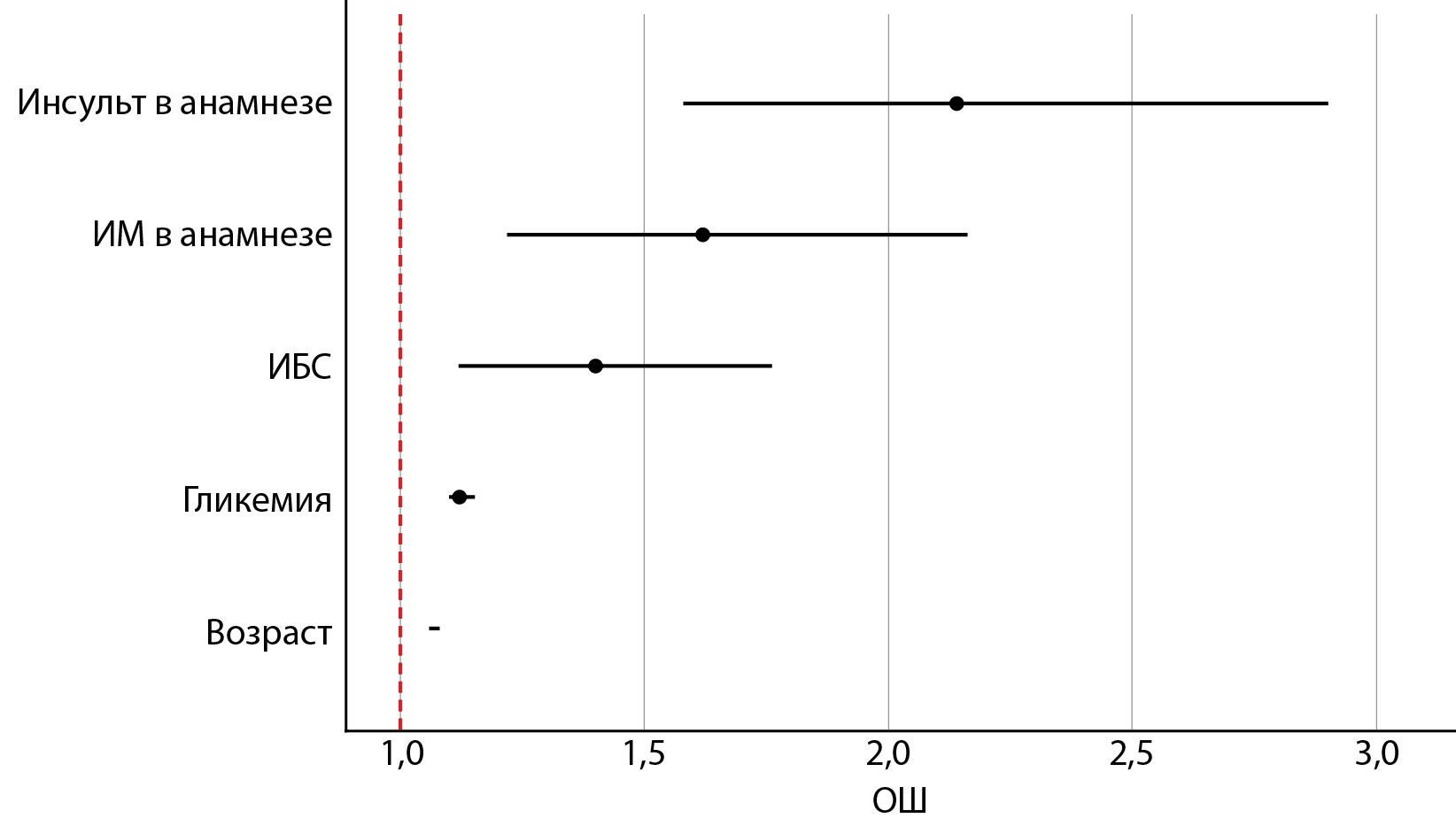
Рисунок 2. ОШ (95% ДИ) вероятности наступления летального исхода для изучаемых предикторов.
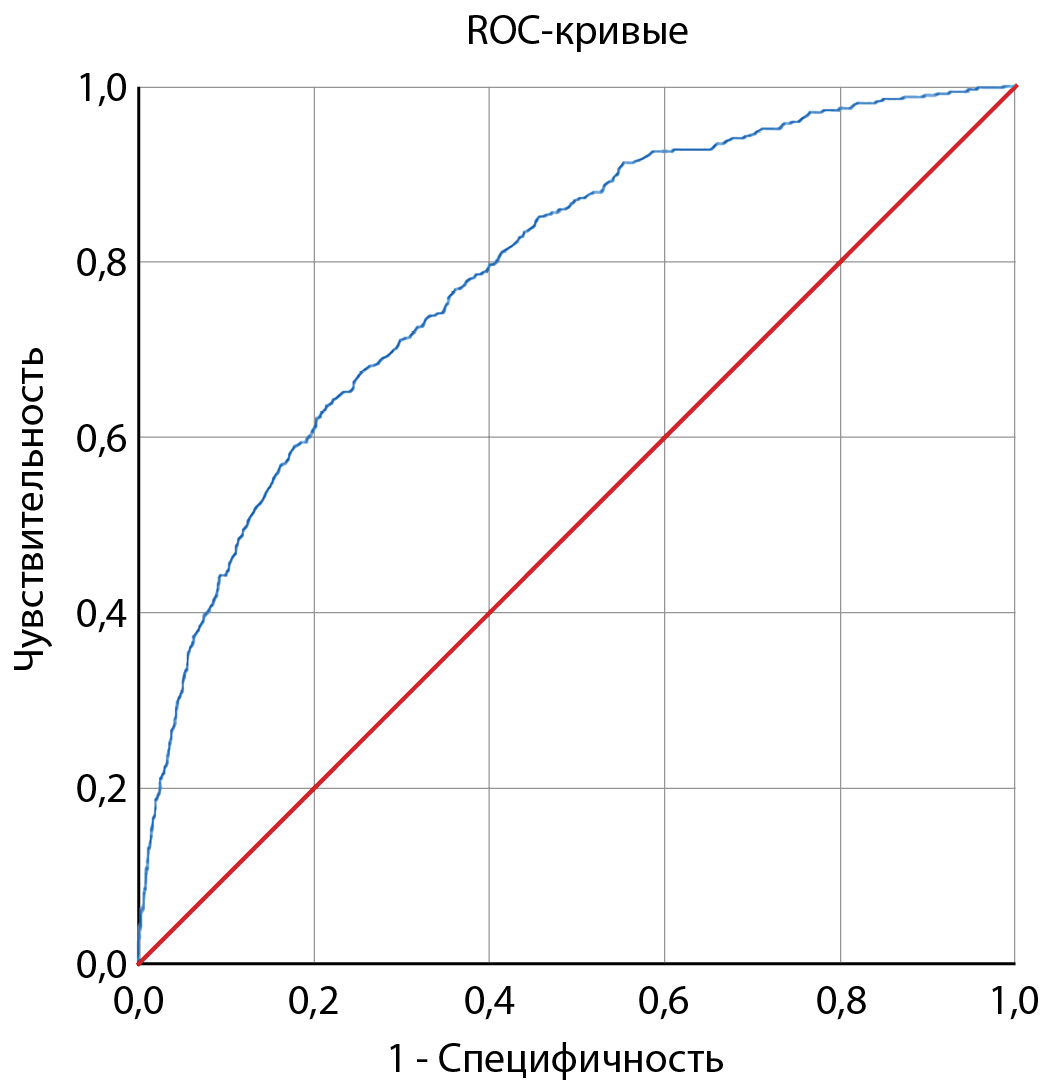
Рисунок 3. ROC-кривая, характеризующая зависимость вероятности наступления летального исхода от значений прогностической функции (1).
ОБСУЖДЕНИЕ
Субанализ объединенных регистров реальной клинической практики АКТИВ и АКТИВ 2, включающих пациентов амбулаторного и госпитального этапов лечения COVID-19 и 12-месячного наблюдения в постковидном периоде, предназначен для оценки влияния гипергликемии на исходы НКИ. Это связано с особым значением, которое многими исследователями придается НУО у больных с COVID-19 как важнейшему фактору риска развития более тяжелого течения инфекции, а также неблагоприятных исходов [1][7][9][3].
В результате анализа данных установлено, что распространенность гипергликемии у пациентов с COVID-19 в выбранной когорте составляет 28,9%, из которых в 11,6% случаев обследованные имеют ВВГ без предшествующего анамнеза НУО, а 17,3% представлены больными с СД2.
Частота летальных исходов у пациентов с гипергликемией в субанализе составляет 10,6%, что значимо выше, чем у больных без НУО (3,9%), при этом летальность больных СД2 достоверно превышает таковую пациентов с ВВГ (11,2% vs 10,4%). Похожая тенденция отмечена и среди пациентов с дыхательной недостаточностью (SpO2<93%), у которых наличие ВВГ или СД2 определяло двукратное увеличение летальности.
Полученные данные, касающиеся уязвимости инфицированных SARS-CoV-2 пациентов с гипергликемией, соотносятся с результатами многочисленных отечественных и зарубежных исследований, в соответствии с которыми количество смертельных исходов среди лиц с СД также в 2–3 раза превышает таковое у лиц без СД. Так, во французском национальном исследовании CORONADO летальность пациентов с СД2 составила 20,6% [14], в США — 28,8% [15], в Великобритании — 30,1% [16], а по данным Федерального регистра сахарного диабета РФ — 15,2% [13].
По результатам субанализа объединенных регистров АКТИВ и АКТИВ 2 можно заключить, что наличие НУО ассоциировано с более тяжелым течением COVID-19. Это подтверждается значимо более высокой встречаемостью КТ3 и КТ4 и среди пациентов с СД2 и с ВВГ, а также, по данным клинико-лабораторных показателей, большей выраженностью иммуновоспалительного синдрома по сравнению с лицами без НУО.
Данная закономерность корреспондирует с зарубежными данными: в метаанализе 47 исследований было продемонстрировано, что СД связан с более выраженной тяжестью течения COVID-19 (OШ 2,20; 95% ДИ 1,69–2,86; p<0,00001) и летальностью (OШ 2,52; 95% ДИ 1,93–3,30; p<0,00001) [17]. Метаанализ 16 исследований показал, что пациенты с предсуществующим СД2 имели повышенный риск более тяжелого течения НКИ (COVID‐19) (ОШ 2,60; 95% ДИ 1,96–3,45; p=0,01) [18]. В объединенном анализе 33 исследований была обнаружена значимая связь СД2 с более тяжелым течением инфекционного процесса (ОШ 2,75; 95% ДИ 2,09–3,62; p<0,01) и с более высокой смертностью от COVID-19 с общим ОШ 1,90 (95% ДИ 1,37–2,64; p<0,01) [19].
Интересно, что вид НУО оказывает различное по выраженности влияние на летальность пациентов с COVID-19. Действительно, наличие СД2 в нашем исследовании увеличивало шансы наступления смертельного исхода в 2,48 раза, а ВВГ — только в 2,04. Напротив, отсутствие НУО уменьшало шансы наступления смерти в 2,94 раза. Ровно так же пациенты с ВВГ в большинстве случаев характеризовались более неблагоприятным течением COVID-19, чем лица без НУО, но не достигали по клинико-лабораторным показателям и объему поражения легких уровня больных СД2.
Это входит в некоторое противоречие с результатами многих исследователей, показавших, что ВВГ является фактором более неблагоприятного течения и прогноза COVID-19, чем известный СД2 [10][20–22]. По-видимому, подобные различия в нашем случае можно объяснить ограничениями наблюдательного дизайна исследования с невозможностью разделения недиагностированного СД2 со стрессовой и стероид-индуцированной гипергликемией.
Особый интерес вызывают результаты, которые продемонстрировали влияние периковидных НУО на течение отдаленного постковидного периода. В субанализе объединенных регистров АКТИВ и АКТИВ 2 были выявлены более высокая частота жалоб и их более длительное сохранение у пациентов с НУО в постковидном периоде. Так, через 12 мес после перенесенной инфекции экспекторация мокроты, торакалгия, сердцебиение, АГ, слабость и диарея значимо чаще встречались у больных СД2 по сравнению с пациентами без НУО. Эти же жалобы, за исключением торакалгии и слабости, более активно предъявляли лица с ВВГ (но реже, чем больные СД2). Полученные данные позволят скорректировать программу реабилитации в постковидном периоде, поскольку пациентов с ВВГ и СД2 следует отнести к группе риска в отношении более длительных и устойчивых жалоб после инфекции [23]. К сожалению, из-за низкого отклика оказалось сложно отследить постковидную летальность, однако данные других исследований показывают, что СД являлся одним из ранних независимых предикторов 90-дневной смертности в выборке из 4643 пациентов с тяжелым течением COVID-19 [24], наличие СД2 у пациентов старше 60 лет увеличивало шанс смерти через 3 мес (ОШ 2,55; 95% ДИ 1,16–5,61; p=0,016) [25], а анализ более 100 тыс. госпитализированных пациентов с COVID-19 в США показал, что через 6 мес риск повторной госпитализации при наличии СД увеличивается на 20% [26].
Существенным результатом настоящего исследования является регистрация высокой частоты сопутствующих заболеваний у пациентов с НУО. Многофакторный анализ показал, что каждое из таких коморбидных состояний, как ИБС, ИМ и инсульт в анамнезе, приводит к существенному увеличению вероятности развития летального исхода в 1,4, в 1,6 и в 2,1 раза соответственно. Интересно, что ожирение, а также АГ, которые, по данным различных исследований, повышали риск наступления летального исхода [7][27], в нашем субанализе не демонстрировали самостоятельного влияния, если не были ассоциированы с вышеперечисленными заболеваниями.
Значение коморбидной патологии у больных СД2 было показано в ранее опубликованных результатах исследования по данным регистра АКТИВ. СД в сочетании с ожирением и сердечно-сосудистыми заболеваниями (ССЗ) приводил к значимому увеличению вероятности летального исхода в остром периоде НКИ на госпитальном этапе (ОШ 2,24; 95% ДИ 1,59–3,15; p<0,01 для всех пациентов и ОШ 2,51; 95% Д: 1,69–3,72; p<0,01 для лиц старше 60 лет). Сочетания АГ + ожирение + СД и АГ + ИБС + ХСН + СД также значимо увеличивали шанс летального исхода (ОШ 2,17; ДИ 1,53–3,08; p<0,01 и ОШ 4,21; 95 ДИ 2,78–6,38; p<0,01 соответственно) [3][28]. Интересно, что отмечалось повышение среднего уровня глюкозы в зависимости от наличия и количества коморбидных заболеваний: 5,44 ммоль/л для пациентов без ССЗ, 6,07 ммоль/л для пациентов с наличием одного ССЗ, 7,1 ммоль/л для пациентов с наличием 2 и 3 ССЗ и 7,79 ммоль/л для пациентов с наличием 4 ССЗ и более (p<0,01) [3].
Одной из важных задач настоящего исследования явилась оценка у пациентов с COVID-19 частоты новых случаев НУО, характера этих нарушений и их стойкости. По данным субанализа, ВВГ в периковидный период (11,6% случаев) реализовалась через 12 мес в 1,7% новых случаев СД2, который управлялся ПССП. Это свидетельствует о транзиторном характере «периковидной гипергликемии», но с учетом ее негативного влияния на течение и исходы инфекции требует ранней диагностики и серьезных усилий по своевременной коррекции.
К новым случаям СД в реконвалесценции COVID-19 приковано внимание большого количества исследователей. Различные тяжесть COVID-19, гендерный и этнический состав, разные штаммы SARS-CoV-2, доминирующие в тот или иной период пандемии, а также неунифицированные медикаментозные подходы по применению ГКС определяют чрезвычайно гетерогенные когорты для изучения частоты новых случаев СД [29]. Видимо, именно этим объясняется незначительное количество работ, которые бы проанализировали исходы ВВГ в отдаленном постковидном периоде, и именно это формирует острую потребность в таких исследованиях. Особняком здесь стоит убедительная работа W. Rathmann и соавт. [30], которые при оценке базы из 8,8 млн пациентов, сопоставив новые случаи СД после COVID-19 с таковыми после острого респираторного заболевания, установили на 28% более высокую частоту встречаемости после COVID-19 СД2, новые случаи которого были выявлены и в нашей работе.
В литературе имеется немало гипотез о возможных путях патологического взаимодействия SARS-CoV-2 и НУО. Точные механизмы, лежащие в их основе, окончательно неизвестны, но, вероятно, имеется целый ряд сложных взаимосвязей, включая непосредственное повреждение клеток поджелудочной железы со снижением секреции инсулина, воздействие острого воспалительного процесса с повышением инсулинорезистентности, стрессовую гипергликемию и негативное влияние терапии ГКС, приводящей к стероид-индуцированной гипергликемии (рис. 4).
Таким образом, взаимодействие между COVID-19 и СД можно охарактеризовать как двунаправленную связь между инфекционным процессом и НУО, осмысление которой и своевременные профилактические мероприятия позволят минимизировать негативное влияние этого опасного «тандема» на прогноз пациента не только в эту пандемию, но и в последующие.
Ограничения исследования
АКТИВ и АКТИВ 2 являются регистрами реальной клинической практики. Данные для некоторых переменных вводились по принципу «если известно» и не были обязательны для заполнения. В связи с этим существует некоторая потеря данных на этапе их ввода врачами-исследователями, и точность информации, полученной при телефонном разговоре, может быть ограничена. Также регистры заполнялись на разных этапах изменения федеральных клинических рекомендаций по ведению пациентов с НКИ (изменения касались в основном ведения и терапии пациентов с НКИ). Необходимо учесть, что в начале пандемии (весна и лето 2020 г.) фактическое количество госпитализаций по причине инфицирования SARS-CoV-2 было выше, чем необходимое по прямым медицинским показаниям, ввиду недостаточного количества информации о данной патологии, в связи с чем можно считать, что в регистре представлены пациенты с различной степенью тяжести COVID-19.
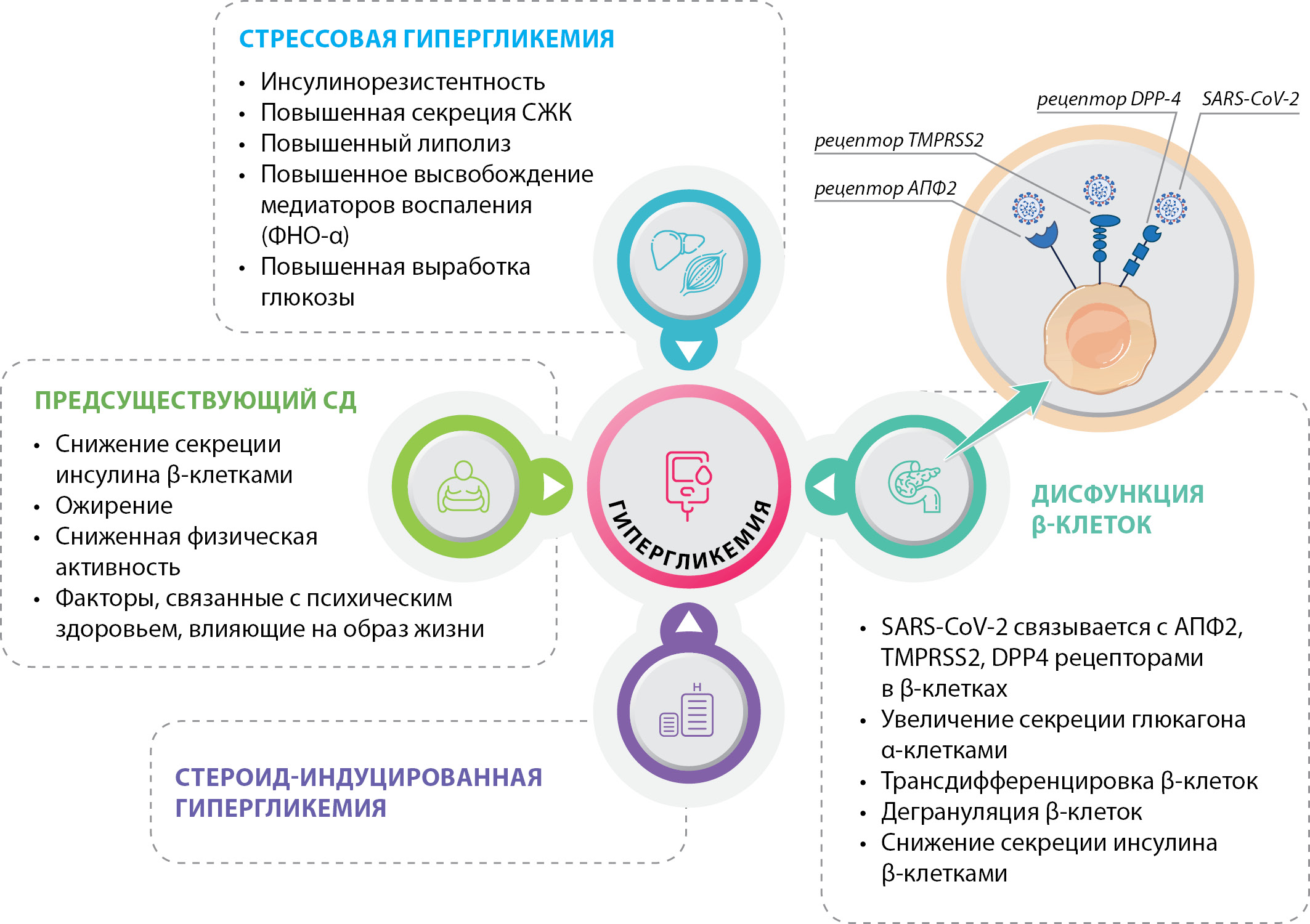
Рисунок 4. Возможные механизмы развития впервые выявленной гипергликемии/сахарного диабета у пациентов с COVID-19. Адаптировано [31].
Примечание. АПФ2 — ангиотензинпревращающий фермент 2; TMPRSS2 — трансмембранная серинпротеаза 2 типа; DPP-4 — дипептидилпептидаза-4 типа; СЖК — свободные жирные кислоты; ФНО-α — фактор некроза опухоли-альфа.
ЗАКЛЮЧЕНИЕ
На сегодняшний день представленный субанализ объединенных регистров АКТИВ и АКТИВ 2 является одним из самых масштабных — более 9 тысяч пациентов — исследованием, которое посвящено изучению влияния НУО на исходы COVID-19. Важной его особенностью следует считать оценку не только влияния ВВГ и СД2 на течение инфекции и летальность в периковидный период, но и исследование отдаленных исходов через 12 мес после COVID-19.
В результате исследования выявлено, что НУО приводят к ухудшению течения НКИ в виде более значимого поражения легочной ткани и дыхательной недостаточности, более выраженному иммуновоспалительному синдрому. Продемонстрировано, что периковидная гипергликемия (ВВГ+СД2) на 20% повышает шансы летального исхода, а его предикторами являются такие коморбидные состояния, как ИБС, ИМ или инсульт в анамнезе, более старший возраст.
Через год после перенесенной инфекции у пациентов с СД2 и ВВГ чаще сохраняются жалобы, характерные для постковидного синдрома, а ВВГ после острого периода заболевания нивелируется в 1,7% новых случаев пациентов с СД2.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Авторы декларируют отсутствие внешнего финансирования для проведения исследования и публикации статьи.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Салухов В.В. — концепция и дизайн исследования, получение и интерпретация результатов, написание рукописи; Арутюнов Г.П. — концепция и дизайн исследования, получение и интерпретация результатов; Тарловская Е.И. — концепция и дизайн исследования, получение и интерпретация результатов; Батлук Т.И. — получение и интерпретация результатов, написание рукописи, Башкинов Р.А. — получение и интерпретация результатов, написание рукописи; Самусь И.В. — статистический анализ данных, интерпретация результатов, написание рукописи; Мельников Е.С. — получение и интерпретация результатов; Трубникова М.А. — получение и интерпретация результатов; Арутюнов А.Г. — концепция и дизайн исследования, получение и интерпретация результатов, внесение правок. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Zanella A, Florio G, Antonelli M, et al. Time course of risk factors associated with mortality of 1260 critically ill patients with COVID-19 admitted to 24 Italian intensive care units. Intensive Care Med. 2021;47(9):995-1008. doi: https://doi.org/10.1007/s00134-021-06495-y
2. Renda G, Ricci F, Spinoni EG, et al. Predictors of mortality and cardiovascular outcome at 6 months after hospitalization for COVID-19. J Clin Med. 2022;11(3):729. doi: https://doi.org/10.3390/jcm11030729
3. Арутюнов Г.П., Тарловская Е.И., Арутюнов А.Г., и др. Регистр «Анализ динамики Коморбидных заболеваний у пациенТов, перенесшИх инфицироВание SARS-CoV-2» (АКТИВ). Оценка влияния комбинаций исходных сопутствующих заболеваний у пациентов с COVID-19 на прогноз // Терапевтический архив. — 2022. — Т. 94. — №1. — C. 32-47. doi: https://doi.org/10.26442/00403660.2022.01.201320
4. Дедов И.И., Шестакова М.В., Викулова О.К., и др. Динамика эпидемиологических показателей сахарного диабета в Российской Федерации за период 2017–2021 гг. / В кн. Сборник тезисов IX (XXVIII) Национального диабетологического конгресса с международным участием «Сахарный диабет и ожирение — неинфекционные междисциплинарные пандемии XXI века» 05-08 сентября 2022 года. — М.; 2022. — С. 61.
5. Дедов И.И., Шестакова М.В., Майоров А.Ю., и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом (10-й выпуск) // Сахарный диабет. — 2021. — Т. 24 — №S1. — С. 1-235. doi: https://doi.org/10.14341/DM12802
6. Bornstein SR, Rubino F, Khunti K, et al. Practical recommendations for the management of diabetes in patients with COVID-19. Lancet Diabetes Endocrinol. 2020;8(6):546-550. doi: https://doi.org/10.1016/S2213-8587(20)30152-2
7. Маркова Т.Н., Пономарева А.А., Самсонова И.В., и др. Факторы риска летального исхода у больных сахарным диабетом 2 типа и новой коронавирусной инфекцией // Эндокринология: новости, мнения, обучение. — 2022. — Т. 11. — №1. — C. 8-16. doi: https://doi.org/10.33029/2304-9529-2022-11-1-8-16
8. Sathish T, Kapoor N, Cao Y, et al. Proportion of newly diagnosed diabetes in COVID‐19 patients: A systematic review and meta‐analysis. Diabetes, Obes Metab. 2021;23(3):870-874. doi: https://doi.org/10.1111/dom.14269
9. Li H, Tian S, Chen T, et al. Newly diagnosed diabetes is associated with a higher risk of mortality than known diabetes in hospitalized patients with COVID‐19. Diabetes, Obes Metab. 2020;22(10):1897-1906. doi: https://doi.org/10.1111/dom.14099
10. Кононова А.А., Сурхаева А.А., Минаков А.А., Салухов В.В. Характер нарушений углеводного обмена у пациентов, получавших лечение по поводу пневмонии, вызванной SARS-CоV-2 // Известия Российской военно-медицинской академии. — 2022. — Т. 41. — №S2. — С. 215-221.
11. Арутюнов Г.П., Тарловская Е.И., Арутюнов А.Г., и др. Международный регистр «Анализ динамики Коморбидных заболеваний у пациенТов, перенесшИх инфицироВание SARS-CoV-2» (AКТИВ) и регистр «Анализ госпитализаций Коморбидных пациенТов ИнфицироВанных в период второй волны SARS-CoV-2» (AКТИВ 2) // Российский кардиологический журнал. — 2021. — Т. 26. — №3. — С. 4358. doi: https://doi.org/10.15829/1560-4071-2021-4358
12. Дедов И.И., Мокрышева Н.Г., Шестакова М.В., и др. Контроль гликемии и выбор антигипергликемической терапии у пациентов с сахарным диабетом 2 типа и COVID-19: консенсусное решение совета экспертов Российской ассоциации эндокринологов // Сахарный диабет. — 2022. — Т. 25. — №1. — С. 27-49. doi https://doi.org/10.14341/DM12873
13. Шестакова М.В., Викулова О.К., Исаков М.А., Дедов И.И. Сахарный диабет и COVID-19: анализ клинических исходов по данным регистра сахарного диабета российской федерации // Проблемы Эндокринологии. — 2020. — Т. 66. — №1. — С. 35-46. doi: https://doi.org/10.14341/probl12458
14. Smati S, Tramunt B, Wargny M, et al. COVID-19 and diabetes outcomes: rationale for and updates from the CORONADO study. Curr Diab Rep. 2022;22(2):53-63. doi: https://doi.org/10.1007/s11892-022-01452-5
15. Bode B, Garrett V, Messler J, et al. Glycemic characteristics and clinical outcomes of COVID-19 patients hospitalized in the United States. J Diabetes Sci Technol. 2020;14(4):813-821. doi: https://doi.org/10.1177/1932296820924469
16. Barron E, Bakhai C, Kar P, et al. Associations of type 1 and type 2 diabetes with COVID-19-related mortality in England: a whole-population study. Lancet Diabetes Endocrinol. 2020;8(10):813-822. doi: https://doi.org/10.1016/S2213-8587(20)30272-2
17. Varikasuvu SR, Dutt N, Thangappazham B, Varshney S. Diabetes and COVID-19: A pooled analysis related to disease severity and mortality. Prim Care Diabetes. 2021;15(1):24-27. doi: https://doi.org/10.1016/j.pcd.2020.08.015
18. Aggarwal G, Lippi G, Lavie CJ, et al. Diabetes mellitus association with coronavirus disease 2019 ( COVID‐19) severity and mortality: A pooled analysis. J Diabetes. 2020;12(11):851-855. doi: https://doi.org/10.1111/1753-0407.13091
19. Wang B, Li R, Lu Z, et al. Does comorbidity increase the risk of patients with COVID-19: evidence from meta-analysis. Aging (Albany NY). 2020;12(7):6049-6057. doi: https://doi.org/10.18632/aging.103000
20. Салухов В.В., Минаков А.А., Шарыпова Т.Г., и др. Нарушения углеводного обмена и их исходы в отдаленном периоде у госпитализированных пациентов с COVID-19 // Сахарный диабет. — 2022. — Т. 25. — №5. — С. 419-427. doi: https://doi.org/10.14341/DM12856
21. Li H, Tian S, Chen T, et al. Newly diagnosed diabetes is associated with a higher risk of mortality than known diabetes in hospitalized patients with COVID‐19. Diabetes, Obes Metab. 2020;22(10):1897-1906. doi: https://doi.org/10.1111/dom.14099
22. Fadini GP, Morieri ML, Longato E, Avogaro A. Prevalence and impact of diabetes among people infected with SARS-CoV-2. J Endocrinol Invest. 2020;43(6):867-869. doi: https://doi.org/10.1007/s40618-020-01236-2
23. Арутюнов А.Г., Сеферович П., Бакулин И.Г., и др. Реабилитация после COVID-19. Резолюция Международного совета экспертов Евразийской ассоциации терапевтов и Российского кардиологического общества // Российский кардиологический журнал. — 2021. — Т. 26. — №9. — С. 4694. doi: https://doi.org/10.15829/1560-4071-2021-4694
24. Lavery AM, Preston LE, Ko JY, et al. Clinical characteristics and day-90 outcomes of 4244 critically ill adults with COVID-19: a prospective cohort study. Intensive Care Med. 2021;47(1):60-73. doi: https://doi.org/10.1007/s00134-020-06294-x
25. Арутюнов Г.П., Тарловская Е.И., Арутюнов А.Г., и др. Клинические особенности постковидного периода. Результаты международного регистра «Анализ динамики коморбидных заболеваний у пациентов, перенесших инфицирование SARS-CoV-2 (АКТИВ SARSCoV-2)». Предварительные данные (6 месяцев наблюдения) // Российский кардиологический журнал. — 2021. — Т. 26. — №10. — С. 4708. doi: https://doi.org/10.15829/1560-4071-2021-4708
26. Lavery AM, Preston LE, Ko JY, et al. Characteristics of hospitalized COVID-19 patients discharged and experiencing same-hospital readmission — United States, march–august 2020. MMWR Morb Mortal Wkly Rep. 2020;69(45):1695-1699. doi: https://doi.org/10.15585/mmwr.mm6945e2
27. Shi Q, Zhang X, Jiang F, et al. Clinical characteristics and risk factors for mortality of COVID-19 patients with diabetes in Wuhan, China: A two-center, retrospective study. Diabetes Care. 2020;43(7):1382-1391. doi: https://doi.org/10.2337/dc20-0598
28. Арутюнов Г.П., Тарловская Е.И., Арутюнов А.Г., и др. Международный регистр «Анализ динамики Коморбидных заболеваний у пациенТов, перенесших инфицирование SARS-CoV-2» (АКТИВ SARS-CoV-2): анализ предикторов неблагоприятных исходов острой стадии новой коронавирусной инфекции // Российский кардиологический журнал. — 2021. — Т. 26. — №4. — С. 4470. doi: https://doi.org/10.15829/1560-4071-2021-4470
29. Чугунов А.А., Салухов В.В., Данцева О.В., и др. Некоторые аспекты применения глюкокортикоидных препаратов в комплексном лечении новой коронавирусной инфекции // Медицинский альянс. — 2021. — Т. 9. — №1. — С. 43-51. doi https://doi.org/10.36422/23076348-2021-9-1-43-51
30. Rathmann W, Kuss O, Kostev K. Incidence of newly diagnosed diabetes after Covid-19. Diabetologia. 2022;65(6):949-954. doi: https://doi.org/10.1007/s00125-022-05670-0
31. Khunti K, Del Prato S, Mathieu C, et al. COVID-19, hyperglycemia, and new-onset diabetes. Diabetes Care. 2021;44(12):2645-2655. doi: https://doi.org/10.2337/dc21-1318
Об авторах
В. В. СалуховРоссия
Салухов Владимир Владимирович – доктор медицинских наук, начальник 1-й кафедры (терапии усовершенствования врачей).
194044, Санкт-Петербург, ул. Академика Лебедева, д. 6
Конфликт интересов:
Нет
Г. П. Арутюнов
Россия
Арутюнов Григорий Павлович – доктор медицинских наук, профессор.
Москва
Конфликт интересов:
Нет
Е. И. Тарловская
Россия
Тарловская Екатерина Иосифовна - доктор медицинских наук, профессор.
Москва; Нижний Новгород
Конфликт интересов:
Нет
Т. И. Батлук
Россия
Батлук Татьяна Ивановна – кандидат медицинских наук.
Москва
Конфликт интересов:
Нет
Р. А. Башкинов
Россия
Башкинов Роман Андреевич.
Москва; Санкт-Петербург
Конфликт интересов:
Нет
И. В. Самусь
Россия
Самусь Ирина Валерьевна - кандидат медицинских наук.
Кемерово
Конфликт интересов:
Нет
Е. С. Мельников
Россия
Мельников Евгений Сергеевич.
Москва; Санкт-Петербург
Конфликт интересов:
Нет
М. А. Трубникова
Россия
Трубникова Марина Александровна.
Москва; Краснодар
Конфликт интересов:
Нет
А. Г. Арутюнов
Россия
Арутюнов Александр Григорьевич – доктор медицинских наук, профессор.
Москва; Ереван
Конфликт интересов:
Нет
Дополнительные файлы
|
|
1. Рисунок 1. ОШ (95% ДИ) наступления летального исхода в зависимости от характера нарушения углеводного обмена. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(96KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. ОШ (95% ДИ) вероятности наступления летального исхода для изучаемых предикторов. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(91KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. ROC-кривая, характеризующая зависимость вероятности наступления летального исхода от значений прогностической функции | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(117KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Возможные механизмы развития впервые выявленной гипергликемии/сахарного диабета у пациентов с COVID-19. Адаптировано [31]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(470KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Салухов В.В., Арутюнов Г.П., Тарловская Е.И., Батлук Т.И., Башкинов Р.А., Самусь И.В., Мельников Е.С., Трубникова М.А., Арутюнов А.Г. Влияние нарушений углеводного обмена на ранние и отдаленные клинические исходы у пациентов с COVID-19 по данным регистров АКТИВ и АКТИВ 2. Проблемы Эндокринологии. 2023;69(1):36-49. https://doi.org/10.14341/probl13175
For citation:
Salukhov V.V., Arutyunov G.P., Tarlovskaya E.I., Batluk T.I., Bashkinov R.A., Samus I.V., Melnikov E.S., Trubnikova M.A., Arutyunov A.G. The impact of carbohydrate metabolism disorders on the early and long-term clinical outcomes of patients with COVID-19 according to the AKTIV and AKTIV 2 registries. Problems of Endocrinology. 2023;69(1):36-49. https://doi.org/10.14341/probl13175

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).









































.jpg)


