Перейти к:
Этиопатогенетические особенности костного метаболизма пациентов с сахарным диабетом, осложненным диабетической нейроостеоартропатией
https://doi.org/10.14341/probl13362
Аннотация
Дистальная диабетическая нейропатия является одним из наиболее распространенных осложнений сахарного диабета (СД) и ассоциируется с медиакальцинозом артерий нижних конечностей, значительным снижением минеральной плотности костной ткани стоп и высокой частотой сердечно-сосудистых заболеваний (ССЗ). Медиакальциноз является индикатором тяжести и/или продолжительности заболевания, поскольку тесно связан с осложнениями диабета, в особенности с автономной нейропатией. Наличие медиакальциноза является важным маркером будущих сердечно-сосудистых нарушений у пациентов с СД. Изменения фосфорного-кальциевого обмена встречаются у пациентов с диабетической нейроостеоартропатией или стопой Шарко, когда наблюдается локальный остеопороз стоп и в 90% случаев происходит обызвествление сосудов нижних конечностей, а также изменение уровня витамина D и его метаболитов. Длительность течения СД и состояние компенсации значительно влияют на процесс минерально-костных нарушений. В данном обзоре обсуждаются особенности метаболизма витамина D, важность своевременной диагностики фосфорно-кальциевых нарушений и особенности терапии данной категории больных. Уделяется внимание своевременной диагностике острой стадии стопы Шарко на основании оценки отека костного мозга при проведении МРТ и возможности уменьшения срока иммобилизации пораженной конечности за счет его регресса.
Ключевые слова
Для цитирования:
Ярославцева М.В., Бондаренко О.Н., Эль-Тарави Я.А., Магеррамова С.Т., Пигарова Е.А., Ульянова И.Н., Галстян Г.Р. Этиопатогенетические особенности костного метаболизма пациентов с сахарным диабетом, осложненным диабетической нейроостеоартропатией. Проблемы Эндокринологии. 2024;70(4):57-64. https://doi.org/10.14341/probl13362
For citation:
Yaroslavceva M.V., Bondarenko O.N., El-Taravi Ya.A., Magerramova S.T., Pigarova E.A., Ulyanova I.N., Galstyan G.R. Etiopathogenetic features of bone metabolism in patients with diabetes mellitus and Charcot foot. Problems of Endocrinology. 2024;70(4):57-64. (In Russ.) https://doi.org/10.14341/probl13362
ВВЕДЕНИЕ
Диабетическая нейроостеоартропатия (ДНОАП), или стопа Шарко — тяжелое инвалидизирующее состояние, ассоциированное с сахарным диабетом (СД) и диабетическая нейропатия (ДН) [1], проявляющееся стойкой выраженной деформацией стопы с нарушением ее биомеханических свойств и высоким риском формирования обширных язв, что может приводить к развитию гнойно-некротического процесса в мягких тканях стопы и остеомиелиту, повышая риск ампутаций. Пациенты с неудовлетворительным контролем гликемии в течение длительного периода заболевания, сопутствующими хроническими микрососудистыми осложнениями, такими как хроническая болезнь почек и ДНОАП, имеют значимо более высокий риск последовательных структурных и гемодинамических нарушений, клинические последствия которых ассоциируются с высоким риском сердечно-сосудистых заболеваний (ССЗ) и смерти [2][3]. Сведения о частоте ДНОАП чрезвычайно вариабельны, от 0,15% всех пациентов с диабетом до 29% в популяции пациентов с ДН [4]. Противоречивость результатов обусловлена различной трактовкой изменений костной ткани, а также использованием неравнозначных по информативности методов диагностики. Различные исследования по распространенности остеоартропатии выявили высокую частоту ее развития у пациентов с длительностью диабета более 12 лет независимо от возраста, пола и типа диабета. У большинства пациентов процесс односторонний, тогда как двустороннее поражение встречается в 9–25% случаев [5].
Метаболические и структурные изменения в костной ткани при ДНОАП сопряжены с медиакальцинозом (МК) артерий нижних конечностей вследствие ДН, одного из наиболее распространенных осложнений СД. У пациентов со стопой Шарко наблюдается локальный остеопороз стоп, и в 90% случаев происходит обызвествление сосудов стоп и голеней (рис. 1 А, Б) [3] . Выявляемый рентгенологически МК артерий нижних конечностей нередко ошибочно принимают за облитерирующий атеросклероз, что приводит к неверной тактике лечения. Обызвествление стенок артерий может обнаруживаться и у лиц без нарушений углеводного обмена, причем с возрастом частота МК возрастает (от 5% у молодых до 37% у пожилых). При СД МК выявляется в среднем в 3 раза чаще, чем у лиц с нормальным углеводным обменом [6]. По данным ряда исследований, распространенность МК была выявлена у 17–42% пациентов с СД 2 типа (СД2) [7], у 27–40% пациентов с прогрессирующей ХБП [8].
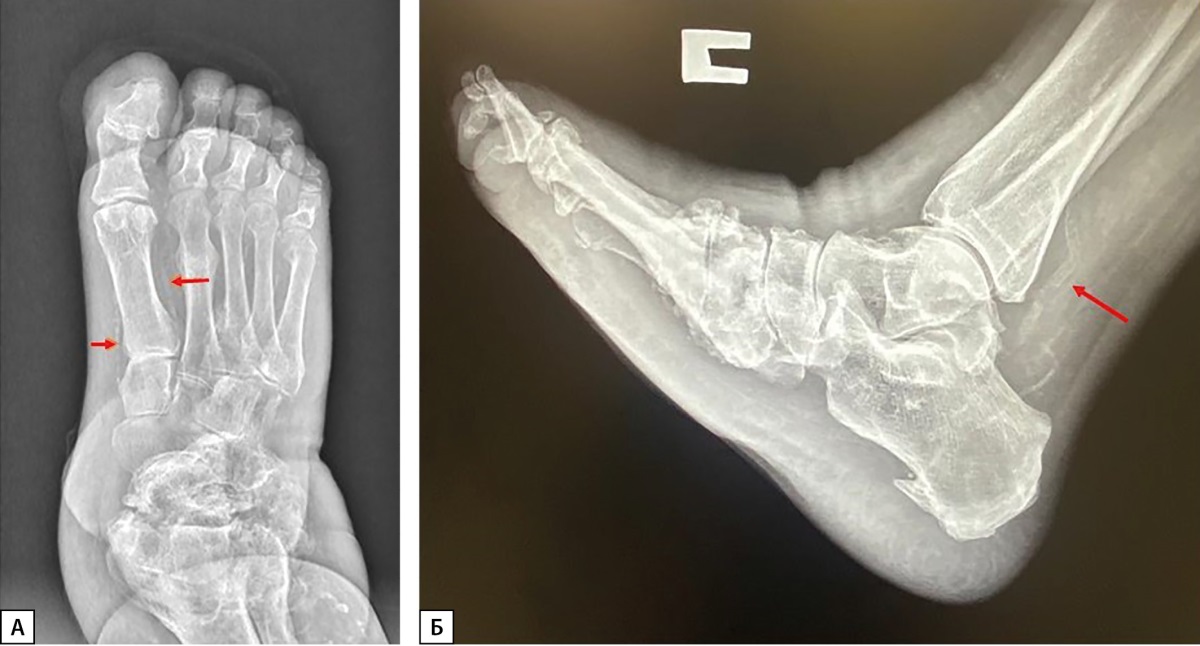
Рисунок 1. А. Рентгенограмма левой стопы пациента с ДНОАП в прямой проекции.
(стрелками обозначен медиакальциноз артерий стопы).
Б. Рентгенограмма правой стопы пациента с ДНОАП в боковой проекции
(стрелками обозначен медиакальциноз артерий стопы).
МК является индикатором тяжести и/или длительности заболевания, поскольку он тесно связан с осложнениями диабета, особенно с автономной нейропатией и хронической болезнью почек (ХБП). Данная категория больных находится в группе риска развития минерально-костных нарушений (МКН), которые в свою очередь могут усугублять течение ДНОАП, усиливая резорбцию костной ткани и эктопическую кальцификацию, клиническим следствием которой являются сердечно-сосудистые события и повышение смертности таких пациентов. Особенности метаболизма витамина D в патогенезе МКН при ДНОАП остаются малоизученными [9][12].
Известно, что пациенты с СД имеют повышенный риск переломов по сравнению с лицами без диабета. В 2021 г. Rabe et al. провели ретроспективный анализ большой группы пациентов с ДНОАП, указывающий на повышенный риск переломов и остеопороза у больных со стопой Шарко в сравнении с больными с СД без Шарко [13]. Исследования минеральной плотности кости (МПК), измеренной при помощи рентгеноденситометрии у пациентов с ДНОАП, показали снижение МПК пораженной стопы по сравнению с контрлатеральной конечностью. Однако данных о снижении МПК в позвоночнике и бедре нет, и это позволяет предположить, что костная патология у данной категории больных носит локальный характер [14][15].
Патогенез фосфорно-кальциевых нарушений у пациентов с СД малоизучен. На процесс ремоделирования костной ткани у пациентов с СД могут влиять такие факторы, как длительность СД, контроль заболевания, наличие хронических осложнений СД, в том числе ХБП, проведение заместительной почечной терапии (ЗПТ) или трансплантация солидных органов и получение иммуносупрессивной терапии. В литературе также обсуждается связь дефицита некоторых витаминов с ДНОАП [16][17]. В данной статье будет рассмотрено влияние перечисленных факторов на развитие стопы Шарко и их связь с дефицитом витамина D и его метаболизма.
Многофакторность патогенеза ДНОАП затрудняет ведение пациентов с длительным и осложненным течением СД. В данном обзоре обсуждаются этиопатогенетические особенности костного метаболизма у пациентов с СД, осложненным ДНОАП, важность своевременной диагностики фосфорно-кальциевых нарушений и особенности терапии у данной категории больных. Уделяется внимание своевременной диагностике острой стадии стопы Шарко на основании оценки отека костного мозга (ОКМ) при проведении МРТ и возможности уменьшения срока иммобилизации пораженной конечности за счет его регресса.
ЭТИОЛОГИЯ
Стопа Шарко обычно проявляется в виде асептического воспаления и прогрессирующей дегенерации костной ткани, что может приводить к спонтанным переломам и необратимым костным деформациям, что по сути проявляется разобщением процессов синтеза и резорбции костной ткани [1]. Существует гипотеза, что развитие ДНОАП запускается факторами, увеличивающими кровоток в конечностях при наличии у пациента изначальной предрасположенности к данному заболеванию вследствие наличия у него ДН. Такими факторами могут быть: легкая травма, предшествующая язва стопы и даже реваскуляризация. Однако, несмотря на доказанный факт развития остеоартропатии лишь при наличии ДН, прогнозировать ее развитие практически невозможно, так как она возникает далеко не у всех больных даже с выраженной нейропатией.
Согласно данным ряда исследований, МПК у больных СД выявляются в 30–67% случаев на уровне остеопении, а остеопороз — в 7–47% [17][18]. Сегодня существует множество исследований МПК у больных СД, показывающих, что риск переломов возрастает с увеличением продолжительности диабета и наличием его поздних осложнений. Так, нарушение функции почек приводит к снижению МПК, а диабетическая нейропатия, снижение остроты зрения и цереброваскулярные заболевания — к высокому риску падений и травмам нижних конечностей. Поскольку неудовлетворительный контроль гликемии ассоциирован с высоким риском переломов, большое внимание уделяется влиянию лекарственной терапии диабета. Исследование Meier et al. показало, что противодиабетические препараты из группы тиазолидиндионов, такие как пиоглитазон, увеличивают риск переломов у женщин с СД2 за счет снижения МПК, риск у мужчин менее очевиден [19]. В некоторых исследованиях метформин был связан со снижением риска переломов, а препараты сульфонилмочевины не влияли на МПК или частоту переломов. Ряд исследований инкретиномиметиков (ситаглиптин, лираглутид) продемонстрировал протективное действие на МПК [20], в экспериментальных исследованиях назначение аГПП-1 и иДПП-4 ассоциировалось с усилением костеобразования и снижением костной резорбции [21]. В исследованиях продемонстрирована статистически значимая связь применения канаглифлозина с высокой частотой переломов [22][23]. Напротив, применение других препаратов из группы ингибиторов НГЛТ-2 (эмпаглифлозин, дапаглифлозин) не влияет на риск развития переломов. Учитывая, что неудовлетворительный контроль СД снижает МПК и увеличивает риск переломов, необходима дальнейшая исследовательская работа над этими группами препаратов, чтобы уточнить их влияние на МПК.
ПАТОГЕНЕЗ
Изучение патогенеза стопы Шарко эволюционировало от нейротравматической и нейроваскулярной теории до концепции остеокласто-остеобластного дисбаланса, вызывающего резорбцию кости, деминерализацию и остеопению. Данная теория основана на взаимодействии локальных молекулярно-биологических механизмов, в том числе остеопротегерина (osteoprotegerin — OPG) и лиганда рецептора-активатора ядерного фактора каппа-В (RANKL), являющихся членами семейств лигандов и рецепторов фактора некроза опухолей (tumor necrosis factor — TNF). Исследования последних лет свидетельствуют о том, что они играют ключевую роль в формировании, дифференцировке и активности клеток костной ткани [24]. RANKL является ключевым фактором активации остеокластов (ОК). Связываясь со специфическим рецептором ОК, который обозначается как рецептор-активатор ядерного фактора каппа-В (RANK), RANKL стимулирует резорбирующую активность этих клеток. Полагают, что характер ремоделирования костной ткани во многом определяется соотношением продукции OPG и RANKL. OPG, связывая RANKL, предотвращает активирующее влияние последнего на RANK ОК, что снижает как остеокластогенез, так и активность ОК. Ряд исследований показал, что ОК пациентов с острой стадией стопы Шарко проявляли повышенную резорбтивную активность под воздействием RANKL [25], но опубликованы данные, показавшие, что повышенное соотношение RANKL/OPG присутствует только в острой стадии заболевания и не является постоянно повышенным у людей со стопой Шарко.
Система OPG/RANKL играет важную роль как в процессе кальцификации артерий, так и развитии локальной остеопении у больных СД [26]. Несмотря на большое количество исследований, посвященных системе RANK/RANK-L/OPG, а также существование моноклонального антитела к RANK-L Деносумаба, неясно, можно ли использовать остеопротегерин в качестве потенциальной мишени для разработки новых препаратов терапии МКН.
ОСОБЕННОСТИ КОСТНОГО МЕТАБОЛИЗМА У БОЛЬНЫХ ХБП
Длительное течение СД с неудовлетворительным контролем заболевания закономерно ведет к развитию поздних осложнений, в том числе к снижению функции почек. Почки являются ключевым органом, участвующим в фосфорно-кальциевом обмене, а прогрессирование ХБП ведет к дисбалансу процессов костного метаболизма и развитию МКН. МКН при ХБП ассоциированы с аномальным ремоделированием костной ткани, почечной остеодистрофией и внескелетной кальцификацией [27]. Последнее приводит к избыточной кальцификации сосудов и клапанов сердца и увеличению смертности от сердечно-сосудистых заболеваний, как на додиализных стадиях ХБП [28], так и у пациентов на гемодиализе [29].
Остеопения и остеопороз встречаются у пациентов с ХБП в 2–3 раза чаще, чем в общей популяции [30–32]. Известно, что риск переломов достоверно увеличивается с возрастом, тяжестью ХБП и продолжительностью диализа у пациентов с ХБП 5Д [33–35]. При этом установлено, что повышенный риск смертности при переломе шейки бедра значительно выше у пациентов со сниженной функцией почек [36]. При ХБП уровни витамина D и всех его метаболитов находятся под влиянием множества патогенетических процессов: снижается активность почечных ферментов — участников метаболизма витамина D в силу уменьшения количества функционирующей почечной ткани; изменяется катаболизм витамина D вследствие высоких уровней фактора роста фибробластов-23 и паратиреоидного гормона (ПТГ), имеющих дискордантный эффект на активность 24-гидроксилазы; происходит нарушение его всасывания в кишечнике, а также значительные его потери с мочой при выраженной протеинурии [37]. Сложностью в поддержании адекватного уровня фосфорно-кальциевого обмена также является низкая комплаентность пациентов, которым показано лечение препаратами витамина D. При этом оптимальный уровень витамина D, обеспечивающий защиту от переломов, все еще требует уточнения.
Учитывая повышенный риск переломов у пациентов с СД [38], рабочая группа Международного фонда остеопороза (International Osteoporosis Foundation — IOF), крупнейшая в мире неправительственная организация, занимающаяся профилактикой, диагностикой и лечением остеопороза и связанных с ним заболеваний опорно-двигательного аппарата, предложила использовать в качестве порогового значения для диагностики остеопороза у пациентов с СД -2,0 SD по Т-критерию вместо -2,5 SD. Такое изменение алгоритмов диагностики остеопороза у пациентов с СД позволит выявлять снижение МПК на более ранних стадиях и назначать своевременное лечение данной категории больных [39].
Сегодня вопрос относительно степени изменения метаболитов витамина D и маркеров костного метаболизма при стопе Шарко на разных ее стадиях все еще остается открытым. Отдельно хотелось бы обсудить особенности изменения метаболитов витамина D в сыворотке крови у пациентов с длительным течением СД и наличием множественных его осложнений. Имеющиеся данные указывают на биохимическую противоречивость связи уровня витамина D и его метаболитов с СД и его осложнениями [40]. Luo et al. предположили, что это противоречие может быть связано с тем, что некоторые метаболиты витамина D могут быть значительно снижены на фоне целевых значений общего витамина D. По данным метаанализа, удалось доказать, что низкие уровни 25(OH)D3 и 1,25(OH)2D3 играют значительную роль в развитии диабетической ретинопатии [41]. Butler et al. установили, что у пациентов с СД2 также наблюдались более низкие уровни всех метаболитов витамина D, за исключением 3-epi-25(OH)D3 [42]. Стоит отметить, что исследований, посвященных изучению метаболитов витамина D у пациентов ДНОАП, в литературе найдено не было. Это диктует необходимость проведения таких работ и установления роли витамина D и всех его метаболитов в развитии стопы Шарко.
При критическом снижении функции почек и терминальной стадии ХБП инициируется заместительная почечная терапия. МПК у пациентов на гемодиализе значительно ниже, чем в популяции [43]. В дополнение к этому, согласно ряду исследований, распространенность фосфорно-кальциевых нарушений среди пациентов, находящихся на диализе, достоверно выше, чем у пациентов без диализа [44][45]. Изменения уровней ПТГ, кальция и фосфора в сыворотке крови ассоциированы с повышенной смертностью пациентов на ЗПТ [46][47]. Учитывая, что более чем у половины пациентов на ЗПТ имеются отклонения от нормы уровня ПТГ [48], критически важно строго контролировать параметры минерального обмена у данной группы пациентов и своевременно его корректировать. Кроме того, у пациентов, перенесших аллотрансплантацию почки, может развиваться особый фенотип нарушений минерального обмена [49]. Пока достоверно неясно, какой механизм развития подобных нарушений у пациентов доминирующий: усугубление имевшихся на фоне СД фосфорно-кальциевых изменений, использование влияющих на МПК глюкокортикостероидов в классических схемах иммуносупрессивной терапии или остеодистрофия и дисфункция диаметра трансплантата. У пациентов на ЗПТ проблема кальцификации сосудов и смерти от сердечно-сосудистых заболеваний стоит более остро [50].
СВЯЗЬ КОСТНОГО МЕТАБОЛИЗМА С КОНЦЕНТРАЦИЕЙ ВИТАМИНА В12 И ФОЛИЕВОЙ КИСЛОТЫ
Ряд исследований указывает на наличие ассоциации гомоцистеина, витамина В12 и фолиевой кислоты с состоянием МПК, остеопорозом и развитием переломов у пациентов с СД и стопой Шарко [51][52]. В двух метаанализах подтверждается связь между высокой концентрацией гомоцистеина и риском переломов [53][54], а в исследовании Brattström et al. подтверждается, что такие показатели гомоцистеина ассоциированы с дефицитом витамина В12 и фолиевой кислоты [55]. Таким образом, дефицит витамина В12 и фолиевой кислоты могут быть ассоциированы с повышенным риском переломов у пациентов с СД. Кроме того, низкие концентрации витамина В12 коррелируют с низкими концентрациями остеокальцина в сыворотке крови. Однако остается неясным, уменьшает ли дополнительный прием витаминов группы В риск развития переломов. Кроме того, в литературе не было найдено исследований, посвященных изучению содержания витамина В12, фолиевой кислоты, гомоцистеина у больных со стопой Шарко. Широко известно, что витамин В12 необходим для правильного функционирования периферической и центральной нервных систем, обеспечивает передачу нервных импульсов. Недостаток витамина В12 (менее 400 пмоль/л) развивается у пациентов, получающих метформин (препарат первой линии, применяемый для лечения СД2), уже через 3–6 месяцев после начала терапии, что вызывает демиелинизацию и поражение нервных волокон с явлениями нейропатии. К данной группе риска также относятся пациенты после бариатрических вмешательств, у которых из-за нарушения всасывания высока вероятность развития дефицита витамина В12. Периферическая нейропатия увеличивает риск развития синдрома диабетической стопы, ДНОАП. Следовательно, своевременное лечение полинейропатии может привести к снижению риска развития ДНОАП. Существуют исследования, результаты которых показывают уменьшение симптомов полинейропатии у пациентов, длительное время дополнительно получающих витамин В12. Отмечается улучшение качества жизни, снижение болевого синдрома, однако в клинической практике назначение препаратов витамина В12 широкого применения не получило.
ДИАГНОСТИКА
С учетом высокого процента ампутаций нижних конечностей у больных СД, последующей инвалидизации и послеампутационной летальности данной категории пациентов, особую актуальность приобретает проблема наиболее ранней диагностики стопы Шарко. Рентгенография стоп при ДНОАП может характеризоваться неизмененной картиной, поэтому на этом этапе у таких пациентов важно своевременное проведение МРТ стоп или трехфазной сцинтиграфии костей с целью выявления отека костного мозга (ОКМ), повышенной резорбции кости в пораженной стопе и локального снижения МПК. Основные сложности возникают при диагностике острой стадии стопы Шарко, когда при наличии типичной клинической картины рентгенографические изменения отсутствуют. В таких случаях необходимо назначение дополнительных методов исследования. Предложенная Е.А. Shantelau и G. Grutzner в 2014 г. классификация ДНОАП на основании клинической картины и результатов МРТ описывает обязательные и возможные качественные признаки поражения костной ткани на разных стадиях ДНОАП и не отражает количественную оценку этих изменений [56].
Преимуществом МРТ перед рентгенографией стопы является ее способность визуализировать мягкие ткани и ОКМ, что позволяет диагностировать ДНОАП уже на этапе ОКМ, внутрикостных кист и микропереломов, а также проводить дифференциальную диагностику между остеомиелитом и стопой Шарко. Внедрение количественной оценки ОКМ на МРТ позволит более точно оценить активность патологического процесса в костях и мягких тканях, а также уменьшить длительность иммобилизации пораженной конечности (за счет регресса ОКМ), что в свою очередь приведет к снижению частоты ампутаций.
МРТ является наилучшим методом визуализации мониторинга активности ДНОАП. До тех пор, пока на МРТ визуализируется ОКМ, необходимо продолжать лечебные мероприятия, в том числе разгрузку конечности при помощи индивидуальной разгрузочной повязки (ИРП), о чем подробнее будет сказано ниже. После значительного уменьшения или полного исчезновения ОКМ гипсовую повязку можно снять и рекомендовать пациенту специальную ортопедическую обувь и стельки.
Наличие столь эффективного метода визуализации активности ДНОАП диктует необходимость в разработке специальной клинической шкалы на основе данных МРТ стоп. Такая шкала может быть направлена как на диагностику острой стадии процесса, так и оценку эффективности терапии, и переход активности процесса в стадию ремиссии на основании выраженности ОКМ. Попытки ввести подобные шкалы в клиническую практику уже были [57][58]. Однако цели данных исследований были преимущественно направлены на изучение диагностики острой стадии ДНОАП, а их масштаб не позволяет пока в полной мере оценить эффективность и безопасность данной методики. Вопрос проведения крупных рандомизированных клинических испытаний является сегодня наиболее актуальным, и ответ на него позволит увеличить эффективность диагностики и лечения пациентов со стопой Шарко и улучшить их качество жизни.
ЛЕЧЕНИЕ
На данный момент единственными эффективными методами терапии ДНОАП и предотвращением прогрессирования деформации поврежденной конечности являются иммобилизация и разгрузка пораженного сустава при помощи ИРП. Стандартом иммобилизации считается несъемная индивидуальная разгрузочная повязка (ИРП) из полимерных материалов Тotal Contact Cast. Иммобилизация конечности продолжается до исчезновения отека, гиперемии, снижения температуры кожных покровов пораженной стопы и рентгенологически или с помощью МРТ подтвержденной консолидации костных отломков. В большинстве случаев длительность лечения — не менее 4–6 месяцев, иногда достигает 1 года. Учитывая, что терапевтический подход в группе пациентов со стопой Шарко ограничен, а единственным значимым методом профилактики является поддержание гликемических показателей в пределах индивидуальных целевых норм, существует необходимость проведения новых исследований, которые позволят в будущем расширить спектр лечения. При наличии выраженной деформации стопы проводится хирургическое лечение — реконструктивное (с применением внешней или внутренней фиксации) и резекция пролабирующих/выступающих фрагментов костей стопы с последующей иммобилизацией и динамическим наблюдением.
Применяемые в различное время лекарственные препараты, влияющие на метаболизм костной ткани, для лечения стопы Шарко не доказали своей клинической эффективности и не нашли применения в рутинной практике. Инъекции бисфосфанатов, обладающие антирезорбтивным эффектом, применялись у пациентов с острой стадией ДНОАП и вызывали значительное снижение температуры кожи над пораженными участками стоп. Выявлялось также снижение маркеров резорбции костной ткани по сравнению с группой плацебо, однако применение бисфосфонатов ассоциировалось с развитием большего количества их побочных эффектов. Бисфосфонаты не сокращали время иммобилизации пораженной конечности в индивидуальной разгрузочной повязке. Более того, не доступны никакие данные относительно их долгосрочных эффектов. Применяемый в клинической практике назальный спрей с кальцитонином, обогащенным кальцием и влияющий непосредственно на систему RANKL/OPG у больных СД со стопой Шарко, продемонстрировал снижение маркеров костной резорбции через 3 месяца применения в сравнении с группой, получавшей только препараты кальция [59]. В своем исследовании Busch-Westbroek et al. применяли моноклональное антитело RANKL у больных с СД и ДНОАП. Однократную дозу антител RANKL (деносумаб) подкожно вводили 11 пациентам, на фоне чего отмечалось снижение сроков консолидации переломов пораженной конечности и сроков иммобиллизации в сравнении с контрольной группой на 70 дней [60]. Исследований влияния деносумаба на МПКТ и возникновение рисков переломов у больных СД сегодня в литературе нет. В 2019 г. Rastogi et al. провели аналогичное исследование, посвященное терипаратиду (рекомбинантный паратиреоидный гормон человека), препарату для лечения остеопороза, повышающему плотность и прочность костной ткани. Препарат вводился 10 пациентам с хронической стадией стопы Шарко, продемонстрировав увеличение скорости ремоделирования костной ткани и увеличение МПК [61]. Других подобных исследований у больных с СД и стопой Шарко не проводилось.
ЗАКЛЮЧЕНИЕ
Представленный обзор литературы отражает многофакторность патогенеза поражения костной ткани у больных СД (ХБП, длительный прием иммуносупрессивной терапии, включающей глюкокортикоиды, периферическая полинейропатия тяжелой степени, ВГПТ, дефицит витаминов и их метаболитов), что определяет трудности коррекции и особенности течения заболевания. Требуется дальнейшее изучение выявленных особенностей метаболизма витамина D у пациентов с ДНОАП. Необходимы поиск и разработка препаратов, направленных на регенерацию костного матрикса у больных с ДНОАП и ХБП. А своевременная диагностика и лечение острой стадии ДНОАП позволят снизить риски инвалидизации у данной категории больных.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Исследование выполнено за счет гранта Российского научного фонда №19-15-00243, https://rscf.ru/project/19-15-00243/
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Jansen RB, Svendsen OL. A review of bone metabolism and developments in medical treatment of the diabetic Charcot foot. J Diabetes Complications. 2018;32(7):708-712. doi: https://doi.org/10.1016/j.jdiacomp.2018.04.010
2. Lehto S, Niskanen L, Suhonen M, Rönnemaa T, Laakso M. Medial artery calcification. A neglected harbinger of cardiovascular complications in non-insulin-dependent diabetes mellitus. Arterioscler Thromb Vasc Biol. 1996;16(8):978-983. doi: https://doi.org/10.1161/01.atv.16.8.978
3. Jeffcoate W. Vascular calcification and osteolysis in diabetic neuropathy-is RANK-L the missing link? Diabetologia. 2004;47(9):1488-1492. doi: https://doi.org/10.1007/s00125-004-1477-5
4. Frykberg RG, Belczyk R. Epidemiology of the Charcot foot. Clin Podiatr Med Surg. 2008;25(1):17-v. doi: https://doi.org/10.1016/j.cpm.2007.10.001
5. Jeffcoate W, Lima J, Nobrega L. The Charcot foot. Diabet Med. 2000;17(4):253-258. doi: https://doi.org/10.1046/j.1464-5491.2000.00233.x
6. Doherty TM, Fitzpatrick LA, Inoue D, et al. Molecular, endocrine, and genetic mechanisms of arterial calcification. Endocr Rev. 2004;25(4):629-672. doi: https://doi.org/10.1210/er.2003-0015
7. Lanzer P, Hannan FM, Lanzer JD, et al. Medial Arterial Calcification: JACC State-of-the-Art Review. J Am Coll Cardiol. 2021;78(11):1145-1165. doi: https://doi.org/10.1016/j.jacc.2021.06.049
8. Nelson AJ, Raggi P, Wolf M, Gold AM, Chertow GM, Roe MT. Targeting Vascular Calcification in Chronic Kidney Disease. JACC Basic Transl Sci. 2020;5(4):398-412. doi: https://doi.org/10.1016/j.jacbts.2020.02.002
9. Yammine K, Hayek F, Assi C. Is there an association between vitamin D and diabetic foot disease? A meta-analysis. Wound Repair Regen. 2020;28(1):90-96. doi: https://doi.org/10.1111/wrr.12762
10. Greenhagen RM, Frykberg RG, Wukich DK. Serum vitamin D and diabetic foot complications. Diabet Foot Ankle. 2019;10(1):1579631. doi: https://doi.org/10.1080/2000625X.2019.1579631
11. Pilz S, Iodice S, Zittermann A, Grant WB, Gandini S. Vitamin D status and mortality risk in CKD: a meta-analysis of prospective studies. Am J Kidney Dis. 2011;58(3):374-382. doi: https://doi.org/10.1053/j.ajkd.2011.03.020
12. Jayedi A, Soltani S, Shab-Bidar S. Vitamin D status and all-cause mortality in patients with chronic kidney disease: A systematic review and dose-response meta-analysis. J Clin Endocrinol Metab. 2017;102(7):2136-2145. doi: https://doi.org/10.1210/jc.2017-00105
13. Rabe OC, Winther-Jensen M, Allin KH, Svendsen OL. Fractures and Osteoporosis in Patients With Diabetes With Charcot Foot. Diabetes Care. 2021;44(9):2033-2038. doi: https://doi.org/10.2337/dc21-0369
14. Petrova NL, Edmonds ME. A prospective study of calcaneal bone mineral density in acute Charcot osteoarthropathy. Diabetes Care. 2010;33(10):2254-2256. doi: https://doi.org/10.2337/dc10-0636
15. Jansen RB, Christensen TM, Bülow J, et al. Bone mineral density and markers of bone turnover and inflammation in diabetes patients with or without a Charcot foot: An 8.5-year prospective case-control study. J Diabetes Complications. 2018;32(2):164-170. doi: https://doi.org/10.1016/j.jdiacomp.2017.11.004
16. Qu GB, Wang LL, Tang X, Wu W, Sun YH. The association between vitamin D level and diabetic peripheral neuropathy in patients with type 2 diabetes mellitus: An update systematic review and meta-analysis. J Clin Transl Endocrinol. 2017;9:25-31. doi: https://doi.org/10.1016/j.jcte.2017.04.001
17. Kemink SA, Hermus AR, Swinkels LM, Lutterman JA, Smals AG. Osteopenia in insulin-dependent diabetes mellitus; prevalence and aspects of pathophysiology. J Endocrinol Invest. 2000;23(5):295-303. doi: https://doi.org/10.1007/BF03343726
18. Liao CC, Lin CS, Shih CC, et al. Increased risk of fracture and postfracture adverse events in patients with diabetes: two nationwide population-based retrospective cohort studies [published correction appears in Diabetes Care. 2017;40(8):1134]. Diabetes Care. 2014;37(8):2246-2252. doi: https://doi.org/10.2337/dc17-er08c
19. Meier C, Schwartz AV, Egger A, Lecka-Czernik B. Effects of diabetes drugs on the skeleton. Bone. 2016;82:93-100. doi: https://doi.org/10.1016/j.bone.2015.04.026
20. Yamada C, Yamada Y, Tsukiyama K, et al. The murine glucagon-like peptide-1 receptor is essential for control of bone resorption. Endocrinology. 2008;149(2):574-579. doi: https://doi.org/10.1210/en.2007-1292
21. Henriksen DB, Alexandersen P, Bjarnason NH, et al. Role of gastrointestinal hormones in postprandial reduction of bone resorption. J Bone Miner Res. 2003;18(12):2180-2189. doi: https://doi.org/10.1359/jbmr.2003.18.12.2180
22. Zhang YS, Zheng YD, Yuan Y, Chen SC, Xie BC. Effects of Anti-Diabetic Drugs on Fracture Risk: A Systematic Review and Network Meta-Analysis. Front Endocrinol (Lausanne). 2021;12:735824. doi: https://doi.org/10.3389/fendo.2021.735824
23. Lou Y, Yu Y, Duan J, et al. Sodium-glucose cotransporter 2 inhibitors and fracture risk in patients with type 2 diabetes mellitus: a meta-analysis of randomized controlled trials. Ther Adv Chronic Dis. 2020;11:2040622320961599. doi: https://doi.org/10.1177/2040622320961599
24. Schoppet M, Al-Fakhri N, Franke FE, et al. Localization of osteoprotegerin, tumor necrosis factor-related apoptosis-inducing ligand, and receptor activator of nuclear factor-kappaB ligand in Mönckeberg’s sclerosis and atherosclerosis. J Clin Endocrinol Metab. 2004;89(8):4104-4112. doi: https://doi.org/10.1210/jc.2003-031432
25. Petrova NL, Petrov PK, Edmonds ME, Shanahan CM. Novel use of a Dektak 150 surface profiler unmasks differences in resorption pit profiles between control and Charcot patient osteoclasts [published correction appears in Calcif Tissue Int. 2014;94(4):412-3]. Calcif Tissue Int. 2014;94(4):403-411. doi: https://doi.org/10.1007/s00223-013-9820-9
26. Yaroslavtseva МV, Ul’yanova IN, Galstyan GR, Ilin AV, Nikankina LV, Remizov OV, Dedov II. The system of osteoprotegrin (OPG)/ligand of NF-kB receptor activator (RANKL) in patients with diabetes mellitus, mediacalcinosis and obliteratingatherosclerosis of lower leg arteries. Diabetes mellitus. 2009;12(1):25-28. doi: https://doi.org/10.14341/2072-0351-5416
27. Wang AY, Akizawa T, Bavanandan S, et al. 2017 Kidney Disease: Improving Global Outcomes (KDIGO) Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD) Guideline Update Implementation: Asia Summit Conference Report. Kidney Int Rep. 2019;4(11):1523-1537. doi: https://doi.org/10.1016/j.ekir.2019.09.007
28. KDOQI; National Kidney Foundation. KDOQI Clinical Practice Guidelines and Clinical Practice Recommendations for Anemia in Chronic Kidney Disease [published correction appears in Am J Kidney Dis. 2006;48(3):518]. Am J Kidney Dis. 2006;47(5 Suppl 3):S11-S145. doi: https://doi.org/10.1053/j.ajkd.2006.03.010
29. Tentori F, Blayney MJ, Albert JM, et al. Mortality risk for dialysis patients with different levels of serum calcium, phosphorus, and PTH: the Dialysis Outcomes and Practice Patterns Study (DOPPS). Am J Kidney Dis. 2008;52(3):519-530. doi: https://doi.org/10.1053/j.ajkd.2008.03.020
30. Cailleaux PE, Ostertag A, Metzger M, et al. Longitudinal Bone Loss Occurs at the Radius in CKD. Kidney Int Rep. 2021;6(6):1525-1536. doi: https://doi.org/10.1016/j.ekir.2021.03.874
31. Nickolas TL, McMahon DJ, Shane E. Relationship between moderate to severe kidney disease and hip fracture in the United States. J Am Soc Nephrol. 2006;17(11):3223-3232. doi: https://doi.org/10.1681/ASN.2005111194
32. Ureña P, Bernard-Poenaru O, Ostertag A, et al. Bone mineral density, biochemical markers and skeletal fractures in haemodialysis patients. Nephrol Dial Transplant. 2003;18(11):2325-2331. doi: https://doi.org/10.1093/ndt/gfg403
33. Moe SM, Nickolas TL. Fractures in Patients with CKD: Time for Action. Clin J Am Soc Nephrol. 2016;11(11):1929-1931. doi: https://doi.org/10.2215/CJN.09500916
34. 34. Iseri K, Carrero JJ, Evans M, et al. Incidence of Fractures Before and After Dialysis Initiation. J Bone Miner Res. 2020;35(12):2372-2380. doi: https://doi.org/10.1002/jbmr.4141
35. Naylor KL, Garg AX, Zou G, et al. Comparison of fracture risk prediction among individuals with reduced and normal kidney function. Clin J Am Soc Nephrol. 2015;10(4):646-653. doi: https://doi.org/10.2215/CJN.06040614
36. Nitsch D, Mylne A, Roderick PJ, Smeeth L, Hubbard R, Fletcher A. Chronic kidney disease and hip fracture-related mortality in older people in the UK. Nephrol Dial Transplant. 2009;24(5):1539-1544. doi: https://doi.org/10.1093/ndt/gfn678
37. Ureña Torres PA, Souberbielle JC, Solal MC. Bone Fragility in Chronic Kidney Disease Stage 3 to 5: The Use of Vitamin D Supplementation. Metabolites. 2022;12(3):266. doi: https://doi.org/10.3390/metabo12030266
38. Valderrábano RJ, Linares MI. Diabetes mellitus and bone health: epidemiology, etiology and implications for fracture risk stratification. Clin Diabetes Endocrinol. 2018;4:9. doi: https://doi.org/10.1186/s40842-018-0060-9
39. Ferrari SL, Abrahamsen B, Napoli N, et al. Diagnosis and management of bone fragility in diabetes: an emerging challenge. Osteoporos Int. 2018;29(12):2585-2596. doi: https://doi.org/10.1007/s00198-018-4650-2
40. Zheng JS, Luan J, Sofianopoulou E, et al. The association between circulating 25-hydroxyvitamin D metabolites and type 2 diabetes in European populations: A meta-analysis and Mendelian randomisation analysis. PLoS Med. 2020;17(10):e1003394. doi: https://doi.org/10.1371/journal.pmed.1003394
41. Luo BA, Gao F, Qin LL. The Association between Vitamin D Deficiency and Diabetic Retinopathy in Type 2 Diabetes: A Meta-Analysis of Observational Studies. Nutrients. 2017;9(3):307. doi: https://doi.org/10.3390/nu9030307
42. Butler AE, Dargham SR, Latif A, et al. Association of vitamin D3 and its metabolites in patients with and without type 2 diabetes and their relationship to diabetes complications. Ther Adv Chronic Dis. 2020;11:2040622320924159. doi: https://doi.org/10.1177/2040622320924159
43. Yun HJ, Ryoo SR, Kim JE, et al. Trabecular bone score may indicate chronic kidney disease-mineral and bone disorder (CKD-MBD) phenotypes in hemodialysis patients: a prospective observational study. BMC Nephrol. 2020;21(1):299. doi: https://doi.org/10.1186/s12882-020-01944-0
44. Díaz López JB, Jorgetti V, Caorsi H, et al. Epidemiology of renal osteodystrophy in Iberoamerica. Nephrol Dial Transplant. 1998;13(3):41-45. doi: https://doi.org/10.1093/ndt/13.suppl_3.41
45. Araújo SM, Ambrosoni P, Lobão RR, et al. The renal osteodystrophy pattern in Brazil and Uruguay: an overview. Kidney Int Suppl. 2003;(85):S54-S56. doi: https://doi.org/10.1046/j.1523-1755.63.s85.13.x
46. Naves-Díaz M, Passlick-Deetjen J, Guinsburg A, et al. Calcium, phosphorus, PTH and death rates in a large sample of dialysis patients from Latin America. The CORES Study. Nephrol Dial Transplant. 2011;26(6):1938-1947. doi: https://doi.org/10.1093/ndt/gfq304
47. Fernández-Martín JL, Carrero JJ, Benedik M, et al. COSMOS: the dialysis scenario of CKD-MBD in Europe. Nephrol Dial Transplant. 2013;28(7):1922-1935. doi: https://doi.org/10.1093/ndt/gfs418
48. Abrita RR, Pereira BDS, Fernandes NDS, et al. Evaluation of prevalence, biochemical profile, and drugs associated with chronic kidney disease-mineral and bone disorder in 11 dialysis centers. J Bras Nefrol. 2018;40(1):26-34. doi: https://doi.org/10.1590/2175-8239-JBN-3527
49. Torregrosa JV, Ferreira AC, Cucchiari D, Ferreira A. Bone Mineral Disease After Kidney Transplantation. Calcif Tissue Int. 2021;108(4):551-560. doi: https://doi.org/10.1007/s00223-021-00837-0
50. Chen NC, Hsu CY, Chen CL. The Strategy to Prevent and Regress the Vascular Calcification in Dialysis Patients. Biomed Res Int. 2017;2017:9035193. doi: https://doi.org/10.1155/2017/9035193
51. Sharif PS, Abdollahi M. The role of platelets in bone remodeling. Inflamm Allergy Drug Targets. 2010;9(5):393-399. doi: https://doi.org/10.2174/187152810793938044
52. Salari P, Abdollahi M. Controversial effects of non-steroidal anti-inflammatory drugs on bone: a review. Inflamm Allergy Drug Targets. 2009;8(3):169-175. doi: https://doi.org/10.2174/187152809788681065
53. van Wijngaarden JP, Doets EL, Szczecińska A, et al. Vitamin B12, folate, homocysteine, and bone health in adults and elderly people: a systematic review with meta-analyses. J Nutr Metab. 2013;2013:486186. doi: https://doi.org/10.1155/2013/486186
54. Yang J, Hu X, Zhang Q, Cao H, Wang J, Liu B. Homocysteine level and risk of fracture: A meta-analysis and systematic review. Bone. 2012;51(3):376-382. doi: https://doi.org/10.1016/j.bone.2012.05.024
55. Brattström L. Vitamins as homocysteine-lowering agents. J Nutr. 1996;126(4 Suppl):1276S-80S. doi: https://doi.org/10.1093/jn/126.suppl_4.1276S
56. Chantelau EA, Grützner G. Is the Eichenholtz classification still valid for the diabetic Charcot foot?. Swiss Med Wkly. 2014;144:w13948. doi: https://doi.org/10.4414/smw.2014.13948
57. Chantelau EA, Antoniou S, Zweck B, Haage P. Follow up of MRI bone marrow edema in the treated diabetic Charcot foot - a review of patient charts. Diabet Foot Ankle. 2018;9(1):1466611. doi: https://doi.org/10.1080/2000625X.2018.1466611
58. Gooday C, Game F, Woodburn J, et al. A randomised feasibility study of serial magnetic resonance imaging to reduce treatment times in Charcot neuroarthropathy in people with diabetes (CADOM). J Foot Ankle Res. 2023;16(1):2. doi: https://doi.org/10.1186/s13047-023-00601-7
59. Bem R, Jirkovská A, Fejfarová V, Skibová J, Jude EB. Intranasal calcitonin in the treatment of acute Charcot neuroosteoarthropathy: a randomized controlled trial. Diabetes Care. 2006;29(6):1392-1394. doi: https://doi.org/10.2337/dc06-0376
60. Busch-Westbroek TE, Delpeut K, Balm R, et al. Effect of Single Dose of RANKL Antibody Treatment on Acute Charcot Neuro-osteoarthropathy of the Foot. Diabetes Care. 2018;41(3):e21-e22. doi: https://doi.org/10.2337/dc17-1517
61. Rastogi A, Hajela A, Prakash M, et al. Teriparatide (recombinant human parathyroid hormone [1-34]) increases foot bone remodeling in diabetic chronic Charcot neuroarthropathy: a randomized double-blind placebo-controlled study. J Diabetes. 2019;11(9):703-710. doi: https://doi.org/10.1111/1753-0407.12902
Об авторах
М. В. ЯрославцеваРоссия
Ярославцева Марианна Викторовна - к.м.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
О. Н. Бондаренко
Россия
Бондаренко Ольга Николаевна - к.м.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Я. А. Эль-Тарави
Россия
Эль-Тарави Ясмин Ахмед Али
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
С. Т. Магеррамова
Россия
Магеррамова Сара Тофиковна
117292, Москва, ул. Дмитрия Ульянова, д. 11
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Е. А. Пигарова
Россия
Пигарова Екатерина Александровна - д.м.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
И. Н. Ульянова
Россия
Ульянова Ирина Николаевна - к.м.н., главный врач.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Г. Р. Галстян
Россия
Галстян Гагик Радикович - д.м.н., профессор.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Дополнительные файлы
|
|
1. Рисунок 1. А. Рентгенограмма левой стопы пациента с ДНОАП в прямой проекции. (стрелками обозначен медиакальциноз артерий стопы). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(248KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Ярославцева М.В., Бондаренко О.Н., Эль-Тарави Я.А., Магеррамова С.Т., Пигарова Е.А., Ульянова И.Н., Галстян Г.Р. Этиопатогенетические особенности костного метаболизма пациентов с сахарным диабетом, осложненным диабетической нейроостеоартропатией. Проблемы Эндокринологии. 2024;70(4):57-64. https://doi.org/10.14341/probl13362
For citation:
Yaroslavceva M.V., Bondarenko O.N., El-Taravi Ya.A., Magerramova S.T., Pigarova E.A., Ulyanova I.N., Galstyan G.R. Etiopathogenetic features of bone metabolism in patients with diabetes mellitus and Charcot foot. Problems of Endocrinology. 2024;70(4):57-64. (In Russ.) https://doi.org/10.14341/probl13362

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).









































.jpg)


