Перейти к:
Метастатическое поражение гипофиза
https://doi.org/10.14341/probl13395
Аннотация
Метастатическое поражение гипофиза является редким состоянием и диагностируется в 1,8–4% случаев. Авторы представляют трех пациентов с метастатическим поражением гипофиза, которые подверглись нейрохирургическому лечению в ГНЦ ФГБУ НМИЦ эндокринологии с последующим патоморфологическим подтверждением диагноза. Первичными опухолями были рак молочной железы, карциноид легкого, светлоклеточный рак почки. У двух пациентов были также обнаружены отдаленные метастазы, кроме гипофиза. Клиническая манифестация заключалась в появлении симптомов пангипопитуитаризма, хиазмального синдрома и масс-эффекта во всех случаях. Период наблюдения после хирургического лечения составил 0,25–2,5 года. У двух пациенток отмечено прогрессирование основного заболевания. Одной из них проводилось стереотаксическое радиохирургическое лечение и стереотаксическое облучение. У одного пациента состояние стабильно. Наблюдение и лечение таких пациентов является сложной задачей и требует повышенного внимания со стороны мультидисциплинарной команды специалистов.
Для цитирования:
Лапшина А.М., Базарова Е.А., Пржиялковская Е.Г., Хандаева П.М., Азизян В.Н., Григорьев А.Ю., Иващенко О.В., Тарбаева Н.В., Белая Ж.Е. Метастатическое поражение гипофиза. Проблемы Эндокринологии. 2024;70(5):46-53. https://doi.org/10.14341/probl13395
For citation:
Lapshina A.M., Bazarova E.A., Przhialkovskaya E.G., Khandaeva P.M., Azizyan V.N., Grigoriev A.Yu., Ivashchenko O.V., Tarbaeva N.V., Belaya Zh.E. Metastatic pituitary lesion. Problems of Endocrinology. 2024;70(5):46-53. (In Russ.) https://doi.org/10.14341/probl13395
ВВЕДЕНИЕ
Гипофиз является достаточно редкой мишенью для распространения метастазов из различных первичных злокачественных опухолей. Процесс метастазирования и непосредственно сама патология недостаточно изучены.
Известно, что среди всех интракраниальных метастазов вторичные очаги в гипофизе составляют 3%, в операционном материале частота диагностики достигает 1,8%, по данным аутопсий, несколько больше — до 4% у пациентов с известным онкологическим заболеванием [1, 2].
В систематическом обзоре Sam Ng et al. [2] показано, что наиболее распространенные злокачественные опухоли, которые метастазируют в гипофиз, были рак легких (31%) и рак молочной железы (26%). Третье место занимает рак почки (8,1%).
Распределение по полу в достаточной мере не изучено. Однако известно, что рак легких является наиболее частой первичной опухолью у мужчин, метастазирующей в гипофиз, а рак молочной железы — у женщин. Более редкими первичными новообразованиями являются опухоли печени, желудочно-кишечного тракта, меланомы, лимфомы и др. Возраст пациентов, страдающих от данной патологии, составляет от 50 до 60 лет.
Выживаемость достаточно низкая, в среднем около 12–14 мес. На период выживаемости влияют такие факторы, как локализация первичной опухоли и распространенность процесса, проведение радиотерапии или химиотерапии. Известно, что период выживаемости при наличии метастазов в гипофизе рака молочной железы или рака почки гораздо выше (до 22–30 месяцев) по сравнению с опухолями легкого.
Мы представляем серию пациентов с метастатическим поражением гипофиза, которые подверглись нейрохирургическому лечению в ГНЦ ФГБУ НМИЦ эндокринологии с последующим патоморфологическим подтверждением диагноза.
КЛИНИЧЕСКИЙ СЛУЧАЙ 1
Пациентка С., 34 года, поступила с жалобами на снижение зрения с височной стороны, общую слабость, утомляемость, периодически головные боли, отсутствие менструаций. Летом 2018 г. пациентка самостоятельно обнаружила уплотнение в левой молочной железе, по поводу которого в течение года наблюдалась по месту жительства. По данным трепанбиопсии опухоли от июля 2019 г., выявлены структуры инвазивной протоковой карциномы II степени злокачественности. Проводилось иммуногистохимическое исследование, выявлена экспрессия HER2 (3+++), индекс Ki67 составил 30%. Проведено всего 8 курсов химиотерапии. При динамическом наблюдении, по данным КТ грудной клетки и органов брюшной полости (декабрь 2019 г.), выявлено метастатическое поражение печени и тела поясничного позвонка L1. Далее, в марте 2020 г., выполнена радикальная мастэктомия по Мадену слева. По данным патоморфологического исследования, выявлен лечебный патоморфоз 1–2 степени злокачественности инвазивной карциномы G II с метастазом в 1 из 10 лимфоузлов.
С октября 2020 г. стала отмечать ухудшение общего самочувствия в виде сухости, жжения и покраснения в глазах, спустя время отметила двоение в глазах, появились головные боли преимущественно в теменной области. Выполнено МРТ головного мозга в ноябре 2020 г., в хиазмально-селлярной области выявлено кистозно-солидное объемное образование размерами 22х23х13 мм с компрессией хиазмы, умеренной деформацией зрительных трактов; деформирует дно третьего желудочка, требуется проведение дифференциальной диагностики с краниофарингиомой, однако ранее по МРТ головного мозга от августа 2019 г. образование не визуализировалось (рис. 1.1). При госпитализации в ГНЦ ФГБУ «НМИЦ эндокринологии» Минздрава в декабре 2020 г. у пациентки подтвержден гипопитуитаризм: вторичная надпочечниковая недостаточность (кортизол утром — 96,16 нмоль/л (171–536), АКТГ утром — 13,86 пг/мл (7,2–63,3)), вторичный гипотиреоз (ТТГ — 1,59 мМЕ/л (0,25–3,5), свТ4 — менее 5,15 пмоль/л (9–19)), гипогонадотропный гипогонадизм (ФСГ — 2,21 Ед/л (1,9–11,7), ЛГ — 0,22 Ед/л (2,6–12,1), эстрадиол — 58,07 пмоль/л (97–592)). Данных за гормональную активность образования (пролактин — 263,5 мЕд/л (64–395), ИФР-1 — 199,45 нг/мл (78–311) и нарушение функции нейрогипофиза не получено. При осмотре офтальмологом выявлена частичная атрофия зрительных нервов, при периметрии сужение полей зрения не зафиксировано. Проведено МСКТ органов грудной клетки, очаговых и инфильтративных изменений в паренхиме легких не определяется. Ранее, в ноябре 2020 г., проводилась сцинтиграфия костей всего тела, визуализировалось избыточное накопление индикатора в области правой половины тела L1, пациентка на момент поступления получала золедроновую кислоту по 4 мг в/в 1 раз в 1,5 месяца. В отделении инициирована терапия гидрокортизоном, левотироксином, в связи с раком молочной железы, от назначения менопаузальной гормональной терапии принято решение воздержаться. В связи с развитием масс-эффекта опухоли (головные боли, снижение зрения) пациентке выполнено трансназальное транссфеноидальное хирургическое вмешательство в декабре 2020 г. В операционном материале среди ткани аденогипофиза имелись участки опухоли в виде гнезд и кластеров (рис. 1.2), при иммуногистохимическом исследовании клетки опухоли негативны к транскрипционным факторам гипофиза, гормонам гипофиза, эстрогеновым и прогестероновым рецепторам, позитивные к цитокератину 7 (рис. 1.3, 1.4). Т.е. гистологическая картина и иммунофенотип соответствовали метастазу неспецифицированного рака молочной железы.
У данной пациентки период между постановкой диагноза первичной опухоли и выявлением метастаза в гипофиз составил около 24 месяцев. На момент обнаружения новообразования в гипофизе у пациентки подтвержден распространенный метастатический процесс с выявлением вторичных очагов в левой гемисфере мозжечка, печени, позвонке L1. Далее, в 2021 г., дважды проведено стереотаксическое радиохирургическое лечение с прогрессированием заболевания. В 2022 г. выполнено дистанционное стереотаксическое ориентированное облучение на аппарате «гамма нож». На фоне приема 90 мг преднизолона отмечено развитие экзогенного гиперкортицизма и остеопении в поясничных позвонках и в проксимальном отделе бедренной кости после облучения. Длительность наблюдения с момента установления метастаза в гипофиз составляет 31 месяц.
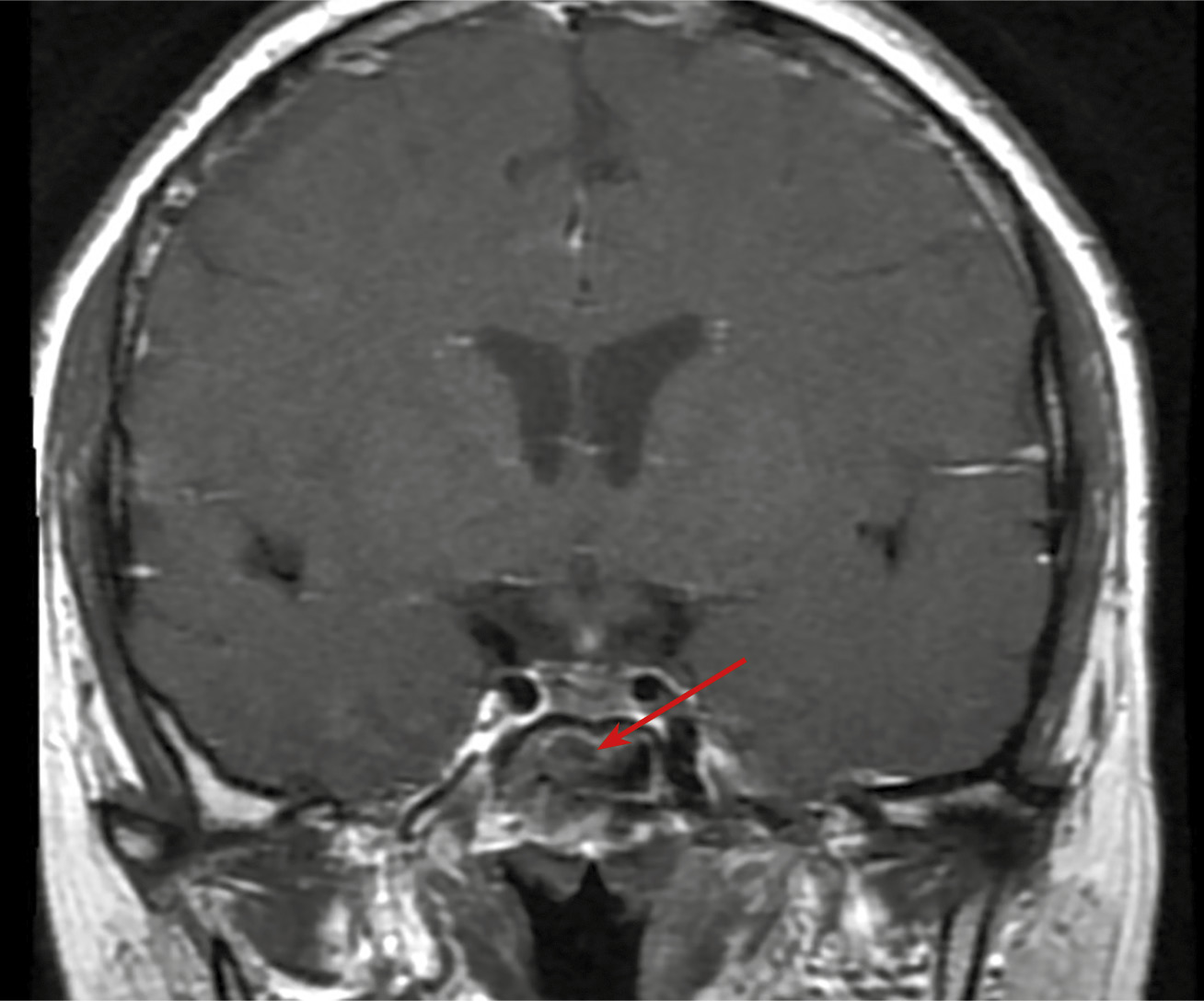
Рисунок 1.1. Кистозно-солидное объемное образование гипофиза с супра- и латероселлярным ростом влево, с компрессией хиазмы, умеренной деформацией зрительных трактов и третьего желудочка.
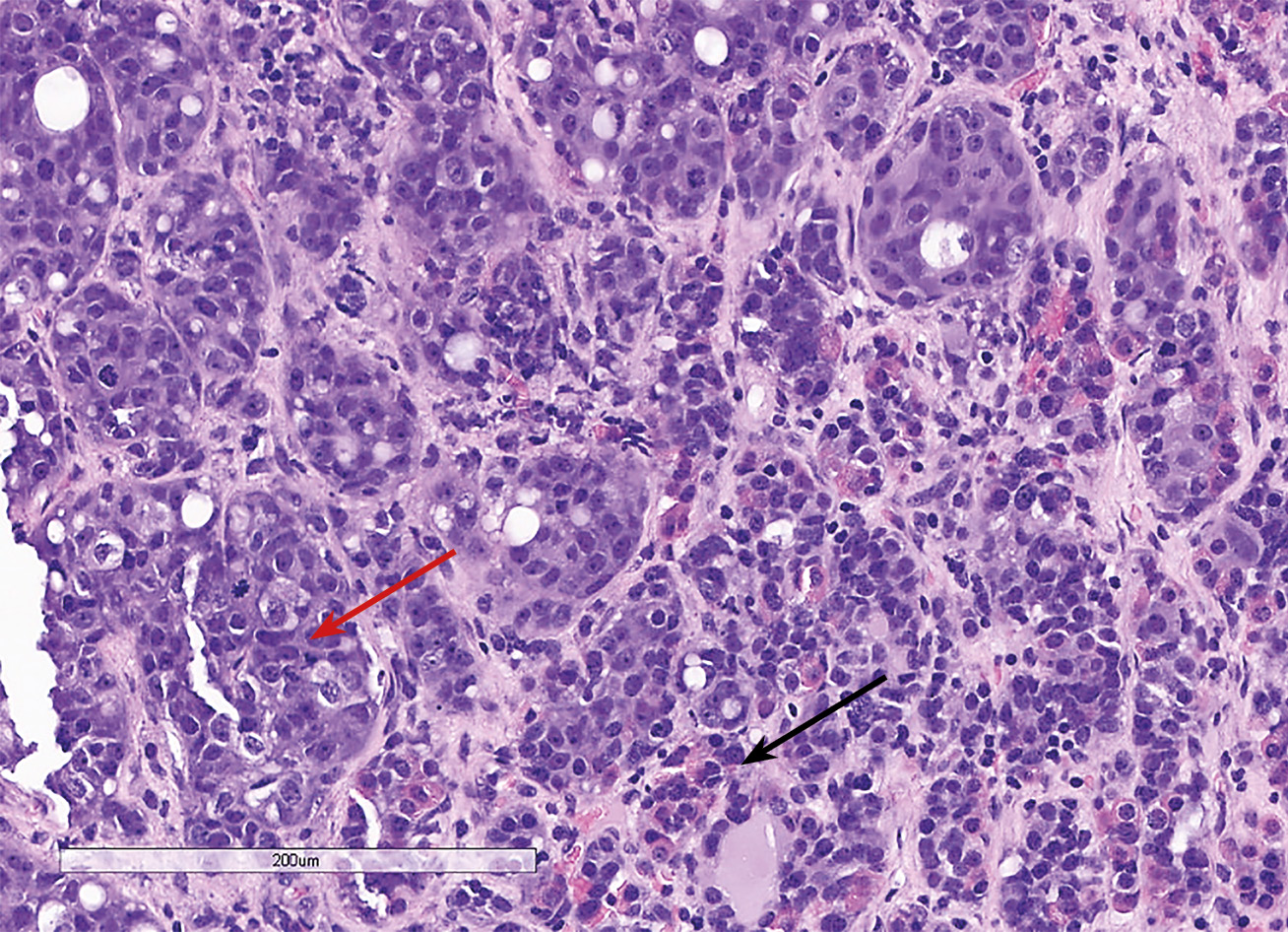
Рисунок 1.2. Окраска гематоксилином и эозином.
Среди элементов опухоли (красная стрелка) определяются фокусы аденогипофиза (черная стрелка).
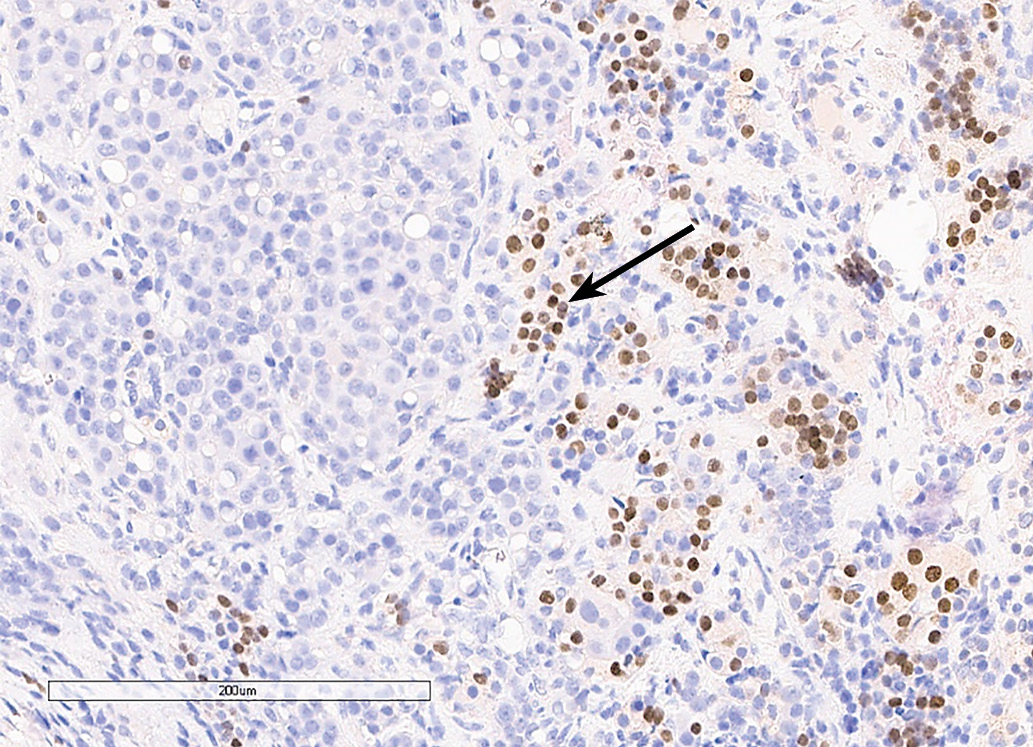
Рисунок 1.3. Иммуногистохимическое исследование: отсутствие окрашивания с антителами к транскрипционному фактору PIT1 в клетках опухоли при окрашивании клеток аденогипофиза (черная стрелка).
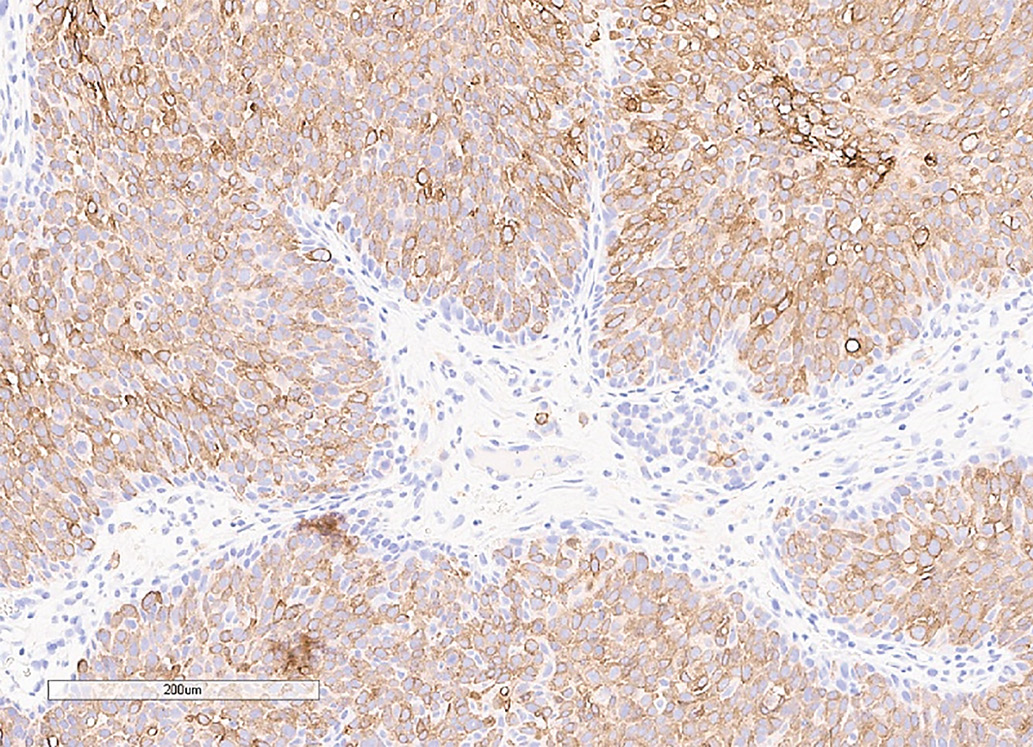
Рисунок 1.4. Иммуногистохимическое исследование: окрашивание с антителами к СК 7 в клетках опухоли.
КЛИНИЧЕСКИЙ СЛУЧАЙ 2
Пациентка К., 73 лет, поступила с жалобами на головную боль, ухудшение зрения, общую слабость.
Из анамнеза известно, что в 2012 г. перенесла комплексное лечение по поводу типичного карциноида правого легкого Т1N1M0 IIA, выполнена средняя лобэктомия справа с медиастинальной лимфаденэктомией, дистанционная лучевая терапия. По данным иммуногистохимического исследования, маркер Ki67 составил 2%.
В 2021 г. появились головные боли. В октябре 2021 г., по данным МРТ, выявлена макроаденома гипофиза, проводился осмотр офтальмолога, зарегистрировано снижение остроты зрения.
С марта-апреля 2022 г. отметила усиление головных болей, снижение зрения, выраженную общую слабость. В марте 2022 г., по данным МРТ, подтверждено объемное образование хиазмально-селлярной области размером 31х20х33 мм с супра- и параселлярным распространением. Впервые, по данным гормонального обследования, при госпитализации в ГНЦ ФГБУ «НМИЦ эндокринологии» Минздрава в марте 2022 г. выявлена умеренная гиперпролактинемия (пролактин — 1356,2 мМЕ/л при норме до 557, повышенного уровня макропролактина не выявлено), назначена терапия каберголином. Также лабораторно отмечены низкие значения гонадотропинов (ЛГ — 0,13 Ед/л, ФСГ — 3,08 Ед/л) у пациентки в менопаузе, что говорит о наличии вторичного гипогонадизма.
В мае 2022 г. впервые госпитализирована в ГНЦ ФГБУ «НМИЦ эндокринологии» Минздрава России. При гормональном обследовании убедительных данных за гормональную активность опухоли гипофиза не получено: исключен гиперкортицизм (кортизол в суточной моче — 68 нмоль/л (при норме до 379), акромегалия (ИФР-1 — 166,4 нг/мл (норма — до 238 нг/мл)), пролактинома (пролактин на фоне 5-дневного приема 0,25 мг каберголина в сутки — 175 мЕД/л (норма до 340). У пациентки установлен диагноз вторичной надпочечниковой недостаточности: уровень кортизола крови утром — 170 нмоль/л. Инициирована терапия глюкокортикоидами. Данных за вторичный гипотиреоз (ТТГ — 4,29 мМЕ/л (0,25 — 3,5), свТ4 — 14,69 пмоль/л (9–19)) и нарушение функции нейрогипофиза не получено.
Проведен осмотр офтальмолога: по данным периметрии, выявлено сужение полей зрения концентрическое на оба глаза на 10–20 градусов. Оптимальным методом лечения выбрана трансназальная транссфеноидальная аденомэктомия.
Из значимой сопутствующей патологии: в 2017 г. установлен первичный гиперпаратиреоз, проведено хирургическое лечение, при госпитализации в июне 2022 г. подтверждена ремиссия, пациентка получает антирезорбтивную терапию по поводу остеопороза.
Принимая во внимание карциноид легкого в анамнезе, проведено КТ органов грудной клетки с контрастированием: образования в 9-м ребре слева и 7-м ребре справа максимальным размером до 3,3 см, для дифференциальной диагностики между бурыми опухолями, метастазами карциноида, рекомендовано проведение соматостатин-рецепторной сцинтиграфии.
Учитывая сочетание нескольких нейроэндокринных опухолей, рекомендовано генетическое исследование для исключения синдрома множественной эндокринной неоплазии 1 типа, однако установлен диагноз фенотипически. В рамках поиска других опухолей проводилась КТ органов брюшной полости: признаков нейроэндокринных опухолей поджелудочной железы, образований надпочечников не обнаружено. По результатам лабораторного обследования, данных за наличие активной нейроэндокринной опухоли нет: гастрин — 69,4 пг/мл (13,0 — 115,0), хромогранин А — 0,90 нмоль/л (<2,00), инсулин — 13,68 мкЕ/мл (2,6 — 24,9).
Пациентке выполнено эндоскопическое трансназальное удаление опухоли гипофиза в июне 2022 г.
По данным патоморфологического исследования, выявлены фрагменты опухоли из железистоподобных структур, клетки которых обладали признаками нейроэндокринной дифференцировки (рис. 2.1). По данным иммуногистохимического исследования, в клетках опухоли обнаружена экспрессия TTF-1, хромогранина А, низкомолекулярного цитокератина (клон САМ 5.2), что свидетельствовало о наличии метастаза нейроэндокринной опухоли легкого. Экспрессия гормонов гипофиза (АКТГ, СТГ, ПРЛ, ТТГ, ЛГ, ФСГ) отсутствует. Индекс метки Ki-67 составил 12,2% (рис 2.2, 2.3).
У данной пациентки период между постановкой диагноза первичной опухоли карциноида легкого и выявления метастаза в гипофиз составил около 108 месяцев. На ПЭТ КТ с 18Ф-ФДГ (декабрь 2022 г.) обнаружен очаг в S6 правого легкого, единичные очаги во внутригрудных лимфоузлах, очаги в костях скелета, в том числе в ребрах. На момент написания статьи длительность наблюдения пациентки составляет 12 месяцев.
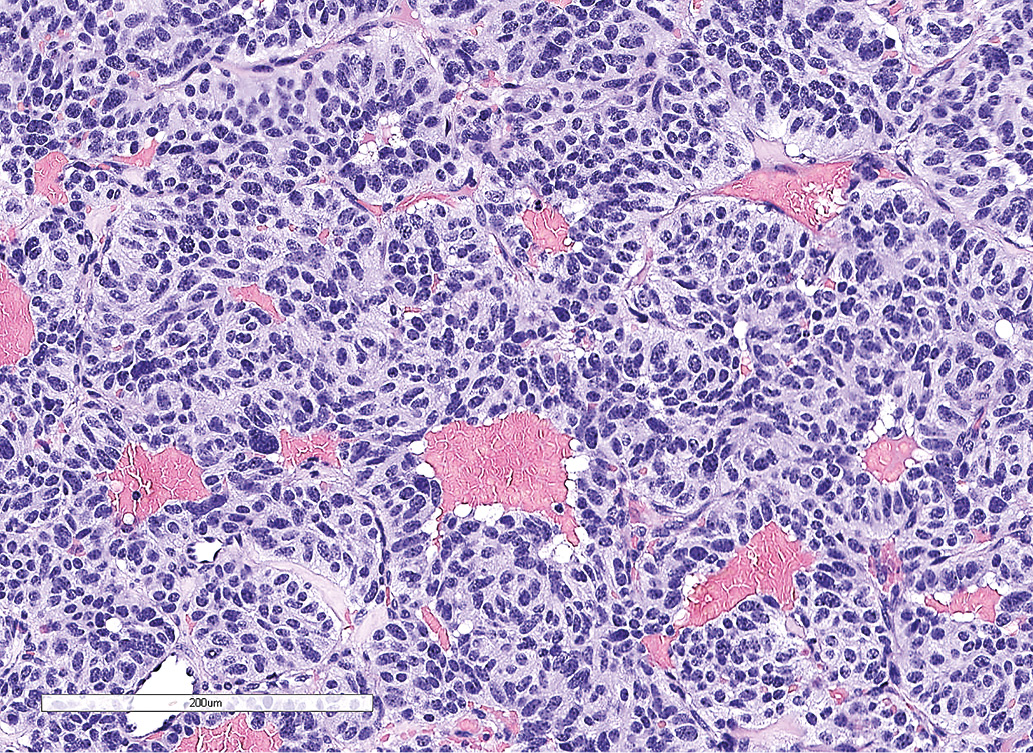
Рисунок 2.1. Окраска гематоксилином и эозином. Железисто-подобные структуры и клетки опухоли с признаками нейроэндокринной дифференцировки.
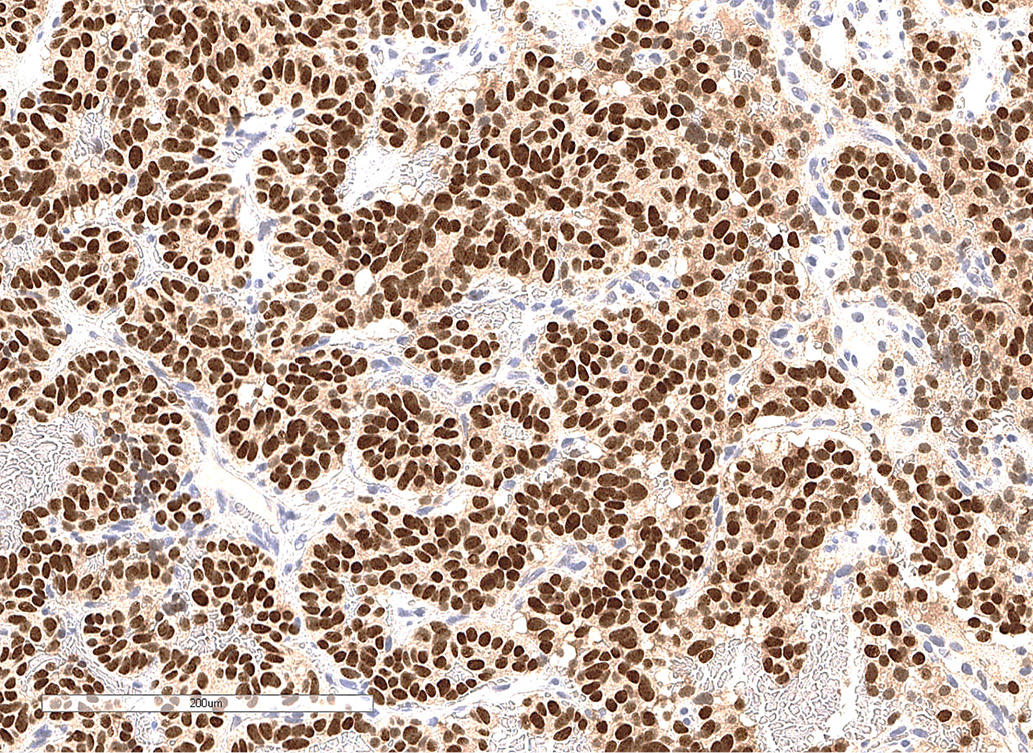
Рисунок 2.2. Иммуногистохимическое исследование: окрашивание ядер опухолевых клеток с антителами к TTF-1.
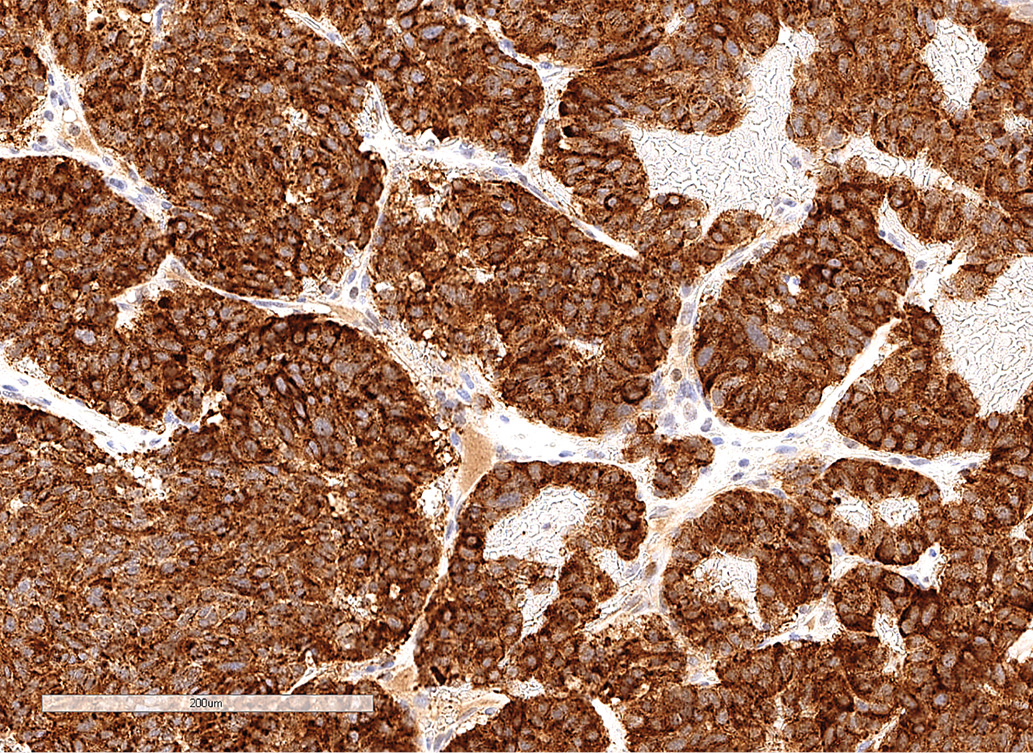
Рисунок 2.3. Иммуногистохимическое исследование: окрашивание цитоплазмы опухолевых клеток с антителами к хромогранину А.
КЛИНИЧЕСКИЙ СЛУЧАЙ 3
Пациент Г., мужчина 73 лет, отметил появление выраженных зрительных нарушений (снижение остроты зрения на левый глаза, двоение) с последующим ухудшением. Данная симптоматика возникла через 6 лет после радикальной левосторонней нефрэктомии в 2017 г., выполненной по поводу светлоклеточного почечноклеточного рака (рТ2N0M0). По данным компьютерной томографии через 4 года (2021 г.), выявлена опухоль в правой почке 14х15х14 мм солидной структуры. В январе 2022 г. в связи с потерей сознания госпитализирован в городскую больницу по месту жительства, где диагностирована вторичная надпочечниковая недостаточность. Назначена заместительная терапия препаратами преднизолона. Впервые в феврале 2022 г. выполнена КТ головного мозга, обнаружены признаки объемного образования хиазмально-селлярной области, пролабирующего через верхнюю апертуру турецкого седла с ровными контурами, размером 10х12х14 мм, параселлярные структуры без особенностей. МРТ не проводилась в связи с клаустрофобией у пациента. Во время госпитализации в ГНЦ ФГБУ НМИЦ эндокринологии в марте 2022 г. подтверждена вторичная надпочечниковая недостаточность (АКТГ <5,00 пг/мл (0–46), кортизол <1,00 мкг/дл (5–25), а также установлен гипогонадотропный гипогонадизм (тестостерон — 3,22 нг/дл (167–654), ФСГ — 0,32 мМЕ/мл (0,95—11,95). При обследовании была исключена гормональная активность опухоли при наличии умеренного повышения уровня общего пролактина до 1243 мЕд/л, что было интерпретировано как масс-эффект опухоли. По результатам МСКТ забрюшинного пространства с контрастным усилением, данных за рецидив заболевания не получено, сохраняется образование правой почки, без отрицательной динамики. При повторной госпитализации через 1 год (март 2023 г.) отмечалась отрицательная динамика в виде прогрессирования зрительных нарушений и роста образования хиазмально-селлярной области до 18х27х15 мм с признаками сдавления хиазмы и пролабирования в полость 3 желудочка на 7,2 мм, компримируя его передние отделы (рис. 3.1).
Пациент осмотрен офтальмологом, выполнена компьютерная периметрия, выявлено сужение периферической границы поля зрения концентрическое на 10 градусов справа, с височной стороны на 15–20 градусов слева. При обследовании данных за наличие метастазов почечноклеточного рака другой локализации не получено.
Пациенту выполнено трансназальное трансфеноидальное удаление опухоли в марте 2023 г. Операционный материал был представлен фрагментами ткани опухоли из клеток с оптически светлой цитоплазмой, расположенные в тонкой сосудистой сети (рис. 3.2), позитивные к CD10 при иммуногистохимическом исследовании (рис. 3.3). Ткань нейро- и аденогипофиза не получена. Диагностирован метастаз светлоклеточного почечноклеточного рака.
У данного пациента период между постановкой диагноза первичной опухоли и выявления метастаза в гипофиз составил 53 месяца. Данные о других метастазах у пациента отсутствуют. Период наблюдения пациента составляет 18 месяцев, после проведенного хирургического лечения — 4 месяца.
Основные клинические характеристики пациентов суммированы в таблице 1.
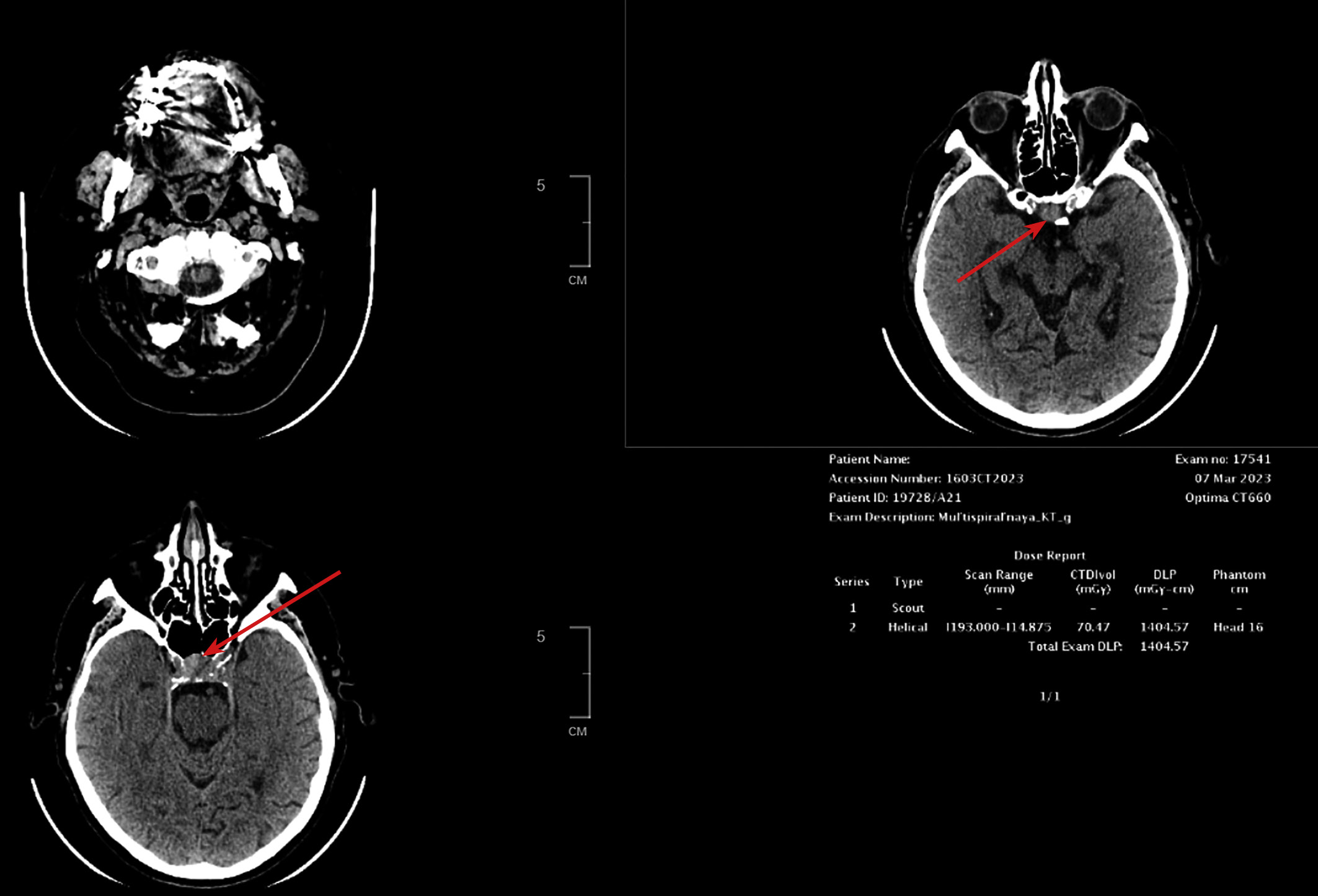
Рисунок 3.1. КТ головного мозга.
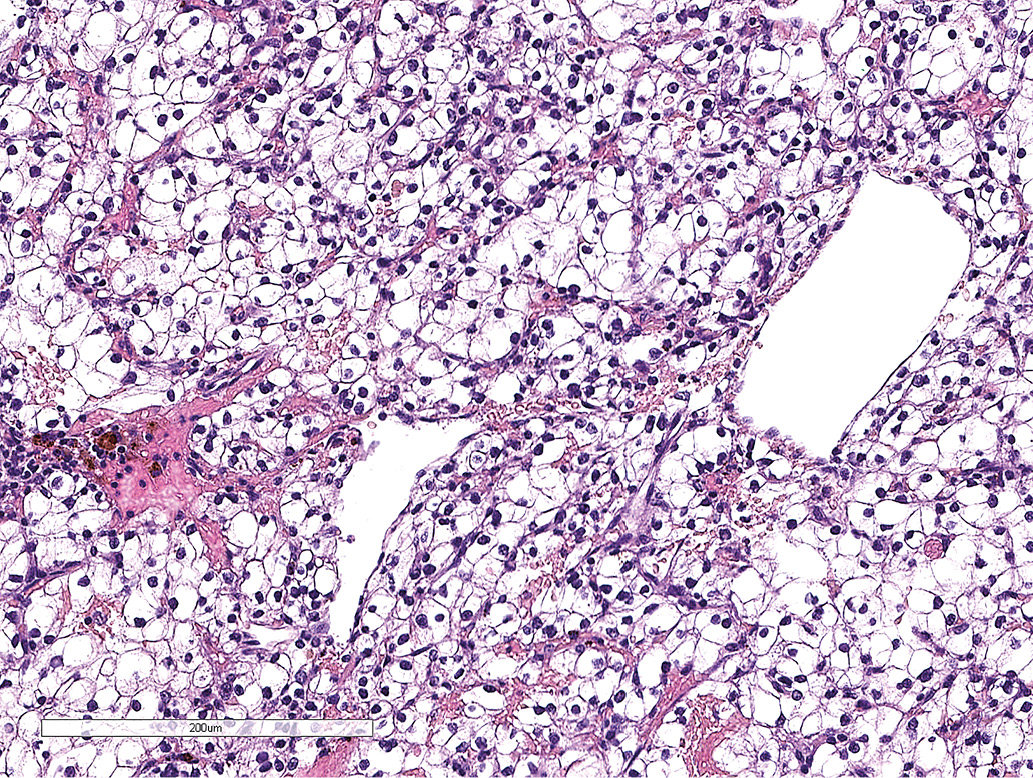
Рисунок 3.2. Окраска гематоксилином и эозином. Метастаз светлоклеточного почечноклеточного рака.

Рисунок 3.3. Иммуногистохимическое исследование: окрашивание клеток опухоли с антителами к CD10.
Таблица 1. Клиническая характеристика пациентов
№ | пол | Возраст манифестации (годы) | Первичная опухоль | Наличие других метастазов | Максимальный размер метастаза в гипофизе (мм) | Клиническая картина | Период наблюдения после НХ (годы) |
1 | ж | 32 | РМЖ | да | 23 | Пангипопитуита-ризм, зрительные нарушения | 2,5 |
2 | ж | 61 | Карциноид легкого | да | 33 | Пангипопитуита-ризм, зрительные нарушения | 1,0 |
3 | м | 67 | СПР | нет | 27 | Пангипопитуита-ризм, зрительные нарушения | 0,25 |
Сокращения: РМЖ — рак молочной железы, СПР — светлоклеточный почечноклеточный рак, НХ — нейрохирургия.
ОБСУЖДЕНИЕ
Представлены клинические случаи метастатического поражения гипофиза при различных первичных злокачественных опухолях (рак молочной железы, карциноид легкого, светлоклеточный рак почки), подтвержденные гистологически. Период между диагностикой первичной опухоли и метастазов в гипофиз составил от 24 до 216 месяцев (1–9 лет). Во втором и третьем клинических случаях пациенты находились, в целом, в длительной ремиссии по поводу основного заболевания на момент диагностики метастатического поражения гипофиза. Однако пациентка с раком молочной железы проходила множественные курсы химиотерапии по поводу распространенного метастатического процесса. На дооперационном этапе у одного пациента диагностирован центральный несахарный диабет, все пациенты отмечали снижение зрения и головные боли, был подтвержден гипопитуитаризм. Полученные данные в целом совпадают с данными литературы. Так, клиническая манифестация метастатического поражения гипофиза наблюдается примерно у 18% пациентов. Наиболее часто исследователи отмечают развитие несахарного диабета, хиазмального синдрома, нарушение функции передней доли гипофиза в виде частичного выпадения секреции гормонов либо пангипопитуитаризма, а также неспецифического признака — головной боли [3]. В серии наших пациентов практически у всех наблюдалось выпадение функции передней доли гипофиза, головная боль и хиазмальный синдром. Размеры новообразования хиазмально-селлярной области, выявленные в нашем исследовании, в целом совпадают с другими работами.
По данным МРТ, средний диаметр вторичных очагов гипофиза составил 21,2±10,3 мм (n=318), у 22,3% зафиксировано распространение опухоли в кавернозный синус [2][4][5].
В отличие от первичных опухолей гипофиза, которые развиваются в передней доле, метастазы чаще встречаются в задней доле и воронке. По данным различных авторов, в 57,0–84,6% случаев поражается только задняя доля или в комбинации с передней, в то время как передняя доля — в 13,0–15,4%. Вероятно, частота поражения задней доли обусловлена гематогенной диссеминацией метастазов и особенностями кровоснабжения нейро- и аденогипофиза. Кровоснабжение передней доли гипофиза в основном происходит за счет гипофизарной портальной системы с наличием 2 капиллярных сплетений, что, предположительно, является своеобразным препятствием для распространения опухолевых клеток, а задней доли — непосредственно из нижней гипофизарной артерии [3]. Вместе с тем у пациентов, описанных в нашей серии, преимущественно выпадала функция передней доли гипофиза.
Для проведения декомпрессии хиазмально-селлярной области всем пациентам выполнено трансназальное транссфеноидальное нейрохирургическое вмешательство. Основным методом верификации метастатического поражения гипофиза является патоморфологическое исследование. Образование хиазмально-селлярной области в сочетании с быстро прогрессирующим нарушением зрения, головными болями, центральным несахарным диабетом и гипопитуитаризмом у пациентов старше 50 лет или у пациентов с онкологическим анамнезом подразумевает исключение метастатического поражения гипофиза, даже несмотря на длительную ремиссию ранее известного онкологического заболевания [5][6]. По данным Sam Ng et al., в изучаемой когорте у 58,6% пациентов уже известна локализация и гистогенез первичной опухоли. Метастатический статус подтвержден только в 21,9% случаев [3].
Среди методов лечения возможно выбрать нейрохирургическое удаление метастатического очага гипофиза, радиотерапию, химиотерапию или таргетную терапию. В целом выживаемость не отличается среди пациентов, которые подверглись нейрохирургическому лечению, и теми, кого лечили нехирургическими методами. В пользу выбора хирургического метода служит быстрое устранение компрессии хиазмы и получение ткани опухоли для патоморфологического исследования. В случае обширного распространения метастаза в кавернозные синусы и другие структуры тотальная резекция не приводит к увеличению периода выживаемости. Потенциально предпочтительными являются радиотерапия, что связано с тенденцией к росту выживаемости, переносится пациентами легче и дает меньше осложнений по сравнению с хирургическим методом или химиотерапией. Химиотерапия или таргетная терапия могут рассматриваться в качестве дополнительных методов лечения, которые предполагают повышение периода выживаемости [7][8].
Прогноз у таких пациентов в целом неблагоприятный и в первую очередь зависит от типа первичной опухоли и распространенности процесса. Молодой возраст, небольшой объем поражения гипофиза и короткий период между диагностикой первичного злокачественного новообразования и метастазами в гипофиз может ассоциироваться с более длительным периодом выживаемости [9-11].
ЗАКЛЮЧЕНИЕ
Таким образом, несмотря на редкость метастатического поражения гипофиза, у врачей должна сохраняться настороженность, чтобы не пропустить потенциально жизнеугрожающее состояние гипопитуитаризма и вторичной надпочечниковой недостаточности, компенсация которых позволяет продлить жизнь и улучшить качество жизни пациентов.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена при поддержке гранта РНФ: 19-15-00398-П.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Авторы настоящей статьи получили письменное согласие от пациентов на публикацию медицинских данных, упоминаемых в статье.
Список литературы
1. Mika H, Hiroshi T, Hirofumi H, Soichiro Y, Nagatomo Y. Pituitary metastases: current practice in Japan. J Neurosurg. 2015;123(21):998–1007 DOI: 10.3171/2014.12.JNS14870
2. Ng S, Fomekong F, Delabar V, Jacquesson T, Enachescu C, Raverot G, et al. Current status and treatment modalities in metastases to the pituitary: a systematic review. J Neurooncol [Internet]. 2020;146(2):219–27. Available from: https://doi.org/10.1007/s11060-020-03396-w
3. Shimon I. Metastatic Spread to the Pituitary. Neuroendocrinology. 2020;110(9–10):805–8 doi: https://doi.org/10.1159/000506810
4. Komninos J, Vlassopoulou V, Protopapa D, Korfias S, Kontogeorgos G, Sakas DE, et al. Tumors Metastatic to the Pituitary Gland: Case Report and Literature Review. J Clin Endocrinol Metab. 2004;89(2):574–80 doi: https://doi.org/10.1210/jc.2003-030395
5. Teears RJ, Silverman EM. Clinicopathologic review of 88 cases of carcinoma metastatic to the pituitary gland. Cancer. 1975;36(1):216–20 doi: https://doi.org/10.1002/1097-0142(197507)36:1<216::aid-cncr2820360123>3.0.co;2-e
6. Javanbakht A, D’Apuzzo M, Badie B, Salehian B. Pituitary metastasis: A rare condition. Endocr Connect. 2018;7(10):1049–57 doi: https://doi.org/10.1530/EC-18-0338
7. Shimon I. Metastatic Spread to the Pituitary. Neuroendocrinology. 2020;110(9–10):805–8
8. Kramer CK, Ferreira N, Silveiro SP, Gross JL, Dora JM, de Azevedo MJ. Pituitary gland metastasis from renal cell carcinoma presented as a non-functioning macroadenoma. Arq Bras Endocrinol Metabol. 2010;54(5):498–501 doi: https://doi.org/10.1590/s0004-27302010000500011
9. Leramo OB, Booth JD, Zinman B, Bergeron C, Sima AF, Morley TP. Hyperprolactinemia, hypopituitarism, and chiasmal compression due to carcinoma metastatic to the pituitary. Neurosurgery. 1981;8(4):477–80 doi: https://doi.org/10.1227/00006123-198104000-00015
10. Morita A, Meyer FB, Laws ER. Symptomatic pituitary metastases. J Neurosurg. 1998;89(1):69–73 doi: https://doi.org/10.3171/jns.1998.89.1.0069
11. Asa SL, Mete O, Perry A, Osamura RY. Overview of the 2022 WHO Classification of Pituitary Tumors. Endocr Pathol [Internet]. 2022;33(1):6–26. Available from: https://doi.org/10.1007/s12022-022-09703-7
Об авторах
А. М. ЛапшинаРоссия
Лапшина Анастасия Михайловна - к.м.н.
117036, Москва, улица Дм. Ульянова, д. 11
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Е. А. Базарова
Россия
Базарова Екатерина Александровна.
117036, Москва, улица Дм. Ульянова, д. 11
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Е. Г. Пржиялковская
Россия
Пржиялковская Елена Георгиевна - к.м.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
П. М. Хандаева
Россия
Хандаева Патимат Магомедовна
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
В. Н. Азизян
Россия
Азизян Вилен Неронович - к.м.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
А. Ю. Григорьев
Россия
Григорьев Андрей Юрьевич - д.м.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
О. В. Иващенко
Россия
Иващенко Оксана Владимировна
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Н. В. Тарбаева
Россия
Тарбаева Наталья Викторовна - к.м.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Ж. Е. Белая
Россия
Белая Жанна Евгеньевна - д.м.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Дополнительные файлы
|
|
1. Рисунок 1.1. Кистозно-солидное объемное образование гипофиза с супра- и латероселлярным ростом влево, с компрессией хиазмы, умеренной деформацией зрительных трактов и третьего желудочка. | |
| Тема | ||
| Тип | Research Instrument | |
Посмотреть
(164KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 1.2. Окраска гематоксилином и эозином. Среди элементов опухоли (красная стрелка) определяются фокусы аденогипофиза (черная стрелка). | |
| Тема | ||
| Тип | Research Instrument | |
Посмотреть
(602KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 1.3. Иммуногистохимическое исследование: отсутствие окрашивания с антителами к транскрипционному фактору PIT1 в клетках опухоли при окрашивании клеток аденогипофиза (черная стрелка) | |
| Тема | ||
| Тип | Research Instrument | |
Посмотреть
(337KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 1.4. Иммуногистохимическое исследование: окрашивание с антителами к СК 7 в клетках опухоли | |
| Тема | ||
| Тип | Research Instrument | |
Посмотреть
(419KB)
|
Метаданные ▾ | |
|
|
5. Рисунок 2.1. Окраска гематоксилином и эозином. Железисто-подобные структуры и клетки опухоли с признаками нейроэндокринной дифференцировки | |
| Тема | ||
| Тип | Research Instrument | |
Посмотреть
(716KB)
|
Метаданные ▾ | |
|
|
6. Рисунок 2.2. Иммуногистохимическое исследование: окрашивание ядер опухолевых клеток с антителами к TTF-1 | |
| Тема | ||
| Тип | Research Instrument | |
Посмотреть
(653KB)
|
Метаданные ▾ | |
|
|
7. Рисунок 2.3. Иммуногистохимическое исследование: окрашивание цитоплазмы опухолевых клеток с антителами к хромогранину А | |
| Тема | ||
| Тип | Research Instrument | |
Посмотреть
(670KB)
|
Метаданные ▾ | |
|
|
8. Рисунок 3.1. КТ головного мозга | |
| Тема | ||
| Тип | Research Instrument | |
Посмотреть
(256KB)
|
Метаданные ▾ | |
|
|
9. Рисунок 3.2. Окраска гематоксилином и эозином. Метастаз светлоклеточного почечноклеточного рака | |
| Тема | ||
| Тип | Research Instrument | |
Посмотреть
(732KB)
|
Метаданные ▾ | |
|
|
10. Рисунок 3.3. Иммуногистохимическое исследование: окрашивание клеток опухоли с антителами к CD10 | |
| Тема | ||
| Тип | Research Instrument | |
Посмотреть
(926KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Лапшина А.М., Базарова Е.А., Пржиялковская Е.Г., Хандаева П.М., Азизян В.Н., Григорьев А.Ю., Иващенко О.В., Тарбаева Н.В., Белая Ж.Е. Метастатическое поражение гипофиза. Проблемы Эндокринологии. 2024;70(5):46-53. https://doi.org/10.14341/probl13395
For citation:
Lapshina A.M., Bazarova E.A., Przhialkovskaya E.G., Khandaeva P.M., Azizyan V.N., Grigoriev A.Yu., Ivashchenko O.V., Tarbaeva N.V., Belaya Zh.E. Metastatic pituitary lesion. Problems of Endocrinology. 2024;70(5):46-53. (In Russ.) https://doi.org/10.14341/probl13395

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).









































.jpg)


