Перейти к:
Метаанализ экспериментальных исследований влияния монотерапии мелатонином на уровень тиреоидных гормонов и глюкокортикоидов у крыс, содержащихся в стандартных условиях
https://doi.org/10.14341/probl13396
Аннотация
ОБОСНОВАНИЕ. Известно, что мелатонин модулирует суточные и сезонные ритмы метаболизма, размножения и поведения. Однако до сих пор неясен эффект приема экзогенного мелатонина на функционирование щитовидной железы и надпочечников у видов без четко выраженной сезонности в репродукции.
ЦЕЛЬ ИССЛЕДОВАНИЯ. С помощью метаанализа публикаций исследовать эффект монотерапии мелатонином на концентрацию тиреотропного гормона гипофиза, тиреоидных гормонов (ТГ), адренокортикотропного гормона гипофиза и кортикостерона (КС) у крыс, содержащихся в стандартных лабораторных условиях.
МАТЕРИАЛЫ И МЕТОДЫ. С помощью программы Review Manager 5.3 мы провели метаанализ публикаций, исследующих влияние монотерапии мелатонином на функционирование щитовидной железы (22 работы) и надпочечников (20 работ) у крыс, содержащихся в стандартных условиях.
РЕЗУЛЬТАТЫ. По результатам нашего метаанализа, эффекты мелатонина на уровень ТГ и КС зависят от дозы и продолжительности терапии. Снижение ТГ и КС было ассоциировано с терапией продолжительностью не более 4–5 недель и с высокими дозами мелатонина. Увеличение КС и тенденция повышения уровня ТГ наблюдались при более длительной терапии. Однако в единичных исследованиях продемонстрировали снижение ТГ при очень длительной терапии мелатонином (≥32 недели). Среди всех ТГ максимальную чувствительность к экзогенному мелатонину показал общий тироксин (Т4), что свидетельствует о влиянии мелатонина на секреторную функцию щитовидной железы. Кроме того, мелатонин увеличивал относительную массу надпочечников. Не было получено убедительных доказательств влияния на эффекты мелатонина способа и времени введения, а также времени забора проб крови.
ЗАКЛЮЧЕНИЕ. В итоге экзогенный мелатонин может модулировать уровень ТГ и КС, даже у видов без четко выраженной сезонности в репродуктивной функции.
Ключевые слова
Для цитирования:
Кузьменко Н.В., Цырлин В.А., Плисс М.Г. Метаанализ экспериментальных исследований влияния монотерапии мелатонином на уровень тиреоидных гормонов и глюкокортикоидов у крыс, содержащихся в стандартных условиях. Проблемы Эндокринологии. 2024;70(5):91-105. https://doi.org/10.14341/probl13396
For citation:
Kuzmenko N.V., Tsyrlin V.A., Pliss M.G. Meta-analysis of experimental studies of the effect of melatonin monotherapy on the levels of thyroid hormones and glucocorticoids in rats kept under standard condition. Problems of Endocrinology. 2024;70(5):91-105. (In Russ.) https://doi.org/10.14341/probl13396
ОБОСНОВАНИЕ
В настоящее время гормон эпифиза мелатонин активно исследуется на предмет использования для профилактики и терапии сердечно-сосудистых, эндокринных, нервных, психических, онкологических и других заболеваний. Широкий спектр терапевтических эффектов мелатонина (гипотензивный, кардиопротективный, улучшение показателей липидного профиля, иммунопротективный, антипролиферативный, нейропротективный, антидепрессивный и др.) объясняется тем, что чувствительные к мелатонину мембранные и ядерные рецепторы расположены практически во всех органах и тканях [1]. Изучая терапевтическое действие мелатонина, исследователи делают основной акцент на его эффекты, реализующиеся через мелатонин-чувствительные рецепторы органов-мишеней (сердца, сосудов, печени, поджелудочной железы, селезенки, тимуса и т.д.), а также на антиоксидантные свойства. При этом часто игнорируется эффект мелатонина на активность тиреоидных гормонов (ТГ) и кортикостерона (КС), которые определяют общий метаболизм.
Известно, что увеличение эндогенного мелатонина при уменьшении длины дня вызывает у позвоночных уменьшение секреции тиреотропного гормона гипофиза (ТТГ) в рars tuberalis, уменьшение активности дейодиназы 2, увеличение активности дейодиназы 3 и снижение уровня активного трийодтиронина (Т3) [2]. Несмотря на то, что уровень глюкокортикоидов также имеет четкий суточный и сезонный профиль, до сих пор нет однозначных представлений о механизмах регуляции секреции гормонов коры надпочечников с помощью мелатонина. Установлено, что супрахиазматическое ядро гипоталамуса контролирует циркадную секрецию глюкокортикоидов через моносинаптические проекции в паравентрикулярное ядро гипоталамуса, регулируя уровень кортикотропин-рилизинг гормона, а также через полисинаптический путь к надпочечникам [3][4]. В работе [4] было продемонстрировано вызванное светом быстрое снижение уровня кортикостерона в плазме, которое не было связано с уменьшением уровня адренокортикотропного гормона гипофиза (АКТГ). Есть предположение, что эффект АКТГ на кору надпочечников будет определяться сезоном и уровнем половых гормонов. Также есть мнение, что масса надпочечников зависит от сезона [5]. В некоторых исследованиях была обнаружена взаимосвязь между уровнем тиролиберина и концентрацией АКТГ [6]. В структурах головного мозга, ассоциированных с биологическими ритмами (супрахиазматическое ядро, pars tuberalis гипофиза), а также в надпочечниках представлены в основном мелатонинергические рецепторы 1 типа (МТ1) [7-9]. При этом в щитовидной железе (ЩЖ) были идентифицированы МТ1 и МТ2 рецепторы [10].
Исследования показали, что дефицит эндогенного мелатонина оказывает влияние на уровень ТГ и КС. Так, после удаления пинеальной железы у крыс наблюдалось увеличение уровня ТТГ, свободного тироксина (свТ4) и свободного трийодтиронина (свТ3) без существенных изменений общего Т4 и Т3 [11][12]. Постоянное освещение было ассоциировано со снижением Т4 у самцов, но не у самок [13]. У крыс, содержащихся при длинном дне, в среднем уровень ТГ и КС был выше, чем у животных, находящихся в условиях короткого дня или стандартного освещения [14]. Однако есть наблюдения, что постоянное освещение снижает средний уровень КС, поскольку полностью нивелирует акрофазу [15]. Пинеалэктомия вызвала у крыс увеличение среднего уровня АКТГ и КС, а также изменение циркадного профиля КС [12][16][17]. В противоположность, в исследовании [18] не было зафиксировано каких-либо изменений в суточном ритме и концентрации мелатонина и КС после пинеалэктомии. По результатам одних исследований, пинеалэктомия увеличивала массу надпочечников [19], по результатам других — не изменяла массу надпочечников, но увеличивала массу ЩЖ [20]. Введение экзогенного мелатонина нивелировало эффекты пинеалэктомии на уровень свТ3 и свТ4, но не КС [12]. В условиях постоянного освещения мелатонин незначительно снижал уровень Т3, но не Т4 [13].
ЦЕЛЬ ИССЛЕДОВАНИЯ
Цель нашей работы — исследовать с помощью метаанализа публикаций эффект монотерапии мелатонином на концентрацию ТТГ, ТГ, АКТГ и КС у крыс без патологий, содержащихся в стандартных (или близких к стандартным) лабораторных условиях. Экспериментальные исследования действия мелатонина на параметры общего метаболизма у крыс интересны в том числе по причине того, что репродуктивная функция крыс, как и у людей, не имеет четко выраженной сезонности.
МАТЕРИАЛЫ И МЕТОДЫ
Метаанализ был выполнен в соответствии с рекомендациями PRISMA (http://www.prisma-statement.org). Поиск исследований осуществлялся весной-летом 2023 г. на английском и русском языках независимо двумя людьми в базах PubMed, Scopus, Google Scholar, elibrary без ограничения периода публикации. При поиске были использованы ключевые слова, связанные с ТГ и глюкокортикоидами (щитовидная железа, надпочечники, тиреотропный гормон гипофиза, тиролиберин, трийодтиронин, тироксин, адренокортикотропный гормон гипофиза, кортикотропин-рилизинг гормон, кортикостерон, кортизол), которые сочетались с воздействием (мелатонин, терапия мелатонином, инфузия мелатонина), объектом исследования (крысы). Кроме того, дополнительно были просмотрены списки литературы публикаций, отобранных для метаанализа.
В метаанализ были включены исследования только монотерапии мелатонином. Отбирались работы, в которых животные содержались в стандартных лабораторных условиях или условиях, близких к стандартным. Были исключены исследования, в которых крысы находились при постоянных или непропорционально длительных темноте или освещении. Если в публикации не были уточнены условия содержания, то мы считали, что животные содержались в стандартных лабораторных условиях. Также мы исключили экспериментальные работы, поставленные на линиях крыс, чувствительных к изменению фотопериода (например Fisher) и с генетическими нарушениями метаболизма (например Zucker). В метаанализ включались исследования, проведенные только на интактных или ложнооперированных животных. Исключались работы с использованием крысят до 1,5 месяца возраста и беременных самок. Время введения мелатонина и регистрации показателей также имели значения для отбора работ, в которых мелатонин вводился однократно. В этом случае были отобраны только те исследования, в которых после однократного введения мелатонина регистрация показателей была осуществлена не позднее 60 мин после введения гормона. В статистический анализ не были включены работы, исследующие эффекты мелатонина при центральном введении. Кроме того, были исключены публикации, в которых результаты были отображены в непонятной форме, не позволяющей оценить среднее значение и SD / SEM.
Из отобранных работ извлекались данные по уровню в крови ТТГ, Т3, Т4, свТ3, свТ4, КС, массе щитовидной железы и надпочечников (абсолютной и относительной). После извлечения из публикаций значения исследуемых биохимических показателей были переведены в одинаковые единицы измерения с помощью online калькуляторов http://unitslab.com/ru и http://www.scymed.com/en/smnxtm/tmbbcbb1.htm : мМЕ/л — для ТТГ, нг/мл — для Т3, КС и АКТГ, мкг/дл — для Т4, нг/дл — для свТ3 и свТ4. Для перевода ТТГ использовали стандарт Интернациональная Единица — 36,6 мг [21], для АКТГ — стандарт 1 мкг/мл эквивалентен 0,014 мМЕ/100 мл [22].
Данные объединялись в субгруппы по времени терапии мелатонином (без учета дозы). Кроме того, там, где позволяло количество исследований, был проведен анализ зависимости эффекта от дозы, способа и времени введения мелатонина, времени забора крови, возраста животных.
Метаанализ результатов исследований был проведен с помощью статистической программы Review Manager 5.3 (Cochrane Library). Для анализа был использован inverse variance тест (Mean Difference). Гетерогенность включенных в метаанализ исследований устанавливали по критерию I2. Выбор модели фиксированных или рандомизированных эффектов осуществляли в соответствии с рекомендациями [23]. Для оценки статистической значимости суммарных результатов применяли Z-тест. Предвзятость при отборе публикаций проверяли с помощью графика-воронки. Доверительный интервал — 95%. Различия считались статистически значимыми при р<0,05. В тексте данные приведены в виде медианы и интерквартильного размаха или в виде среднего значения ± стандартного отклонения.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В базах было найдено 149 работ (из них 19 обзоров), изучающих влияние мелатонина на уровень ТТГ и ТГ у крыс, и 195 работ (из них 16 обзоров), исследующих влияние мелатонина на гормоны коры надпочечников. После исключения публикаций по заголовкам и резюме 39 публикаций были отобраны для метаанализа [12][13][24–60] (табл. 1).
Влияние мелатонина на уровень ТТГ и тиреоидных гормонов
Для метаанализа были отобраны 22 публикации, исследующие влияния монотерапии мелатонином на уровень циркулирующего ТТГ и ТГ: ТТГ — 12 работ, Т3 — 16 работ, Т4 — 15 работ, 4 — свТ3 и свТ4 (табл. 1). Графики воронки не показали предвзятости при отборе публикаций. Два исследования [50][55] не были включены в количественный статистический анализ по причине содержания крыс в условиях короткого дня (8/16) и естественного освещения. В двух работах исследовалось влияние однократного введения мелатонина на уровень гормонов, в остальных мелатонин вводился от 4 дней до 80 недель. В исследованиях был использован мелатонин в дозах от 0,05 до 10 мг/кг/день, который вводился подкожно, внутрибрюшинно или орально (с питьевой водой или через зонд). В 4 работах сообщается о сборе проб крови натощак (табл. 1).
Однократное внутривенное введение мелатонина не изменяло уровень Т3 и Т4, но уменьшало уровень ТТГ (рис. 1). Исследование [29] продемонстрировало дозозависимый эффект мелатонина на уровень ТТГ, но из-за отсутствия других публикаций, подтверждающих это, сделать окончательный вывод нельзя.
Поскольку результаты работ очень гетерогенны, не было получено убедительных данных об изменении уровня ТТГ и ТГ после продолжительной терапии мелатонином (рис. 2), но наблюдалась тенденция снижения ТТГ, Т3 и Т4 при более высоких дозах мелатонина (табл. 2). Начало терапии было ассоциировано со снижением уровня Т4 в среднем на -0,82 [ -1,45, -0,19] мкг/дл (I²=93%, Z=2,54, р=0,01), однако при терапии более 7 недель отмечалось незначительное увеличение Т4 в среднем на 0,56 [ -0,07, 1,20] мкг/дл (I²=83%, Z=1,73, р=0,08). Тенденции для Т3 были противоположны Т4 через 4–5 дней терапии, но если терапии длилась дольше, то Т3 и Т4 изменялись однонаправленно. В одном исследовании наблюдали снижение ТГ при очень длительной терапии мелатонином (≥32 недели) [58] (рис. 2). Метаанализ не выявил взаимосвязи между способом введения мелатонина и эффектом терапии (табл. 2).
Эффект мелатонина на ТТГ и ТГ не был очевиден ни при дневном, ни при ночном заборе крови (рис. 3). Известно, что в течение суток у крыс, содержащихся в условиях 12 день: 12 ночь, уровень мелатонина максимален ночью и минимален днем, ТТГ максимален вечером и минимален утром, Т3 и Т4 максимальны утром и минимальны вечером [47]. Следует отметить, что введение мелатонина даже в малых дозах (0,5 и 1 мг/кг/день) существенно увеличивало уровень циркулирующего мелатонина в течение всего дня [13][47]. Введение мелатонина перед темной фазой (17:00–18:30) смещало циркадные профили Т3 и Т4, но не мелатонина и ТТГ [47]. Однако при использовании аналогичных доз и времени введения мелатонина другие авторы не наблюдали изменения циркадного профиля свТ3 и свТ4 [12].
Молодой возраст животных был ассоциирован со значительным снижением Т4 при терапии мелатонином (без учета продолжительности) (табл. 2). Через 7–10 дней терапии у всех животных, кроме старых, отмечалось снижение уровня Т3 в среднем на -0,11 [ -0,18, -0,04] нг/мл (I²=55%, Z=2,96, р=0,003), а Т4 на -0,68 [ -1,25, -0,11] мкг/дл (I²=89%, Z=2,34, р=0,02). Показано, что у крыс максимальная активность ТГ наблюдается в 1,5–2-месячном возрасте, к 3 месяцам резко снижается и далее постепенно уменьшается [61]. У 24-месячных крыс по сравнению с 6-месячными уровень Т3 снижен в 3,4 раза, Т4 — в 2 раза, свТ3 — в 2 раза, свТ4 — в 4,6 раза, без существенных изменений ТТГ [62], что указывает на уменьшение секреторной активности ЩЖ у старых животных. По данным работы [38], 10-дневная терапия мелатонином восстанавливала функцию ЩЖ и дозозависимо повышала уровень Т3 и Т4 у 19-месячных крыс.
В работе [13] установили, что мелатонин после 4-недельной терапии (2 мг/кг/день, подкожно) снижает уровень Т4 у самцов и увеличивает Т4 у самок. В работе [50] также наблюдали у самок увеличение Т3 и Т4 после 7 недель подкожного введения мелатонина в дозе 1 мг/кг/день, однако в этом исследовании крысы содержались в условиях короткого дня (8/16).
При содержании животных в условиях естественного освещения введение мелатонина в течение 10 дней в дозе 1 мг/кг/день снижало уровень Т3 и зимой и летом, а уровень Т4 и ТТГ — только зимой [55]. Можно предположить, что преобладающий эффект экзогенного мелатонина заключается в угнетении превращения Т4 в Т3. На это также указывает и то, что в условиях постоянного освещения мелатонин незначительно снижал уровень Т3, но не Т4 [13]. Было установлено, что мелатонин может увеличивать экспрессию DIO3, уменьшая активность ДНК-метилтрансферазы [63]. Однако наш метаанализ показал высокую чувствительность Т4 к терапии мелатонином, что свидетельствует о влиянии экзогенного мелатонина на секреторную функцию ЩЖ. В исследованиях in vitro было обнаружено, что мелатонин снижает уровень цАМФ в эксплантатах щитовидной железы [64], а также дозозависимо уменьшает митотическую активность фолликулярных клеток ЩЖ [65][66]. В работе [67] у крыс Wistar после 4-недельной терапии мелатонином (5 мг/кг/день) наблюдали подавление функциональной активности ЩЖ — уменьшение площади фолликулярного, интерфолликулярного эпителия и высоты тироцитов, увеличение накопления коллоида и соединительной ткани. По данным одних работ, после терапии масса ЩЖ уменьшается [41, 66], по данным других — не изменяется [68].
Таблица 1. Публикации, отобранные для метаанализа
Публикация | Доза, способ, время и продолжительность введения | Световой режим день/ночь | Линии | Возраст крыс (мес) | Объем выборки опыт / контроль | Параметры | Время регистр. |
Однократное введение | |||||||
Arushanian E.B., | 0,1, 1, 10 мг/кг, в.б., 30 мин | естеств. | Белые лаб. | взрос. | 8 / 8 | КС | - |
Barchas J., | 1 мг/кг, п.к., 30 мин | 12 / 12 | Long-Evans | 2,5 | 10 / 10* | КС | - |
Gromova E.A., | 0,5, 1, 2 мг/кг, п.к., 60 мин | 12 / 12 | Wistar | взрос. | 4–6 / 12 | КС | - |
Maslova L.N., | 4 мг/кг, п.к., 60 мин | - | Белые лаб. | взрос. | 10 / 6 | КС | - |
Maslova L.N., | 2 мг/кг, в.б., 60 мин | - | Белые лаб. | взрос. | 5 / 5 | КС | - |
Maslova L.N., | 4 мг/кг, в.б., 60 мин | - | Белые лаб. | взрос. | 6 / 6 | КС | - |
Mattila J., | 1 и 10 мг/кг, в.в., 30 мин | 12 / 12 | Sp. Dawley | 2 | 5 / 5 | ТТГ, Т3, Т4 | 12:00–13:00 |
Mitsuma T., | 1, 1,25, 2,5, 5 мг/кг, в.в., 30 мин | 12 / 12 | Wistar | взрос. | 7 / 7 | ТТГ | - |
Niles L.P., | 0,1 мг/кг, в.б., 60 мин | 12 / 12 | Sp. Dawley | 3 | 8 / 8 | КС | 12:00 |
Длительная терапия | |||||||
Abd Allah E.S.H., | 10 мг/кг/день, в.б., 6 нед | 12 / 12 | Wistar | взрос. | 6 / 6 | КС | 8:30–10:00 |
Ahmed H.H., | 5 мг/кг/день, в.б., 10 дней | 12 / 12 | Sp. Dawley | взрос. | 6 / 6* | Т3, Т4# | - |
Aoyama H., | 5 мг/крыса/день (20 мг/кг/день), в.б., 11 нед | - | Wistar | 2 | 6 / 6 | МН | - |
Arushanian E.B., | 0,1, 1, 10 мг/кг, в.б., 12 дней | естеств. | Белые лаб. | взрос. | 8 / 8 | КС | - |
Baltaci A.K., | 3 мг/кг/день, в.б., 4 нед | 12 / 12 | Sp. Dawley | взрос. | 10 / 10 | ТТГ, Т3, Т4, свТ3, свТ4 | - |
Barchas J., | 1 мг/кг/день, п.к., 10 дней | 12 / 12 | Long-Evans | 2,5 | 10 / 10* | КС, АКТГ | - |
Benova T., | 5 мг/кг/день (40 мкг/мл), п.о. с водой (ночью), 5 нед | - | Wistar | 5 | 12 / 12 | Т3, Т4# | 8:00–9:00 |
Bojková B., | 0,5 мг/кг/день (4 мкг/мл), п.о. с водой (15:00–8:00), 12 нед | 12 / 12 | Wistar самцы | 1,5 | 14 / 14 | КС, МН# | - |
Bojková B., | 0,5 мг/кг/день, п.о. с водой (15:00–8:00), 12 нед | 12 / 12 | Wistar самки | 1,5 | 14 / 14 | КС, МН# | - |
Bojková B., | 0,5 мг/кг/день (4 мкг/мл), п.о. с водой (15:00–8:00), 11 нед | 12 / 12 | Sp. Dawley самцы | 6 | 8 / 12 | КС, МН# | - |
Bojková B., | 0,5 мг/кг/день, п.о. с водой (15:00–8:00), 11 нед | 12 / 12 | Sp. Dawley самки | 6 | 10 / 7 | КС, МН# | - |
Bondarenko L.A., | 0,05 мг/кг/день, в.б. (перед темной фазой), 10 дней | 12 / 12 | Wistar | 19 | 12 / 12 | Т3, Т4, ТТГ | - |
Bondarenko L.A., | 0,5 мг/кг/день, в.б. (перед темной фазой), 10 дней | 12 / 12 | Wistar | 19 | 13 / 12 | Т3, Т4, ТТГ | - |
Brazão V., | 5 мг/кг/день, п.о., 9 дней | 12 / 12 | Wistar | 1,5 | 5 / 5 | КС | - |
Brazão V., | 5 мг/кг/день, п.о., 9 дней | 12 / 12 | Wistar | 18 | 5 / 5 | КС | - |
Esquifino A., | 0,125 мг/кг/день (25 мкг/крыса), п.к. (перед темной фазой), 4 дня | 12 / 12 | Wistar | 2 | 6 / 6 | Т3, Т4, ТТГ# | - |
Esquifino A., | 0,250 мг/кг/день (50 мкг/крыса), п.к. (перед темной фазой), 4 дня | 12 / 12 | Wistar | 2 | 6 / 6 | Т3, Т4, ТТГ# | - |
Esquifino A., | 0,5 мг/кг/день (100 мкг/крыса), п.к. (перед темной фазой), 4 дня | 12 / 12 | Wistar | 2 | 6 / 6 | Т3, Т4, ТТГ# | - |
Gevorkyan A.R., (1) [41] | 0,05 мг/кг/день, в.б. (перед темной фазой), 10 дней | - | Wistar | 3 | 10 / 10 | Т3, Т4, МЩ | днем и ночью |
Gevorkyan A.R., (2) [41] | 0,5 мг/кг/день, в.б. | - | Wistar | 3 | 10 / 10 | Т3, Т4 | днем и ночью |
Gomaa A.M., | 10 мг/кг/день, в.б. | 12 / 12 | Wistar | взрос. | 7 / 7 * | КС, МН # | - |
Jiménez-Ortega V., | 0,5 мг/кг/день (3 мкг/мл), п.о. с водой, 4 нед | 12 / 12 | Wistar | 1,5 | 45 / 45 | ТТГ, КС | в течение суток |
Kinson G.A., | 20 мг п.к. (3,5 мг/кг/день), 4 нед | 12 / 12 | Sp. Dawley | 2 | 6 / 6 | КС# | - |
Konakchieva R., | 0,08 мг/кг/день, п.к. (19:00), 1 нед | 12 / 12 | Wistar | взрос. | 5 / 5 | КС | в течение суток |
Mercau M.E., | 20 мг помпа п.к., 4,5 мг/кг/день, 3 нед | 12 / 12 | Wistar | взрос. | 10 / 10 | КС, АКТГ | 9:00–10:00 |
Mirunalini S., | 0,5 мг/кг/день, в.б. (17:30–18:00), 45 дней | 12 / 12 | Wistar | взрос. | 6 / 6* | ТТГ, Т3, Т4 | в течение суток |
Mirunalini S., | 1 мг/кг/день, в.б. (17:30–18:00), 45 дней | 12 / 12 | Wistar | взрос. | 6 / 6* | ТТГ, Т3, Т4 | в течение суток |
Mustonen A.M., | п.к.помпа (12 мг, 2 мг/кг/день), 4 нед | 12 / 12 | Wistar самцы | 2 | 10 / 10* | Т3, Т4 | 10:00–14:00 |
Mustonen A.M., | п.к. помпа (12 мг, 2 мг/кг/день), 4 нед | 12 / 12 | Wistar самки | 2 | 10 / 10* | Т3, Т4 | 10:00–14:00 |
Nasiraei-Moghadam S.N., 2014 [48] | 5 мг/кг/день, в.б., 2 нед | 12 / 12 | Лабор. | взрос. | 7 / 7 | КС | - |
Nir I., | 100 мкг/100г/день (1 мг/кг/день), в.б. утром, 10 дней | 12 / 12 | Лабор. | взрос. | 36 / 37 | Т3, Т4 | 10:00–12:00 |
Nordio M., | 100 мкг/100г/день (1 мг/кг/день), п.к. (17:00), 7 нед | 8 / 16 | Sp. Dawley самки | 1–2 | 10 / 10 | Т3, Т4, МЩ# | 9:00–12:00 |
Olukole S.G., | 10 мг/кг/день, в.б., 2 нед | 12 / 12 | Wistar | 4 | 7 / 7 | КС, АКТГ, МН | - |
Ostrowska Z., | 50 мкг/100г/день (0.5 мг/кг/день), в.б. (17:00–18:00), 4 нед | 12 / 12 | Wistar | взрос. | 48 / 48 | свТ3, свТ4, КС | с 08:00 в течение дня |
Ozturk G., | 10 мг/кг/день, п.к., за 2 часа до темной фазы, 1 нед | 12 / 12 | Sp. Dawley | 2 | 12 / 12* | ТТГ, Т3, Т4 | 10:00 и 02:00 |
Poliandri A.H., | 3 мкг/мл (0,3 мг/кг/день), п.о. с водой, 1 мес | 12 / 12 | Wistar | 2 | 6 / 6 | ТТГ | 09:00 и 01:00 |
Rasmussen D.D., | 4 мкг/мл (0,3 мг/кг/день), п.о. с водой, 48 нед | 14 / 10 | Sp. Dawley | 10 | 8 / 8 | Т3, Т4, КС | - |
Rom-Bugoslavskaia E.S., 1986 (1) [55] | 100 мкг/100г/день (1 мг/кг/день), в.б. (17:00–18:00), 10 дней | естеств. зима | Wistar | взрос. | 18 / 16 | ТТГ, Т3, Т4 | - |
Rom-Bugoslavskaia E.S., 1986 (2) [55] | 100 мкг/100г/день (1 мг/кг/день), в.б. (17:00–18:00), 10 дней | естеств. лето | Wistar | взрос. | 13 / 9 | ТТГ, Т3, Т4 | - |
Sewerynek E., | 5 мг/кг/день, в.б. | 14 / 10 | Wistar | взрос. | 9 / 9 | свТ3, свТ4 | - |
Vaughan M.K., | 25 мкг/крыса/день (0,1 мг/кг/день), п.к. (16:00-18:00), 12 нед | 14 / 10 | Sp. Dawley | 2–3 | 6 / 6 | ТТГ, Т3, Т4 | 9:00–12:00 |
Vinogradova I.A., | 1,5 мг/кг/день (10 мг/л), п.о. с водой (ночью), 20 мес | 12 / 12 | Лабор. | 4 | 16 / 16 | ТТГ, свТ3, свТ4 | - |
Wang L., | 10 мг/кг/день, через зонд (в 16:00), 8 нед | 12 / 12 | Sp. Dawley | 2 | 10 / 10* | Т3 | - |
Wolden-Hanson T., | 0,04 мг/кг/день (0,4 мкг/мл), п.о. с водой, 12 нед | 14 / 10 | Sp. Dawley | 10 | 19 / 18 | КС, МН | день и ночь |
Примечание: ТТГ — тиреотропный гормон гипофиза, Т3 — общий трийодтиронин, свТ3 — свободный трийодтиронин, Т4 — тироксин, свТ4 — свободный тироксин, АКТГ — адренокортикотропный гормон гипофиза, МЩ — масса щитовидной железы, МН — масса надпочечников, * — есть сообщение о рандомизации, # — есть сообщение о заборе проб крови натощак, в.в. — внутривенное введение, в.б. — внутрибрюшинное введение, п.к. — подкожное введение, п.о. — пероральное введение.
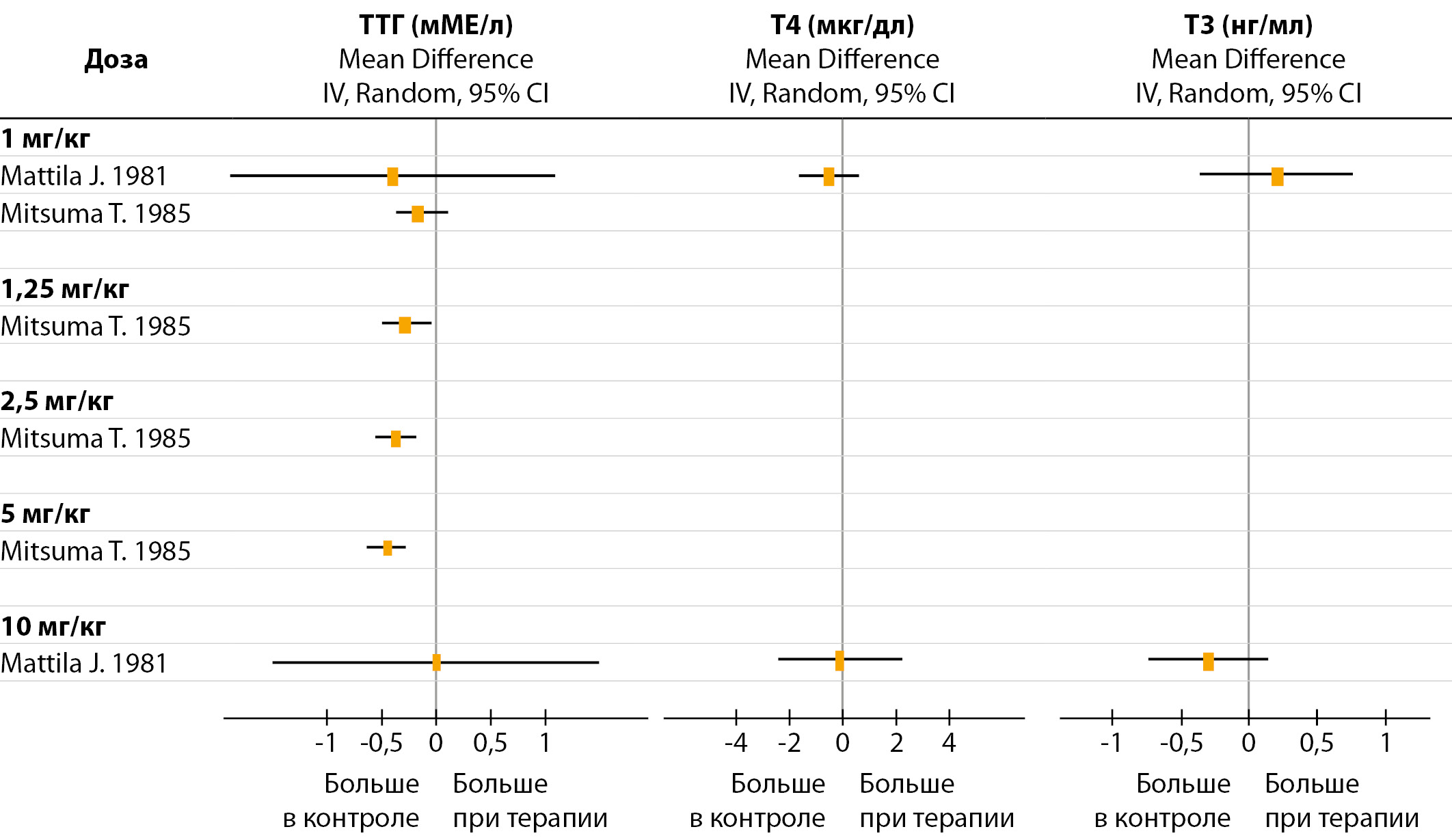
Рисунок 1. Влияние однократного внутривенного введения мелатонина на уровень ТТГ и тиреоидных гормонов.
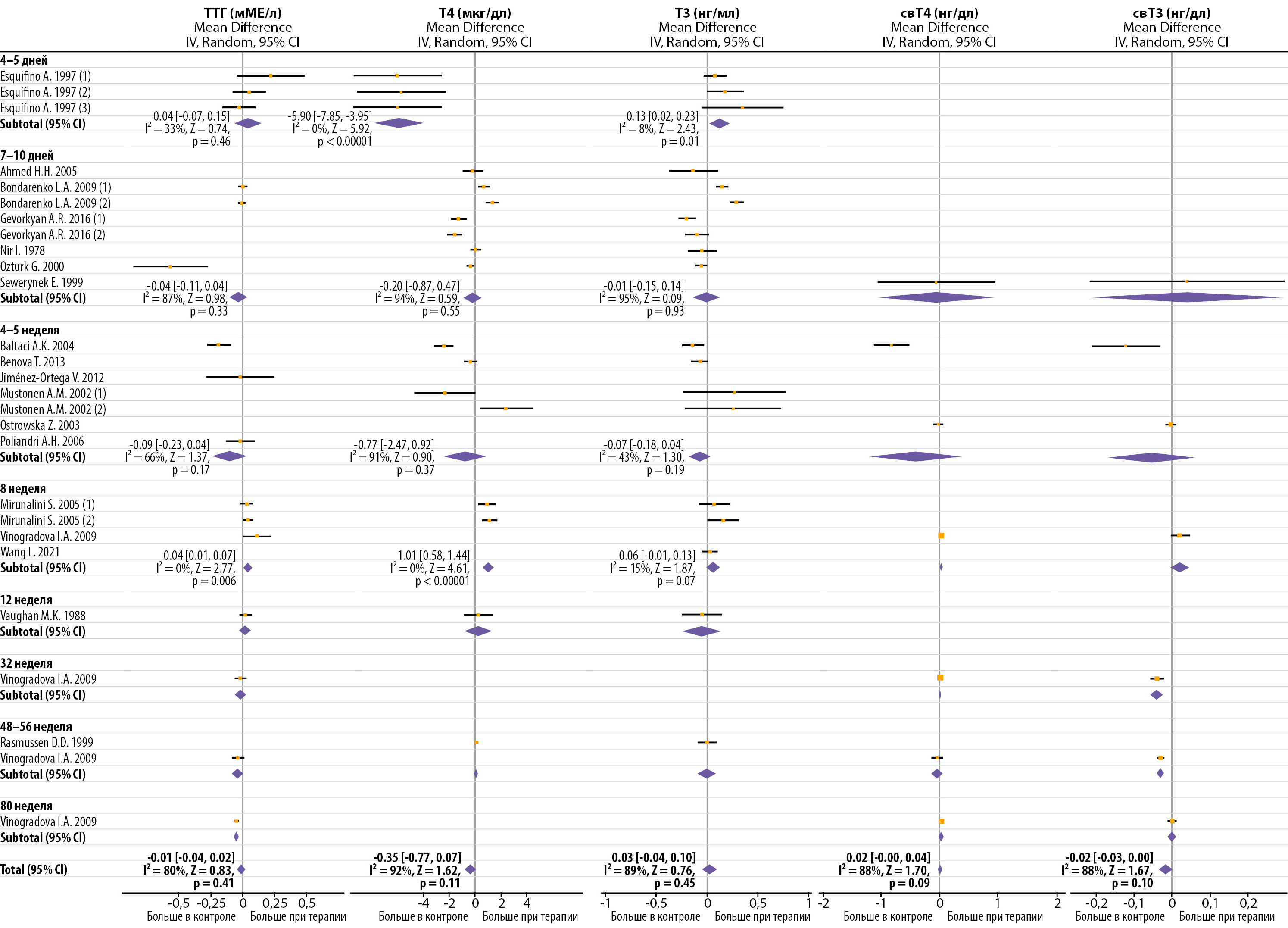
Рисунок 2. Влияние продолжительной терапии мелатонином на уровень циркулирующих ТТГ и тиреоидных гормонов.
Без дополнительной стандартизации по дозе и способу введения.
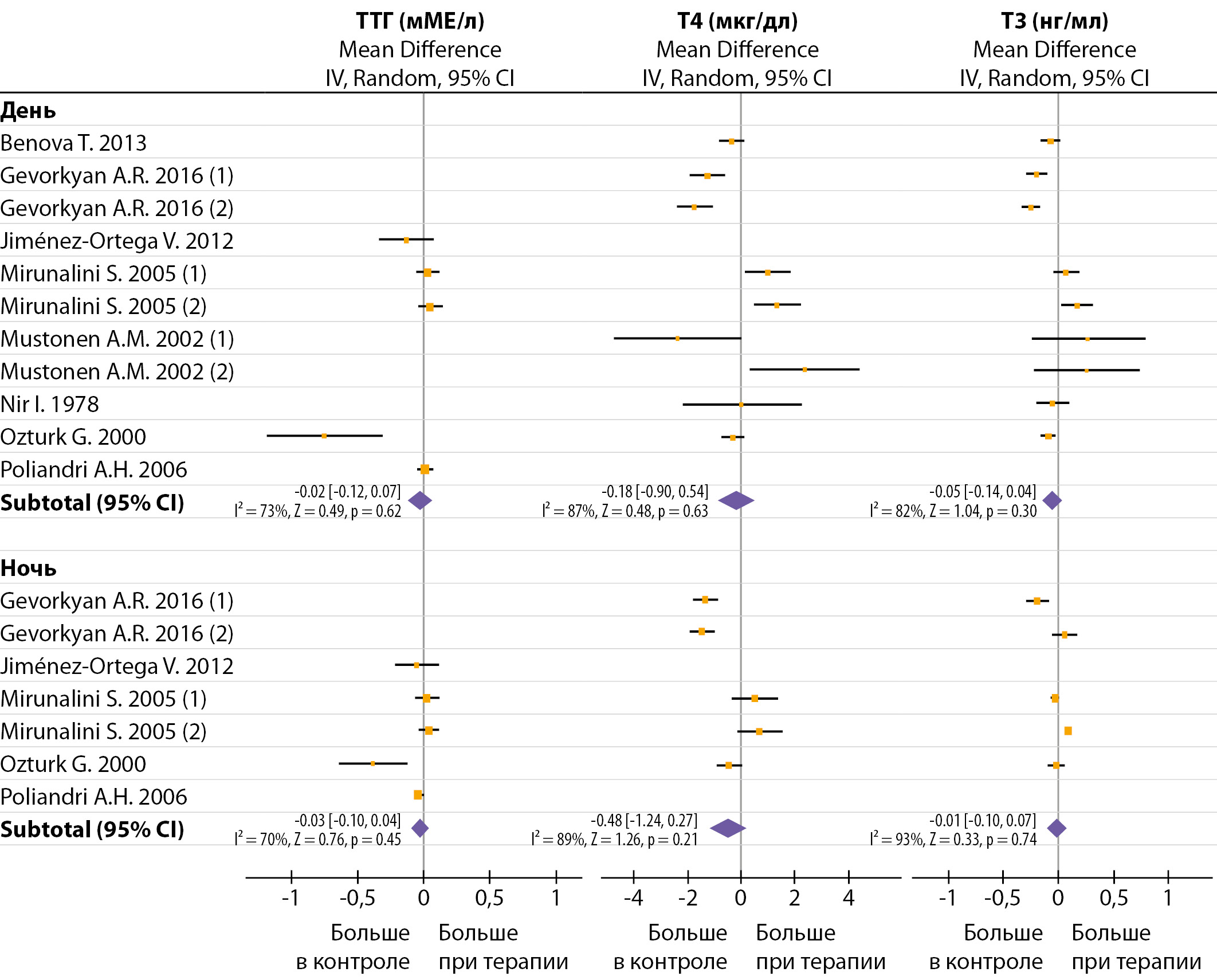
Рисунок 3. Влияние продолжительной терапии мелатонином на изменение дневных и ночных значений ТТГ и тиреоидных гормонов.
Без дополнительной стандартизации по дозе и способу введения.
Влияние мелатонина на уровень кортикостерона
Для метаанализа было отобрано 20 публикаций, исследующих влияние монотерапии мелатонином на гормоны коры надпочечников крыс. В 5 работах оценивали влияние однократного введения мелатонина, в 16 — длительного (от 1 до 40 недель). Кроме того, в 3 работах исследовали изменение циркулирующего АКТГ после 1–3 недель введения мелатонина и в 6 работах — массу надпочечников после 1–12-недельной терапии мелатонином (табл. 1). Мелатонин вводился подкожно, внутрибрюшинно и орально (в основном с питьевой водой). В 4 работах сообщается о сборе проб крови натощак (табл. 1).
Для однократного введения авторы использовали мелатонин в дозах 0,1–10 мг/кг, который вводили подкожно или внутрибрюшинно. Через 30–60 мин после введения мелатонина в дозе ≥1 мг/кг в большинстве работ наблюдали повышение уровня КС. В меньших дозах мелатонин не оказывал значимого влияния на уровень КС (рис. 4). По результатам одной работы [25], однократное подкожное введение мелатонина в дозе 1 мг/кг не изменяло уровень АКТГ (рис. 4). Интрацеребровентрикулярная инфузия мелатонина вызывала у крыс существенное снижение циркулирующих АКТГ, но не КС [69]. По данным другого исследования [27], центральное введение мелатонина существенно увеличивало уровень КС в крови. Эксперименты in vitro показали, что при обработке изолированных клеток коры надпочечников самок крыс мелатонином секреция КС уменьшается при низких дозах и не изменяется при высоких дозах; при этом у самцов мелатонин вызывал дозозависимое увеличение КС. Ни у самцов, ни у самок мелатонин (независимо от дозы) не изменял стимулирующий эффект АКТГ на секрецию КС [70]. Однако в другом исследовании [8] после обработки АКТГ мелатонин снижал секрецию КС вечером, но не утром. В работе [30] наблюдали снижение КС через 1 час после введения мелатонина ночью, днем же аналогичная инъекция гормона не влияла на уровень КС. Эксперименты [71] показали, что активность эфферентных надпочечниковых нервов уменьшается при низких дозах и увеличивается при высоких дозах мелатонина.
Для длительной терапии авторы использовали мелатонин в дозах от 0,04 до 10 мг/кг/день. После 1–4 недель терапии большинство авторов наблюдали существенное снижение уровня КС, в среднем на -78,53 [ -112,65, -44,40] нг/мл, I²=96%, Z=4,51, P<0,00001. Однако после 11–40 недель терапии уровень КС существенно увеличивался, в среднем на 51,83 [17,88, 85,78] нг/мл, I²=78%, Z=2,99, P=0,003 (рис. 5). Оценка зависимости эффекта терапии от дозы показала, что в дозе ≤1 мг/кг/день мелатонин существенно не изменяет уровень КС, а в дозе 3,5–10 мг/кг/день значительно понижает КС (табл. 2). Однако по результатам работы [24], мелатонин, вводимый в течение 12 дней в дозах 0,1, 1 и 10 мг/кг/день, дозозависимо повышал уровень КС (данные не включены в статистический анализ, т.к. представлены в относительных единицах). Наш метаанализ показал, что способ введения мелатонина не оказывал существенного влияния на уровень КС (табл. 2).
Данные влияния мелатонина на уровень КС в зависимости от времени забора проб крови очень противоречивы. Одни исследователи наблюдали после терапии увеличение КС днем и уменьшение КС ночью, другие исследователи получили противоположные результаты (рис. 6). В течение суток у крыс минимальный уровень КС отмечается утром, максимальный — вечером. Введение мелатонина в дозе 0,5 мг/кг/день перед темной фазой (17:00–18:00) смещало акрофазу КС на утро, а надир на вечер [12], но более низкие дозы мелатонина и более позднее введение (19:00) не изменяли циркадный профиль КС [45].
По результатам метаанализа, у старых крыс снижение КС после терапии мелатонином было незначительно больше, чем у молодых животных (табл. 2). Известно, что при старении уровень КС увеличивается [39][72], и при одновременном исследовании 1,5-месячных и 18-месячных крыс 9-дневная терапия мелатонином (в дозе 5 мг/кг/день, орально) эффективнее снижала КС у старых животных [39].
По данным [25][51], 10–14 дней терапии мелатонином в дозах 1 и 10 мг/кг/день не оказывали влияния на уровень циркулирующего АКТГ, однако после 3 недель терапии в дозе 4,5 мг/кг/день исследователи [46] наблюдали увеличение АКТГ в крови (рис. 5). Также есть наблюдения, что 10-дневное введение мелатонина в дозе 1 мг/кг/день существенно не изменяло уровень АКТГ в гипофизе [25]. 6-дневное введение мелатонина (1,25 мг/мл) снижало аффинность глюкокортикоидных рецепторов в гипоталамусе, гипофизе и гиппокампе [73].
Терапия мелатонином не влияла на абсолютный вес надпочечников, но значительно увеличивала их относительную массу как при низких [36][37], так и при более высоких дозах гормона (рис. 5) [51]. Центральное введение мелатонина в течение 10 дней также увеличивало массу надпочечников [74].
Два исследования [36][37] не выявили различий у самцов и самок в изменении КС и относительной массы надпочечников после терапии мелатонином в течение 11–12 недель.
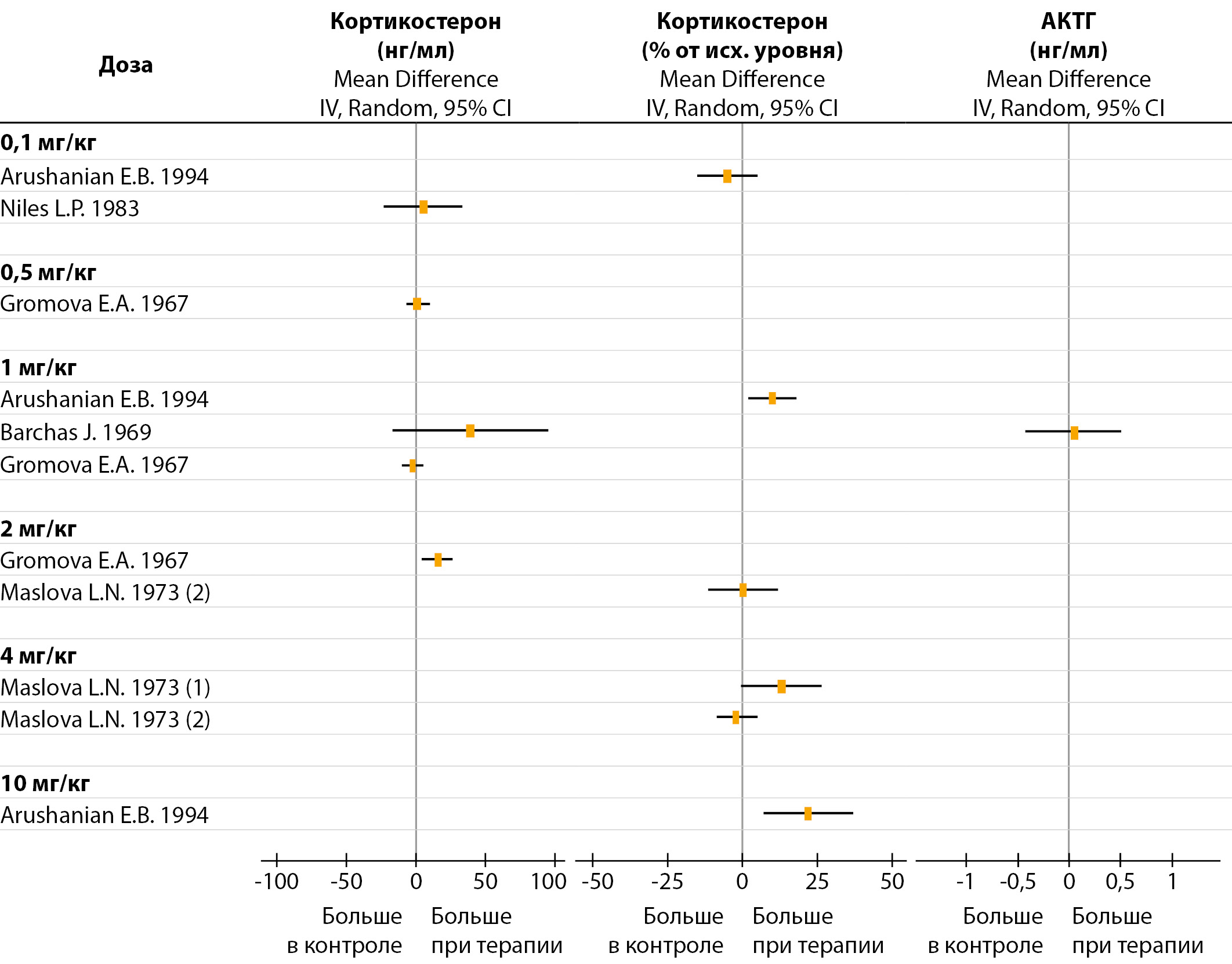
Рисунок 4. Влияние однократного введения мелатонина на уровень кортикостерона и АКТГ.
Таблица 2. Зависимость эффекта продолжительной терапии мелатонином на уровень тиреоидных гормонов и кортикостерона от дозы, способа, времени введения и возраста крыс
Время нед. | Доза | N работ | Объем выборки терапия / контроль | Средняя разность | I2 % | Z | P | |
Т3 (нг/мл) | ||||||||
≤1 мг/кг/день | 1–48 | 0,05–1 | 7 | 121 / 119 | 0,06 [ -0,04, 0,16] | 90 | 1,18 | 0,24 |
≥2 мг/кг/день | 1–8 | 2–10 | 6 | 70 / 70 | -0,05 [ -0,11, 0,01] | 50 | 1,56 | 0,12 |
подкожно | 1–12 | 0,125–10 | 4 | 56 / 56 | 0,07 [ -0,04, 0,18] | 61 | 1,24 | 0,22 |
внутрибрюшинно | 1–8 | 0,05–5 | 6 | 105 / 103 | 0,01 [ -0,12, 0,14] | 94 | 0,14 | 0,89 |
орально | 5–48 | 0,3–10 | 3 | 30 / 30 | -0,01 [ -0,07, 0,05] | 44 | 0,36 | 0,72 |
перед и в темную фазу | 1–12 | 0,05–10 | 8 | 115 / 114 | 0,05 [ -0,04, 0,14] | 91 | 1,09 | 0,28 |
только молодые крысы (2–3 мес) | 1–12 | 0,05–10 | 6 | 86 / 86 | 0,00 [ -0,08, 0,08] | 75 | 0,02 | 0,98 |
Т4 (мкг/дл) | ||||||||
≤1 мг/кг/день | 1–48 | 0,05–1 | 7 | 125 / 125 | -0,23 [ -0,78, 0,31] | 93 | 0,84 | 0,40 |
≥2 мг/кг/день | 1–5 | 2–10 | 5 | 60 / 60 | -0,63 [ -1,60, 0,33] | 87 | 1,28 | 0,20 |
подкожно | 1–12 | 0,125–10 | 4 | 56 / 56 | -1,86 [ -3,43, -0,30] | 86 | 2,33 | 0,02 |
внутрибрюшинно | 1–8 | 0,05–5 | 6 | 109 / 109 | -0,17 [ -1,08, 0,74] | 95 | 0,36 | 0,72 |
орально | 5 и 48 | 0,3–5 | 2 | 20 / 20 | -0,09 [ -0,48, 0,30] | 68 | 0,44 | 0,66 |
перед и в темную фазу | 1–12 | 0,05–10 | 7 | 105 / 104 | -0,47 [ -1,15, 0,21] | 93 | 1,35 | 0,18 |
только молодые крысы (2–3 мес) | 1–12 | 0,05–10 | 5 | 76 / 76 | -1,38 [ -2,26, -0,50] | 87 | 3,08 | 0,002 |
ТТГ (мМЕ/л) | ||||||||
≤1,5 мг/кг/день | 1–80 | 0,05–1 | 7 | 123 / 123 | 0,00 [ -0,02, 0,03] | 73 | 0,08 | 0,94 |
≥3 мг/кг/день | 1 и 4 | 3 и 10 | 2 | 22 / 22 | -0,28 [ -0,59, 0,04] | 42 | 1,74 | 0,08 |
подкожно | 1 и 12 | 0,125–10 | 3 | 36 / 36 | -0,03 [ -0,16, 0,10] | 79 | 0,43 | 0,67 |
внутрибрюшинно | 4 и 8 | 0,05–3 | 3 | 42 / 42 | -0,01 [ -0,05, 0,03] | 83 | 0,49 | 0,62 |
орально | 4–80 | 0,3–1,5 | 3 | 67 / 67 | -0,03 [ -0,06, 0,00] | 50 | 1,70 | 0,09 |
перед и в темную фазу | 1–80 | 0,05–10 | 6 | 84 / 84 | -0,01 [ -0,04, 0,02] | 80 | 0,46 | 0,64 |
только молодые крысы (1,5–2 мес) | 1–12 | 0,125–10 | 5 | 87 / 87 | -0,02 [ -0,11, 0,07] | 69 | 0,42 | 0,67 |
Кортикостерон (нг/мл) | ||||||||
≤1 мг/кг/день | 1–48 | 0,04–1 | 8 | 181 / 181 | 19,78 [ -9,50, 49,06] | 84 | 1,32 | 0,19 |
3-10 мг/кг/день | 1–6 | 3,5–10 | 7 | 53 / 53 | -39,60 [ -61,00, -18,20] | 98 | 3,63 | 0,0003 |
подкожно | 1–4 | 0,08–4,5 | 4 | 31 / 31 | -10,12 [ -39,08, 18,84] | 95 | 0,68 | 0,49 |
внутрибрюшинно | 2–6 | 0,5–10 | 5 | 75 / 75 | -9,80 [ -23,98, 4,37] | 90 | 1,36 | 0,18 |
орально | 1–48 | 0,04–5 | 7 | 128 / 128 | -46,42 [ -117,86, 25,02] | 95 | 1,27 | 0,20 |
перед и в темную фазу | 1–6 | 0,5–10 | 3 | 60 / 60 | -12,53 [ -32,42, 7,36] | 70 | 1,23 | 0,22 |
только молодые крысы (1.5-4 мес) | 1–12 | 0,5–10 | 6 | 101 / 101 | -8,53 [ -63,13, 46,07] | 88 | 0,31 | 0,76 |
возрастные крысы (6-18 мес) | 1–48 | 0,04–5 | 4 | 50 / 50 | -55,99 [ -152,16, 40,19] | 97 | 1,14 | 0,25 |

Рисунок 5. Влияние продолжительной терапии мелатонином на уровень циркулирующих АКТГ, кортикостерона и массу надпочечников.
Без дополнительной стандартизации по дозе и способу введения.

Рисунок 6. Влияние продолжительной терапии мелатонином на изменение дневных и ночных значений кортикостерона.
Без дополнительной стандартизации по дозе и способу введения.
ЗАКЛЮЧЕНИЕ
В итоге не было получено убедительных данных об изменении уровня ТТГ и ТГ после терапии мелатонином без учета дозы и сроков терапии, но наблюдалась тенденция снижения ТТГ, Т3 и Т4 при более высоких дозах мелатонина, однако работ слишком мало для окончательного вывода. Начало терапии было ассоциировано со снижением активности ТГ, после 7 недель терапии активность ТГ незначительно возрастала. Максимальную чувствительность к экзогенному мелатонину показал Т4, что свидетельствует о влиянии мелатонина на секреторную функцию ЩЖ.
По результатам нашего метаанализа, эффект мелатонина на уровень КС зависит от дозы и продолжительности терапии. Снижение КС было ассоциировано с терапией продолжительностью не более 4 недель и с высокими дозами мелатонина. Повышение КС наблюдалось при длительной терапии. Кроме того, мелатонин увеличивал относительный вес надпочечников. К настоящему времени плохо изучена секреция КС при использовании мелатонина в дозах 10 мг/кг и более.
Интересно отметить, что ранее проведенный нами метаанализ показал: первые недели терапии мелатонином и более высокие дозы гормона ассоциированы с увеличением уровня циркулирующей глюкозы, триглицеридов, инсулина у крыс, содержащихся в стандартных условиях [75]. Результаты настоящего и предыдущего [75] метаанализов свидетельствуют о том, что воздействие мелатонина на углеводный и липидный обмен может осуществляться в том числе и через модулирование уровня ТГ и КС.
Следует учесть, что при каких-либо возмущающих воздействиях эффект мелатонина на параметры метаболизма может изменяться. Например, при стандартной диете мелатонин практически не влияет на липидный профиль, однако при высокофруктозной, высокожировой и высокохолестериновой диете мелатонин эффективно снижает уровень триглицеридов и холестерина [75]. Это объясняется тем, что, с одной стороны, высококалорийные диеты могут изменять экспрессию и аффинность рецепторов, чувствительных к мелатонину; а с другой — мелатонин нивелирует окислительный стресс, вызванный диетами.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Финансирование из средств государственного задания №056-00119-22-00.
Конфликт интересов. Авторы декларируют отсутствие конфликта интересов.
Вклад авторов. Кузьменко Н.В, Плисс М.Г. — концепция,подбор литературы, проведение метаанализа; Кузьменко Н.В., Цырлин В.А. — написание текста; Кузьменко Н.В. — иллюстрации. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Emet M, Ozcan H, Ozel L, et al. A Review of Melatonin, Its Receptors and Drugs. Eurasian J Med. 2016;48(2):135-41. doi: https://doi.org/10.5152/eurasianjmed.2015.0267
2. Dardente H, Hazlerigg DG, Ebling FJ. Thyroid hormone and seasonal rhythmicity. Front Endocrinol (Lausanne). 2014;5(19). doi: https://doi.org/10.3389/fendo.2014.00019
3. Kinlein SA, Karatsoreos IN. The hypothalamic-pituitary-adrenal axis as a substrate for stress resilience: Interactions with the circadian clock. Front Neuroendocrinol. 2020;56:100819. doi: https://doi.org/10.1016/j.yfrne.2019.100819
4. Buijs RM, Wortel J, Van Heerikhuize JJ, et al. Anatomical and functional demonstration of a multisynaptic suprachiasmatic nucleus adrenal (cortex) pathway. Eur J Neurosci. 1999;11(5):1535-44. doi: https://doi.org/10.1046/j.1460-9568.1999.00575.x
5. Romero LM. Seasonal changes in plasma glucocorticoid concentrations in free-living vertebrates. Gen Comp Endocrinol. 2002;128(1):1-24. doi: https://doi.org/10.1016/s0016-6480(02)00064-3
6. Lim CT, Khoo B. Normal Physiology of ACTH and GH Release in the Hypothalamus and Anterior Pituitary in Man.; 2000.
7. Ng KY, Leong MK, Liang H, Paxinos G. Melatonin receptors: distribution in mammalian brain and their respective putative functions. Brain Struct Funct. 2017;222(7):2921-2939. doi: https://doi.org/10.1007/s00429-017-1439-6
8. Richter HG, Torres-Farfan C, Garcia-Sesnich J, et al. Rhythmic expression of functional MT1 melatonin receptors in the rat adrenal gland. Endocrinology. 2008;149(3):995-1003. doi: https://doi.org/10.1210/en.2007-1009
9. Torres-Farfan C, Richter HG, Rojas-García P, et al. Mt1 melatonin receptor in the primate adrenal gland: Inhibition of adrenocorticotropin-stimulated cortisol production by melatonin. J Clin Endocrinol Metab. 2003. doi: https://doi.org/10.1210/jc.2002-021048
10. Ghosh H, Rai S, Manzar MD, et al. Differential expression and interaction of melatonin and thyroid hormone receptors with estrogen receptor α improve ovarian functions in letrozole-induced rat polycystic ovary syndrome. Life Sci. 2022;295:120086. doi: https://doi.org/10.1016/j.lfs.2021.120086
11. Baltaci AK, Mogulkoc R, Bediz CS, et al. Pinealectomy and zinc deficiency have opposite effects on thyroid hormones in rats. Endocr Res. 2003;29(4):473-81. doi: https://doi.org/10.1081/erc-120026953
12. Ostrowska Z, Kos-Kudla B, Nowak M, et al. The relationship between bone metabolism, melatonin and other hormones in sham-operated and pinealectomized rats. Endocr Regul. 2003;37(4):211-24. https://www.sav.sk/journals/endo/full/2003/2003_04c.pdf
13. Mustonen AM, Nieminen P, Hyvärinen H. Effects of continuous light and melatonin treatment on energy metabolism of the rat. J Endocrinol Invest. 2002;25(8):716-23. doi: https://doi.org/10.1007/BF03345106
14. Ostrowska Z, Kos-Kudla B, Marek B, Kajdaniuk D. Influence of lighting conditions on daily rhythm of bone metabolism in rats and possible involvement of melatonin and other hormones in this process. Endocr Regul. 2003;37(3):163-74. https://www.sav.sk/journals/endo/full/2003/2003_03d.pdf
15. Claustrat B, Valatx JL, Harthé C, Brun J. Effect of constant light on prolactin and corticosterone rhythms evaluated using a noninvasive urine sampling protocol in the rat. Horm Metab Res. 2008;40(6):398-403. doi: https://doi.org/10.1055/s-2008-1065330
16. Tchekalarova J, Atanasova M, Ivanova N, et al. Endurance training exerts time-dependent modulation on depressive responses and circadian rhythms of corticosterone and BDNF in the rats with pinealectomy. Brain Res Bull. 2020;162:40-48. doi: https://doi.org/10.1016/j.brainresbull.2020.05.012
17. Acuña D, Garcia del Rio C, Garcia-Torres L, et al. Role of pineal gland in kidney-adrenal homeostasis. Horm Metab Res. 1984;16(11):589-92. doi: https://doi.org/10.1055/s-2007-1014858
18. la Fleur SE, Kalsbeek A, Wortel J, et al. Role for the pineal and melatonin in glucose homeostasis: pinealectomy increases night-time glucose concentrations. J Neuroendocrinol. 2001;13(12):1025-32. doi: https://doi.org/10.1046/j.1365-2826.2001.00717.x
19. Fraschini F, Mess B, Martini L. Pineal gland, melatonin and the control of luteinizing hormone secretion. Endocrinology. 1968;82(5):919-24. doi: https://doi.org/10.1210/endo-82-5-919
20. DeFronzo RA, Roth WD. Evidence for the existence of a pineal-adrenal and a pineal-thyroid axis. Acta Endocrinol (Copenh). 1972;70(1):35-42. doi: https://doi.org/10.1530/acta.0.0700035
21. Ekins R. Immunoassay standardization. Scand J Clin Lab Invest. 1991. doi: https://doi.org/10.3109/00365519109104600
22. Berson SA, Yalow RS. Radioimmunoassay of ACTH in plasma. J Clin Invest. 1968;47(12):2725-51. doi: https://doi.org/10.1172/JCI105955
23. Borenstein M, Hedges L V, Higgins JPT, Rothstein HR. Introduction to Meta-Analysis. 2009. doi: https://doi.org/10.1002/9780470743386
24. Арушанян Е.Б., Эльбекьян К.С. Различные сдвиги плазменного кортикостерона в зависимости от дозы и схемы введения мелатонина // Экспериментальная и клиничская фармакология. — 1994. — Т. 57. — №5. — С. 34-5.
25. Barchas J, Conner R, Levine S, Vernikos-Danellis J. Effects of chronic melatonin and saline injections on pituitary adrenal secretion. Experientia. 1969;25(4):413-4. doi: https://doi.org/10.1007/BF01899954
26. Gromova EA, Kraus M, Krecek J. Effect of melatonin and 5-hydroxytryptamine on aldosterone and corticosterone production by adrenal glands of normal and hypophysectomized rats. J Endocrinol. 1967;39(3):345-50. doi: https://doi.org/10.1677/joe.0.0390345.
27. Маслова Л.Н., Евтюгина Е.М., Онищенко Л.С. Влияние мелатонина на гипоталамо-гипофизарно-надпочечниковую ось // Проблемы эндокринологии. — 1973. — Т. 19. — №5. — С. 55-9.
28. Mattila J, Männistö PT. Studies on the role of the pineal gland in the regulation of TSH secretion in postpuberal male rats. Horm Res. 1981;14(1):24-35. doi: https://doi.org/10.1159/000179354
29. Mitsuma T, Nogimori T. Effects of various drugs on thyrotropin secretion in rats. Horm Metab Res. 1985;17(7):337-41. doi: https://doi.org/10.1055/s-2007-1013537
30. Niles LP, Brown GM. Arginine vasotocin stimulates glucocorticoid secretion in male rats. Prog Neuropsychopharmacol Biol Psychiatry. 1983;7(4-6):841-4. doi: https://doi.org/10.1016/0278-5846(83)90079-9
31. Abd Allah ESH, Mahmoud AM. Melatonin attenuates chronic immobilization stress-induced muscle atrophy in rats: Influence on lactate-to-pyruvate ratios and Na+/K+ ATPase activity. Pathophysiology. 2018;25(4):353-357. doi: https://doi.org/10.1016/j.pathophys.2018.06.002
32. Ahmed HH, Mannaa F, Elmegeed GA, Doss SH. Cardioprotective activity of melatonin and its novel synthesized derivatives on doxorubicin-induced cardiotoxicity. Bioorg Med Chem. 2005;13(5):1847-57. doi: https://doi.org/10.1016/j.bmc.2004.10.066
33. Aoyama H, Mori N, Mori W. Anti-glucocorticoid effects of melatonin on adult rats. Acta Pathol Jpn. 1987; 37(7):1143-8. doi: https://doi.org/10.1111/j.1440-1827.1987.tb00431.x
34. Baltaci AK, Mogulkoc R, Kul A, Bediz CS, Ugur A. Opposite effects of zinc and melatonin on thyroid hormones in rats. Toxicology. 2004;195(1):69-75. doi: https://doi.org/10.1016/j.tox.2003.09.001
35. Benova T, Viczenczova C, Radosinska J, et al. Melatonin attenuates hypertension-related proarrhythmic myocardial maladaptation of connexin-43 and propensity of the heart to lethal arrhythmias. Can J Physiol Pharmacol. 2013;91(8):633-9. doi: https://doi.org/10.1139/cjpp-2012-0393
36. Bojková B, Marková M, Ahlersová E, et al. Metabolic effects of prolonged melatonin administration and short-term fasting in laboratory rats. Acta Vet Brno. 2006. doi: https://doi.org/10.2754/avb200675010021
37. Bojková B, Orendás P, Friedmanová L, et al. Prolonged melatonin administration in 6-month-old Sprague-Dawley rats: metabolic alterations. Acta Physiol Hung. 2008;95(1):65-76. doi: https://doi.org/10.1556/APhysiol.95.2008.4
38. Бондаренко Л.А., Геворкян А.Р. Влияние курсового введения мелатонина на гормональную активность гипофизарно-тиреоидной системы у старых крыс с возрастным гипотиреозом // Буковинский медицинский вестник. — 2009. — Т. 13. — №4. — С. 38-40.
39. Brazão V, Santello FH, Colato RP, et al. Melatonin down-regulates steroidal hormones, thymocyte apoptosis and inflammatory cytokines in middle-aged T. cruzi infected rats. Biochim Biophys Acta Mol Basis Dis. 2020;1866(11):165914. doi: https://doi.org/10.1016/j.bbadis.2020.165914
40. Esquifino A, Agrasal C, Velázquez E, et al. Effect of melatonin on serum cholesterol and phospholipid levels, and on prolactin, thyroid-stimulating hormone and thyroid hormone levels, in hyperprolactinemic rats. Life Sci. 1997;61(11):1051-8. doi: https://doi.org/10.1016/s0024-3205(97)00613-9
41. Gevorkyan A.R. Chronobiological features of the effect of exogenous melatonin on hormone thyroid activity in young rats. Journal of Education, Health and Sport. 2016;6 (10):547-556. doi: https://doi.org/10.5281/zenodo.167878
42. Gomaa AM, Galal HM, Abou-Elgait AT. Neuroprotective effects of melatonin administration against chronic immobilization stress in rats. Int J Physiol Pathophysiol Pharmacol. 2017;9(2):16-27. doi: https://e-century.us/files/ijppp/9/2/ijppp0050029.pdf
43. Jiménez-Ortega V, Cano Barquilla P, Fernández-Mateos P, et al. Cadmium as an endocrine disruptor: correlation with anterior pituitary redox and circadian clock mechanisms and prevention by melatonin. Free Radic Biol Med. 2012;53(12):2287-97. doi: https://doi.org/10.1016/j.freeradbiomed.2012.10.533
44. Kinson GA, MacDonald NE, Liu CC. The effects of melatonin and serotonin on blood flow fraction and testosterone metabolism in selected organs of the male rat. Can J Physiol Pharmacol. 1973;51(5):313-8. doi: https://doi.org/10.1139/y73-047
45. Konakchieva R, Mitev Y, Almeida OF, Patchev VK. Chronic melatonin treatment counteracts glucocorticoid-induced dysregulation of the hypothalamic-pituitary-adrenal axis in the rat. Neuroendocrinology. 1998;67(3):171-80. doi: https://doi.org/10.1159/000054312
46. Mercau ME, Calanni JS, Aranda ML, et al. Melatonin prevents early pituitary dysfunction induced by sucrose-rich diets. J Pineal Res. 2019;66(2):e12545. doi: https://doi.org/10.1111/jpi.12545
47. Mirunalini S, Subramanian P. Temporal oscillations of thyroid hormones in long term melatonin treated rats. Pharmazie. 2005;60(1):52-6. doi: https://www.ingentaconnect.com/content/govi/pharmaz/2005/00000060/00000001/art00010?crawler=true
48. Nasiraei-Moghadam SN, Parivar K, Ahmadiani A, et al. Protective Effect of Melatonin against Inequality-Induced Da mages on Testicular Tissue and Sper m Para meters. Int J Fertil Steril. 2014;7(4):313-22. doi: https://www.ijfs.ir/article_45208.html
49. Nir I, Hirschmann N, Puder M, Petrank J. Changes in rodent thyroid hormones and cyclic-AMP following treatment with pineal indolic compounds. Arch Int Physiol Biochim. 1978;86(2):353-62. doi: https://doi.org/10.3109/13813457809069910
50. Nordio M, Vaughan MK, Sabry I, Reiter RJ. Undernutrition potentiates melatonin effects in maturing female rats. J Endocrinol Invest. 1989;12(2):103-10. doi: https://doi.org/10.1007/BF03349933
51. Olukole SG, Lanipekun DO, Ola-Davies EO, Oke BO. Melatonin attenuates bisphenol A-induced toxicity of the adrenal gland of Wistar rats. Environ Sci Pollut Res Int. 2019;26(6):5971-5982. doi: https://doi.org/10.1007/s11356-018-4024-5
52. Ozturk G, Coşkun S, Erbaş D, Hasanoglu E. The effect of melatonin on liver superoxide dismutase activity, serum nitrate and thyroid hormone levels. Jpn J Physiol. 2000;50(1):149-53. doi: https://doi.org/10.2170/jjphysiol.50
53. Poliandri AH, Esquifino AI, Cano P, et al. In vivo protective effect of melatonin on cadmium-induced changes in redox balance and gene expression in rat hypothalamus and anterior pituitary. J Pineal Res. 2006;41(3):238-46. doi: https://doi.org/10.1111/j.1600-079X.2006.00360.x
54. Rasmussen DD, Boldt BM, Wilkinson CW, et al. Daily melatonin administration at middle age suppresses male rat visceral fat, plasma leptin, and plasma insulin to youthful levels. Endocrinology. 1999;140(2):1009-12. doi: https://doi.org/10.1210/endo.140.2.6674
55. Ром-Бугославская Е.С., Щербакова В.С. Сезонные особенности влияния мелатонина на функцию щитовидной железы // Бюллетень экспериментальной биологии и медицины. — 1986. — Т. 101. — №3. — С. 268-9. doi: https://link.springer.com/article/10.1007/BF00835913
56. Sewerynek E, Wiktorska J, Lewinski A. Effects of melatonin on the oxidative stress induced by thyrotoxicosis in rats. Neuro Endocrinol Lett. 1999;20(3-4):157-161. https://www.nel.edu/userfiles/articlesnew/NEL203499A01.pdf
57. Vaughan MK, Oaknin S, Cozzi B, et al. Influence of melatonin on the testicular regression induced by subcutaneous testosterone pellets in male rats kept in long or short photoperiod. J Reprod Fertil. 1988;82(1):277-84. doi: https://doi.org/10.1530/jrf.0.0820277
58. Виноградова И.А. Влияние препаратов «Мелатонин» и «Эпиталон» на возрастную динамику тиреотропной активности гипофиза и функции щитовидной железы в разных световых режимах // Успехи геронтологии. — 2009. — Т. 22. — №4. — С. 631-8.
59. Wang L, McFadden JW, Yang G, et al. Effect of melatonin on visceral fat deposition, lipid metabolism and hepatic lipo-metabolic gene expression in male rats. J Anim Physiol Anim Nutr (Berl). 2021;105(4):787-796. doi: https://doi.org/10.1111/jpn.13497
60. Wolden-Hanson T, Mitton DR, McCants RL, et al. Daily melatonin administration to middle-aged male rats suppresses body weight, intraabdominal adiposity, and plasma leptin and insulin independent of food intake and total body fat. Endocrinology. 2000;141(2):487-97. doi: https://doi.org/10.1210/endo.141.2.7311
61. Segal J, Troen BR, Ingbar SH. Influence of age and sex on the concentrations of thyroid hormone in serum in the rat. J Endocrinol. 1982;93(2):177-81. doi: https://doi.org/10.1677/joe.0.0930177
62. Silvestri E, Lombardi A, de Lange P, et al. Age-related changes in renal and hepatic cellular mechanisms associated with variations in rat serum thyroid hormone levels. Am J Physiol Endocrinol Metab. 2008;294(6):E1160-8. doi: https://doi.org/10.1152/ajpendo.00044.2008
63. Stevenson TJ, Prendergast BJ. Reversible DNA methylation regulates seasonal photoperiodic time measurement. Proc Natl Acad Sci U S A. 2013;110(41):16651-6. doi: https://doi.org/10.1073/pnas.1310643110
64. Lewiński A, Sewerynek E, Zerek-Mełeń G, et al. Influence of melatonin and N-acetylserotonin on the cyclic AMP concentration in the rat thyroid lobes incubated in vitro. J Pineal Res. 1989;7(1):55-61. doi: https://doi.org/10.1111/j.1600-079x.1989.tb00442.x
65. Lewiński A, Sewerynek E. Melatonin inhibits the basal and TSH-stimulated mitotic activity of thyroid follicular cells in vivo and in organ culture. J Pineal Res. 1986;3(3):291-9. doi: https://doi.org/10.1111/j.1600-079x.1986.tb00752.x
66. Wajs E, Lewiński A. Inhibitory influence of late afternoon melatonin injections and the counter-inhibitory action of melatonin-containing pellets on thyroid growth process in male Wistar rats: comparison with effects of other indole substances. J Pineal Res. 1992;13(4):158-66. doi: https://doi.org/10.1111/j.1600-079x.1992.tb00071.x
67. Янко Р.В. Морфологическая структура щитовидной железы молодых крыс, получавших мелатонин // Эндокринология. — 2014. — Т. 19. — №3. — С. 195-199. https://endokrynologia.com.ua/index.php/journal/article/download/268/239/
68. De Prospo ND, Hurley J. A comparison of intracerebral and intraperitoneal injections of melatonin and its precursors on 131 I uptake by the thyroid glands of rats. Agents Actions. 1971;2(1):14-7. doi: https://doi.org/10.1007/BF01965374
69. Juszczak M, Roszczyk M, Kowalczyk E, Stempniak B. The influence of melatonin receptors antagonists, luzindole and 4-phenyl-2-propionamidotetralin (4-P-PDOT), on melatonin-dependent vasopressin and adrenocorticotropic hormone (ACTH) release from the rat hypothalamo-hypophysial system. In vitro and in vivo studies. J Physiol Pharmacol. 2014;65(6):777-84. https://www.jpp.krakow.pl/journal/archive/12_14/pdf/777_12_14_article.pdf
70. Lesniewska B, Nowak M, Nussdorfer GG, Malendowicz LK. Sex-dependent effect of melatonin on the secretory activity of rat and hamster adrenal gland in vitro. Life Sci. 1990;47(3):241-5. doi: https://doi.org/10.1016/0024-3205(90)90326-m
71. Niijima A, Chun SJ, Shima T, et al. Effect of intravenous administration of melatonin on the efferent activity of the adrenal nerve. J Auton Nerv Syst. 1998;71(2-3):134-8. doi: https://doi.org/10.1016/s0165-1838(98)00067-8
72. Scaccianoce S, Di Sciullo A, Angelucci L. Age-related changes in hypothalamo-pituitary-adrenocortical axis activity in the rat. In vitro studies. Neuroendocrinology. 1990;52(2):150-5. doi: https://doi.org/10.1159/000125566
73. Marinova C, Persengiev S, Konakchieva R, et al. Melatonin effects on glucocorticoid receptors in rat brain and pituitary: significance in adrenocortical regulation. Int J Biochem. 1991;23(4):479-81. doi: https://doi.org/10.1016/0020-711x(91)90177-o
74. De Prospo N, Hurley J. Effects of injecting melatonin and its precursors into the lateral cerebral ventricles on selected organs in rats. J Endocrinol. 1971;49(3):545-6. doi: https://doi.org/10.1677/joe.0.0490545
75. Кузьменко Н.В., Цырлин В.А., Плисс, М.Г. Метаанализ экспериментальных исследований влияния монотерапии мелатонином на уровень циркулирующих триглицеридов, холестерина, глюкозы и инсулина в зависимости от диеты крыс // Российский физиологический журнал им. И.М. Сеченова. — 2023. —Т. 109. — №2. — С. 139–162. doi: https://doi.org/10.1134/S0022093023010180
Об авторах
Н. В. КузьменкоРоссия
Кузьменко Наталия Владимировна - к.б.н.
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие конфликта интересов
В. А. Цырлин
Россия
Цырлин Виталий Александрович - д.м.н., профессор.
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие конфликта интересов
М. Г. Плисс
Россия
Плисс Михаил Гениевич - к.м.н.
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие конфликта интересов
Дополнительные файлы

|
1. Рисунок 1. Влияние однократного внутривенного введения мелатонина на уровень ТТГ и тиреоидных гормонов. | |
| Тема | ||
| Тип | Research Instrument | |
Скачать
(60KB)
|
Метаданные ▾ | |

|
2. Рисунок 2. Влияние продолжительной терапии мелатонином на уровень циркулирующих ТТГ и тиреоидных гормонов. | |
| Тема | ||
| Тип | Research Instrument | |
Скачать
(323KB)
|
Метаданные ▾ | |

|
3. Рисунок 3. Влияние продолжительной терапии мелатонином на изменение дневных и ночных значений ТТГ и тиреоидных гормонов. | |
| Тема | ||
| Тип | Research Instrument | |
Скачать
(40KB)
|
Метаданные ▾ | |

|
4. Рисунок 4. Влияние однократного введения мелатонина на уровень кортикостерона и АКТГ. | |
| Тема | ||
| Тип | Research Instrument | |
Скачать
(28KB)
|
Метаданные ▾ | |

|
5. Рисунок 5. Влияние продолжительной терапии мелатонином на уровень циркулирующих АКТГ, кортикостерона и массу надпочечников. | |
| Тема | ||
| Тип | Research Instrument | |
Скачать
(66KB)
|
Метаданные ▾ | |

|
6. Рисунок 6. Влияние продолжительной терапии мелатонином на изменение дневных и ночных значений кортикостерона. | |
| Тема | ||
| Тип | Research Instrument | |
Скачать
(42KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Кузьменко Н.В., Цырлин В.А., Плисс М.Г. Метаанализ экспериментальных исследований влияния монотерапии мелатонином на уровень тиреоидных гормонов и глюкокортикоидов у крыс, содержащихся в стандартных условиях. Проблемы Эндокринологии. 2024;70(5):91-105. https://doi.org/10.14341/probl13396
For citation:
Kuzmenko N.V., Tsyrlin V.A., Pliss M.G. Meta-analysis of experimental studies of the effect of melatonin monotherapy on the levels of thyroid hormones and glucocorticoids in rats kept under standard condition. Problems of Endocrinology. 2024;70(5):91-105. (In Russ.) https://doi.org/10.14341/probl13396

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).









































.jpg)


