Перейти к:
Резолюция национального междисциплинарного совета экспертов «Высокодозный витамин D (Девилам) в практике акушера-гинеколога»
https://doi.org/10.14341/probl13465
Аннотация
28 марта 2024 года в Москве состоялся Совет Экспертов «Высокодозовый витамин D (Девилам) в практике акушерагинеколога, гинеколога и эндокринолога» с участием ведущих экспертов гинекологов, эндокринологов и акушеровгинекологов, в рамках которого были обсуждены новые возможности применения высокодозного витамина D у пациенток различных возрастов, нуждающихся в коррекции имеющихся дефицита или недостаточности витамина D.
Для цитирования:
Андреева Е.Н., Артымук Н.В., Веснина А.Ф., Зазерская И.Е., Карахалис Л.Ю., Каткова Н.Ю., Пигарова Е.А., Сахаутдинова И.В., Спиридонова Н.В., Тапильская Н.И., Хамошина М.Б., Шереметьева Е.В., Юренева С.В., Ярмолинская М.И. Резолюция национального междисциплинарного совета экспертов «Высокодозный витамин D (Девилам) в практике акушера-гинеколога». Проблемы Эндокринологии. 2024;70(2):103-116. https://doi.org/10.14341/probl13465
For citation:
Andreeva E.N., Artymuk N.V., Vesnina A.F., Zazerskaya I.E., Karakhalis L.Y., Katkova N.Y., Pigarova E.A., Sakhautdinova I.V., Spiridonova N.V., Tapilskaya N.I., Khamoshina M.B., Sheremetyeva E.V., Yureneva S.V., Yarmolinskaya M.I. Resolution of the national interdisciplinary council of experts "High-dose vitamin D (Devilam) in the practice of an obstetrician-gynecologist". Problems of Endocrinology. 2024;70(2):103-116. (In Russ.) https://doi.org/10.14341/probl13465
Дефицит витамина D — это состояние, характеризующееся снижением концентрации 25(ОН)D в крови ниже оптимального уровня, которое может приводить к снижению всасывания кальция в кишечнике, развитию вторичного гиперпаратиреоза и повышению риска переломов, особенно у пожилых лиц [1][2].
В последние десятилетия значительный интерес представляет подробное изучение физиологической роли витамина D в организме, его значения в функционировании тканей и органов, а также вклада, который вносит изменение его метаболизма в развитие хронических заболеваний, течение и исход беременности [3].
В настоящее время дефицит витамина D принял характер пандемии XXI века, затрагивающей все континенты и типы пациентов, независимо от места проживания, пола, возраста, социального статуса и расы [4–9].
Публикации последних лет свидетельствуют, что эта проблема актуальна не только для специалистов-эндокринологов, терапевтов и врачей общей практики, но и в целом в современном акушерстве и гинекологии. Многочисленные исследования, включая метаанализы последних лет, подтверждают влияние недостаточного уровня витамина D на репродуктивное здоровье женщины, включая здоровье ее потомства [10–14 ]. А также существуют исследования, которые показали положительное влияние витамина D на здоровье мужчины и его роль на фертильность мужской половины человечества [15–18].
Кроме того, и женщины, находящиеся в периоде пери- и постменопаузы, подвержены негативному риску влияния на общее здоровье, сердечно-сосудистую, общую смертность и смертность, связанную с онкологическими заболеваниями, связанными с дефицитом или недостаточностью витамина D [19–23].
Общепризнанным является значение витамина D не только в качестве вещества, участвующего в кальциево-фосфорном обмене, и, как следствие, в развитии остеопороза и связанных с ним переломов и падений, особенно у женщин старших возрастных категорий, когда продукция и защитные функции женских половых гормонов значимо снижаются [24–26].
Таким образом, риску развития патологических состояний, связанных с дефицитом/недостаточностью витамина D, подвержены женщины различных возрастов.
РОЛЬ ВИТАМИНА D В ПРОФИЛАКТИКЕ ГЕСТАЦИОННЫХ ОСЛОЖНЕНИЙ НА ЭТАПЕ ПОДГОТОВКИ К БЕРЕМЕННОСТИ
Важное значение недостаточность/дефицит витамина D приобретает в прегравидарный период и в период беременности [27]. Современные представления о плейотропных эффектах витамина D позволяют предположить, что из-за недостатка этого вещества может снижаться вероятность наступления беременности либо, в случае ее наступления, увеличивается риск развития различных патологий [28]. Анализ многочисленных исследований свидетельствует о неблагоприятном влиянии дефицита витамина D на течение и исход беременности.
С его дефицитом ассоциированы риски развития гестационного сахарного диабета, преэклампсии, плацентарной недостаточности, низкой массы тела при рождении, преждевременных родов, бактериальных инфекций [29–32]. Следовательно, необходимо определить адекватную дозировку колекальциферола, которая позволит компенсировать как непосредственно дефицит витамина D, так и возможное отрицательное влияние на течение беременности.
Совет экспертов рекомендует внести в Клинические рекомендации по прегравидарной подготовке к беременности определение уровня сывороточного 25(ОН)D как минимум за 3 месяца до планируемой беременности у женщин из группы риска по тяжелому дефициту витамина D, чтобы в случае выявленного дефицита/недостаточности витамина D иметь возможность компенсировать данное состояние, включая использование возможностей скорости насыщения организма пациентки высокодозным витамином D «Девилам» [33].
Дефицит витамина D и исходы вспомогательных репродуктивных технологий (ВРТ)
Повышение эффективности методов вспомогательных репродуктивных технологий (ВРТ) — актуальная задача современной репродуктивной медицины. Исследования последних лет показывают четкую взаимосвязь между уровнем витамина D и исходами беременности в программах ВРТ. Витамин D играет важную роль в поддержании репродуктивного здоровья женщин. Рецепторы к витамину D обнаружены во многих структурах репродуктивной системы: в яичниках (особенно в гранулезных клетках), эндометрии, эпителии маточных труб, плаценте, децидуальных клетках, гипофизе и гипоталамусе [34]. Биологические эффекты витамина D и прогестерона синергичны — они способствуют поддержанию беременности за счет индукции противовоспалительных путей (Th2- и Treg-клеток), стимуляции высвобождения кортикотропин-рилизинг-фактора (CRF), активина А, фактора роста сосудистого эндотелия (VEGF), остеопонтина, кальбиндина, ингибировании провоспалительных путей (NK, Th1- и Th17-клетки), регуляции эндометриальной экспрессии гена HOXA10, участвующего в процессах имплантации эмбриона [35].
Главные доказательства участия витамина D в репродуктивных процессах были получены в исследованиях с использованием ВРТ, показавших снижение уровней наступления клинической беременности в результате негативного влияния дефицита D на рецептивность эндометрия [36–39]. По данным метаанализов 2018 г. было отмечено:
-при дефиците витамина D наблюдается достоверное снижение уровня живорождения после циклов ВРТ по сравнению с женщинами с нормальным уровнем витамина D;
-вероятность наступления клинической беременности оказалась статистически значимо выше в группе женщин с адекватным уровнем витамина D, как и вероятность рождения живых детей, по сравнению с женщинами с недостаточностью или дефицитом витамина D [40][41].
В руководящих документах РФ подчеркнута необходимость скрининга уровня витамина D у пациентов группы риска [42][43]. С учетом представленных данных выше женщины с бесплодием, с несколькими неудачными попытками ЭКО, а также планирующих протоколы ВРТ, тоже могут быть отнесены к группе риска. В рамках подготовки к процедурам ВРТ следует помнить о возможном дефиците витамина D или его недостаточном уровне и необходимости коррекции выявленных нарушений, особенно у женщин, входящих в группы повышенного риска (например, пациентки с ожирением, бариатрическими операциями в анамнезе и т.д.).
Совет экспертов особо отметил важность назначения исследования на недостаточность/дефицит витамина D в рамках подготовки к процедурам ЭКО/ВРТ не только для женщины, но и обязательное исследование, а при обнаружении — и лечение недостаточности/дефицита витамина D для мужчины в бесплодной паре. Если семья планирует ВРТ, на этапе подготовки к процедуре необходимо назначение определения уровня 25(OH)D, кальция и альбумина в биохимическом анализе крови для обоих партнеров.
Дефицит/недостаточность витамина D у женщин с синдромом поликистозных яичников
Синдром поликистозных яичников (СПЯ) — полигенное эндокринное расстройство, обусловленное как генетическими, так и эпигенетическими факторами, при этом ожирение и инсулинорезистентность (ИР) часто встречаются при этой патологии и усугубляют течение самого заболевания. Во многих исследованиях выявлена обратная связь между обеспеченностью витамином D и метаболическими нарушениями при СПЯ. Недостаточность витамина D может являться фактором риска нарушения толерантности к глюкозе, ИР и сахарного диабета 2 типа (СД2) [44].
Ожирение коррелирует с более низким уровнем 25(OH)D в основном в результате разрушения липофильного витамина в жировой ткани [45]. Механизм действия витамина D при ожирении связан с влиянием на гены регуляции углеводного и жирового метаболизма [46]. Получены данные о высокой распространенности дефицита витамина D среди женщин с СПЯ и его обратной корреляции с маркерами чувствительности к инсулину [47][48]. В систематический обзор и метаанализ эффекта применения Ca/витамина D у женщин с СПЯ [49] было включено 6 рандомизированных контролированных исследований (n=280), авторы отметили, что оптимальный уровень витамина D способствует:
- снижению уровня инсулина в сыворотке крови (p=0,03);
- снижению инсулинорезистентности (HOMA-IR) (p=0,04);
- снижению уровня глюкозы в крови натощак (p=0,002);
- снижению уровня триглицеридов (р=0,02), холестерина ЛПОНП (р=0,02), уровня общего холестерина (р<0,001), холестерина ЛПНП (р<0,001).
Таким образом, витамин D может быть использован в качестве дополнительного препарата, способствующего улучшению чувствительности тканей к инсулину и улучшающего метаболизм у женщин с СПЯ.
Адекватный статус витамина D имеет большое значение для успешной овуляции и повышения частоты наступления беременности у страдающих бесплодием женщин с СПЯ. В исследованиях было показано:
- уровень в сыворотке 25(OH)D может служить независимым прогностическим маркером репродуктивного успеха после индукции овуляции у таких пациенток [50];
- вероятность живорождения снижалась на 44% у женщин с уровнем 25(OH)D < 30 нг/мл [51];
- уровень 25(OH)D в сыворотке статистически значимо положительно коррелировал с успешной имплантацией и показателями наступления клинической беременности.
Дефицит витамина D и эндометриоз
Эндометриоз — это хроническое, рецидивирующее, прогрессирующее, гормонозависимое заболевание, характеризующееся доброкачественным разрастанием за пределами полости матки ткани, сходной по морфологической структуре и функциям с эндометрием. Эндометриоз, несомненно, является мультифакторным заболеванием, загадочным и многоликим в своих клинических проявлениях, которое диагностировано более чем у 256 миллионов женщин в мире, ассоциировано с бесплодием у 35–50% пациенток, с хроническим болевым синдромом — у 70–80% женщин [52, 53]. Эндометриоз-ассоциированный хронический болевой синдром является серьезной проблемой и может отрицательно влиять на психоэмоциональное состояние и качество жизни пациенток [54]. Не существует единого подхода и универсального метода лечения, который гарантировал бы полное излечение и отсутствие рецидивов заболевания [55].
Данные относительно ассоциации уровня 25(OH)D и эндометриоза довольно противоречивы. Результатов многочисленных исследований на данном этапе недостаточно для доказательства роли витамина D в патогенезе генитального эндометриоза, а для применения колекальциферола в качестве нового подхода в терапии заболевания необходимо проведение дополнительных исследований [56]. В работе Miyashita M. и соавт. отмечены более низкие уровни 25(OH)D в сыворотке крови у больных с распространенным эндометриозом по сравнению с заболеванием средней степени тяжести у здоровых женщин [57], в то время как Somigliana E. и соавт., напротив, обнаружили более высокие концентрации сывороточного 25(OH)D в группе женщин с эндометриозом, при этом средний уровень 25(ОН)D у больных эндометриозом составил 24,9±14,8 нг/мл, что, согласно референсным значениям, относится к недостаточности его содержания [58]. Таким образом, ряд исследователей утверждает, что существенной связи между уровнем 25(ОН)D и эндометриозом не выявлено [59–62]; между тем другие работы демонстрируют значительно более низкие уровни 25(ОН)D в сыворотке крови в группах пациенток с эндометриозом [63-67].
Baek J.C. и соавт. [65] отметили достоверную корреляцию между уровнем 25(ОН)D и тяжестью заболевания, а Anastasi E. и соавт. [66], напротив, не выявили зависимости между концентрацией 25(ОН)D в сыворотке крови и степенью распространенности заболевания, бесплодием или индексом массы тела, но обнаружили значимую корреляцию между низким уровнем 25(OH)D и наличием любого типа эндометриоз-ассоциированного болевого синдрома с выраженностью ≥5 баллов по ВАШ. Также исследователи показали, что в группе женщин с эндометриозом средний уровень сывороточного 25(ОН)D составлял 21,3±8,9 нг/мл: дефицит 25(ОН)D наблюдался у 48%, недостаточность — у 32%, и только у 20% женщин отмечено содержание в пределах референсных значений. Дефицит/недостаточность 25(ОН)D значительно чаще диагностировались у больных эндометриозом по сравнению со здоровыми женщинами (80 против 33,3%; р<0,001) [63]. Ciavatini A. и соавт. отметили достоверную линейную корреляцию между уровнем витамина D в сыворотке крови и диаметром эндометриоидных кист. У 85,7% обследованных женщин с односторонней эндометриомой был диагностирован сниженный уровень витамина D в сыворотке крови (уровень 25(ОН)D ниже 30 нг/мл), при этом в данной группе больных средний диаметр кисты яичника был практически в 2 раза больше, чем у пациенток c эндометриоидными кистами и уровнем витамина D в пределах референсных значений [68]. Российские исследователи также утверждают, что для женщин с эндометриозом яичников характерно снижение концентрации 25(ОН)D до значений, соответствующих критериям недостаточности (23,98±6,82 нг/мл), а при наличии выраженной тазовой боли — до 19,26±6,01 нг/мл, что соответствует критериям дефицита. Также была отмечена достоверная умеренная обратная корреляция между интенсивностью тазовой боли, обусловленной эндометриозом яичников, и уровнем витамина D в крови [69].
Известно, что рецептор витамина D (VDR) кодируется геном рецептора витамина D (VDR). Наиболее значимыми и исследованными полиморфными вариантами гена VDR, ассоциированными с развитием ряда заболеваний, являются: rs1544410 (BsmI), rs2228570 (FokI), rs731236 (TaqI), rs7975232 (ApaI). Известно, что частота аллеля G полиморфного варианта rs1544410 (BsmI) гена VDR достоверно выше у пациенток с наружным генитальным эндометриозом (НГЭ) по сравнению с популяционной выборкой. Установлено наличие достоверных различий для генотипа G/G полиморфного варианта rs1544410 (BsmI) гена VDR у больных НГЭ относительно группы контроля (p<0,05), согласно коэффициенту соотношения шансов риск развития НГЭ в 1,9 раза выше при данном генотипе (OR=1,93 CI=1,082-3,450). Сочетание генотипов A/A+G/A, напротив, достоверно чаще встречается в популяции (p=0,025) по сравнению с пациентками с генитальным эндометриозом [70].
VDR экспрессируются как в эндометриоидных гетеротопиях, так и в эндометрии больных НГЭ, а также в эндометрии здоровых женщин. Zelenko Z. и соавт. обнаружили, что экспрессия VDR ниже в среднюю секреторную по сравнению с ранней секреторной фазой менструального цикла как у женщин с НГЭ, так и в контрольной группе [71]. Bergadà L. и соавт. представили данные иммуногистохимического анализа, которые показали снижение уровня экспрессии VDR у больных карциномой эндометрия (n-157) по сравнению с нормальным эндометрием (n-60) [72]. Известно, что эндометриоидные гетеротопии характеризуются сниженным уровнем экспрессии VDR по сравнению с эндометрием больных НГЭ и эндометрием контрольной группы в секреторную фазу менструального цикла. При этом в эндометриоидных гетеротопиях уровень экспрессии VDR сопоставим со значениями в эндометрии контрольной группы в пролиферативную фазу менструального цикла. Экспрессия VDR у здоровых женщин в эндометрии в 1,5 раза выше в секреторную фазу менструального цикла по сравнению с пролиферативной фазой, то есть имеет циклические изменения. У больных НГЭ, напротив, не выявлено циклических изменений экспрессии VDR в эндометрии, что, возможно, имеет важное значение в патогенезе заболевания, может свидетельствовать об изменении рецептивности эндометрия, нарушениях имплантации и быть одной из причин эндометриоз-ассоциированного бесплодия. Однако необходимо проведение дальнейших исследований в данном направлении [73].
Результаты работ на экспериментальных моделях — мышах и крысах — хирургически-индуцированного эндометриоза демонстрируют значительное снижение площади эндометриоидных гетеротопий и, в некоторых случаях, полную резорбцию поражений на фоне проводимой терапии колекальциферолом и его селективным агонистом элокальцитолом [74–78]. Также в этих работах продемонстрирована способность колекальциферола и элокальцитола оказывать неклассические эффекты, среди которых: противовоспалительный эффект за счет снижения количества макрофагов и уровня провоспалительного цитокина интерлейкина-1 (IL-1) в перитонеальной жидкости [74]; антиапоптотический — развитие апоптоза в стромальном компоненте имплантатов [75] и антиангиогенный за счет снижения уровней VEGF (васкулоэндотелиального фактора роста), матриксной металлопротеиназы-9 (MMP-9) и возможности повышать содержание TIMP-2 (тканевой ингибитор металлопротеиназы-2) [76].
Данные относительно влияния колекальциферола на болевой синдром носят противоречивый характер. При проведении двойного слепого клинического исследования Almassinokiani F. и соавт. не обнаружили существенных различий в уменьшении выраженности хронической тазовой боли и дисменореи после лечения колекальциферолом или плацебо [79]. Lasco A. и соавт. в своем исследовании, напротив, установили, что колекальциферол при однократном приеме в дозе 300 000 МЕ за 5 дней до предполагаемой менструации по сравнению с плацебо у женщин с первичной дисменореей, ассоциированной с эндометриозом, статистически значимо уменьшает выраженность болевого синдрома [80]. Снижение интенсивности болевого синдрома, вероятно, связано со способностью кальцитриола (путем подавления циклооксигиназы-2) влиять на синтез простагландинов в эндометрии и инактивировать их вследствие усиления регуляции 15-гидроксипростагландин-дегидрогеназы [81]. Также известно, что сочетанное применение аГнРГ 3,75 мг или диеногеста 2 мг с колекальциферолом способствует более выраженному уменьшению болевого синдрома и стабилизации психоэмоционального фона по сравнению со стандартной гормономодулирующей терапией [67][82][83].
Антипролиферативные свойства витамина D
Антипролиферативные свойства витамина D оказывают влияние как на состояние эпидермиса и волосяных фолликулов, так и на их способность к восстановлению после повреждения УФ-излучением. Доказанным считается влияние на подавление пролиферации эпителиальных клеток при раке молочной железы (РМЖ), толстой кишки, простаты [84]. У женщин в постменопаузе с раком молочной железы наблюдалась связь между недостаточностью или дефицитом витамина D и опухолями с худшими прогностическими признаками РМЖ [85].
У коморбидной пациентки на приеме у акушера-гинеколога выявление дефицита или недостаточности витамина D представляется крайне важным для его своевременного и эффективного восполнения с целью повышения качества жизни, качественной прегравидарной подготовки и ведения беременности, комбинированной терапии СПЯ, онкопротекции относительно РМЖ, снижения риска развития депрессии, сердечно-сосудистых заболеваний (ССЗ), а также снижения риска развития остеопении и саркопении у пожилых пациенток. Два последних состояния, с учетом их достаточно медленного и малосимптомного развития, способны привести к развитию таких осложнений, как частые падения и низкоэнергетические переломы крупных костей, что резко ухудшает прогноз для пожилого пациента [84][87–94].
Дефицит витамина D и менопауза
Дефицит витамина D оказывает негативное влияние на течение переходного периода женщины и в период менопаузы. Дефицит витамина D составляет 31–70% у женщин в постменопаузе. Женщины в постменопаузе подвержены повышенному риску ССЗ. Уровни 25(OH)D в сыворотке связаны с такими важными факторами риска ССЗ, как СД, высокий уровень триглицеридов, гипертония, ожирение и высокий риск смертности. Таким образом, существует связь между менопаузой, низким содержанием витамина D в сыворотке и сердечно-сосудистыми заболеваниями [95–98].
В исследовании NHANES (2023 г.) отмечено, что дефицит и недостаточность витамина D могут быть связаны с более ранним возрастом наступления менопаузы [95].
К плейотропным эффектам витамина D в период менопаузы можно отнести: профилактику саркопении, снижение рисков ССЗ, протекцию в рамках генитоуринарного менопаузального синдрома (ГУМС), купирование вазомоторных симптомов, модулирование иммунной функции и влияние на выработку адипокинов, а также антипролиферативное действие на опухолевые клетки [99][100].
Распространенность метаболического синдрома резко увеличивается с наступлением менопаузы и может достигать 30–70% по сравнению с 14–45% у женщин репродуктивного возраста [101][102]. У женщин в постменопаузе с дефицитом витамина D прием 1000 МЕ/сут в течение 9 месяцев способствовал снижению риска метаболического синдрома [103]. Витамин D способствует компенсации нарушений углеводного обмена у женщин в постменопаузе [104].
Женщины с низким уровнем витамина D имеют больше риска развития пролапса тазовых органов. Более того, уровень витамина D был обратно пропорционален тяжести пролапса тазовых органов [105][106]. Повышение уровня витамина D было связано с уменьшением риска расстройств тазового дна, улучшением среднего модифицированного индекса здоровья влагалища у женщин в возрастной группе 65–78 лет [107].
Для успешного формирования настороженности у акушеров-гинекологов необходимо привлечь их внимание к возможному риску возникновения дефицита/недостаточности витамина D у пациенток различных возрастных категорий с наиболее часто встречающимися у специалиста на приеме заболеваниями. Понятный акушеру-гинекологу портрет пациентки позволит в условиях дефицита времени максимально эффективно принять решение, запланировать обследование и сделать назначения, направленные на устранение выявленных нарушений.
Таким образом, с учетом необходимости быстрого и простого выбора пациенток, нуждающихся в скрининге для определения сывороточного витамина D, оптимальным представляется формирование перечня основных портретов пациенток, для которых установлен высокий риск развития дефицита/недостаточности витамина D:
- витамин D у девочек-подростков с нарушениями менструального цикла: с избытком массы тела/ожирением, неполноценным питанием (ограничениями в питании в связи с соблюдением различных систем питания для снижения веса);
- витамин D в раннем репродуктивном возрасте:прегравидарная подготовка, пациентки с привычным невынашиванием, СПЯ, подготовка к ЭКО/ВРТ, девушки с избытком массы тела/ожирением, СД 1 типа, пациентки с аутоиммунными заболеваниями;
- витамин D в позднем репродуктивном периоде, 35–44 года: готовятся к беременности в позднем репродуктивном возрасте (в том числе протоколы ЭКО/ВРТ), СПЯ, миома матки, гестационный СД в анамнезе, НТГ и СД 2 типа, рак молочной железы и яичников, эндометриоз [19][89][108–112];
- витамин D и женщина в перименопаузе: низкоэнергетические переломы в анамнезе, риск переломов, остеопороз, вульвовагинальная атрофия. Витамин D участвует в регуляции роста и дифференцировки многих клеток, особенно тканей, выстилающих многослойный плоский эпителий [113]. Витамин D3 связывается с внутриклеточным рецептором, который является членом семейства рецепторов стероидных гормонов щитовидной железы. Витамин D3 и его рецепторы образуют комплекс, который связывается с элементом ответа генов на витамин D3 и положительно или отрицательно влияет на транскрипцию этого гена [114].
Витамин D может быть полезен при вагинальном дискомфорте у женщин в период менопаузы [107][115], однако некоторые экспериментальные результаты противоречивы [118][119]. В исследовании 2017 г. было показано, что витамин D обладает фунгицидной активностью в отношении Candida Albicans. Исследование проводилось с помощью антимикробного скрининга с использованием модифицированного агара методом диффузии. Механизм противогрибкового действия может быть связан с повышенной жирорастворимостью витамина D, способного изменять целостность клеточной мембраны [120].
Результаты исследования показали, что чем выше уровень витамина D, тем ниже риск возникновения дисфункции тазового дна у женщин [121][122], дислипидемии, метаболического синдрома, сахарного диабета 2 типа.
Совет экспертов особо отметил необходимость скрининга на дефицит витамина D и внесения в стандарты ОМС и Клинические рекомендации положения о праве врача акушера-гинеколога назначать исследование уровня витамина D в сыворотке крови, а также вместе с определением уровня витамина D определять уровень общего кальция и альбумина в биохимическом анализе крови с расчетом уровня кальция, скорректированного на альбумин, у пациенток, предрасположенных к развитию недостаточности/дефицита витамина D:
- юные пациентки с избытком массы тела/ожирением или выраженным недостатком массы тела;
- женщины в период прегравидарной подготовки к беременности;
- пациентки с синдромом поликистозных яичников, в том числе с наследственной формой СПЯ;
- пациентки с привычным невынашиванием;
- пациентки, готовящиеся к ЭКО/ВРТ;
- пациентки с различными типами нарушений углеводно-жирового обмена, включая ожирение, НТГ и СД2, гестационный сахарный диабет в анамнезе;
- пациентки с эндометриозом, включая наружный генитальный эндометриоз;
- пациентки с миомой матки, в т.ч. в анамнезе;
- пациентки с раком молочной железы и яичников, в т.ч. в анамнезе;
- пациентки с вульвовагинальной атрофией;
- пациентки с наличием в анамнезе падений/низкоэнергетических переломов;
- пациентки, придерживающиеся вегетарианства/веганства, находящиеся на строгой диете с целью быстрого снижения веса.
Согласно проекту «Клинические рекомендации по диагностике, лечению и профилактике дефицита витамина D у взрослых» Российской ассоциации эндокринологов, критериями недостаточности/дефицита витамина D являются [1]:
Клиническая фармакология, эффективность и безопасность приема высокодозового витамина D
Девилам — новый высокодозный препарат витамина D c содержанием колекальциферола 5000 МЕ или 50 000 МЕ в одной таблетке. Препарат Девилам имеет преимущества формы выпуска (матричной таблетки), что позволяет обеспечивать сохранность от воздействия факторов окружающей среды и более равномерное всасывание колекальциферола, точность дозирования и высокую биодоступность лекарственного препарата [33][123].
Форма выпуска препарата Девилам в виде матричной таблетки представляет в своей основе матричный каркас — многоуровневую ячеистую структуру из натурального желатина. Из порошка колекальциферола формируются сыпучие микрочастицы, покрытые липидными комплексами и путем напыления под высоким давлением колекальциферол, покрытый липидными комплексами, в виде «бусин» помещается в ячейки матрикса. Множество матричных слоев соединяются между собой и формируют таблетку. Таблетка покрывается снаружи пленочной оболочкой, резистентной к воздействию кислой среды желудочного сока (рис. 1).
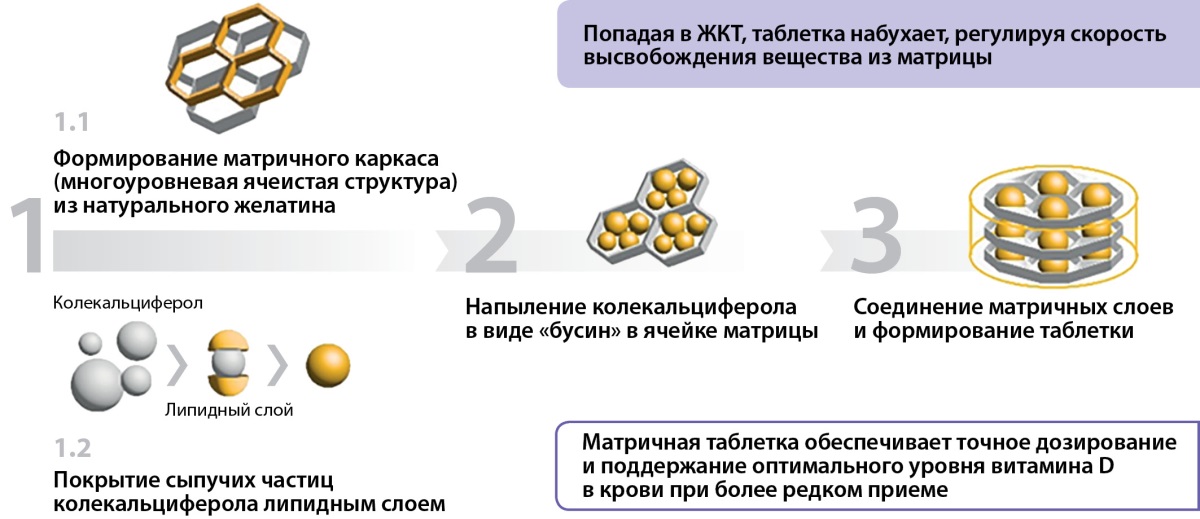
Рисунок 1. Этапы формирования матричной таблетки Девилам.
Figure 1. Stages of formation of the Devilam matrix tablet.
Таким образом, выход колекальциферола из матричной таблетки происходит в тонком кишечнике путем медленной диффузии из матричного каркаса покрытых липидной оболочкой молекул колекальциферола, что как раз и позволяет обеспечить равномерность всасывания и точность дозирования препарата (рис. 2).
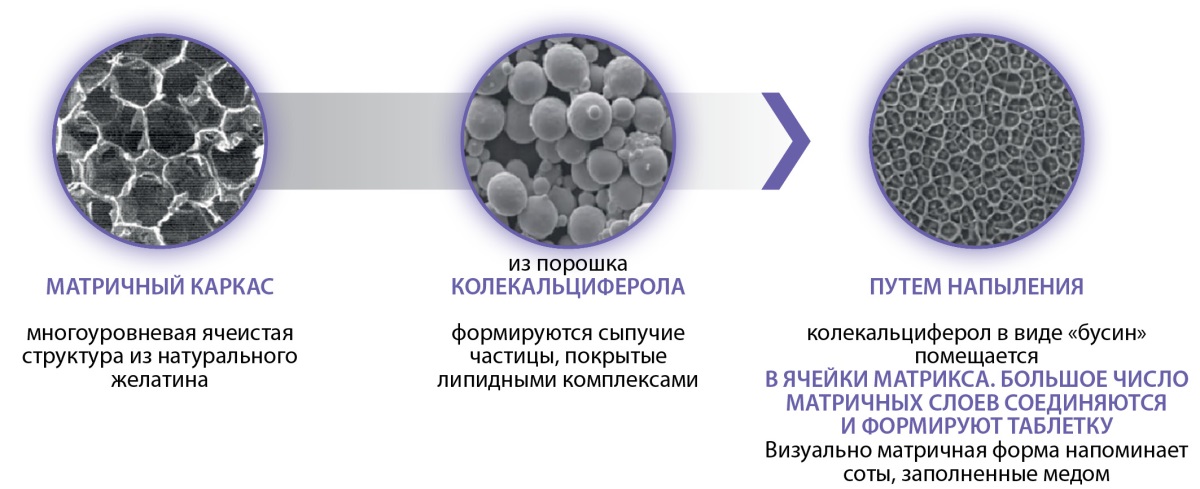
Рисунок 2. Структура матричной таблетки Девилам под увеличением.
Figure 2. Structure of Devilam matrix tablet under magnification
Исследования показали, что прием высоких доз колекальциферола 50 000 МЕ более эффективно и быстро повышает уровни 25(ОН)D в сыворотке крови, чем при низкодозных курсах [124][125].
С точки зрения безопасности было показано, что высокодозная схема приема витамина D безопасна и эффективна у коморбидных пациентов с метаболическим синдромом [126].
Эксперты постановили, что препараты колекальциферола (в частности, препарат Девилам) в форме матричной таблетки с дозировкой 50 000 МЕ и 5 000 МЕ могут быть востребованы в РФ в рамках профилактики и устранения недостаточности/дефицита витамина D (табл. 1).
Таблица 1. Примеры режимов дозирования препарата Девилам*
для профилактики и лечения дефицита витамина D
Table 1. Examples of Devilam* dosage regimens
for the prevention and treatment of vitamin D deficiency
|
Доза колекальциферола |
Таблетки Девилам 5000 |
Таблетки Девилам 50 000 |
|
Профилактика дефицита/недостаточности витамина D: Колекальциферол 800–4000 МЕ в сутки ИЛИ 5000–30 000 МЕ в неделю ИЛИ 25 000–50 000 в месяц |
Девилам 5000 через день ИЛИ Девилам 5000 от 1 до 6 таблеток в неделю |
Девилам 50 000 1 таблетка 1 раз в месяц ИЛИ 1 таблетка 1 раз в 2 недели в зависимости от массы тела пациента |
|
Профилактика дефицита/недостаточности витамина D у лиц с морбидным ожирением или тяжелым нарушением функции кишечником 5000–10 000 МЕ в сутки |
Девилам 5000 МЕ ежедневно |
Девилам 50 000 МЕ 1 таблетка 1 раз в 2 недели |
|
Лечение установленного дефицита/недостаточности витамина D (<30 нг/мл) |
Девилам 10 таб. По 5000 МЕ еженедельно |
Девилам 50 000 МЕ 1 таб. 1 раз в неделю в течение 4 недель при уровне витамина D (20–30 нг/мл), в течение 8 недель при уровне витамина D <20 нг/мл, далее перейти на поддерживающие дозы колекальциферола |
* — лекарственный препарат Девилам противопоказан при беременности и грудном вскармливании, поскольку не проводились рандомизированные клинические исследования у данных когорт пациенток.
В таблице 1 представлены варианты приема таблеток Девилам на рекомендуемые профилактические и лечебные дозы колекальциферола [127].
Вместе с тем отдельно можно выделить некоторые группы пациентов, требующие дифференцированного подхода (табл. 2) [127].
Таблица 2. Алгоритм подбора дозы с лабораторным контролем уровня 25(ОН)D
Table 2. Algorithm for dose selection with laboratory monitoring of 25(OH)D levels
|
Прием витамина D* |
Группы пациентов |
Рекомендуемые дозы |
|
Прием витамина D противопоказан |
• активный саркоидоз; • другие гранулематозы, сопровождающиеся гиперкальциемией; • гиперпаратиреоз с уровнем общего кальция крови более 2,8 ммоль/л; • пациенты с выявленной генетической мутацией (мутация 24-гидроксилазы) |
- |
|
Прием витамина D (определение исходной концентрации витамина D в крови перед назначением лекарственных препаратов витамина D не требуется) |
Взрослые 18+ |
800–4000 МЕ/сут ИЛИ 5000 МЕ через день ИЛИ 50 000 МЕ 1 раз в месяц (сезонность: ноябрь–апрель) Пример: высокодозный витамин D (Девилам) • 5000–15 000–30 000 МЕ в неделю или • 50 000 МЕ в месяц |
|
Пожилые 65+ |
800–4000 МЕ/сут ИЛИ 5000 МЕ через день или 50 000 МЕ 1 раз в месяц Например, высокодозный витамин D (Девилам) • 5000–15000–30 000 МЕ в неделю или • 50 000 МЕ в месяц |
|
|
У некоторых пациентов или при наличии определенных заболеваний или состояний для профилактики рекомендуются в 2–3 раза более высокие дозы витамина D по сравнению со здоровыми взрослыми без других факторов риска (но без применения доз витамина D, превышающих 4000–10 000 МЕ/сут): -пациенты с синдромом мальабсорбции; -пациенты с ожирением ИМТ≥30 кг/м²; -пациенты с темной кожей (монголоидной и негроидной расы) |
до 4000–5000–10000 МЕ/сут или 50 000 МЕ/раз в 2 недели Пример: высокодозный Витамин D (Девилам) • 25–30 000 МЕ в неделю или • 50 000 МЕ в 2 недели |
|
|
Пациенты с диагностированным остеопорозом, остеомаляцией и др. костными заболеваниями перед назначением антирезорбтивной терапии |
50 000 МЕ однократно, до инициации антирезорбтивной терапии, а далее — в соответствии с выше рекомендованными дозами в комплексе с препаратами для лечения остеопороза Например, Девилам 50 000 МЕ однократно с переводом на поддерживающую терапию |
|
|
Прием витамина D (требуется определение исходной концентрации витамина D в крови перед назначением лекарственных препаратов витамина D)**# |
Пациенты, нуждающиеся в активном скрининге, с высокой вероятностью выявления дефицита витамина D: остеопороз; остеомаляция; лица со скелетно-мышечной болью; хроническая болезнь почек; печеночная недостаточность; синдромы мальабсорбции (например, муковисцидоз, воспалительные заболевания кишечника, бариатрическая хирургия, радиационный энтерит); гиперпаратиреоз; хроническое лечение препаратами, влияющими на метаболизм витамина D (например, противосудорожными, противотуберкулезными препаратами, глюкокортикоидами, лекарствами от СПИДа, противогрибковыми средствами, холестирамином, гиполипидемическими препаратами, орлистатом); хронические аутоиммунные заболевания (например, рассеянный склероз, ревматоидный артрит); беременные и кормящие женщины; пациенты домов престарелых; пожилые люди с падениями или нетравматическими переломами в анамнезе; заболевания, образующие гранулемы, в неактивной форме (например, саркоидоз, туберкулез, гистоплазмоз, бериллиоз, кокцидиомикоз); пациенты с болезнью Альцгеймера и сосудистыми нарушениями в анамнезе; пациенты, придерживающиеся вегетарианства или строгой диеты с целью быстрого снижения веса |
При выявленном дефиците витамина D (уровень 25(ОН)D<20 нг/мл): • 50 000 МЕ еженедельно в течение 8 недель внутрь Например, Девилам 50 000 МЕ 1 таблетка в неделю 8 недель с последующим переводом на профилактическую терапию При выявленной недостаточности витамина D (уровень 25(ОН)D≥20 и <30 нг/мл): • 50 000 МЕ еженедельно в течение 4 недель внутрь Например, Девилам 50 000 МЕ 1 таблетка в неделю 4 недели с последующим переводом на профилактическую терапию Следует избегать однократных доз свыше 50 000 МЕ особенно в старшей возрастной когорте пациентов После достижения адекватного уровня витамина D |
* — длительный прием препаратов витамина D, особенно высокодозных, у пациентов с деменцией/иными когнитивными нарушениями, должен производиться под контролем родственников/сиделок/иного обслуживающего персонала;
** — рекомендовано определение уровня кальция в крови перед назначением терапевтических доз витамина D и через 2 месяца терапии;
*** — препараты витамина D наряду с кальцием входят в любые схемы и режимы лечения остеопороза. Если перед началом патогенетической терапии остеопороза пациент не принимал добавки витамина D и исследование концентрации 25(OH)D в сыворотке крови невозможно, а при этом планируется лечение сильными антирезорбтивными препаратами (золедроновая кислота, деносумаб), рекомендуется назначить умеренную нагрузочную дозу нативного витамина D — 5000 МЕ/сут в течение 10 дней либо однократно 50 000 МЕ, после чего перейти на обычную поддерживающую дозу 800–2000 МЕ/сут. [127–129].
# — рекомендован контроль концентрации витамина D после 2 месяцев приема терапевтических доз витамина D. Контроль следует проводить на 3–4 день после приема последней терапевтической дозы.
Особое внимание Совет экспертов обратил на внесение в Резолюцию информации, что терапия и профилактика недостаточности/дефицита витамина D должны проводиться лекарственными препаратами, зарегистрированными в ГРЛС, а не биологически активными добавками, поскольку последние не предназначены для лечения и профилактики недостаточности/дефицита витамина D, а являются лишь нутриентами для нормализации пищевого рациона, проходят контроль только при регистрации препарата, но не имеют контроля по мониторингу и регистрации нежелательных явлений (фармаконадзор), и, в соответствии с действующим законодательством, БАД-D в РФ могут применяться в дозах, не превышающих 600 МЕ/сут, что недостаточно для лечения и поддерживающей терапии дефицита и недостаточности витамина D [130].
Эксперты рекомендовали широко использовать препарат Девилам (50 000 МЕ, 5 000 МЕ) в рамках зарегистрированной инструкции по применению — в качестве препарата выбора для профилактики и лечения дефицита/недостаточности витамина D, с учетом быстрого достижения терапевтического эффекта, хорошей переносимости и безопасности препарата, связанной с особым механизмом высвобождения действующего вещества и удобства интермиттирующего приема для достижения большей комплаентности пациентов проводимому лечению.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования».
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Участие авторов. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Проект клинических рекомендаций РАЭ. Дефицит витамина D. НМИЦ Эндокринологии МЗ РФ, 2021
2. Pludowski P, Takacs I, Boyanov M, et al. Clinical Practice in the Prevention, Diagnosis and Treatment of Vitamin D Deficiency: A Central and Eastern European Expert Consensus Statement. Nutrients. 2022;14(7):1483. doi: https://doi.org/10.3390/nu14071483
3. Пигарова Е.А. Неклассические эффекты витамина D // Остеопороз и остеопатии. — 2017. — Т. 20. — №3. — С. 90-101. doi: https://doi.org/10.14341/osteo2017390-101
4. Игнатьева М.А., Новикова С.В., Костинов М.П. Метаболизм витамина D при нормальных и патологических состояниях у беременных // Российский вестник акушера-гинеколога. — 2018. — Т. 18. — №1. — С. 30-36
5. Kumar J, Yadav A. Vitamin D deficiency pandemic among pregnant women. J Fam Med Prim Care. 2019;8(4):1515. doi: https://doi.org/10.4103/jfmpc.jfmpc_202_19
6. Суплотова Л.А., Авдеева В.А., Пигарова Е.А., и др. Первое российское многоцентровое неинтервенционное регистровое исследование по изучению частоты дефицита и недостаточности витамина D в Российской Федерации у взрослых // Терапевтический архив. — 2021. — Т. 93. — №10. — С. 1209–1216. https://doi.org/10.26442/00403660.2021.10.201071
7. Manson JE, Brannon PM, et al. Vitamin D Deficiency — Is There Really a Pandemic? N Engl J Med. 2016;375:1817-1820. doi: https://doi.org/10.1056/NEJMp1608005
8. Holic M. The vitamin D deficiency pandemic: Approaches for diagnosis, treatment and prevention. Rev Endocr Metab Disord. 2017;18(2):153-165. doi: https://doi.org/10.1007/s11154-017-9424-1
9. Silveira E, Moura L, Castro M, et al. Prevalence of Vitamin D and Calcium Deficiency and Insufficiency in Women of Childbearing Age and Associated Risk Factors: A Systematic Review and Meta-Analysis. Nutrients. 2022;14(20):4351. doi: https://doi.org/10.3390/nu14204351
10. Durá-Travé T, Gallinas-Victoriano F. Pregnancy, Breastfeeding, and Vitamin D. Int J Mol Sci. 2023;24(15):11881. doi: https://doi.org/10.3390/ijms241511881
11. Muscogiuri G, Altieri B, de Angelis C, et al. Shedding new light on female fertility: The role of vitamin D. Rev. Endocr. Metab. Disord. 2017;18:273–283. doi: https://doi.org/10.1007/s11154-017-9407-2
12. Várbíró S, Takács I, Tűű L, et al. Effects of Vitamin D on Fertility, Pregnancy and Polycystic Ovary Syndrome — A Review. Nutrients. 2022; 14(8):1649. doi: https://doi.org/10.3390/nu14081649
13. Хабаров С.В., Хадарцева К.А., Волков В.Г. Витамин D и репродуктивное здоровье женщины // Российский вестник акушера-гинеколога. — 2020. — Т. 20. — №5. — С. 45-53
14. Mansur JL, Oliveri B, Giacoia E, et al. Vitamin D: Before, during and after Pregnancy: Effect on Neonates and Children. Nutrients. 2022;14(9):1900. doi: https://doi.org/10.3390/nu14091900
15. Adamczewska D, Słowikowska-Hilczer J, Walczak-Jędrzejowska R. The Association between Vitamin D and the Components of Male Fertility: A Systematic Review. Biomedicines. 2022;11(1):90. doi: https://doi.org/10.3390/biomedicines11010090
16. Calagna G, Catinella V, Polito S, et al. Vitamin D and Male Reproduction: Updated Evidence Based on Literature Review. Nutrients. 2022;14(16):3278. doi: https://doi.org/10.3390/nu14163278
17. Homayouni-Meymandi M, Sotoodehnejadnematalahi F, Nasr-Esfahani MH. Relationship between Serum Vitamin D in Male, Sperm Function and Clinical Outcomes in Infertile Men Candidate for ICSI: A Cohort Study. Int J Fertil Steril. 2022;16(2):115-121. doi: https://doi.org/10.22074/IJFS.2021.522049.1067
18. Morshed-Behbahani B, Doryanizadeh L, Shahali S, et al. Effect of and the association between vitamin D and outcomes of assisted reproductive techniques among infertile men and women: protocol for an overview of systematic reviews and meta-analysis. BMJ Open. 202;13(3):e060483. doi: https://doi.org/10.1136/bmjopen-2021-060483
19. Cappola A, Auchtus R, Fuleihan G, et al. Hormones and Aging: An Endocrine Society Scientific Statement. The Journal of Clinical Endocrinology & Metabolism. 2023;00: 1–40. doi: https://doi.org/10.1210/clinem/dgad225
20. Brøndum-Jacobsen P, Benn M, Jensen GB, Nordestgaard BG. 25-hydroxyvitamin D levels and risk of ischemic heart disease, myocardial infarction, and early death: population-based study and meta-analyses of 18 and 17 studies. Arterioscler Thromb Vasc Biol. 2012;32(11):2794-2802
21. Ju SY, et al. Low 25-hydroxyvitamin D levels and the risk of frailty syndrome: a systematic review and dose-response meta-analysis. BMC Geriatr. 2018;18(1):206
22. William B. Grant Association between vitamin D supplementation and mortality: systematic review and meta-analysis. BMJ. 2019;366. doi: https://doi.org/10.1136/bmj.l4673
23. Gaksch M, et al. Vitamin D and mortality: individual participant data meta-analysis of standardized 25–hydroxyvitamin D in 26916 individuals from a European consortium. PLoS One. 2017;12(2):e0170791
24. Chakhtoura M, et al. Vitamin D supplementation and fractures in adults: a systematic umbrella review of meta-analyses of controlled trials. J Clin Endocrinol Metab. 2022;107(3):882-898. doi: https://doi.org/10.1210/clinem/dgab742
25. LeBoff MS, et al. Supplemental vitamin D and incident fractures in midlife and older adults. N Engl J Med. 2022;387(4):299-309
26. Gillespie LD, Robertson MC, Gillespie WJ, et al. Interventions for preventing falls in older people living in the community. Cochrane Database Syst Rev. 2012;2021(6). doi: https://doi.org/10.1002/14651858.CD007146.pub3
27. Баранов И.И., Дорофейников В.В., Зазерская И.Е., и др. Междисциплинарное руководство по профилактике и лечению дефицита витамина D в прегравидарном периоде, во время беременности и после родов (код по Международной классификации болезней 10-го пересмотра — Е55) / Под ред. Гриневой Е.Н., Коган И.Ю., Уваровой Е.В. Санкт-Петербург: Эко-Вектор, 2020. 79 с.
28. Mousa A, Abell S, Scragg R, Courten B. Vitamin D in reproductive health and pregnancy. Semin Reprod Med. 2016;34:e1–13
29. Платонова Н.М., Рыбакова А.А., Никанкина Л.В., и др. Витамин D и беременность: современное состояние проблемы в центральных регионах РФ // Проблемы эндокринологии. — 2020. — Т. 66. — №6. — С. 81-87. doi: https://doi.org/10.14341/probl12693
30. Gregor S, Casorat M, Amuchastegu S, et al. Regulatory T cells induced by 1 alpha, 25-dihydroxy vitamin D3 and mycophenolate mofetil treatment mediate transplantation tolerance. J Immunol. 2001;167:1945–1953
31. Tehrani HG, Mostajeran F, Banihashemi B. Effect of vitamin D supplementation on the incidence of gestational diabetes. Adv Biomed Res. 2017;6:79
32. Moon RJ, Harvey NC, Cooper C. Endocrinology in pregnancy: Influence of maternal vitamin D status on obstetric outcomes and the fetal skeleton. Eur J Endocrinol. 2015;173:69–83
33. Инструкция по медицинскому применению лекарственного препарата Девилам. https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=1d0d5e5a-37a5-4fa8-8261-888e9194cd06
34. Laganà AS, Vitale SG, BanFrangež H, et al. Vitamin D in human reproduction: the more, the better? An evidence-based critical appraisal. Eur Rev Med Pharmacol Sci. 2017;21:4243–4251
35. Monastra G, De Grazia S, De Luca L, Vittorio S, Unfer V. Vitamin D: a steroid hormone with progesterone-like activity. Eur Rev Med Pharmacol Sci. 2018;22(8):2502-2512
36. Ozkan S, Jinda S, Greenseid K, et al. Replete vitamin D stores predictre productive success following IVF. Fertil Steril. 2010;94(4):1314–1319
37. Garbedian K, Boggild M, Moody J, Liu KE. Effect of vitamin D status on clinical pregnancy rates following in vitro fertilization. CMA J Open. 2013;1(2):77–82
38. Paffoni A, Ferrari S, Vigano P, et al. Vitamin D deficiency and infertility: insights from in vitro fertilization cycles. J Clin Endocrinol Metab. 2014;99:2372–2376
39. Polyzos NP, Anckaert E, Guzman L, et al. Vitamin D deficiency and pregnancy rates in women undergoing single embryo, blastocyst stage, transfer (SET) for IVF/ICSI. Hum Reprod. 2014;29:2032–2040
40. Zhao J, Huang X, Xu B, et al. Whether vitamin D was associated with clinical outcome after IVF/ICSI: a systematic review and metaanalysis. Reprod Biol Endocrinol. 2018;16:13
41. Chu J, Gallos I, Tobias A, et al. Vitamin D and assisted reproductive treatment outcome: A systematic review and meta-analysis. Hum Reprod. 2018;33(1):65–80
42. Клинические рекомендации. Дефицит витамина D у взрослых: диагностика, лечение и профилактика / Российская ассоциация эндокринологов, ФГБУ «Эндокринологический научный центр» Минздрава России. М., 2015. 75 с.
43. Профилактика, диагностика и лечение дефицита витамина D и кальция для взрослого населения и у пациентов с остеопорозом. Рекомендации РАОП, 2016
44. Гродницкая Е.Э., Курцер М.А. Дефицит витамина D у женщин с синдромом поликистозных яичников // Проблемы репродукции. 2015;21(5):38-42
45. Alimirah F, Peng X, Yuan L. Cross talk between the peroxisome proliferator-activated receptorγ (PPAR γ) and the vitamin D receptor (VDR) in human breast cancer cells: PPARγ binds to VDR and inhibits 1α,25-dihydroxy vitamin D3 mediated transactivation. Exp Cell Res. 2012;318(19):2490–2497
46. Pal L, Berry A, Coraluzzi L, et al. Therapeutic effects of vitamin D and calciumin in overweight women with overweight with polycystic ovary syndrome. Gynecol Endocrinol. 2012;28(12):965–968
47. He C, Lin Z, Robb SW, Ezeamama AE. Serum vitamin D levels and polycystic ovary syndrom: A systematic review and metaanalysis. Nutrients. 2015;7:4555–4577
48. Kumar A, Barki S, Raghav V, et al. Correlation of vitamin D with metabolic parameters in polycystic ovarian syndrome. Journal of Family Medicine and Primary Care. 2017;6(1):115
49. Shojaeian Z, Sadeghi R, Latifnejad Roudsari R. Calcium and vitamin D supplementation effects on metabolic factors, menstrual cycles and follicular responses in women with polycystic ocvary syndrome: A systematic review and meta-analysis. Caspian J Intern Med. 2019;10(4):359-369
50. Pal L, Zhang H, Williams J, et al. Vitamin D status relates to reproductive outcome in women with polycystic ovary syndrome: secondary analysis of a multicenter randomized controlled trial. J Clin Endocrinol Metab. 2016;101:3027–3035
51. Zhao J, Liu S, Wang Y, et al. Vitamin D improves the outcome of in vitro fertilization (IVF) in infertile women with polycystic ovary syndrome and insulin resistance. Minerva Med. 2019;110(3):199–208
52. Barnett R, Banks N, Decherney AH. Endometriosis and fertility preservation. Clinical obstetrics and gynecology. 2017; 60(3):517-523. doi: https://doi.org/10.1097/GRF.0000000000000311
53. Parasar P, Ozcan P, Terry KL. Endometriosis: Epidemiology, Diagnosis and Clinical Management. Current obstetrics and gynecology reports. 2017;6(1):34-41. doi: https://doi.org/10.1007/s13669-017-0187-1
54. Aerts L, Grangier L, Streuli I, et al. Psychosocial impact of endometriosis: From co-morbidity to intervention. Best Pract Res Clin Obstet Gynaecol. 2018;50:2-10. doi: https://doi.org/10.1016/j.bpobgyn.2018.01.008
55. Ярмолинская М.И., Айламазян Э.К. Генитальный эндометриоз: Различные грани проблемы. — Спб.: ЭкоВектор, 2017. — 615 с.
56. Giampaolino P, Corte LD, Foreste V, Bifulco G. Is there a Relationship Between Vitamin D and Endometriosis? An Overview of the Literature. Curr Pharm Des. 2019;25(22):2421-2427. doi: https://doi.org/10.2174/1381612825666190722095401
57. Miyashita M, Koga K, Izumi G, et al. Effects of 1,25-Dihydroxy Vitamin D3 on Endometriosis. J Clin Endocrinol Metab. 2016;101(6):2371-2379. doi: https://doi.org/10.1210/jc.2016-1515
58. Somigliana E, Panina-Bordignon P, Murone S, Di Lucia P, Vercellini P, Vigano P. Vitamin D reserve is higher in women with endometriosis. Hum Reprod. 2007;22(8):2273-2278. doi: https://doi.org/10.1093/humrep/dem142
59. Gil Á, Plaza-Diaz J, Mesa MD. Vitamin D: Classic and Novel Actions. Ann Nutr Metab. 2018;72(2):87-95. doi: https://doi.org/10.1159/000486536
60. Pagliardini L, Vigano’ P, Molgora M, et al. High Prevalence of Vitamin D Deficiency in Infertile Women Referring for Assisted Reproduction. Nutrients. 2015;7(12):9972-9984. doi: https://doi.org/10.3390/nu7125516
61. Bodnar LM, Simhan HN, Powers RW, Frank MP, Cooperstein E, Roberts JM. High prevalence of vitamin D insufficiency in black and white pregnant women residing in the northern United States and their neonates. J Nutr. 2007. doi: https://doi.org/10.1093/jn/137.2.447
62. Tandoi I, Somigliana E, Riparini J, Ronzoni S, Vigano’ P, Candiani M. High Rate of Endometriosis Recurrence in Young Women. J Pediatr Adolesc Gynecol. 2011;24(6):376-379. doi: https://doi.org/10.1016/j.jpag.2011.06.012
63. Cho MC, Kim JH, Jung MH, et al. Analysis of vitamin D-binding protein (VDBP) gene polymorphisms in Korean women with and without endometriosis. Clin Exp Reprod Med. 2019. doi: https://doi.org/10.5653/cerm.2019.00122
64. Harris HR, Chavarro JE, Malspeis S, Willett WC, Missmer SA. Dairy-Food, Calcium, Magnesium, and Vitamin D Intake and Endometriosis: A Prospective Cohort Study. Am J Epidemiol. 2013;177(5):420-430. doi: https://doi.org/10.1093/aje/kws247
65. Baek JC, Jo JY, Lee SM, et al. Differences in 25-hydroxy vitamin D and vitamin D-binding protein concentrations according to the severity of endometriosis. Clin Exp Reprod Med. 2019;46(3):125-131. doi: https://doi.org/10.5653/cerm.2018.00416
66. Anastasi E, Fuggetta E, De Vito C, et al. Low levels of 25-OH vitamin D in women with endometriosis and associated pelvic pain. Clin Chem Lab Med. 2017;55(12). doi: https://doi.org/10.1515/cclm-2017-0016
67. Денисова А.С., Ярмолинская М.И., Ткаченко Н.Н. Статус 25(ОН)D у больных наружным генитальным эндометриозом и клиническая эффективность применения колекальциферола в терапии заболевания // Журнал акушерства и женских болезней. — 2021. — Т. 70. — №4. — С. 125-133. doi: https://doi.org/10.17816/JOWD62883
68. Ciavattini A, Serri M, Delli Carpini G, Morini S, Clemente N. Ovarian endometriosis and vitamin D serum levels. Gynecol Endocrinol. 2017;33(2):164-167. doi: https://doi.org/10.1080/09513590.2016.1239254
69. Оразов М.Р., Радзинский В.Е., Хамошина М.Б. и др. Витамин D3 (холекальциферол) и тазовая боль, индуцированная эндометриозом яичников // Трудный пациент. — 2018. — Т.16. — №4. — С. 34-39
70. Yarmolinskaya M, Denisova A, Tkachenko N, et al. Vitamin D significance in pathogenesis of endometriosis. Gynecol Endocrinol. 2021;37(sup1):40-43. doi: https://doi.org/10.1080/09513590.2021.2006516
71. Zelenko Z, Aghajanova L, Irwin JC, Giudice LC. Nuclear receptor, coregulator signaling, and chromatin remodeling pathways suggest involvement of the epigenome in the steroid hormone response of endometrium and abnormalities in endometriosis. Reproductive Sciences. 2012;19(2):152–162. doi: https://doi.org/10.1177/1933719111415546
72. Bergadà L, Pallares J, Arcidiacono MV, Cardus A, Santacana M, Valls J, et al. Role of local bioactivation of vitamin D by CYP27A1 and CYP2R1 in the control of cell growth in normal endometrium and endometrial carcinoma. Laboratory Investigation. 2014;94(6):608–622. doi: https://doi.org/10.1038/labinvest.2014.57
73. Ярмолинская М.И., и др. Анализ экспрессии рецепторов витамина D у больных наружным генитальным эндометриозом // Акушерство и гинекология. — 2021. — №3. — С. 117-123
74. Mariani M, Vigano P, Gentilini D, et al. The selective vitamin D receptor agonist, elocalcitol, reduces endometriosis development in a mouse model by inhibiting peritoneal inflammation. Hum Reprod. 2012;27(7):2010-2019. doi: https://doi.org/10.1093/humrep/des150
75. Abbas MA, Taha MO, Disi AM, Shomaf M. Regression of endometrial implants treated with vitamin D3 in a rat model of endometriosis. European journal of pharmacology. 2013;715(1-3):72-75. doi: https://doi.org/10.1016/j.ejphar.2013.06.016
76. Yildirim B, Guler T, Akbulut M, Oztekin O, Sariiz G. 1-Alpha, 25-Dihydroxyvitamin D3 Regresses Endometriotic Implants in Rats by Inhibiting Neovascularization and Altering Regulation of Matrix Metalloproteinase. Postgraduate medicine. 2014;126(1):104-110. doi: https://doi.org/10.3810/pgm.2014.01.2730
77. Ярмолинская М.И., Денисова А.С., Андреева Н.Ю. Эффективность применения витамина D3 (колекальциферола) в терапии хирургически индуцированного эндометриоза у крыс // Российский вестник акушера-гинеколога. — 2019. — Т. 19. — №3. — С. 37-42
78. Burjiah A, Adi A, Widjiati W. Vitamin D inhibited endometriosis development in mice model through interleukin 17 modulation. Open Vet J. 2022;12(6):956. doi: https://doi.org/10.5455/OVJ.2022.v12.i6.23
79. Almassinokiani F, Khodaverdi S, Solaymani-dodaran M, et al. Effects of vitamin D on endometriosis-related pain: a double-blind clinical trial. Medical science monitor: international medical journal of experimental and clinical research. 2016;22:4960-4966. doi: https://doi.org/10.12659/MSM.901838
80. Lasco A, Catalano A, Benvenga S. Improvement of primary dysmenorrhea caused by a single oral dose of vitamin D: results of a randomized, double-blind, placebo-controlled study. Archives of Internal Medicine. 2012;172(4):366-367. doi: https://doi.org/10.1001/archinternmed.2011.715
81. Stratton P, Berkley KJ. Chronic pelvic pain and endometriosis: translational evidence of the relationship and implications. Hum Reprod Update. 2011;17:327-346. doi: https://doi.org/10.1093/humupd/dmq050
82. Ярмолинская М.И., Денисова А.С. Способ лечения наружного генитального эндометриоза, 2020
83. Ярмолинская М.И. ред. Медикаментозная терапия генитального эндометриоза: реалии и перспективы. Руководство для врачей. М.: ГЭОТАР-Медиа; 2021. 384 с.
84. Sha S, Chen L-J, Brenner H, Schöttker B. Associations of 25-hydroxyvitamin D status and vitamin D supplementation use with mortality due to 18 frequent cancer types in the UK Biobank cohort. Eur J Cancer. 2023;191:113241. doi: https://doi.org/10.1016/j.ejca.2023.113241
85. de Sousa Almeida-Filho B, De Luca Vespoli H, Pessoa EC, Machado M, Nahas-Neto J, Nahas EAP. Vitamin D deficiency is associated with poor breast cancer prognostic features in postmenopausal women. J Steroid Biochem Mol Biol. 2017;174:284-289. doi: https://doi.org/10.1016/j.jsbmb.2017.10.009
86. Norman PE, Powell JT. Vitamin D and Cardiovascular Disease. Circ Res. 2014;114(2):379-393. doi: https://doi.org/10.1161/CIRCRESAHA.113.301241
87. William B. Grant Association between vitamin D supplementation and mortality: systematic review and meta-analysis. BMJ 2019; 366. doi: https://doi.org/10.1136/bmj.l4673
88. Palma F, Volpe A, Villa P, Cagnacci A. Vaginal atrophy of women in postmenopause. Results from a multicentric observational study: The AGATA study. Maturitas. 2016;83:40-44. doi: https://doi.org/10.1016/j.maturitas.2015.09.001
89. Anagnostis P, et al. EMAS position statement: Vitamin D and menopausal health. Maturitas. 2023;169:2–9. doi: https://doi.org/10.1016/j.maturitas.2022.12.0062
90. Bener A, Saleh NM. Low vitamin D, and bone mineral den- sity with depressive symptoms burden in menopausal and postmenopausal women. J Midlife Health. 2015;6(3):108-114. doi: https://doi.org/10.4103/0976-7800.165590
91. Berridge MJ. Vitamin D and Depression: Cellular and Regulatory Mechanisms. Pharmacol Rev. 2017;69(2):80–92. doi: https://doi.org/10.1124/pr.116.013227
92. Морозова Ю.Е., Тарасова М.А. Физиологическая роль витамина D и значение его дефицита в патогенезе климактерического синдрома // Акушерство и женские болезни. 2018;67(3):74–82. doi: https://doi.org/10.17816/JOWD67374-82
93. Riazi H, Ghazanfarpour M, Taebi M, Abdolahian S. Effect of Vitamin D on the Vaginal Health of Menopausal Women: A Systematic Review. J Menopausal Med. 2019;25(3):109. doi: https://doi.org/10.6118/jmm.19194
94. Purdue-Smithe AC, Whitcomb BW, Szegda KL, et al. Vi- tamin D and calcium intake and risk of early menopause. Am J Clin Nutr. 2017;105(6):1493-1501. doi: https://doi.org/10.3945/ajcn.116.145607
95. Alinia T, Sabour S, Hashemipour M, et al. Relationship between vitamin D levels and age of menopause and reproductive lifespan: Analysis based on the National health and nutrition examination survey (NHANES) 2001-2018. Eur J Obstet Gynecol Reprod Biol. 2023;289:183-189. doi: https://doi.org/10.1016/j.ejogrb.2023.09.003
96. Speroff L, Fritz MA. 8th ed. Philadelphia: Lippincott Williams and Wilkins. Clinical gynaecologic endocrinology and infertility. 2011:566–88
97. Martins D, Wolf M, Pan D, et al. Prevalence of cardiovascular risk factors and the serum levels of 25-hydroxyvitamin D in the United States: Data from the Third National Health and Nutrition Examination Survey. Arch Intern Med. 2007;167:1159–65
98. Vacek JL, Vanga SR, Good M, et al. Vitamin D deficiency and supplementation and relation to cardiovascular health. Am J Cardiol. 2012;109:359–63
99. Mei Z, Hu H, Zou Y, Li D. The role of vitamin D in menopausal women’s health. Front Physiol. 2023;14:1211896. doi: https://doi.org/10.3389/fphys.2023.1211896
100. Erdélyi A, Pálfi E, Tűű L, et al. The Importance of Nutrition in Menopause and Perimenopause-A Review. Nutrients. 2023;16(1):27. doi: https://doi.org/10.3390/nu16010027
101. Stefanska A, Bergmann K, Sypniewska G. Metabolic Syndrome and Menopause: Pathophysiology, Clinical and Diagnostic Significance. Adv Clin Chem. 2015;72:1-75
102. Janssen I, Powell LH, Crawford S, Lasley B, Sutton-Tyrrell K. Menopause and the metabolic syndrome: the Study of Women’s Health Across the Nation. Arch Intern Med. 2008;168:1568-75
103. Ferreira PP, et al. Vitamin D supplementation improves the metabolic syndrome risk profile in postmenopausal women. Climacteric. 2020;23(1):24-31. doi: https://doi.org/10.1080/13697137.2019.1611761
104. Hao L, Lu A, Gao H, Niu J, Prabahar K, Seraj SS, Pan Y. The Effects of Vitamin D on Markers of Glucose and Obesity in Postmenopausal Women: A Meta-analysis of Randomized Controlled Trials. Clin Ther. 2023;45(9):913-920. doi: https://doi.org/10.1016/j.clinthera.2023.07.009.1
105. Legan M, Barbič M, Osredkar J, Blaganje M. Association of vitamin D deficiency and pelvic organ prolapse in postmenopausal women: a cross-sectional study. Womens Midlife Health. 2022;8(1):9. doi: https://doi.org/10.1186/s40695-022-00078-7
106. Paul ZR, Khanam NN, Barai SC, et al. Association of Low Vitamin D Level with Pelvic Organ Prolapse in Post Menopausal Women: A Case Control Study. Mymensingh Med J. 2023;32(4):1109-1117
107. Kaur H, Bala R, Nagpal M. Role of Vitamin D in urogenital health of geriatric participants. J Midlife Health. 2017. doi: https://doi.org/10.4103/jmh.JMH_84_16
108. Сидорова И.С., Унанян А.Л., Агеев М.Б., и др. Современное состояние вопроса о патогенезе, клинике, диагностике и лечении миомы матки у женщин репродуктивного возраста // Акушерство. Гинекология. Репродукция. — 2012. — Т. 6. — №4. — С. 25
109. Адамян Л.В., Серов В.Н., Сухих Г.Т., Филиппов О.С. Клинические рекомендации // Акушерство и гинекология (спецвыпуск). Проблемы репродукции. — 2015. — Т. 21. — №6. — С. 321
110. AAGL Practice Report: Practice Guidelines for the Diagnosis and Management of Submucous Leiomyomas. 2012;19:152–171
111. SOGC clinical practice guideline, The Management of Uterine Leiomyomas. 2015;318
112. Bjelakovic G, Gluud L, Nikolova D, et al. Vitamin D supplementation for prevention of cancer in adults
113. Ким Т.Х., Ли Х.Х., Парк Дж. Иммуногистохимическое обнаружение рецептора 1,25-дигидрокси витамина D во влагалище человека. Иран Дж. // Репрод Мед. 2014. — Т. 12. — С. 805–810;
114. Пайк Дж.В., Мейер М.Б. Рецептор витамина D: новые парадигмы регуляции экспрессии генов с помощью 1,25-дигидроксивитамина D(3) //Endocrinol Metab Clin North Am. 2010. — Т. 39. — С. 255–269
115. Йылдирим Б., Калели Б., Дузкан Э., Топуз О. Влияние лечения витамином D в постменопаузе на атрофию влагалища // Матуритас. — 2004. — Т. 49. — С. 334–337
116. Бала Р., Каур Х., Нагпал М. Подлинность витамина D в модифицированном индексе здоровья влагалища у пожилых людей. Int J Reprod Contracept Obstet Gynecol. — 2016. — Т. 5. — С. 4119–4122
117. Рад П., Тадайон М., Аббаспур М., и др. Влияние витамина D на атрофию влагалища у женщин в постменопаузе. Иран. // J Nurs Midwifery Res. — 2015. — Т. 20. — С. 211–215
118. Чека М.А., Гарридо А., Прат М., и др. Сравнение ралоксифена и кальция плюс витамина D при вагинальной атрофии после прекращения длительной гормональной терапии в постменопаузе у женщин с остеопорозом. Рандомизированное однолетнее проспективное исследование с замаскированной оценкой // Матуритас. — 2005. — Т. 52. — С. 70–77
119. Зареаи М. Влияние витамина Е на атрофию влагалища у женщин в постменопаузе // Цените здоровье. — 2014. — Т. 17. — A750
120. Bouzid D, Merzouki S, Bachiri M, et al. Vitamin D3 a new drug against Candida albicans. J Mycol Med. 2017;27(1):79-82. doi: https://doi.org/10.1016/j.mycmed.2016.10.003
121. Badalian SS, Rosenbaum PF. Vitamin D and pelvic floor disorders in women: results from the National Health and Nutrition Examination Survey. Obstet Gynecol. 2010;115(4):795- 803. doi: https://doi.org/10.1097/AOG.0b013e3181d34806
122. Морозова Ю.Е., Тарасова М.А. Физиологическая роль витамина D и значение его дефицита в патогенезе климактерического синдрома // Акушерство и женские болезни. — 2018. — Т. 67. — №3. — С. 74–82. doi: https://doi.org/10.17816/JOWD67374-82
123. Коцур Ю.М., Флисюк Е.В. Современные полимеры в технологии таблеток с пролонгированным высвобождением // Формулы фармации. — Т. 2. — №1. — С. 36-43
124. De Niet S, Coffiner M, Da Silva S, et al. A Randomized Study to Compare a Monthly to a Daily Administration of Vitamin D₃ Supplementation. Nutrients. 2018;10(6):659
125. Malihi Z, Lawes CMM, Wu Z, Huang Y, et al. Monthly high-dose vitamin D supplementation does not increase kidney stone risk or serum calcium: results from a randomized controlled trial. Am J Clin Nutr. 2019;109(6):1578-1587
126. Karampela I, Sakelliou A, Vallianou N, et al. Vitamin D and Obesity: Current Evidence and Controversies. Curr Obes Rep. 2021;10(2):162-180
127. Белая Ж.Е., Пигарова Е.А., Рожинская Л.Я., и др. Резолюция национального междисциплинарного совета экспертов «Применение высокодозного витамина D для профилактики и лечения дефицита витамина D, в том числе у коморбидных пациентов в практике эндокринологов, ревматологов, геронтологов и терапевтов/ ВОП» // Остеопороз и остеопатии. — 2024. — Т. 27. — №1. — С. 10-20. doi: https://doi.org/10.14341/osteo13171
128. Лесняк О.М., Никитинская О.А., Торопцова Н.В., и др. Профилактика, диагностика и лечение дефицита витамина D и кальция у взрослого населения России и пациентов с остеопорозом (по материалам подготовленных клинических рекомендаций) // Научно-практическая ревматология. — 2015. — Т. 53. — №4. — С. 403-408. doi: https://doi.org/10.14412/1995-4484-2015-403-408
129. Rizzoli R, Boonen S, Brandi ML, et al. Vitamin D supplementation in elderly or postmenopausal women: a 2013 update of 2008 recommendations from European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO). Curr Med Res Opin. 2013;29(4):305–13. doi: https://doi.org/10.1185/03007995.2013.766162
130. Мельниченко Г.А., Намазова-Баранова Л.С., и соавт. Профилактика и лечение дефицита витамина D: выбор оптимального подхода // Вопросы современной педиатрии. — 2021. — Т. 20. — №4. — С. 338-345
Об авторах
Е. Н. АндрееваРоссия
Андреева Елена Николаевна, д.м.н., профессор
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Н. В. Артымук
Россия
Артымук Наталья Владимировна, д.м.н., профессор
Researcher ID: N-2919-2016
Scopus Author ID: 35108913300
Кемерово
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
А. Ф. Веснина
Россия
Веснина Анна Федоровна, к.м.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
И. Е. Зазерская
Россия
Зазерская Ирина Евгеньевна, д.м.н., профессор
Санкт-Петербург
Scopus Author ID: 55981393900
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Л. Ю. Карахалис
Россия
Карахалис Людмила Юрьевна, д.м.н., профессор
Краснодар
Scopus Author ID: 56611990800
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Н. Ю. Каткова
Россия
Каткова Надежда Юрьевна, д.м.н., профессор
Нижний Новгород
Scopus Author ID: 57200605131
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Е. А. Пигарова
Россия
Пигарова Екатерина Александровна, д.м.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
И. В. Сахаутдинова
Россия
Сахаутдинова Индира Венеровна, д.м.н., профессор
Уфа
Scopus Author ID: 57210148389
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Н. В. Спиридонова
Россия
Спиридонова Наталья Владимировна, д. м. н., профессор
Самара
Researcher ID: S-6918-2016
Scopus Author ID: 56089251400
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Н. И. Тапильская
Россия
Тапильская Наталья Игоревна, д.м.н., профессор
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
М. Б. Хамошина
Россия
Хамошина Марина Борисовна, д.м.н., профессор
Москва
Researcher ID: E-6154-2017
Scopus Author ID: 36182882600
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Е. В. Шереметьева
Россия
Шереметьева Екатерина Викторовна, к.м.н.
117036, Москва, ул. Дмитрия Ульянова, д. 11
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
С. В. Юренева
Россия
Юренева Светлана Владимировна, д.м.н., профессор
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
М. И. Ярмолинская
Россия
Ярмолинская Мария Игоревна, д.м.н., профессор
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Дополнительные файлы
|
|
1. Рисунок 1. Этапы формирования матричной таблетки Девилам. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(290KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Структура матричной таблетки Девилам под увеличением. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(293KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Андреева Е.Н., Артымук Н.В., Веснина А.Ф., Зазерская И.Е., Карахалис Л.Ю., Каткова Н.Ю., Пигарова Е.А., Сахаутдинова И.В., Спиридонова Н.В., Тапильская Н.И., Хамошина М.Б., Шереметьева Е.В., Юренева С.В., Ярмолинская М.И. Резолюция национального междисциплинарного совета экспертов «Высокодозный витамин D (Девилам) в практике акушера-гинеколога». Проблемы Эндокринологии. 2024;70(2):103-116. https://doi.org/10.14341/probl13465
For citation:
Andreeva E.N., Artymuk N.V., Vesnina A.F., Zazerskaya I.E., Karakhalis L.Y., Katkova N.Y., Pigarova E.A., Sakhautdinova I.V., Spiridonova N.V., Tapilskaya N.I., Khamoshina M.B., Sheremetyeva E.V., Yureneva S.V., Yarmolinskaya M.I. Resolution of the national interdisciplinary council of experts "High-dose vitamin D (Devilam) in the practice of an obstetrician-gynecologist". Problems of Endocrinology. 2024;70(2):103-116. (In Russ.) https://doi.org/10.14341/probl13465

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).








































.jpg)


