Перейти к:
Дискордантные показатели инсулиноподобного фактора роста 1 (ИФР-1) и соматотропина (СТГ) в диагностике и мониторинге акромегалии
https://doi.org/10.14341/probl12791
Аннотация
Акромегалия — это редкое эндокринное заболевание, ассоциированное с множественными осложнениями и повышенной смертностью. Своевременная диагностика и адекватное лечение позволяют приблизить продолжительность жизни пациентов с акромегалией к общепопуляционному уровню. При скрининге, верификации диагноза и оценке эффективности различных методов лечения акромегалии используются следующие показатели: уровень гормона роста (соматотропного гормона, СТГ) в крови, как базальный, так и в ходе орального глюкозотолерантного теста (СТГ в ходе ОГТТ), и концентрация инсулиноподобного фактора роста-1 (ИФР-1). Вместе с тем в клинической практике до 39% пациентов с акромегалией имеют дискордантные результаты этих анализов. Ошибочная интерпретация не соответствующих друг другу лабораторных данных может приводить к гипердиагностике акромегалии или, наоборот, — несвоевременному выявлению заболевания, а также к избыточному назначению ненужных методов лечения или, в обратном случае, — длительному отсутствию адекватной терапии. В данном обзоре обсуждаются распространенность дискордантных результатов СТГ и ИФР-1 у пациентов с акромегалией; факторы, обуславливающие это расхождение, а также влияние несоответствия гормональных показателей на исходы лечения. Однозначного объяснения дискордантности уровней СТГ и ИФР-1 и руководства к ведению пациентов с акромегалией, имеющих такие результаты, к сожалению, в настоящее время не найдено. Специалисту крайне важно применять комплексный подход и учитывать все возможные факторы при интерпретации этих лабораторных показателей.
Для цитирования:
Сахнова Е.Е., Пржиялковская Е.Г., Белая Ж.Е., Мельниченко Г.А. Дискордантные показатели инсулиноподобного фактора роста 1 (ИФР-1) и соматотропина (СТГ) в диагностике и мониторинге акромегалии. Проблемы Эндокринологии. 2022;68(1):40-48. https://doi.org/10.14341/probl12791
For citation:
Sakhnova E.E., Przhiyalkovskaya E.G., Belaya Zh.E., Melnichenko G.A. Discordant parameters of insulin-like growth factor 1 and growth hormone in the diagnosis and monitoring of acromegaly. Problems of Endocrinology. 2022;68(1):40-48. (In Russ.) https://doi.org/10.14341/probl12791
ВСТУПЛЕНИЕ
Акромегалия — это редкая, медленно прогрессирующая эндокринная патология, распространенность которой составляет 28–137 случаев на 1 млн населения, а заболеваемость колеблется от 2 до 11 случаев на 1 млн населения в год [1]. По данным Всероссийского регистра опухолей гипоталамо-гипофизарной области, пациенты с акромегалией встречаются с частотой 8,65 случая на 100 тыс. жителей Российской Федерации [2]. Акромегалия чаще всего обусловлена стойкой гиперсекрецией соматотропного гормона (СТГ) опухолью гипофиза, который, в свою очередь, стимулирует синтез инсулиноподобного фактора роста 1 (ИФР-1) в печени. Действие данных гормонов в органах и тканях приводит к развитию характерной клинической картины, различных системных осложнений и, как следствие, — повышенной смертности. За последние годы немалый прогресс достигнут в лечении акромегалии, которое включает нейрохирургическое вмешательство, медикаментозную терапию и лучевое воздействие. Своевременная диагностика и адекватное лечение позволяют приблизить продолжительность жизни пациентов с акромегалией к общепопуляционному уровню [3].
При скрининге, верификации диагноза и оценке эффективности различных методов лечения акромегалии используются следующие показатели: уровень СТГ в крови, как базальный, так и в ходе орального глюкозотолерантного теста (СТГ в ходе ОГТТ), и концентрация ИФР-1 [4]. Вместе с тем в клинической практике до 39% пациентов с акромегалией имеют дискордантные результаты этих анализов [5], что, безусловно, затрудняет выбор дальнейшей тактики ведения пациента. Ошибочная интерпретация не соответствующих друг другу лабораторных данных может приводить к гипердиагностике акромегалии или, наоборот, — несвоевременному выявлению заболевания, а также к избыточному назначению ненужных методов лечения или, в обратном случае, — длительному отсутствию адекватной терапии. Последствия таких неправильных решений — это снижение качества и продолжительности жизни пациентов и повышение экономических затрат системы здравоохранения.
В данном обзоре обсуждаются вопросы лабораторной диагностики и лабораторного мониторинга акромегалии на фоне различных методов лечения с акцентом на дискордантность результатов СТГ и ИФР-1. Описаны особенности физиологической и патологической секреции СТГ и ИФР-1, распространенность дискордантных результатов СТГ и ИФР-1 при акромегалии, факторы, обуславливающие это расхождение, а также влияние несоответствия гормональных показателей на исходы разных видов лечения.
Цель обзора — информировать специалистов о необходимости учитывать различные причины дискордантности лабораторных показателей в ходе принятия решения о ведении пациентов с акромегалией.
ОСОБЕННОСТИ ФИЗИОЛОГИЧЕСКОЙ СЕКРЕЦИИ СТГ И ИФР-1
СТГ — это полипептидный гормон из семейства ростовых факторов, который синтезируется преимущественно в соматотрофах гипофиза, а также в других тканях, включая репродуктивную, лимфатическую системы и желудочно-кишечный тракт [6]. Для физиологической секреции СТГ характерна пульсация: выброс приблизительно каждые 3 ч и суточные колебания с преобладанием секреции в ночное время. Частота пульсации зависит от разных факторов, в первую очередь от пола и возраста. После рождения концентрация СТГ остается высокой очень недолго, затем снижается и поддерживается на одном уровне до пубертата, во время которого достигает пика и вырастает в 3 раза. С возрастом секреция СТГ падает: у мужчин — постепенно, приблизительно на 14% каждые 10 лет, у женщин — резко после достижения менопаузы [6].
Синтез и секреция СТГ регулируются в основном двумя гипоталамическими гормонами: рилизинг-гормоном соматолиберином, который повышает оба процесса, и соматостатином, который, взаимодействуя с соматостатиновыми рецепторами на соматотрофах, снижает выброс СТГ, но не влияет на его синтез. Кроме того, пептид грелин, который вырабатывается преимущественно в клетках желудка, стимулирует выброс СТГ [7]. ИФР-1 по принципу отрицательной обратной связи также подавляет секрецию гормона роста (рисунок).
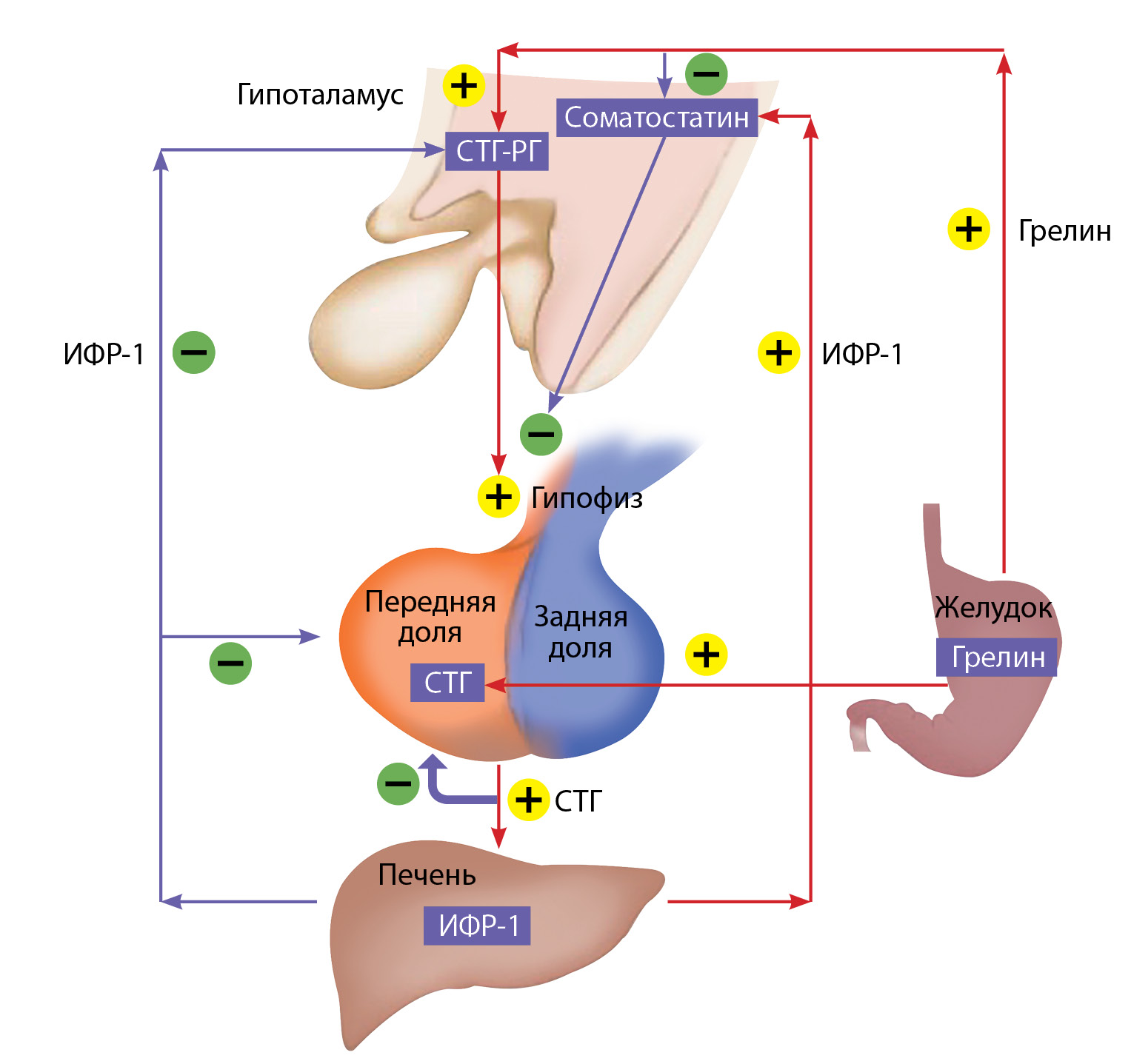
Рисунок. Схема физиологической регуляции синтеза и секреции соматотропного гормона и инсулиноподобного фактора роста 1. СТГ — соматотропный гормон, ИФР-1 — инсулиноподобный фактор роста 1, СТГ-РГ — соматолиберин.
Стрелки указывают на стимулирующий (+) или угнетающий эффект (-) различных регуляторов.
Адаптировано из: Wilkinson M., Imran S. Regulation of Growth Hormone Secretion. In Clinical Neuroendocrinology: An Introduction (pp. 134-153). Cambridge: Cambridge University Press; 2019. doi: 10.1017/9781108149938.009
ИФР-1 — это ростовой фактор, который синтезируется в основном в печени под действием СТГ. Концентрация ИФР-1 в крови определяется связывающими ИФР-1 белками. В отличие от СТГ уровень ИФР-1 не зависит от времени суток, приема пищи, физических упражнений или сна и вместе с этим отражает секрецию СТГ в течение нескольких предыдущих дней [8].
Уровень ИФР-1 в плазме увеличивается в 7 раз с момента рождения, достигая пика в период полового созревания [9]. Затем его концентрация быстро падает и к 20 годам составляет не более 50% максимального пубертатного уровня. Далее наблюдается постепенное снижение уровня ИФР-1 [10]. С одной стороны, это вызвано возрастными колебаниями уровня СТГ, с другой — может иметь генетическую обусловленность. Ученые обнаружили несколько полиморфизмов в гене ИФР-1 и ИФР-1-связывающих белков, объясняющих вариабельность концентраций ИФР-1 у здорового населения [11].
ОБЩИЕ ВОПРОСЫ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ И МОНИТОРИНГА АКРОМЕГАЛИИ
В связи с тем, что патологическая секреция СТГ и ИФР-1 лежит в основе развития акромегалии, именно эти показатели стали активно использовать для диагностики и оценки эффективности различных методов лечения этого заболевания. Поскольку секреция СТГ подвержена значительным колебаниям, случайное измерение СТГ имеет низкую диагностическую ценность и не рекомендуется для рутинного выявления акромегалии [8].
Золотым стандартом для скрининга и диагностики заболевания является измерение ИФР-1 в сыворотке крови [3][12].
В сомнительных случаях (при незначительном повышении уровня ИФР-1, отсутствии явной клинической картины акромегалии), в качестве второго метода диагностики используется определение СТГ в ходе ОГТТ. У здоровых людей повышение уровня глюкозы крови подавляет секрецию СТГ. Этот механизм изучен не полностью, предполагается опосредованное глюкозой увеличение секреции гипоталамического соматостатина [3]. Так, введение ингибитора ацетилхолинэстеразы (пиридостигмина), блокирующего выделение соматостатина в гипоталамусе, препятствует подавлению СТГ в ходе ОГТТ [13]. При бесконтрольной секреции гормона роста аденомой гипофиза чувствительность к физиологической регуляции утрачивается и, следовательно, подавления секреции СТГ не наблюдается [3].
Показано, что гипергликемия, обусловленная приемом 75 г безводной глюкозы, вызывает снижение уровня СТГ вплоть до минимально определяемых цифр у 94% здоровых лиц, но не у больных акромегалией [14]. В то же время до 41% лиц с акромегалией демонстрируют парадоксальный подъем уровня СТГ в ответ на гипергликемию. Данный феномен, по-видимому, объясняется повышенной экспрессией в СТГ-секретирующих аденомах гипофиза рецептора к глюкозозависимому инсулинотропному полипептиду [15].
Активную стадию акромегалии диагностируют, если хотя бы в одной точке, кроме базальной, отсутствует снижение уровня СТГ в ходе ОГТТ ниже 1 нг/мл, а при использовании высокочувствительных тестов — менее 0,4 нг/мл [16]. При наличии нарушений углеводного обмена возможно исследование ритма СТГ (5 точек в течение 2 ч с интервалом 30 мин) без приема глюкозы [12].
Безусловно, для окончательного подтверждения диагноза акромегалии, кроме данных лабораторного обследования, требуются наличие клинических проявлений и визуализация опухоли. К наиболее характерным симптомам акромегалии относятся изменения внешности (огрубение черт лица, увеличение кистей, стоп), отеки, головная боль, потливость, боли в суставах, онемение в кончиках пальцев, нарушения менструального цикла [3]. При топической диагностике методом выбора является магнитно-резонансная томография головного мозга. В случае противопоказаний возможно проведение компьютерной томографии. Отсутствие аденомы гипофиза при магнитно-резонансной томографии, выполненной с контрастированием на аппарате с высоким разрешением, требует дополнительных исследований для исключения эктопической формы акромегалии [12].
Оценка уровней СТГ и ИФР-1 применяется не только в диагностике, но и в мониторинге акромегалии. Поскольку высокие уровни СТГ и ИФР-1 ассоциированы с увеличением смертности пациентов с акромегалией, достижение нормализации СТГ (базального и в ходе ОГТТ) и ИФР-1 является основной целью различных методов лечения [17].
Снижение СТГ в ходе ОГТТ менее 1 нг/мл, а при использовании высокочувствительного метода определения — менее 0,4 нг/мл является критерием успешного нейрохирургического лечения в раннем послеоперационном периоде. При отсроченном наблюдении стойкая ремиссия акромегалии может быть установлена при нормализации уровня ИФР-1. На фоне медикаментозной терапии аналогами соматостатина рекомендуется исследование СТГ и ИФР-1, в то время как оценка СТГ в ходе ОГТТ мало информативна [17]. Пэгвисомант — антагонист рецептора к СТГ — в связи с особенностями своей структуры не способен снижать уровень СТГ, поэтому у пациентов, получающих лечение пэгвисомантом, концентрация ИФР-1 остается единственным критерием эффективности [18]. На фоне лучевой терапии, эффект которой может быть отсрочен во времени, для оценки наступления ремиссии рекомендовано периодическое исследование СТГ, СТГ в ходе ОГТТ и ИФР-1 [12]. Как и в случае с диагностикой, лабораторные показатели при мониторинге акромегалии должны оцениваться совместно с динамикой клинических проявлений и размеров опухоли. В настоящее время активно идет поиск предиктивных биомаркеров, при исследовании которых можно будет оценить вероятность развития ремиссии заболевания и предсказать чувствительность к разным видам лечения [19].
ДИСКОРДАНТНЫЕ ПОКАЗАТЕЛИ ИФР-1 И СТГ
Итак, ИФР-1, СТГ и СТГ в ходе ОГТТ в настоящее время являются основными биомаркерами, которые используют для оценки активности заболевания у пациентов с акромегалией [16]. В большинстве случаев уровни СТГ и ИФР-1 совпадают, что указывает на ремиссию или активную стадию заболевания. Однако нередко уровни СТГ и СТГ в ходе ОГТТ расходятся с показателем ИФР-1, что значительно затрудняет интерпретацию результатов [20]. Дискордантные значения были продемонстрированы у 25% пациентов с акромегалией после проведенного нейрохирургического лечения [21]. В 35% случаев терапии аналогами соматостатина результаты СТГ не совпадали с данными ИФР-1 [22]. По данным E.O. Machado с коллегами, дискордантность СТГ и ИФР-1 может варьировать от 9,4 до 39% как на момент диагностики, так и при наблюдении пациентов с акромегалией [5].
Можно выделить два вида несоответствия лабораторных показателей: повышение уровня ИФР-1 при нормальных цифрах СТГ и повышение концентрации СТГ/отсутствие подавления СТГ в ходе ОГТТ при достижении референсных показателей ИФР-1.
Первый вариант дискордантности встречается в 5–62% случаев в зависимости от пороговых значений, установленных для СТГ [23]. Известно, что периферические ткани обладают повышенной чувствительностью к циркулирующему СТГ, поэтому даже «нормальная» или незначительно повышенная концентрация СТГ приводит к увеличению ИФР-1 [24].
Неоднократно показано, что многие пациенты (26–47% случаев) с клинической картиной акромегалии имеют «нормальный» уровень СТГ. A. Barkan предложил название «микромегалия» для данной формы заболевания. Пациентов с «микромегалией» отличают меньший размер опухоли гипофиза по сравнению с пациентами с повышенным уровнем СТГ, более низкий уровень ИФР-1 и пожилой возраст, что позволяет считать эту форму заболевания мягкой, но не начальной. У некоторых из таких пациентов может наблюдаться подавление СТГ в ходе ОГТТ ниже целевых значений [25]. Если диагностировать «микромегалию» не представляет трудностей в связи с яркой клинической картиной акромегалии и значительно повышенным уровнем ИФР-1 (более чем на 30% верхней границы нормы), то пациенты без явных симптомов заболевания с незначительным повышением уровня ИФР-1 и адекватным подавлением СТГ в ходе ОГТТ вызывают большие затруднения у специалистов, которые опасаются пропустить акромегалию в начальной стадии. Следует помнить, что у 5% населения может наблюдаться незначительно повышенный уровень ИФР-1. P.W. Rosario и M.R. Calsolari в течение 5 лет наблюдали пациентов с немного увеличенным уровнем ИФР-1 и достаточным подавлением СТГ в ходе ОГТТ, ни у одного из 42 пациентов не развилась акромегалия. Это позволило авторам утверждать, что снижение СТГ в ходе ОГТТ надежно исключает акромегалию [26].
Отсутствие подавления СТГ в ходе ОГТТ в сочетании с нормальным показателем ИФР-1 встречается у 9–39% пациентов. Хотя механизм такой дискордантности полностью не изучен, вероятно, уровень СТГ остается повышенным вследствие нарушенной регуляции секреции СТГ, которая не восстанавливается, несмотря на успешное лечение акромегалии [23].
Затруднения, которые возникают при интерпретации противоречивых данных лабораторных исследований, приводят к тому, что многие специалисты выбирают исследование ИФР-1 как единственный маркер активности акромегалии. Может, не следует вовсе оценивать уровень СТГ при акромегалии? E.H. Oldfield с коллегами показали, что при акромегалии у пациентов с одинаковым уровнем СТГ могут быть совершенно разные показатели ИФР-1 как до, так и после лечения, и нет линейной зависимости между этими показателями. И хотя ИФР-1 является интегрированным показателем повышенной секреции и действия СТГ, аденома гипофиза секретирует именно СТГ, а не ИФР-1. Авторы считают, что для того, чтобы оценить активность опухоли, необходимо обязательно исследовать уровень СТГ у пациентов с акромегалией [27].
ЛАБОРАТОРНЫЕ ПРИЧИНЫ ДИСКОРДАНТНОСТИ СТГ И ИФР-1
При отсутствии очевидного объяснения противоречивых результатов СТГ и ИФР-1 необходимо помнить о наличии двух основных причин такой дискордантности: влияния лабораторных и биологических факторов.
Известно, что в сыворотке крови СТГ циркулирует в виде множества различных изоформ, фрагментов и молекулярных комплексов (гомо- и гетеродимеров и олигомеров). Изоформа весом 22 kDa составляет более 90% всех изоформ и лучше всего отражает общую секрецию СТГ гипофизом. Однако в реальной клинической практике многие лаборатории используют тестовые системы, распознающие более широкий спектр изоформ или вовсе не имеющие изоформной специфичности, что, в свою очередь, часто приводит к неверной интерпретации лабораторных показателей [28].
За последние десятилетия лабораторное тестирование СТГ прошло путь от относительно неспецифического радиоиммунного анализа до современного хемилюминесцентного высокочувствительного метода определения [8]. Эволюция аналитических методов привела к ужесточению целевых значений СТГ, что, естественно, отразилось на частоте дискордантных результатов. Так, процент несоответствия лабораторных показателей у пациентов, которым диагноз акромегалии был поставлен за последние 10 лет, оказался значительно выше, чем в случаях установления диагноза ранее 2011 г. В первую очередь это обусловлено недоступностью высокочувствительных тестов для определения концентрации гормонов и менее строгими критериями диагностики [25]. Так, до 1990-х гг. ремиссии акромегалии после проведенного лечения соответствовал базальный СТГ ниже 5 нг/мл [29]. С появлением новых методов анализа были предложены более низкие пороговые значения. В середине-конце 1990-х гг. базальный СТГ ниже 2,5 нг/мл и СТГ в ходе ОГТТ менее 2 нг/мл стали критериями успешного лечения [30]. В начале 2000-х гг. случайный уровень СТГ ниже 0,4 нг/мл или СТГ в ходе ОГТТ менее 1 нг/мл вместе с нормальным показателем ИФР-1 в соответствии с полом и возрастом были определены как критерии исключения акромегалии [31]. Десять лет спустя данные показатели были пересмотрены, и целевыми показателями после проведенного лечения стали считать случайный базальный уровень СТГ ниже 1 нг/мл и подавление СТГ в ходе ОГТТ менее 0,4 нг/мл при использовании высокочувствительных тестов в сочетании с нормальным ИФР-1. До настоящего времени, в том числе согласно международному консенсусу по диагностике и лечению акромегалии 2019 г., данные критерии не изменились [16].
Проблемы тест-систем в той же степени касаются и оценки уровня ИФР-1. Согласно данным A. Pokrajac et al. (2007), концентрация ИФР-1 у одного и того же больного колебалась в разных лабораториях в широком диапазоне, от 24,3 до 60,9 нмоль/л [32]. В крупном французском исследовании, проведенном среди 911 здоровых добровольцев, уровень ИФР-1, измеренный в 6 различных лабораториях, не совпадал в 38–70% случаев [33].
Тест-системы для определения уровня ИФР-1 также со временем были усовершенствованы. Переход от использования поликлональных антител к иммуноанализу на основе моноклональной сыворотки повысил не только чувствительность, но и специфичность тестов при исследовании ИФР-1. Из-за наличия белков, связывающих ИФР-1, применение высокочувствительных тестов играет ключевую роль в определении истинной концентрации данного показателя [34].
Современные подходы к определению ИФР-1 включают электрохемилюминесцентный или хемилюминесцентный иммуноанализ, при которых используют антитела для связывания антигенов, а также жидкостную хромато-масс-спектрометрию, определяющую концентрацию гормона на основе молекулярной массы за счет ионизации компонентов [35].
При сравнении данных методов в 24% было выявлено несоответствие лабораторных показателей. При масс-спектрометрии измеряется 1, наиболее распространенный ион ИФР-1, исключая варианты с другой молекулярной массой. В свою очередь, при иммуноанализе все типы ИФР-1 одинаково связываются антителами. Поэтому использование иммуноанализа приводило к получению более высоких уровней ИФР-1, а при масс-спектрометрии отмечались ложнозаниженные результаты [34].
Кроме того, в разных лабораториях варьируют референсные интервалы, определение которых напрямую зависит от пола, индекса массы тела, региона проживания, приема фармакологических препаратов и наличия сопутствующей патологии у исследуемой популяции. Усредненный диапазон показателей ИФР-1, характеризующий «норму», должен устанавливаться на основе анализа результатов большой когорты пациентов, отобранных по определенным критериям [8].
Таким образом, рекомендуется использовать одну и ту же надежную лабораторию для оценки ИФР-1 на протяжении всего периода наблюдения за пациентом с акромегалией [35].
БИОЛОГИЧЕСКИЕ ПРИЧИНЫ ДИСКОРДАНТНОСТИ СТГ И ИФР-1
При интерпретации лабораторных показателей необходимо учитывать, что многие физиологические и патологические состояния, гормоны и лекарственные препараты влияют на уровни СТГ и ИФР-1 в сыворотке крови (табл. 1).
Таблица 1. Влияние биологических факторов на концентрации СТГ и ИФР-1
Биологический фактор | СТГ | ИФР-1 |
Ожирение | ↓ | ↓ |
Голодание | ↑ | ↓ |
Нервная анорексия | ↑ | ↓ |
Стресс | ↑ | ↑↓ |
Пубертат | ↑ | ↑ |
Беременность | ↑ | ↓ |
Сон | ↑ | ↑↓ |
Спорт | ↑ | ↑↓ |
Сахарный диабет 1 типа | ↑ | ↓ |
Почечная недостаточность | ↑ | ↓ |
Печеночная недостаточность | ↑ | ↓ |
Гипотиреоз | ↓ | ↓ |
Гипертиреоз | ↑ | ↑ |
Тестостерон | ↑ | ↑ |
Оральные эстрогены | ↑ | ↓ |
Системное воспаление | ↑ | ↓ |
Беременность | ↑ | ↑↓ |
В частности, такие состояния, как пубертат, нервная анорексия, прием эстрогенов, гипертиреоз, сахарный диабет, ожирение, почечная недостаточность и хронический гепатит ассоциированы с отсутствием подавления СТГ в ходе ОГТТ [36].
Так, во время пубертата значительно повышаются уровни СТГ и ИФР-1, что затрудняет диагностику акромегалии у подростков. Такие состояния, как боль, занятия спортом, стресс, нервная анорексия, стимулируют выброс СТГ [8].
Значительное влияние на систему СТГ/ИФР-1 оказывают половые стероиды. Было показано, что тестостерон усиливает спонтанную секрецию СТГ. Напротив, эстрогены ослабляют действие СТГ, тем самым снижая продукцию ИФР-1. Рекомендовано с осторожностью интерпретировать результаты исследования СТГ и ИФР-1 у женщин, получающих оральные эстрогены в качестве заместительной гормональной терапии [7].
Беременность приводит к увеличению секреции СТГ и ИФР-1 из-за выработки большего количества биологически активного плацентарного гормона роста [28], однако концентрация ИФР-1 может снижаться при акромегалии во время беременности за счет высокого содержания эстрогенов.
Недостаток тиреоидных гормонов снижает концентрации СТГ и ИФР-1 в сыворотке крови [37]. При гипертиреозе, наоборот, усиливается выброс СТГ [38]. Избыток тиреоидных гормонов также повышает содержание ИФР-1, однако его биологическая активность снижается в связи с увеличением концентрации ИФР-1-связывающих белков [37].
У пациентов с сахарным диабетом 1 типа наблюдается повышение секреции гормона роста. При этом дефицит инсулина в воротной вене препятствует влиянию СТГ на печень и ведет к снижению продукции ИФР-1 [39]. Данные о влиянии сахарного диабета 2 типа на секрецию СТГ и ИФР-1 противоречивы. Спонтанная секреция СТГ может быть повышена, не изменяться или снижаться. Эти различия в большинстве случаев обусловлены наличием или отсутствием сопутствующего ожирения. Исследования с участием пациентов, имеющих индекс массы тела более 30 кг/м2, продемонстрировали снижение как спонтанной, так и стимулированной секреции СТГ у данной группы пациентов [40].
При снижении почечной функции может повышаться уровень СТГ вследствие снижения почечной деградации СТГ и устойчивости рецепторов к его воздействию. В дополнение к этому снижается клиренс ИФР-1-связывающих белков, что приводит к снижению биологической активности ИФР-1 [41].
При печеночной недостаточности наблюдается снижение синтеза ИФР-1 в печени, что влечет за собой увеличение секреции СТГ за счет механизма отрицательной обратной связи [42].
Ложное снижение уровня ИФР-1 (вплоть до нормальных значений, соответствующих полу и возрасту) возникает при голодании и злоупотреблении алкоголем [16].
ДИСКОРДАНТНОСТЬ СТГ И ИФР-1 ПОСЛЕ НЕЙРОХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ АКРОМЕГАЛИИ
Большинству пациентов с акромегалией трансназальная транссфеноидальная аденомэктомия рекомендована в качестве первого метода лечения [3]. Уровень ИФР-1 для надежного определения ремиссии заболевания должен оцениваться как минимум через 3 мес после операции, так как для нормализации данного показателя необходимо время [43]. СТГ в ходе ОГТТ в послеоперационном периоде менее 1 нг/мл, а при использовании высокочувствительного метода исследования — менее 0,4 нг/мл является критерием послеоперационной ремиссии [16].
Однако если пациенты до операции получали аналоги соматостатина, эти данные следует интерпретировать с осторожностью [44].
Тщательный мониторинг требуется пациентам, имеющим дискордантные показатели СТГ и ИФР-1 через 3 мес после операции. Чаще всего наблюдается подавление СТГ при сохранении повышения уровня ИФР-1, но и обратное расхождение тоже встречается. Последний консенсус по лечению акромегалии рекомендует ориентироваться в большей степени на уровень ИФР-1 у таких пациентов [16]. Предполагается, что полиморфизм рецептора гормона роста (d3-GHR) влияет на дискордантность СТГ и ИФР-1 во время лечения акромегалии. Так, в исследовании A. Bianchi и соавт. 20% пациентов имели несоответствие лабораторных показателей в послеоперационном периоде, и у 71% из них был обнаружен d3-GHR [45].
В исследование, опубликованное в 2004 г., были включены 110 пациентов с акромегалией после проведенной транссфеноидальной аденомэктомии. Из них 76 человек имели полную ремиссию заболевания. Однако у 34% из них наблюдались дискордантные показатели (ИФР-1 в пределах референса при отсутствии адекватного подавления СТГ в ходе ОГТТ). Авторы продемонстрировали, что при длительном наблюдении за этой группой пациентов нецелевой уровень СТГ был связан с более высокой частотой рецидива акромегалии [46].
В ретроспективное исследование T. Graillona и соавт., опубликованное в 2020 г., были включены 167 пациентов, оперированных по поводу впервые выявленной акромегалии в период с 1997 по 2014 гг. Данная группа не получала терапию аналогами соматостатина за месяц до нейрохирургического лечения. Оценка показателей ИФР-1, СТГ в ходе ОГТТ проводилась в раннем послеоперационном периоде (7 дней после операции), через 3 мес, через год и затем ежегодно.
Пациенты были разделены на 4 группы в зависимости от соответствия уровней ИФР-1 и СТГ/СТГ в ходе ОГТТ и необходимости в дополнительном лечении. Очевидно, что наиболее стойкая ремиссия была отмечена у пациентов с нормальным уровнем ИФР-1 и адекватным подавлением СТГ в ходе ОГТТ (менее 0,4 нг/мл) или средним уровнем СТГ менее 1 нг/мл. А самой трудной для наблюдения стала группа пациентов с дискордантными показателями СТГ и ИФР-1, которая наблюдалась без дополнительного лечения акромегалии. Тем не менее 50% пациентов с несовпадающими данными СТГ и ИФР-1 достигли стойкой послеоперационной ремиссии заболевания в течение года без дополнительной терапии, у 10% была однозначно установлена активная стадия, у оставшихся пациентов дискордантность сохранялась более 1 года после нейрохирургического лечения. Вопрос о тактике ведения таких пациентов остается на данный момент нерешенным [47].
ДИСКОРДАНТНОСТЬ СТГ И ИФР-1 НА ФОНЕ МЕДИКАМЕНТОЗНОЙ ТЕРАПИИ АКРОМЕГАЛИИ
Медикаментозное лечение в качестве 2-й линии терапии рекомендовано всем пациентам, не достигшим ремиссии акромегалии после оперативного вмешательства. Как основной метод лечения консервативная терапия может быть предложена пациентам, имеющим противопоказания к транссфеноидальной аденомэктомии, или в случае отказа от хирургического лечения [3].
В исследовании J. Dal, опубликованном в 2017 г., показано, что повышенный уровень базального СТГ и отсутствие его подавления в ходе ОГТТ преобладают у пациентов, получающих терапию аналогами соматостатина, по сравнению с послеоперационными пациентами [48]. К сходным выводам пришли и J.D. Carmichael с коллегами в своей работе, включившей 166 пациентов с акромегалией. Противоречивые результаты ИФР-1 и СТГ в ходе ОГТТ наблюдались у 33% больных после проведенного нейрохирургического лечения, не получающих медикаментозную терапию, у 48% пациентов, находящихся на терапии аналогами соматостатина, и у 18% на фоне лечения агонистами дофаминовых рецепторов. На фоне терапии аналогами соматостатина преобладали несоответствие нормального уровня ИФР-1 и отсутствие подавления СТГ в ходе ОГТТ (42%) по сравнению с повышенным ИФР-1 и адекватным снижением СТГ (6%) [44].
В то время как другие авторы на основе данных бельгийского регистра пациентов с акромегалией, наоборот, чаще демонстрировали высокие цифры ИФР-1 при нормальных показателях СТГ (24%) по сравнению с обратной дискордантностью (11%) [22]. Различные пороговые значения СТГ для установления активности заболевания и неоднородные выборки пациентов могут объяснить широкий разброс частоты и преобладание одного или другого типа дискордантности в разных работах. Тем не менее целесообразность применения СТГ в ходе ОГТТ на фоне терапии аналогами соматостатина подвергается сомнению в последнее время [44].
Дискордантные результаты обычно приводят к увеличению дозы аналогов соматостатина и, соответственно, к улучшению биохимического контроля акромегалии [48]. Однако нельзя исключить, что при нормализации уровня ИФР-1 на фоне терапии аналогами соматостатина сохраняется избыточная секреция СТГ, что требует другого терапевтического подхода [49].
Вторая линия медикаментозной терапии акромегалии — это применение антагониста рецептора СТГ (пэгвисоманта). Препарат показан в первую очередь пациентам, у которых хирургическое лечение оказалось неэффективным и продемонстрирована резистентность к терапии аналогами соматостатина [3]. Пэгвисомант, блокируя действие эндогенного СТГ на рецепторном уровне, снижает продукцию ИФР-1, тем самым уменьшая выраженность клинических проявлений и развитие осложнений, связанных с акромегалией. Так как препарат напрямую не влияет на повышенную секрецию гормона роста, измерение уровня СТГ, базального и в ходе ОГТТ, и исследование причин выявления дискордантных результатов в данном случае нецелесообразно [50]. Кроме того, у пациентов, получающих пэгвисомант, невозможно измерить истинную концентрацию СТГ. В зависимости от тест-системы наличие пэгвисоманта в сыворотке крови может приводить к ложноположительным или ложноотрицательным показаниям СТГ [8].
ЗАКЛЮЧЕНИЕ
В клинической практике интерпретация противоречивых лабораторных данных СТГ и ИФР-1 часто осложняет специалистам выбор дальнейшей тактики ведения пациентов с акромегалией. К сожалению, на данный момент нет единого объяснения дискордантности СТГ и ИФР-1 и единого подхода к принятию врачебного решения. Понимание того, что пороговые значения и референсные интервалы гормональных показателей напрямую зависят от аналитических методов, используемых различными лабораториями, должно способствовать созданию единых критериев для оценки уровня исследуемых показателей. Кроме того, специалисту необходимо учитывать широкий спектр физиологических и патологических факторов, лекарственных препаратов, влияющих на уровни СТГ и ИФР-1.
Таким образом, при ведении пациентов с акромегалией особенно важно применение комплексного подхода: важно не только верно интерпретировать лабораторные показатели, но и принимать во внимание такие параметры, как возраст пациента, размер опухоли, степень ее инвазии, наличие осложнений и сопутствующей патологии. В связи с этим актуальным остается вопрос поиска новых биомаркеров, отражающих биохимическую активность заболевания и способных предсказать чувствительность к различным видам лечения.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Поисково-аналитическая работа и подготовка статьи проведены за счет гранта Российского научного фонда (проект №19-15-00398).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Все авторы внесли значимый вклад в написание статьи, прочли и одобрили финальный вариант рукописи до публикации.
Список литературы
1. Lavrentaki A, Paluzzi A, Wass JA, et. al. Epidemiology of acromegaly: review of population studies. Pituitary. 2017;20(1):4-9. https://doi.org/10.1007/s11102-016-0754-x
2. Белая Ж.Е., Голоунина О.О., Рожинская Л.Я., и др. Эпидемиология, клинические проявления и эффективность различных методов лечения акромегалии по данным единого Российского регистра опухолей гипоталамо-гипофизарной системы // Проблемы эндокринологии. — 2020. — Т. 66. — №1. — С. 93-103. https://doi.org/10.14341/probl1033
3. Colao A, Grasso LFS, Giustina A, et al. Acromegaly. Nat Rev Dis Prim. 2019;5(1):1-17. https://doi.org/10.1038/s41572-019-0071-6
4. Fleseriu M, Beverly Biller M, Freda PU, et al. A Pituitary Society update to acromegaly management guidelines. Pituitary. 2021;24:1-13. https://doi.org/10.1007/s11102-020-01091-7
5. Machado EO, Taboada GF, Neto LV, et al. Prevalence of discordant GH and IGF-I levels in acromegalics at diagnosis, after surgical treatment and during treatment with octreotide LAR. Growth Horm IGF Res. 2008;18(5):389-393. https://doi.org/10.1016/j.ghir.2008.02.001
6. Sherlock M, Toogood AA. Aging and the growth hormone/ insulin like growth factor-I axis. Pituitary. 2007;10(2):189-203. https://doi.org/10.1007/s11102-007-0039-5
7. Murray PG, Higham CE, Clayton PE. The hypothalamo-GH axis: The past 60 years. J Endocrinol. 2015;226(2):T123-T140. https://doi.org/10.1530/JOE-15-0120
8. Schilbach K, Bidlingmaier M. Laboratory investigations in the diagnosis and follow-up of GH-related disorders. Arch Endocrinol Metab. 2019;63(6):618-629. https://doi.org/10.20945/2359-3997000000192
9. Juul A. Serum levels of insulin-like growth factor I and its binding proteins in health and disease. Growth Horm IGF Res. 2003;13(4):113-170. https://doi.org/10.1016/S1096-6374(03)00038-8
10. Vestergaard PF, Hansen M, Frystyk J, et al. Serum levels of bioactive IGF1 and physiological markers of ageing in healthy adults. Eur J Endocrinol. 2014;170(2):229-236. https://doi.org/10.1530/EJE-13-0661
11. Rotwein P. Large-scale analysis of variation in the insulin-like growth factor family in humans reveals rare disease links and common polymorphisms. J Biol Chem. 2017;292(22):9252-9261. https://doi.org/10.1074/jbc.M117.783639
12. Дедов И.И., Молитвословова Н.Н., Рожинская Л.Я., и др. Федеральные клинические рекомендации по клинике, диагностике, дифференциальной диагностике и методам лечения акромегалии // Проблемы Эндокринологии. — 2013. — Т. 59. —№6. — С. 4-18. https://doi.org/10.14341/probl20135964-18
13. Penalva A, Burguera B, Cusahie X, et al. Activation of cholinergic neurotransmission by pyridostigmine reverses the inhibitory effect of hyperglycemia on growth hormone (GH) releasing hormoneinduced GH secretion in man: Does acute hyperglycemia act through hypothalamic release of somatostatin? Neuroendocrinology. 1989;49(5):551-554. https://doi.org/10.1159/000125166
14. Молитвословова Н.Н. Акромегалия: современные достижения в диагностике и лечении // Проблемы Эндокринологии. — 2011. — Т. 57. — №1. — С. 46-59. https://doi.org/10.14341/probl201157146-59
15. Occhi G, Losa M, Albiger N, et al. The glucose-dependent insulinotropic polypeptide receptor is overexpressed amongst GNAS1 mutation-negative somatotropinomas and drives growth hormone (GH)-promoter activity in GH3 cells. J Neuroendocrinol. 2011;23(7):641-649. https://doi.org/10.1111/j.1365-2826.2011.02155.x
16. Giustina A, Barkhoudarian G, Beckers A, et al. Multidisciplinary management of acromegaly: A consensus. Rev Endocr Metab Disord. 2020;21(4):667-678. https://doi.org/10.1007/s11154-020-09588-z
17. Melmed S, Bronstein MD, Chanson P, et al. A Consensus Statement on acromegaly therapeutic outcomes. Nat Rev Endocrinol. 2018;14(9):552-561. https://doi.org/10.1038/s41574-018-0058-5
18. Paisley AN, Hayden K, Ellis A, et al. Pegvisomant interference in GH assays results in underestimation og GH levels. Eur J Endocrinol. 2007;156(3):315-319. https://doi.org/10.1530/eje.1.02341
19. Пржиялковская Е.Г., Османова П.О., Мамедова Е.О., и др. Предиктивные биомаркеры в лечении акромегалии: обзор литературы // Вестник РАМН. — 2019. — Т. 74. —№6. — С. 430-440. https://doi.org/10.15690/vramn1181
20. Capatina C, Wass JAH. Acromegaly. J Endocrinol. 2015;226(2):T141-T160. https://doi.org/10.1530/JOE-15-0109
21. Brzana JA, Yedinak CG, Delashaw JB, et al. Discordant growth hormone and IGF-1 levels post pituitary surgery in patients with acromegaly naïve to medical therapy and radiation: What to follow, GH or IGF-1 values? Pituitary. 2012;15(4):562-570. https://doi.org/10.1007/s11102-011-0369-1
22. Alexopoulou O, Bex M, Abs R, et al. Divergence between growth hormone and insulin-like growth factor-I concentrations in the follow-up of acromegaly. J Clin Endocrinol Metab. 2008;93(4):1324-1330. https://doi.org/10.1210/jc.2007-2104
23. Freda PU. Monitoring of acromegaly: what should be performed when GH and IGF-1 levels are discrepant? Clin Endocrinol (Oxf). 2009;71(2):166. https://doi.org/10.1111/J.1365-2265.2009.03556.X
24. Kanakis GA, Chrisoulidou A, Bargiota A, et al. The ongoing challenge of discrepant growth hormone and insulin-like growth factor I results in the evaluation of treated acromegalic patients: a systematic review and meta-analysis. Clin Endocrinol (Oxf). 2016;85(5):681-688. https://doi.org/10.1111/cen.13129
25. Butz LB, Sullivan SE, Chandler WF, et al. “Micromegaly”: an update on the prevalence of acromegaly with apparently normal GH secretion in the modern era. Pituitary. 2016;19(6):547-551. https://doi.org/10.1007/s11102-016-0735-0
26. Rosario PW, Calsolari MR. Elevated IGF-1 with GH suppression after an oral glucose overload: Incipient acromegaly or falsepositive IGF-1? Arch Endocrinol Metab. 2016;60(6):510-514. https://doi.org/10.1590/2359-3997000000193
27. Oldfield EH, Jane JA, Thorner MO, et al. Correlation between GH and IGF-1 during treatment for Acromegaly. J Neurosurg. 2017;126(6):1959-1966. https://doi.org/10.3171/2016.8.JNS161123
28. Ribeiro de Oliveira Longo Schweizer J, Ribeiro-Oliveira Jr A, Bidlingmaier M. Growth hormone: isoforms, clinical aspects and assays interference. Clin Diabetes Endocrinol. 2018;4(1):18. https://doi.org/10.1186/s40842-018-0068-1
29. Lindholm J, Giwercman B, Giwercman A, et al. Investigation of the criteria for assessing the outcome of treatment in acromegaly. Clin Endocrinol (Oxf). 1987;27(5):553-562. https://doi.org/10.1111/j.1365-2265.1987.tb01185.x
30. Melmed S, Ho K, Klibanski A, et al. Clinical review 75: Recent advances in pathogenesis, diagnosis, and management of acromegaly. J Clin Endocrinol Metab. 1995;80(12):3395-3402. https://doi.org/ 10.1210/jcem.80.12.8530571
31. Giustina A, Barkan A, Casanueva FF, et al. Criteria for Cure of Acromegaly: A Consensus Statement. J Clin Endocrinol Metab. 2000;85(2):526-529. https://doi.org/10.1210/jcem.85.2.6363
32. Pokrajac A, Wark G, Ellis AR, et al. Variation in GH and IGF-I assays limits the applicability of international consensus criteria to local practice. Clin Endocrinol (Oxf). 2007;67(1):65-70. https://doi.org/10.1111/j.1365-2265.2007.02836.x
33. Chanson P, Arnoux A, Mavromati M, et al. Reference Values for IGF-I Serum Concentrations: Comparison of Six Immunoassays. J Clin Endocrinol Metab. 2016;101(9):3450-3458. https://doi.org/10.1210/jc.2016-1257
34. Bonert V, Carmichael J, Wu Z, et al. Discordance between mass spectrometry and immunometric IGF-1 assay in pituitary disease: a prospective study. Pituitary. 2018;21(1):65-75. https://doi.org/10.1007/s11102-017-0849-z
35. Akirov A, Masri-Iraqi H, Dotan I, et al. The Biochemical Diagnosis of Acromegaly. J Clin Med. 2021;10(5):1-8. https://doi.org/10.3390/JCM10051147
36. Hage M, Kamenický P, Chanson P. Growth Hormone Response to Oral Glucose Load: From Normal to Pathological Conditions. Neuroendocrinology. 2019;108(3):244-255. https://doi.org/10.1159/000497214
37. Miell JP, Taylor AM, Zini M, et al. Effects of hypothyroidism and hyperthyroidism on insulin-like growth factors (IGFs) and growth hormoneand IGF-binding proteins. J Clin Endocrinol Metab. 1993;76(4):950-955. https://doi.org/10.1210/jcem.76.4.7682563
38. Iranmanesh A, Lizarralde G, Gohnson M, et al. Nature of altered growth hormone secretion in hyperthyroidism. J Clin Endocrinol Metab. 1991;72(1):108-115. https://doi.org/10.1210/jcem-72-1-108
39. Leung KC, Doyle N, Ballesteros M, et al. Insulin Regulation of Human Hepatic Growth Hormone Receptors: Divergent Effects on Biosynthesis and Surface Translocation1. J Clin Endocrinol Metab. 2000;85(12):4712-4720. https://doi.org/10.1210/jcem.85.12.7017
40. Giustina A, Bresciani E, Tassi C, et al. Effect of pyridostigmine on the growth hormone response to growth hormone-releasing hormone in lean and obese type II diabetic patients. Metabolism. 1994;43(7):893-898. https://doi.org/10.1016/0026-0495(94)90273-9
41. Kamenický P, Mazziotti G, Lombès M, et al. Growth hormone, insulin-like growth factor-1, and the kidney: Pathophysiological and clinical implications. Endocr Rev. 2014;35(2):234-281. https://doi.org/10.1210/er.2013-1071
42. Adamek A, Kasprzak A. Insulin-Like Growth Factor (IGF) System in Liver Diseases. Int J Mol Sci. 2018;19(5):1308. https://doi.org/10.3390/ijms19051308
43. Buttan A, Mamelak AN. Endocrine Outcomes After Pituitary Surgery. Neurosurg Clin N Am. 2019;30(4):491-498. https://doi.org/10.1016/j.nec.2019.05.009
44. Carmichael JD, Bonert VS, Mirocha JM, et al. The Utility of Oral Glucose Tolerance Testing for Diagnosis and Assessment of Treatment Outcomes in 166 Patients with Acromegaly. J Clin Endocrinol Metab. 2009;94(2):523-527. https://doi.org/10.1210/jc.2008-1371
45. Bianchi A, Giustina A, Cimino V, et al. Influence of growth hormone receptor d3 and full-length isoforms on biochemical treatment outcomes in acromegaly. J Clin Endocrinol Metab. 2009;94(6):2015-2022. https://doi.org/10.1210/jc.2008-1337
46. Freda PU, Nuruzzaman AT, Reyes CM, et al. Significance of “Abnormal” Nadir Growth Hormone Levels after Oral Glucose in Postoperative Patients with Acromegaly in Remission with Normal Insulin-Like Growth Factor-I Levels. J Clin Endocrinol Metab. 2004;89(2):495-500. https://doi.org/10.1210/jc.2003-031316
47. Graillon T, Castinetti F, Boucekine M, et al. Fluctuation analysis of postoperative secretory status in patients operated for acromegaly. Ann Endocrinol (Paris). 2020;81(1):11-17. https://doi.org/10.1016/j.ando.2019.11.002
48. Dal J, Klose M, Heck A, et al. Targeting either GH or IGF-I during somatostatin analogue treatment in patients with acromegaly: A randomized multicentre study. Eur J Endocrinol. 2018;178(1):65-74. https://doi.org/10.1530/eje-17-0546
49. Kuker AP, Shen W, Jin Z, et al. Body Composition Changes with Long-term Pegvisomant Therapy of Acromegaly. J Endocr Soc. 2021;5(3):1-12. https://doi.org/10.1210/jendso/bvab004
50. Giustina A, Arnaldi G, Bogazzi F, et al. Pegvisomant in acromegaly: an update. J Endocrinol Invest. 2017;40(6):577-589. https://doi.org/10.1007/s40618-017-0614-1
Об авторах
Е. Е. СахноваРоссия
Сахнова Екатерина Евгеньевна, ординатор, отделение нейроэндокринологии и остеопатий
SPIN-код: 4777-7937
117292, Москва, ул. Дм. Ульянова, д. 11
Е. Г. Пржиялковская
Россия
Пржиялковская Елена Георгиевна, кандидат медицинских наук
SPIN-код: 9309-3256
Москва
Ж. Е. Белая
Россия
Белая Жанна Евгеньевна, доктор медицинских наук, профессор
SPIN-код: 4746-7173
Москва
Г. А. Мельниченко
Россия
Мельниченко Галина Афанасьевна, доктор медицинских наук, профессор, академик РАН
SPIN-код: 8615-0038
Москва
Дополнительные файлы
|
|
1. Рисунок. Схема физиологической регуляции синтеза и секреции соматотропного гормона и инсулиноподобного фактора роста 1. СТГ — соматотропный гормон, ИФР-1 — инсулиноподобный фактор роста 1, СТГ-РГ — соматолиберин. Стрелки указывают на стимулирующий (+) или угнетающий эффект (-) различных регуляторов. Адаптировано из: Wilkinson M., Imran S. Regulation of Growth Hormone Secretion. In Clinical Neuroendocrinology: An Introduction (pp. 134-153). Cambridge: Cambridge University Press; 2019. doi: 10.1017/9781108149938.009 | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(219KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Сахнова Е.Е., Пржиялковская Е.Г., Белая Ж.Е., Мельниченко Г.А. Дискордантные показатели инсулиноподобного фактора роста 1 (ИФР-1) и соматотропина (СТГ) в диагностике и мониторинге акромегалии. Проблемы Эндокринологии. 2022;68(1):40-48. https://doi.org/10.14341/probl12791
For citation:
Sakhnova E.E., Przhiyalkovskaya E.G., Belaya Zh.E., Melnichenko G.A. Discordant parameters of insulin-like growth factor 1 and growth hormone in the diagnosis and monitoring of acromegaly. Problems of Endocrinology. 2022;68(1):40-48. (In Russ.) https://doi.org/10.14341/probl12791

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).









































.jpg)


