Перейти к:
Дилатационная кардиомиопатия у пациента с болезнью Кушинга — клиника, диагностика и лечение: описание случая
https://doi.org/10.14341/probl13147
Аннотация
Кортизол-индуцированные дилатационные кардиомиопатии (КИ-ДКМП) являются редкой клинической манифестацией эндогенного гиперкортицизма (ЭГ). Оптимальное ведение пациентов с КИ-ДКМП представляет собой серьезную проблему в связи с редкостью патологии и отсутствием рекомендаций экспертных сообществ. В статье представлено описание случая успешного ведения пациента с АКТГ-секретирующей опухолью гипофиза и КИ-ДКМП. Пациент 44 лет был госпитализирован с клиническими симптомами выраженной хронической сердечной недостаточности и АКТГ-зависимого ЭГ. По результатам эхокардиографии и коронароангиографии был верифицирован диагноз неишемического поражения миокарда с морфофункциональным фенотипом ДКМП. По данным гормональных и визуализирующих тестов, а также селективного забора крови из нижних каменистых синусов была диагностирована АКТГ-секретирующая аденома гипофиза. Планировалось проведение трансназальной трансфеноидальной аденомэктомии. В связи с наличием симптомов хронической сердечной недостаточности (ХСН) и выраженной систоло-диастолической дисфункцией левого желудочка, существенно повышающей риск неблагоприятных периоперационных кардиальных событий, было принято решение отложить вмешательство. После четырех месяцев терапии высокими дозами бета-адреноблокаторов (бетаАБ), ингибитор ангиотензинпревращающего фермента (ИАПФ), блокаторов минералкортикоидных рецепторов, диуретиков, а также ингибиторов стероидогенеза удалось достичь стабилизации состояния пациента и регресса симптомов ХСН. Это позволило выполнить трансназальную трансфеноидальную аденомэктомию со значимым постоперационным снижением уровня АКТГ и кортизола без периоперационных осложнений. При контрольных исследованиях через 6, 12 и 24 месяца после операции отмечено сохранение эукортицизма, регресс симптомов ХСН и прогрессирующее снижение размеров/ объемов левого желудочка (ЛЖ) с увеличением фракции выброса (ФВ) ЛЖ и последующей ее стабилизацией на субнормальном уровне. Гиперсекреция кортизола может приводить к поражению миокарда с клинико-морфологическим фенотипом ДКМП, при этом симптомы ХСН могут быть доминирующей клинической манифестацией ЭГ. Для контроля симптомов ХСН и подготовки пациента с КИ-ДКМП к хирургическим вмешательствам целесообразно применение бетаАБ, ИАПФ, диуретиков, блокаторов МКР и, возможно, ингибиторов стероидогенеза. После нормализации уровня кортизола отмечается регресс симптомов ХСН и существенное уменьшение размеров/объемов камер сердца с увеличением ФВ ЛЖ, что позволяет сделать вывод об обратимости патологического ремоделирования сердца у пациентов с КИ-ДКМП.
Ключевые слова
Для цитирования:
Кузнецов А.Б., Григорьев A.Ю., Кузнецов В.А., Белая Ж.Е., Рожинская Л.Я. Дилатационная кардиомиопатия у пациента с болезнью Кушинга — клиника, диагностика и лечение: описание случая. Проблемы Эндокринологии. 2025;71(4):16-28. https://doi.org/10.14341/probl13147
For citation:
Kuznetsov A.B., Grigoryev A.Y., Kuznetsov V.A., Belaya Zh.E., Rozhinskaya L.Y. Dilated cardiomyopathy in a patient with Cushing's disease — clinical presentation, diagnosis and treatment: a case report. Problems of Endocrinology. 2025;71(4):16-28. (In Russ.) https://doi.org/10.14341/probl13147
Кортизол-индуцированная дилатационная кардиомиопатия (КИ-ДКМП) является достаточно редкой клинической манифестацией эндогенного гиперкортицизма (ЭГ) [1][2]. Диагностика и оптимальное ведение пациентов с КИ-ДКМП является серьезной мультидисциплинарной проблемой, что обусловлено редкостью данной патологии, отсутствием значимой доказательной базы и рекомендаций экспертных сообществ. Представлено описание клинического случая пациента с АКТГ-секретирующей опухолью гипофиза и КИ-ДКМП.
При описании случая авторы руководствовались рекомендациями CARE [3].
При измерениях и оценке ЭХОКГ-параметров авторы следовали текущим рекомендациям [4][5].
Пациент 44 лет был госпитализирован в ЭНЦ в июле 2017 г. с жалобами на одышку при незначительных физических нагрузках, выраженные периферические отеки, прогрессирующее увеличение массы тела, повышенную утомляемость.
В 2007 г., в возрасте 34 лет, отмечен дебют артериальной гипертензии (АГ). В последующие два года отмечалось появление и прогрессирование симптомов сердечной недостаточности (СН) в виде одышки и утомляемости при обычных физических нагрузках.
В 2012 г. диагностирована ДКМП, инициирована терапия бета-адреноблокаторами (бетаАБ), блокаторами рецепторов ангиотензина (БРА), дигидропиридиновыми блокаторами медленных кальциевых каналов (БМКК) и диуретиками (рис. 1).
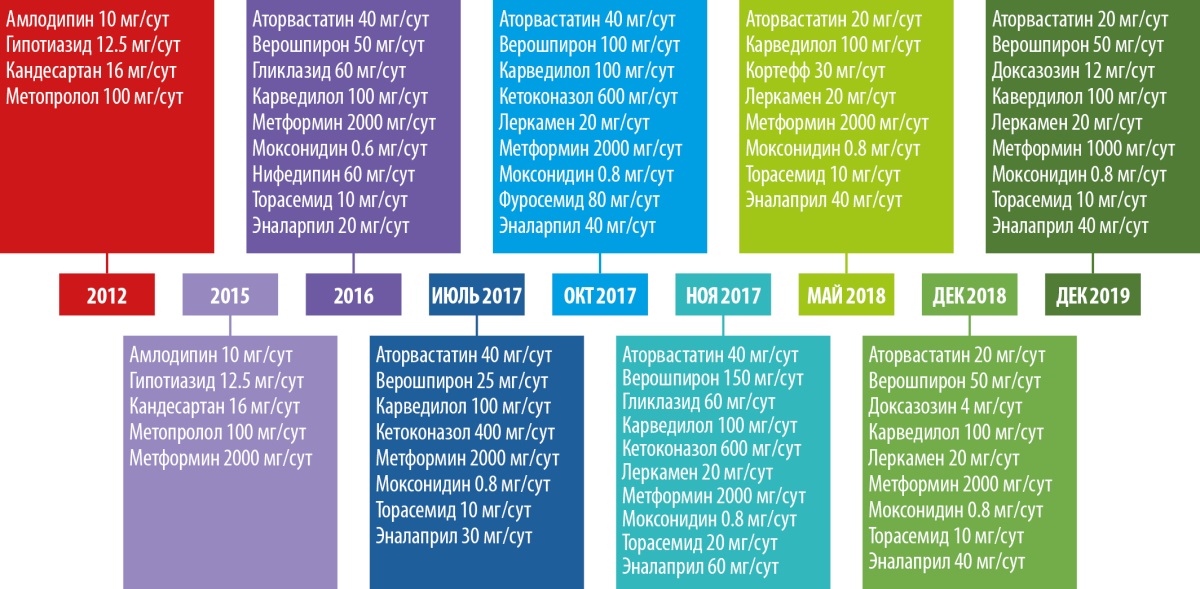
Рисунок 1. Модификация терапии по ходу лечения.
В 2015 г. в связи с прогрессированием симптомов СН и резистентностью к проводимой медикаментозной терапии была запланирована имплантация устройства для сердечной ресинхронизирующей терапии. При предоперационном обследовании было обращено внимание на прогрессирующее увеличение массы тела, выраженную мышечную слабость, плохое заживление кожных микротравм. Тогда же был диагностирован сахарный диабет (СД). Совокупность этих симптомов позволила заподозрить наличие ЭГ. К терапии был добавлен метформин (рис. 1).
В 2016 г. на основании проведенных гормональных тестов у пациента диагностирован АКТГ-зависимый гиперкортицизм, терапия была модифицирована (рис. 1).
При осмотре отмечено наличие ожирения III степени (рост 178 см, вес 142 кг, ИМТ 44,8 кг/м²) с относительно равномерным распределением подкожно-жировой клетчатки. На коже живота имелись неширокие (менее 1,5 см) розовые стрии. Умеренные отеки стоп и голеней. При аускультации легких хрипов не отмечалось, тоны сердца умеренно приглушены. АД — 160/90 мм рт.ст., пульс 80–100/мин, регулярный.
ВРЕМЕННАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ СОБЫТИЙ
Представлена на рисунке 2.
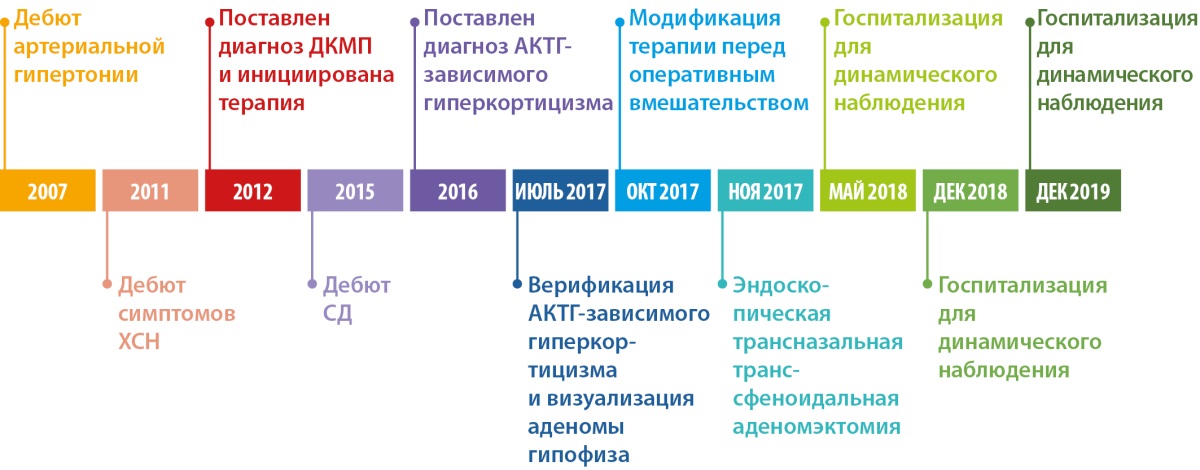
Рисунок 2. Временная последовательность событий.
ДИАГНОСТИКА
Основной задачей первой госпитализации в ЭНЦ было подтверждение диагноза «ЭГ» и определение его типа. Применяемые гормональные тесты, их значения и референсные интервалы представлены в таблице 1. Результаты тестов позволили подтвердить наличие АКТГ-зависимого гиперкортицизма.
Таблица 1. Показатели секреции кортизола и АКТГ
|
Тест/метод |
Значение |
Референсные значения |
|
Предоперационные показатели |
||
|
Кортизол (слюна, утро) (Cobas) |
27,0 нмоль/л |
6,8–25,9 |
|
Кортизол (слюна, вечер) (Cobas) |
27,4 нмоль/л |
0,5–9,4 |
|
Свободный кортизол мочи |
507 нмоль/сут |
60–413 |
|
АКТГ (плазма, утро) |
79,91 пг/мл |
7–66 |
|
АКТГ (плазма, вечер) |
96,29 пг/мл |
0–30 |
|
Постоперационные показатели |
||
|
1-е сутки после операции |
||
|
Кортизол (кровь, утро) (Cobas) |
122 нмоль/л |
123–626 |
|
АКТГ (утро) |
8,76 пг/мл |
7–66 |
|
6-е сутки после операции |
||
|
Кортизол (кровь, утро) (Cobas) |
21,66 нмоль/л |
123–626 |
|
АКТГ (утро) |
5,73 пг/мл |
7–66 |
|
5 месяцев после операции (1-е контрольное исследование) |
||
|
Кортизол (кровь, утро) (Cobas) |
343,5 нмоль/л |
123–626 |
|
АКТГ (утро) |
28,32 пг/мл |
7–66 |
|
12 месяцев после операции (после отмены Кортеффа; 2-ое контрольное исследование) |
||
|
Кортизол (кровь, утро) (Cobas) |
391,2 нмоль/л |
123–626 |
|
Кортизол (кровь, вечер) (Cobas) |
91,48 нмоль/л |
46–270 |
|
Свободный кортизол мочи |
117,6 нмоль/сут |
60–413 |
|
24 месяца после операции (3-е контрольное исследование) |
||
|
Кортизол (кровь, утро) (Cobas) |
403 нмоль/л |
171–536 |
|
Кортизол (кровь, вечер) (Cobas) |
73,27 нмоль/л |
64–327 |
|
Свободный кортизол мочи |
203 нмоль/сут |
100–379 |
|
АКТГ (утро) |
44,51 пг/мл |
7,2–63,3 |
|
АКТГ (вечер) |
15,59 пг/мл |
2–25,5 |
При госпитализации в июле 2017-го были предприняты попытки установить источник гиперсекреции АКТГ. МРТ головного мозга с контрастным усилением не позволила обнаружить визуализируемую аденому гипофиза. Однако селективный забор крови из нижних каменистых синусов выявил выраженный градиент АКТГ «центр-периферия», что позволило сделать вывод о гипофизарном источнике гиперсекреции и подтвердило диагноз болезни Иценко-Кушинга (БИК).
По данным МРТ выявлены дилатация левых камер сердца, гипертрофия ЛЖ, диффузный гипокинез ЛЖ со снижением ФВ ЛЖ до 30%, что соответствует клинико-морфологическому фенотипу ДКМП.
Пациент имел множественные факторы кардиоваскулярного риска (АГ, СД, атерогенная дислипидемия). С целью исключения ишемического генеза дисфункции ЛЖ была проведена коронароангиография (КАГ) (рис. 3). КАГ не выявила поражений коронарных артерий. Таким образом, было подтверждено предположение о неишемическом характере поражения миокарда.
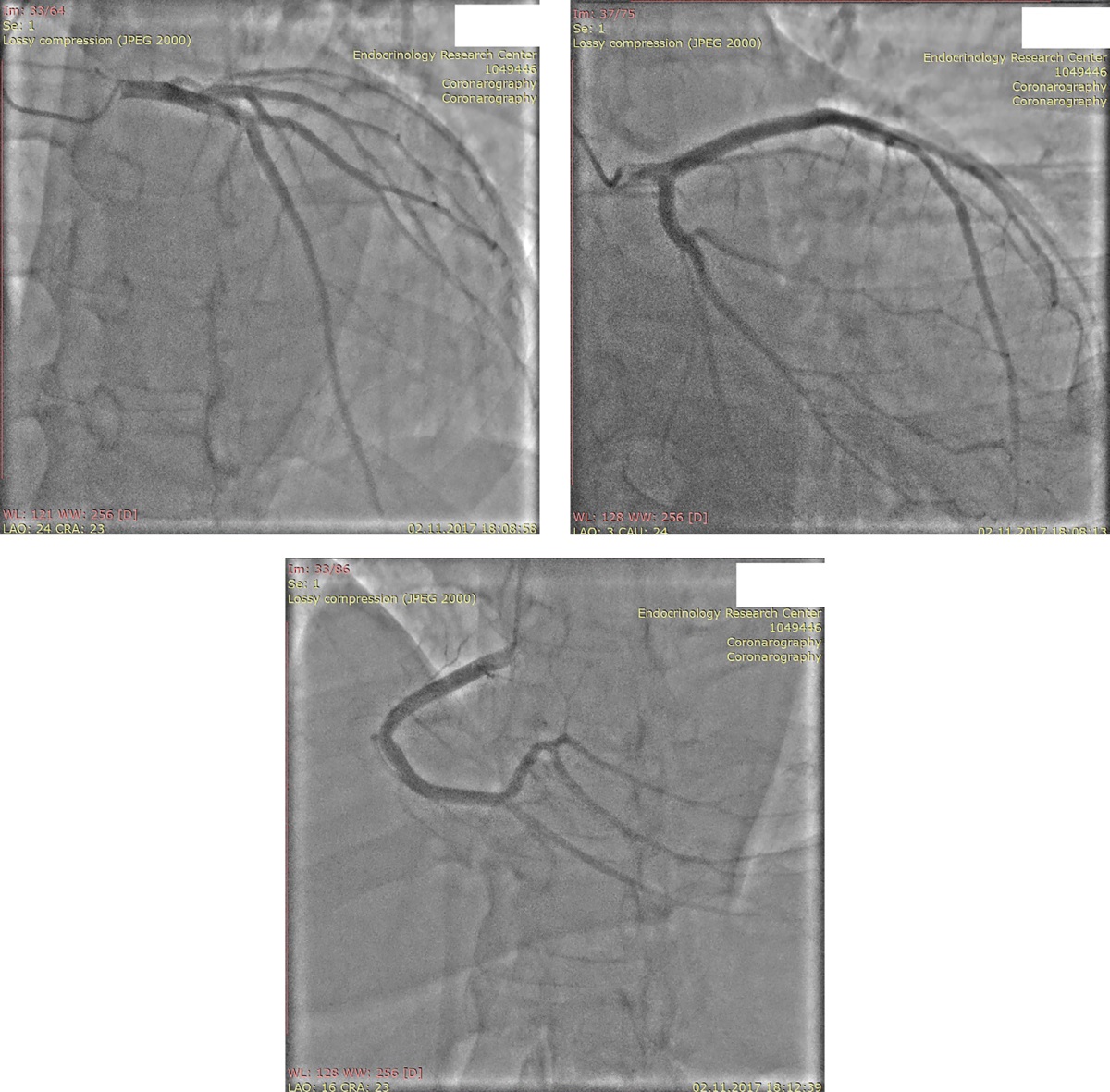
Рисунок 3. Коронароангиография.
Примечание: сверху слева — ствол левой коронарной артерии, сверху справа — передняя межжелудочковая артерия, снизу — правая коронарная артерия.
ЛЕЧЕНИЕ
По результатам обследования было принято решение о проведении эндоскопической трансназальной транссфеноидальной аденомэктомии.
Хроническая СН (ХСН) с толерантностью к нагрузкам на уровне III функционального класса по NYHA и признаками выраженной систолической дисфункции ЛЖ ассоциируется с высоким риском неблагоприятных периоперационных кардиальных и тромбоэмболических событий. Коллегиально было принято решение отложить оперативное вмешательство и стабилизировать состояние пациента. Проводимая терапия была модифицирована — увеличены дозы бетаАБ и ингибиторов ангиотензин-превращающего фермента (ИАПФ), добавлены моксонидин и кетоконазол (рис. 1).
При госпитализации в октябре 2017 г. для проведения оперативного вмешательства было отмечено прогрессирование симптомов ХСН: выраженное снижение толерантности к нагрузкам с развитием одышки при минимальной физической активности, ночное ортопноэ, выраженные периферические отеки, физикальные симптомы легочного застоя (влажные хрипы в нижних отделах легких), гепатомегалия. Пациент сообщил, что получал предписанную терапию в полном объеме. На ЭХОКГ были отмечены выраженная дилатация левых камер сердца, признаки гипертрофии ЛЖ, диффузный гипокинез ЛЖ с выраженным снижением ФВ ЛЖ (19%), рестриктивная диастолическая дисфункция ЛЖ (рис. 4; табл. 2). Таким образом, несмотря на проводимую терапию, отмечено прогрессирование симптомов ХСН с дальнейшим снижением ФВ ЛЖ и развитием выраженной диастолической дисфункции. Потребовалась модификация терапии: назначение внутривенных диуретиков (фуросемид 80 мг) в течение 5 дней. После внутривенной диуретической терапии исчезли эпизоды ночного ортопноэ и физикальная симптоматика легочного застоя, существенно уменьшились периферические отеки. Постоянная пероральная терапия была модифицирована: добавлены БМКК, а также увеличены дозы пероральных диуретиков, ИАПФ, бетаАБ и кетоконазола (рис. 1). Операция была отложена на один месяц.
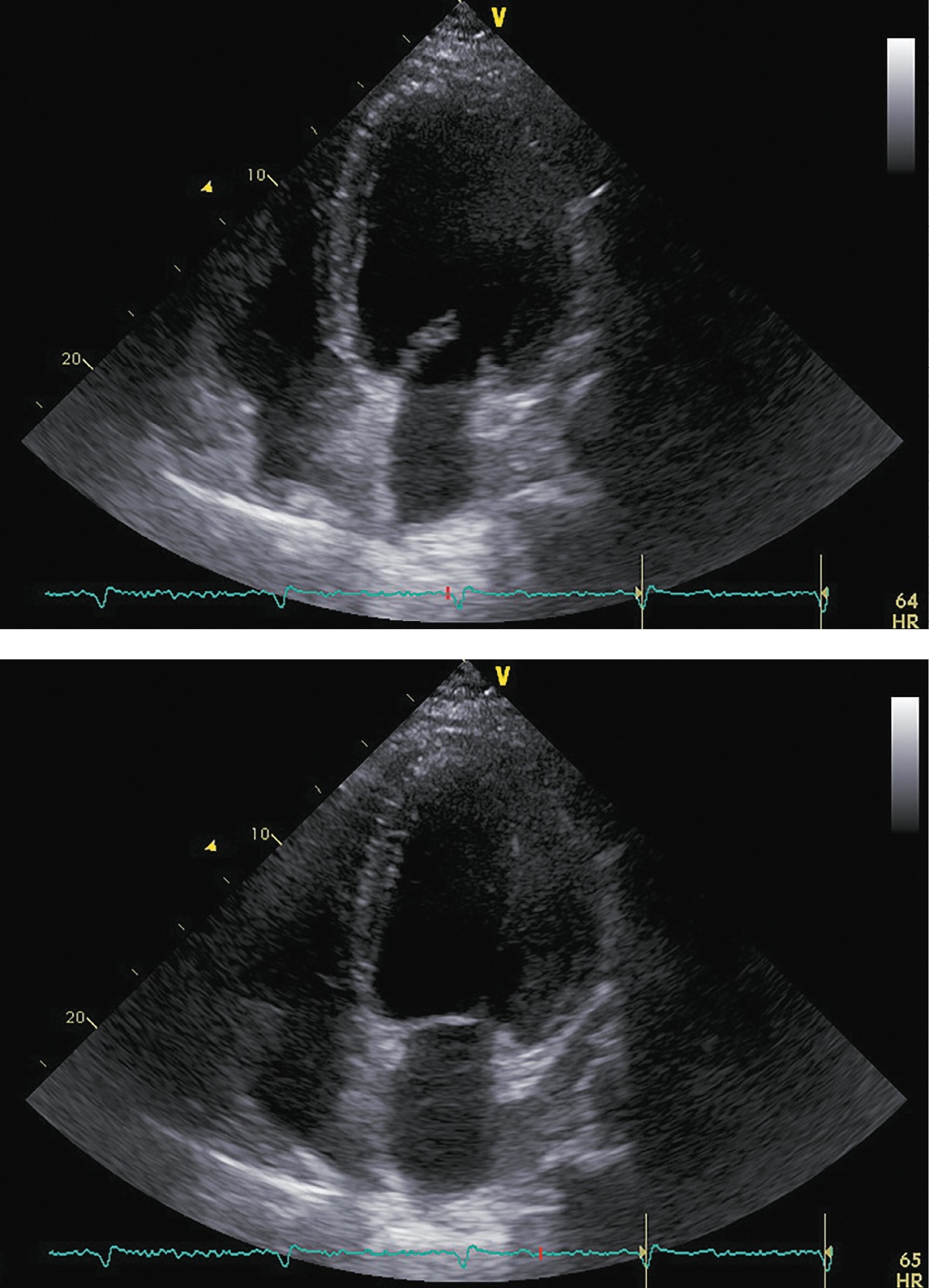
Рисунок 4. ЭХОКГ, 1 месяц до аденомэктомии.
Примечание: верхушечная 4-камерная позиция (сверху представлен кадр в диастолу, снизу — в систолу).
Таблица 2. ЭХОКГ-показатели, 1 месяц до аденомэктомии
|
Показатель |
Значение/индекс |
|
Объем левого предсердия |
135 мл/54 мл/м² |
|
Передне-задний размер левого желудочка |
7,20 см/2,89 см/м² |
|
Конечно-диастолический объем левого желудочка |
369 мл/148 мл/м² |
|
Конечно-систолический объем левого желудочка |
297 мл/119 мл/м² |
|
Локальная кинетика левого желудочка |
диффузный гипокинез |
|
Фракция выброса левого желудочка (усреднение по 4- и 2-камерным верхушечным позициям) |
19% |
|
Диастолическая функция левого желудочка |
градация III, рестриктивный тип |
|
Конечно-диастолическая площадь правого желудочка |
27 см²/10,8 см²/м² |
|
Конечно-систолическая площадь правого желудочка |
13,5 см²/5,4 см/м² |
|
Фракция систолического уменьшения площади |
50% |
|
Расчетное систолическое давление в легочной артерии |
50 мм рт.ст. |
В ноябре 2017 г. пациент госпитализирован повторно для проведения нейрохирургического лечения. Пациент указал, что принимал предписанную терапию в полном объеме. Каких-либо нежелательных лекарственных реакций не выявлено. На фоне лечения симптомы ХСН заметно регрессировали, толерантность к физическим нагрузкам возросла до уровня II ф.к. по NYHA. Физикальной симптоматики легочного застоя и увеличения печени не отмечалось. При контрольной ЭХОКГ (рис. 5; табл. 3) выявлены уменьшение размеров и объемов левого желудочка, значительное увеличение ФВ ЛЖ (до 43%) и снижение класса диастолической дисфункции ЛЖ.
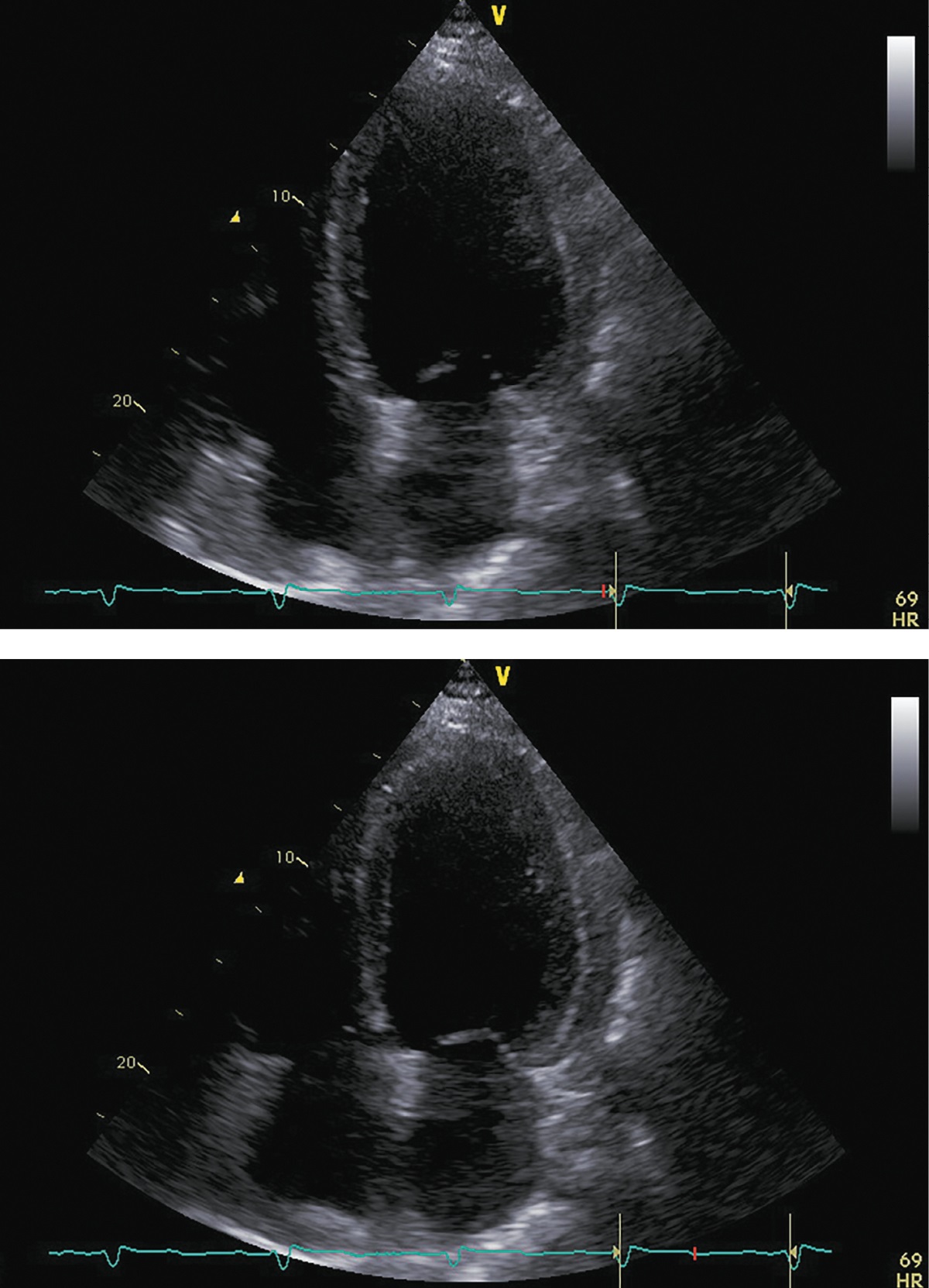
Рисунок 5. ЭХОКГ перед аденомэктомией.
Примечание: верхушечная 4-камерная позиция (сверху представлен кадр в диастолу, снизу — в систолу).
Таблица 3. ЭХОКГ-показатели перед аденомэктомией
|
Показатель |
Значение/индекс |
|
Объем левого предсердия |
100 мл/54 мл/м² |
|
Передне-задний размер левого желудочка |
7,20 см/2,89 см/м² |
|
Конечно-диастолический объем левого желудочка |
285 мл/117 мл/м² |
|
Конечно-систолический объем левого желудочка |
162 мл/67 мл/м² |
|
Локальная кинетика левого желудочка |
умеренный диффузный гипокинез |
|
Фракция выброса левого желудочка (усреднение по 4- и 2-камерным верхушечным позициям) |
43% |
|
Диастолическая функция левого желудочка |
градация II, псевдо-нормальный тип |
|
Конечно-диастолическая площадь правого желудочка |
25,0 см²/10,0 см²/м² |
|
Конечно-систолическая площадь правого желудочка |
12,0 см²/4,8 см/м² |
|
Фракция систолического уменьшения площади |
52% |
|
Расчетное систолическое давление в легочной артерии |
43 мм рт.ст. |
После стабилизации кардиального статуса пациента была проведена эндоскопическая трансназальная транссфеноидальная аденомэктомия. Течение постоперационного периода — без каких-либо кардиальных осложнений. Больной через сутки переведен из ОРИТ в хирургическое отделение.
ИСХОДЫ И КОНТРОЛЬНЫЕ НАБЛЮДЕНИЯ
По результатам постоперационных гормональных тестов отмечены снижение уровня АКТГ и кортизола (табл. 1) и развитие вторичной надпочечниковой недостаточности, что является показателем эффективности/радикальности проведенного вмешательства.
В послеоперационном периоде инициирована заместительная терапия (рис. 1).
При последующих госпитализациях для динамического наблюдения (май 2018 г.; декабрь 2018 г.; декабрь 2019 г.) состояние пациента соответствовало стабильной клинической ремиссии. Заместительная терапия была отменена в декабре 2018 г., в дальнейшем показатели секреции кортизола находились в пределах референсных значений (табл. 1). Толерантность к физическим нагрузкам оставалась на уровне II ф.к. по NYHA. Физикальная симптоматика, характерная для ХСН, отсутствовала. При проведении контрольных ЭХОКГ-исследований отмечалось дальнейшее уменьшение размеров и объемов левого желудочка со стабилизацией ФВ ЛЖ на субнормальном уровне (рис. 6, 7, 8; табл. 4, 5, 6 соответственно). В связи с сохраняющейся АГ поликомпонентная гипотензивная терапия была продолжена в том же объеме с добавлением к ней альфа-адреноблокатора (доксазозин 2 мг два раза в сутки). СД контролировался метформином с достижением целевого уровня гликемии и гликированного гемоглобина. Уровень креатинина оставался стабильным, значимой динамики СКФ обнаружено не было (табл. 7).
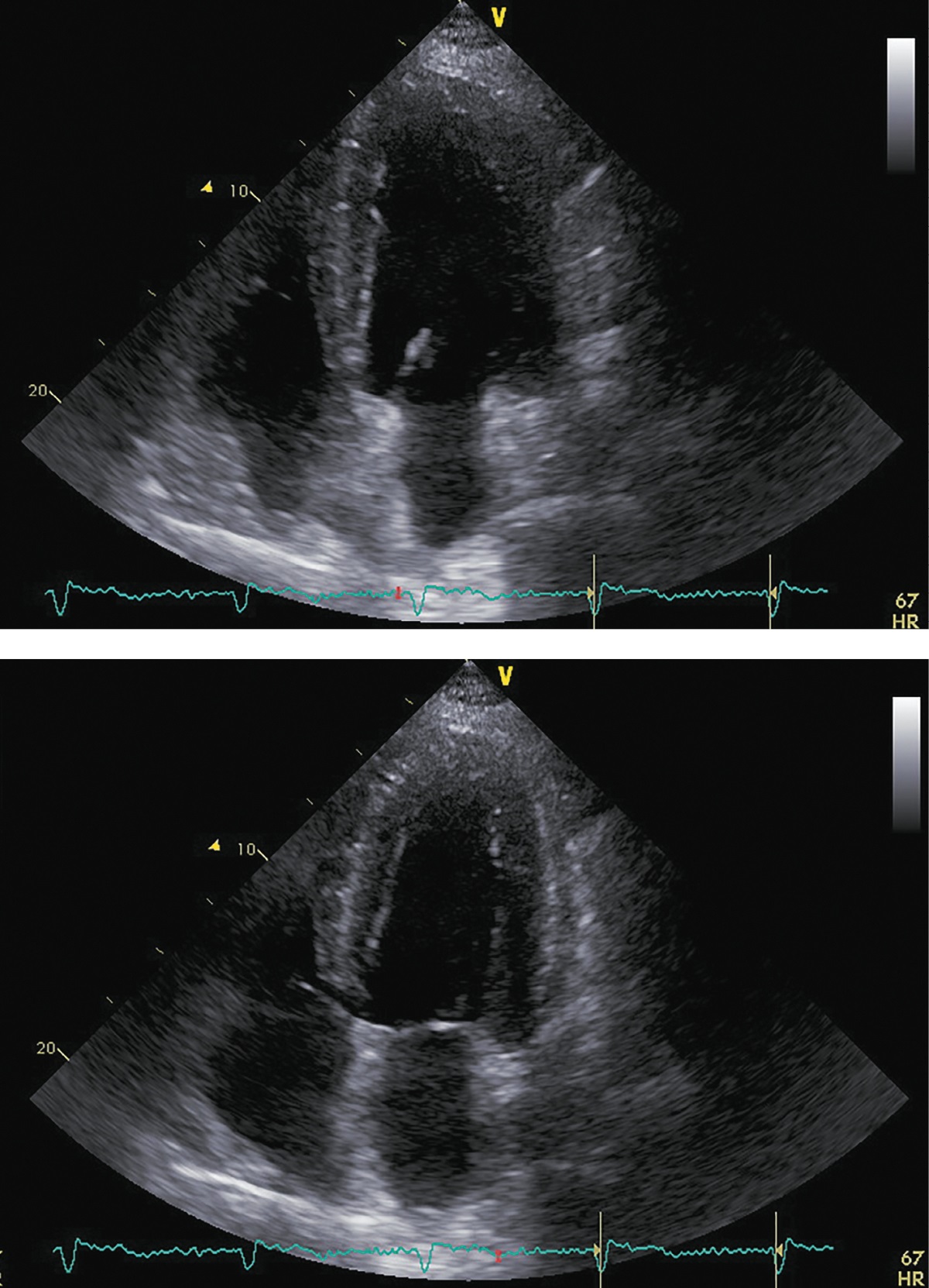
Рисунок 6. ЭХОКГ через 6 месяцев после аденомэктомии.
Примечание: верхушечная 4-камерная позиция (сверху представлен кадр в диастолу, снизу — в систолу).
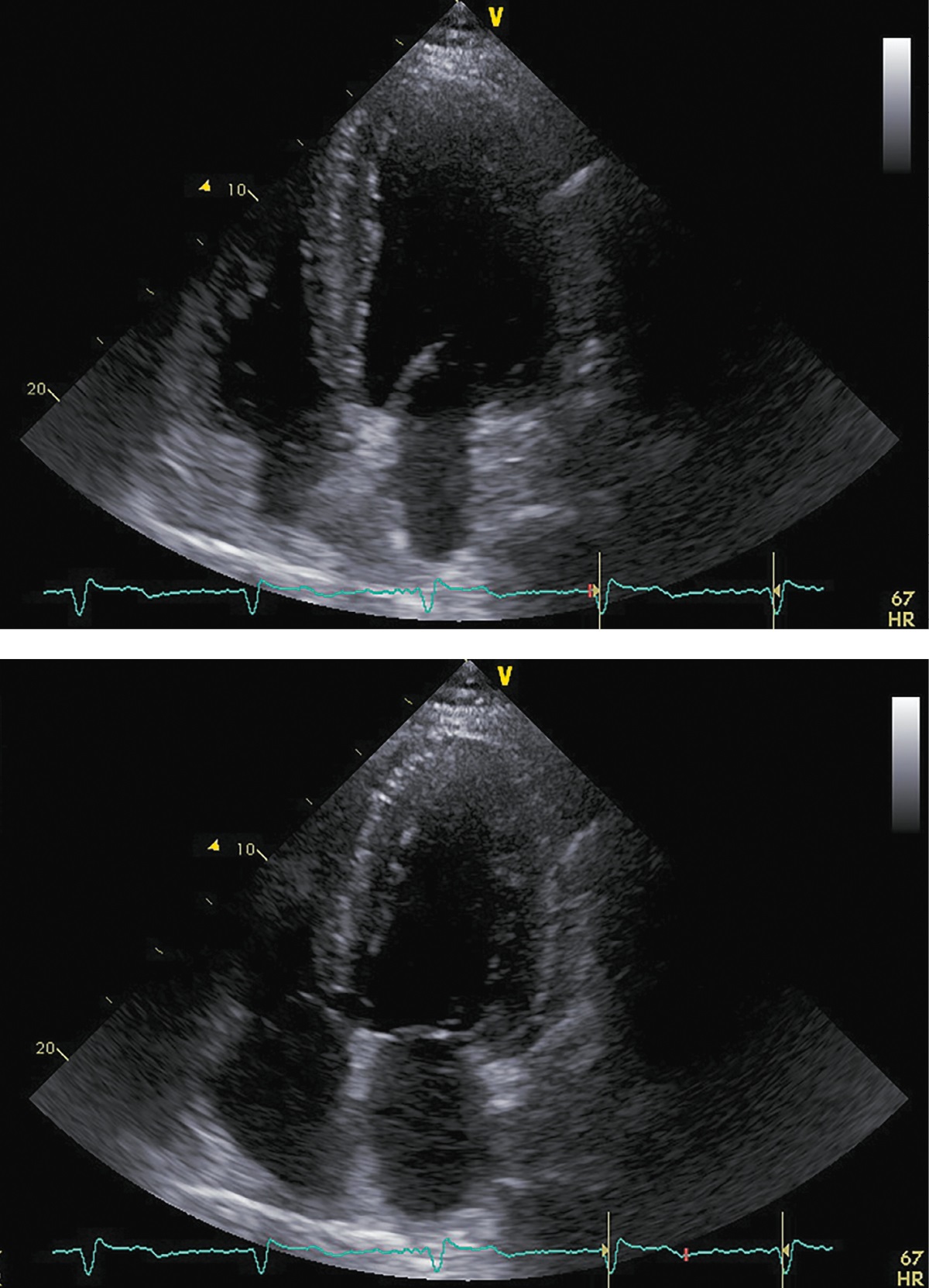
Рисунок 7. ЭХОКГ через 12 месяцев после аденомэктомии.
Примечание: верхушечная 4-камерная позиция (сверху представлен кадр в диастолу, справа — в систолу.
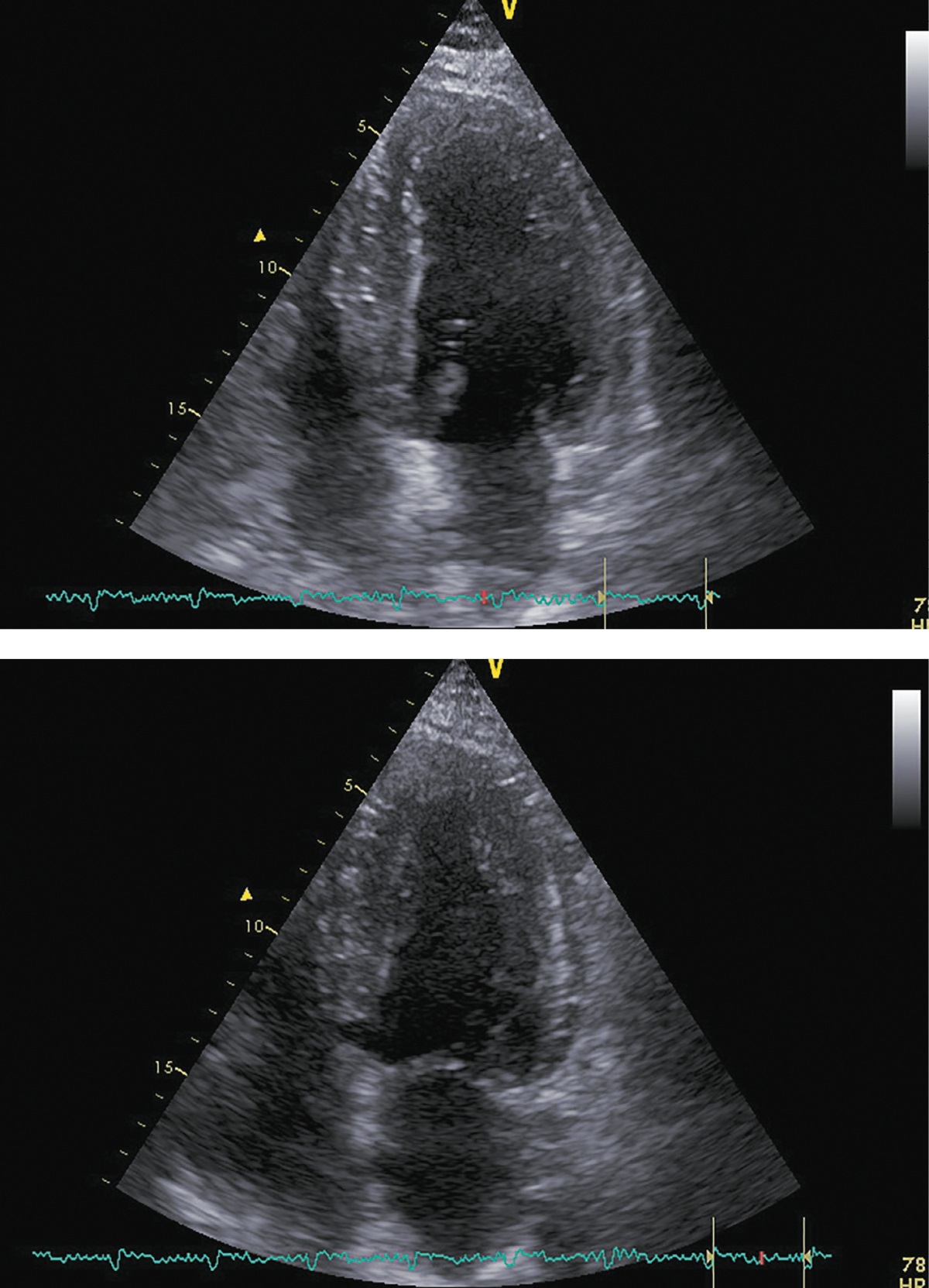
Рисунок 8. ЭХОКГ через 24 месяца после аденомэктомии.
Примечание: верхушечная 4-камерная позиция (сверху представлен кадр в диастолу, справа — в систолу).
Таблица 4. ЭХОКГ-показатели через 6 месяцев после аденомэктомии
|
Показатель |
Значение/индекс |
|
Объем левого предсердия |
77 мл/33 мл/м² |
|
Передне-задний размер левого желудочка |
6,10 см/2,44 см/м² |
|
Конечно-диастолический объем левого желудочка |
211 мл/91 мл/м² |
|
Конечно-систолический объем левого желудочка |
103 мл/44 мл/м² |
|
Локальная кинетика левого желудочка |
Нормальная кинетика |
|
Фракция выброса левого желудочка (усреднение по 4- и 2-камерным верхушечным позициям) |
51% |
|
Диастолическая функция левого желудочка |
градация II, псевдо-нормальный тип |
|
Конечно-диастолическая площадь правого желудочка |
25,5 см²/10,9 см²/м² |
|
Конечно-систолическая площадь правого желудочка |
14,8 см²/6,4 см/м² |
|
Фракция систолического уменьшения площади |
41% |
|
Расчетное систолическое давление в легочной артерии |
41 мм рт.ст. |
Таблица 5. ЭХОКГ-показатели через 12 месяцев после аденомэктомии
|
Показатель |
Значение/индекс |
|
Объем левого предсердия |
81 мл/34 мл/м² |
|
Передне-задний размер левого желудочка |
5,2 см/2,08 см/м² |
|
Конечно-диастолический объем левого желудочка |
174 мл/74 мл/м² |
|
Конечно-систолический объем левого желудочка |
90 мл/38 мл/м² |
|
Локальная кинетика левого желудочка |
Нормальная кинетика |
|
Фракция выброса левого желудочка (усреднение по 4- и 2-камерным верхушечным позициям) |
49% |
|
Диастолическая функция левого желудочка |
градация I, нарушения релаксации |
|
Конечно-диастолическая площадь правого желудочка |
22,9 см²/9,8 см²/м² |
|
Конечно-систолическая площадь правого желудочка |
11,2 см²/4,8 см/м² |
|
Фракция систолического уменьшения площади |
51% |
|
Расчетное систолическое давление в легочной артерии |
48 мм рт.ст. |
Таблица 6. ЭХОКГ-показатели через 24 месяца после аденомэктомии
|
Показатель |
Значение/индекс |
|
Объем левого предсердия |
97 мл/41 мл/м² |
|
Передне-задний размер левого желудочка |
5,2 см/2,19 см/м² |
|
Конечно-диастолический объем левого желудочка |
170 мл/71 мл/м² |
|
Конечно-систолический объем левого желудочка |
77 мл/32 мл/м² |
|
Локальная кинетика левого желудочка |
Нормальная кинетика |
|
Фракция выброса левого желудочка (усреднение по 4- и 2-камерным верхушечным позициям) |
55% |
|
Диастолическая функция левого желудочка |
градация I, нарушения релаксации |
|
Конечно-диастолическая площадь правого желудочка |
20,9 см²/8,8 см²/м² |
|
Конечно-систолическая площадь правого желудочка |
11,2 см²/4,6 см/м² |
|
Фракция систолического уменьшения площади |
47% |
|
Расчетное систолическое давление в легочной артерии |
39 мм рт.ст. |
Таблица 7. Динамика СКФ (по формуле CKD-EPI), HbA1c и ИМТ
|
Дата исследования |
СКФ (мл/мин/1,73 м²) |
HbA1c (%) |
HbA1c (ммоль/моль) |
ИМТ (кг/м²) |
|
Дооперационные показатели |
||||
|
Июль 2017 |
34,7 |
7,5 |
58,5 |
44,8 |
|
Октябрь 2017 |
75,8 |
6,7 |
49,7 |
- |
|
Ноябрь 2017 |
81,1 |
- |
- |
39,8 |
|
Послеоперационные показатели |
||||
|
Май 2018 |
97,7 |
- |
- |
36,4 |
|
Декабрь 2018 |
56,9 |
- |
- |
36,8 |
|
Декабрь 2019 |
103,7 |
7,1 |
54,1 |
39,3 |
ОБСУЖДЕНИЕ
Одной из основных причин смерти пациентов с ЭГ являются сердечно-сосудистые заболевания [6]. БИК ассоциируется с высоким риском инфаркта миокарда/ишемического инсульта [7] и характеризуется высокой распространенностью субклинических атеросклеротических поражений сонных и коронарных артерий [8–11]. Также у пациентов с ЭГ описаны редкие случаи поражения миокарда c морфо-функциональным фенотипом ДКМП [1][2].
Оптимальное лечение таких пациентов представляет серьезную клиническую проблему. Экспертные рекомендации по ведению таких пациентов отсутствуют. Более того, редкость патологии делает практически невозможным проведение РКИ, которые позволили бы оценить эффективность тех или иных вмешательств с точки зрения доказательной медицины. К настоящему времени мы обнаружили лишь два нарративных специализированных обзора, в которых представлено краткое описание случаев ДКМП у пациентов с ЭГ [1][2].
Проблемы ведения пациентов с кортизол-индуцированными ДКМП определяются не только редкостью патологии, но и сложностью диагностики. В нашем случае появление симптомов ХСН предшествовало манифестации типичной симптоматики ЭГ. Несмотря на развитие характерных для ЭГ симптомов, диагноз заподозрен и затем подтвержден только в рамках исследования перед имплантацией устройства для ресинхронизирующей терапии, через 3 года с момента верификации диагноза ДКМП.
Серьезной проблемой также стал выбор оптимальной тактики ведения пациента. Наличие выраженной СН с низкой ФВ ЛЖ не позволяло выполнить оперативное вмешательство в связи с высоким риском неблагоприятных периоперационных кардиальных событий. Была выбрана тактика отсроченного оперативного вмешательства с попыткой медикаментозной стабилизации состояния с помощью ИАПФ, бетаАБ, диуретиков, ингибиторов стероидогенеза. Стабилизировать состояние пациента удалось только после назначения максимально переносимых доз ИАПФ, бетаАБ, БМКК, диуретиков и увеличения дозы ингибитора стероидогенеза кетоконазола. Исчезновение физикальных симптомов, снижение функционального класса ХСН и значительное увеличение ФВ ЛЖ позволило выполнить эндоскопическую трансназальную транссфеноидальную аденомэктомию без каких-либо осложнений.
В большинстве анализируемых литературных источников представлена сходная тактика ведения пациентов с КИДКМП, предполагающая период предоперационной фармакологической стабилизации [1][12–21] с помощью бетаАБ, ИАПФ, диуретиков, верошпирона, а также ингибиторов стероидогенеза кетоконазола или метирапона [13][14][16][17][19] и хирургическое устранение источника гиперсекреции кортизола или АКТГ.
После хирургического вмешательства и коррекции гиперкортицизма практически во всех представленных в литературе случаях отмечено не только улучшение клинической симптоматики и снижение функционального класса СН, но и обратимость КМП — уменьшение размеров/объемов ЛЖ и значительное увеличение ФВ ЛЖ [12–22]. Схожая динамика клинических симптомов и ЭХОКГ-показателей отмечена и в описанном нами случае. Таким образом, результаты позволяют сделать предположение о возможной обратимости морфофункциональных изменений сердца у пациентов с КИДКМП при достижении эукортицизма.
Механизмы кортизол-индуцированного ремоделирования миокарда, приводящие к формированию морфофункционального фенотипа ДКМП, представляются сложными и недостаточно изученными. К сожалению, формат публикации не позволяет предоставить детальный анализ патогенеза КИДКМП. Тем не менее анализ клинико-экспериментальных исследований позволяет выдвинуть гипотезу, что ремоделирование миокарда при болезни/синдроме Кушинга является результатом совокупного воздействия избытка глюкокортикоидов (ГК) на глюкокортикоидные (ГКР) и минералокортикоидные (МКР) рецепторы миокарда.
Морфологические исследования биоптатов миокарда пациентов с КИДКМП и экспериментальные исследования описывают гипертрофию и апоптоз кардиомиоцитов, дезорганизацию миофибрилл, протеолиз сократительных белков, а также интерстициальный и периваскулярный фиброз миокарда [22–30].
Анализ экспериментальных исследований позволяет предположить, что ГК регулируют метаболизм тяжелых цепей миозина в зависимости от концентрации и времени воздействия. При низких концентрациях и коротких сроках воздействия ГК преобладает синтез миозина, при увеличении концентраций и продолжительности воздействия начинает преобладать их лизис [22][31–33]. Основным механизмом лизиса тяжелых цепей миозина может быть кортизол-индуцированная активация убиквитин-протеасомной системы кардиомицоцитов. Под воздействием кортизола происходит повышение экспрессии генов убиквитин-лигаз Atrogin1/MAFbx/MuRF1 [22][33–38] и С3 субъединицы протеасом [36] в кардиомиоцитах.
Особенностью кардиомиоцитов является отсутствие или низкая экспрессия гена 11β-гидроксистероиддегидрогеназы типа 2 (11β-HSD2), что позволяет ГК связываться как с ГКР, так и с МКР. ГК проявляют двойственное действие при взаимодействии с МКР: в нормальных условиях они оказывают ингибирующий эффект; в патологических, особенно в условиях оксидативного стресса, кортизол начинает действовать как агонист МКР. При оксидативном стрессе плотность ГКР снижается и реализуются минералокортикоидные эффекты ГК [41][42], что приводит к структурно-функциональной дезорганизации митохондрий, снижению синтеза АТФ и дальнейшей активации оксидативного стресса [43].
Кроме того, избыток ГК вызывает структурную дезорганизацию и дисфункцию митохондрий, вероятно, через активацию ГК-рецепторов митохондрий/ГК-отвечающего элемента или AngII-зависимого сигнального пути. Избыток ГК снижает экспрессию генов, кодирующих структурные компоненты и ферменты митохондрий, нарушает синтез АТФ и индуцирует оксидативный стресс [25][28][39][40].
Развитие фиброза миокарда рассматривается как следствие минералкортикоидных эффектов ГК или ГК-потенцированной активации AngII-сигнального пути [25][30][44].
Таким образом, патогенез включает 3 основных звена: 1) убиквитин-протеасомная деструкцией сократительных элементов кардиомиоцитов, 2) митохондриальная дисфункция, а также 3) фиброз миокарда.
ЗАКЛЮЧЕНИЕ
Избыток кортизола может приводить к поражению сердца с клинико-морфологическим фенотипом ДКМП. Развитие симптомов ХСН и поражение миокарда с морфофункциональным фенотипом ДКМП могут быть доминирующими клиническими манифестациями и предшествовать появлению других клинических симптомов, характерных для ЭГ. Для безопасного хирургического удаления источника гиперсекреции АКТГ/кортизола у пациентов с КИДКМП предпочтительна тактика отсроченного вмешательства с попыткой фармакологической стабилизации состояния пациента с применением стандартной терапии ХСН и ингибиторов стероидогенеза. Поражение миокарда является обратимым при достижении эукортицизма.
Учитывая редкость КИДКПМ и отсутствие возможности проведения РКИ для определения оптимальной тактики ведения пациентов, представляется целесообразным проведение обзора по методологии scoping-review с анализом всех представленных в литературе случаев. Кроме того, целесообразно проведение отдельного обзорного исследования для анализа молекулярных механизмов ГК-индуцированного ремоделирования сердца.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Marchand L, Segrestin B, Lapoirie M, et al. Dilated Cardiomyopathy Revealing Cushing Disease: A Case Report and Literature Review. Medicine (Baltimore). 2015;94(46):e2011. doi: https://doi.org/10.1097/MD.0000000000002011
2. Miao S, Lu L, Li L, et al. Clinical Characteristics for the Improvement of Cushing’s Syndrome Complicated With Cardiomyopathy After Treatment With a Literature Review. Front Cardiovasc Med. 2021;8:777964. doi: https://doi.org/10.3389/fcvm.2021.777964
3. Riley DS, Barber MS, Kienle GS, et al. CARE guidelines for case reports: explanation and elaboration document. J Clin Epidemiol. 2017;89:218-235. doi: https://doi.org/10.1016/j.jclinepi.2017.04.026
4. Lang RM, Badano LP, Mor-Avi V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr. 2015;28(1):1-39.e14. doi: https://doi.org/10.1016/j.echo.2014.10.003
5. Nagueh SF, Smiseth OA, Appleton CP, et al. Recommendations for the Evaluation of Left Ventricular Diastolic Function by Echocardiography: An Update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr. 2016;29(4):277-314. doi: https://doi.org/10.1016/j.echo.2016.01.011
6. PLOTZ CM, KNOWLTON AI, RAGAN C. The natural history of Cushing’s syndrome. Am J Med. 1952;13(5):597-614. doi: https://doi.org/10.1016/0002-9343(52)90027-2
7. Dekkers OM, Horváth-Puhó E, Jørgensen JO, et al. Multisystem morbidity and mortality in Cushing’s syndrome: a cohort study. J Clin Endocrinol Metab. 2013;98(6):2277-2284. doi: https://doi.org/10.1210/jc.2012-3582
8. Albiger N, Testa RM, Almoto B, et al. Patients with Cushing’s syndrome have increased intimal media thickness at different vascular levels: comparison with a population matched for similar cardiovascular risk factors. Horm Metab Res. 2006;38(6):405-410. doi: https://doi.org/10.1055/s-2006-944545
9. Faggiano A, Pivonello R, Spiezia S, et al. Cardiovascular risk factors and common carotid artery caliber and stiffness in patients with Cushing’s disease during active disease and 1 year after disease remission. J Clin Endocrinol Metab. 2003;88(6):2527-2533. doi: https://doi.org/10.1210/jc.2002-021558
10. Barahona MJ, Resmini E, Viladés D, et al. Coronary artery disease detected by multislice computed tomography in patients after long-term cure of Cushing’s syndrome. J Clin Endocrinol Metab. 2013;98(3):1093-1099. doi: https://doi.org/10.1210/jc.2012-3547
11. Neary NM, Booker OJ, Abel BS, et al. Hypercortisolism is associated with increased coronary arterial atherosclerosis: analysis of noninvasive coronary angiography using multidetector computerized tomography. J Clin Endocrinol Metab. 2013;98(5):2045-2052. doi: https://doi.org/10.1210/jc.2012-3754
12. Hersbach FM, Bravenboer B, Koolen JJ. Hearty hormones. Lancet. 2001;358(9280):468. doi: https://doi.org/10.1016/S0140-6736(01)05626-4
13. Chu JW, Matthias DF, Belanoff J, et al. Successful long-term treatment of refractory Cushing’s disease with high-dose mifepristone (RU 486). J Clin Endocrinol Metab. 2001;86(8):3568-3573. doi: https://doi.org/10.1210/jcem.86.8.7740
14. Marazuela M, Aguilar-Torres R, Benedicto A, Gómez-Pan A. Dilated cardiomyopathy as a presenting feature of Cushing’s syndrome. Int J Cardiol. 2003;88(2-3):331-333. doi: https://doi.org/10.1016/s0167-5273(02)00403-5
15. Petramala L, Battisti P, Lauri G, et al. Cushing’s syndrome patient who exhibited congestive heart failure. J Endocrinol Invest. 2007;30(6):525-528. doi: https://doi.org/10.1007/BF03346339
16. Ma RC, So WY, Tong PC, et al. Adiposity of the heart revisited: reversal of dilated cardiomyopathy in a patient with Cushing’s syndrome. Int J Cardiol. 2011;151(1):e22-e23. doi: https://doi.org/10.1016/j.ijcard.2010.04.041
17. Yong TY, Li JY. Reversible dilated cardiomyopathy in a patient with Cushing’s syndrome. Congest Heart Fail. 2010;16(2):77-79. doi: https://doi.org/10.1111/j.1751-7133.2009.00123.x
18. Al Banna R, Husain A, Al Aali J, et al. Reversible cushing dilated cardiomyopathy mimicking peripartum cardiomyopathy with successful subsequent pregnancy. BMJ Case Rep. 2011;2011:bcr0920114825. doi: https://doi.org/10.1136/bcr.09.2011.4825
19. J Johnston PC, Atkinson AB, Moore MJ, et al. An unusual cause of reversible cardiomyopathy. Ulster Med J. 2012;81(3):134-135
20. Shibusawa N, Yamada M, Hashida T, et al. Dilated cardiomyopathy as a presenting feature of Cushing’s syndrome. Intern Med. 2013;52(10):1067-1071. doi: https://doi.org/10.2169/internalmedicine.52.9051
21. Kim JH, Kim SY, Park JH. Dilated cardiomyopathy with left ventricular thrombi as a presenting feature of Cushing disease. Can J Cardiol. 2014;30(11):. doi: https://doi.org/10.1016/j.cjca.2014.06.018
22. Frustaci A, Letizia C, Verardo R, et al. Atrogin-1 Pathway Activation in Cushing Syndrome Cardiomyopathy. J Am Coll Cardiol. 2016;67(1):116-117. doi: https://doi.org/10.1016/j.jacc.2015.10.040
23. Sugihara N, Shimizu M, Kita Y, et al. Cardiac characteristics and postoperative courses in Cushing’s syndrome. Am J Cardiol. 1992;69(17):1475-1480. doi: https://doi.org/10.1016/0002-9149(92)90904-d
24. Bal MP, de Vries WB, Steendijk P, et al. Histopathological changes of the heart after neonatal dexamethasone treatment: studies in 4-, 8-, and 50-week-old rats. Pediatr Res. 2009;66(1):74-79. doi: https://doi.org/10.1203/PDR.0b013e3181a283a0
25. Roy SG, De P, Mukherjee D, et al. Excess of glucocorticoid induces cardiac dysfunction via activating angiotensin II pathway. Cell Physiol Biochem. 2009;24(1-2):1-10. doi: https://doi.org/10.1159/000227803
26. De P, Roy SG, Kar D, Bandyopadhyay A. Excess of glucocorticoid induces myocardial remodeling and alteration of calcium signaling in cardiomyocytes [published correction appears in J Endocrinol. 2011 May;209(2):255]. J Endocrinol. 2011;209(1):105-114. doi: https://doi.org/10.1530/JOE-10-0431
27. Ren R, Oakley RH, Cruz-Topete D, Cidlowski JA. Dual role for glucocorticoids in cardiomyocyte hypertrophy and apoptosis. Endocrinology. 2012;153(11):5346-5360. doi: https://doi.org/10.1210/en.2012-1563
28. Jin Z, Xia F, Dong J, et al. Omentin-1 attenuates glucocorticoid-induced cardiac injury by phosphorylating GSK3β. J Mol Endocrinol. 2021;66(4):273-283. doi: https://doi.org/10.1530/JME-20-0236
29. de Salvi Guimarães F, de Moraes WM, Bozi LH, et al. Dexamethasone-induced cardiac deterioration is associated with both calcium handling abnormalities and calcineurin signaling pathway activation. Mol Cell Biochem. 2017;424(1-2):87-98. doi: https://doi.org/10.1007/s11010-016-2846-3
30. Tanaka S, Shibuya H, Suzuki S, et al. Long-term administration of prednisolone: Effects on the myocardial tissue of healthy beagle dogs. J Vet Med Sci. 2021;83(1):84-93. doi: https://doi.org/10.1292/jvms.20-0401
31. Clark AF, DeMartino GN, Wildenthal K. Effects of glucocorticoid treatment on cardiac protein synthesis and degradation. Am J Physiol. 1986;250(6 Pt 1):C821-C827. doi: https://doi.org/10.1152/ajpcell.1986.250.6.C821
32. Czerwinski SM, Kurowski TT, McKee EE, et al. Myosin heavy chain turnover during cardiac mass changes by glucocorticoids. J Appl Physiol (1985). 1991;70(1):300-305. doi: https://doi.org/10.1152/jappl.1991.70.1.300
33. Clarke BA, Drujan D, Willis MS, et al. The E3 Ligase MuRF1 degrades myosin heavy chain protein in dexamethasone-treated skeletal muscle. Cell Metab. 2007;6(5):376-385. doi: https://doi.org/10.1016/j.cmet.2007.09.009
34. Menconi M, Gonnella P, Petkova V, et al. Dexamethasone and corticosterone induce similar, but not identical, muscle wasting responses in cultured L6 and C2C12 myotubes. J Cell Biochem. 2008;105(2):353-364. doi: https://doi.org/10.1002/jcb.21833
35. Nishimura M, Mikura M, Hirasaka K, et al. Effects of dimethyl sulphoxide and dexamethasone on mRNA expression of myogenesis- and muscle proteolytic system-related genes in mouse myoblastic C2C12 cells. J Biochem. 2008;144(6):717-724. doi: https://doi.org/10.1093/jb/mvn126
36. Wang L, Luo GJ, Wang JJ, Hasselgren PO. Dexamethasone stimulates proteasome- and calcium-dependent proteolysis in cultured L6 myotubes. Shock. 1998;10(4):298-306. doi: https://doi.org/10.1097/00024382-199810000-00011
37. Wang R, Jiao H, Zhao J, et al. Glucocorticoids Enhance Muscle Proteolysis through a Myostatin-Dependent Pathway at the Early Stage. PLoS One. 2016;11(5):e0156225. doi: https://doi.org/10.1371/journal.pone.0156225
38. Wang XJ, Xiao JJ, Liu L, et al. Excessive glucocorticoid-induced muscle MuRF1 overexpression is independent of Akt/FoXO1 pathway. Biosci Rep. 2017;37(6):BSR20171056. doi: https://doi.org/10.1042/BSR20171056
39. Luan G, Li G, Ma X, et al. Dexamethasone-Induced Mitochondrial Dysfunction and Insulin Resistance-Study in 3T3-L1 Adipocytes and Mitochondria Isolated from Mouse Liver. Molecules. 2019;24(10):1982. doi: https://doi.org/10.3390/molecules24101982
40. Kokkinopoulou I, Moutsatsou P. Mitochondrial Glucocorticoid Receptors and Their Actions. Int J Mol Sci. 2021;22(11):6054. doi: https://doi.org/10.3390/ijms22116054
41. Funder JW. Mineralocorticoid receptor activation and oxidative stress. Hypertension. 2007;50(5):840-841. doi: https://doi.org/10.1161/HYPERTENSIONAHA.107.098012
42. Oakley RH, Cidlowski JA. Glucocorticoid signaling in the heart: A cardiomyocyte perspective. J Steroid Biochem Mol Biol. 2015;153:27-34. doi: https://doi.org/10.1016/j.jsbmb.2015.03.009
43. Hung CS (啟盛) 628401, Chang YY, Tsai CH, et al. Aldosterone suppresses cardiac mitochondria. Transl Res. 2022;239:58-70. doi: https://doi.org/10.1016/j.trsl.2021.08.003
44. Omori Y, Mano T, Ohtani T, et al. Glucocorticoids Induce Cardiac Fibrosis via Mineralocorticoid Receptor in Oxidative Stress: Contribution of Elongation Factor Eleven-Nineteen Lysine-Rich Leukemia (ELL). Yonago Acta Med. 2014;57(3):109-116
Об авторах
А. Б. КузнецовРоссия
Кузнецов Александр Борисович, к.м.н. Отделение кардиологии, эндоваскулярной и сосудистой хирургии
117036, Москва, ул. Дм. Ульянова, д. 11
A. Ю. Григорьев
Россия
Григорьев Андрей Юрьевич, д.м.н., профессор
Москва
В. А. Кузнецов
Россия
Кузнецов Владимир Александрович, студент
Москва
Ж. Е. Белая
Россия
Белая Жанна Евгеньевна, д.м.н., профессор
Москва
Л. Я. Рожинская
Россия
Рожинская Людмила Яковлевна, д.м.н., профессор
Москва
Дополнительные файлы
|
|
1. Рисунок 1. Модификация терапии по ходу лечения. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(1MB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Временная последовательность событий. | |
| Тема | ||
| Тип | Материалы исследования | |
Посмотреть
(648KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Коронароангиография. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(1MB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. ЭХОКГ, 1 месяц до аденомэктомии | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(1MB)
|
Метаданные ▾ | |
|
|
5. Рисунок 5. ЭХОКГ перед аденомэктомией | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(966KB)
|
Метаданные ▾ | |
|
|
6. Рисунок 6. ЭХОКГ через 6 месяцев после аденомэктомии. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(1MB)
|
Метаданные ▾ | |
|
|
7. Рисунок 7. ЭХОКГ через 12 месяцев после аденомэктомии | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(937KB)
|
Метаданные ▾ | |
|
|
8. Рисунок 8. ЭХОКГ через 24 месяца после аденомэктомии. | |
| Тема | ||
| Тип | Прочее | |
Посмотреть
(985KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Кузнецов А.Б., Григорьев A.Ю., Кузнецов В.А., Белая Ж.Е., Рожинская Л.Я. Дилатационная кардиомиопатия у пациента с болезнью Кушинга — клиника, диагностика и лечение: описание случая. Проблемы Эндокринологии. 2025;71(4):16-28. https://doi.org/10.14341/probl13147
For citation:
Kuznetsov A.B., Grigoryev A.Y., Kuznetsov V.A., Belaya Zh.E., Rozhinskaya L.Y. Dilated cardiomyopathy in a patient with Cushing's disease — clinical presentation, diagnosis and treatment: a case report. Problems of Endocrinology. 2025;71(4):16-28. (In Russ.) https://doi.org/10.14341/probl13147

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).









































.jpg)


