Перейти к:
Репликативные и биохимические аспекты старения у женщин с преждевременной недостаточностью яичников
https://doi.org/10.14341/probl13253
Аннотация
ОБОСНОВАНИЕ. Одной из наиболее опасных патологий с точки зрения демографического урона, ухудшения качества жизни и снижения шансов на здоровое долголетие у женщин является преждевременная недостаточность яичников (ПНЯ). Помимо манифестации до 40 лет, данному симптомокомплексу присуще наличие вторичной аменореи, тотального эстрогенного дефицита и гипергонадотропного гипогонадизма. Существуют небезосновательные опасения о влиянии ПНЯ на ожидаемую продолжительность жизни за счет пагубного действия эстрогенного дефицита на длину теломер. Многообещающими мерами по сохранению качества и ожидаемой продолжительности жизни у пациенток с ПНЯ являются определение длины теломер и инициация гормональной заместительной терапии.
ЦЕЛЬ. Изучить особенности репликативного клеточного старения (длины теломер) и биохимических показателей у женщин с ПНЯ.
МАТЕРИАЛЫ И МЕТОДЫ. Исследование проведено на базе ФГБУ «НМИЦ эндокринологии» Минздрава России совместно с МНОЦ МГУ им. М.В.Ломоносова в период с 10.01.2021 г. по 01.08.2022 г.
В одномоментном сравнительном исследовании приняли участие 33 женщины с неятрогенным гипергонадотропным гипогонадизмом в исходе ПНЯ и 24 здоровые женщины репродуктивного возраста (18–49 лет). Пациенткам проведен лабораторный генетический (длина теломер лейкоцитов), биохимический анализы крови. Экстракция ДНК — набором Qiagen DNA blood mini kit (Германия). Оценка длины теломер лейкоцитов — методом полимеразной цепной реакции (ПЦР) в реальном времени (алгоритм Flow-fish).
РЕЗУЛЬТАТЫ. Женщины с ПНЯ вследствие эстрогенного дефицита имеют незначительно более низкую среднюю длину теломер (10,0 [7,9–10,7] кБ, чем здоровые пациентки репродуктивного возраста (10,8 [10,0–13,1] кБ, р<0,001). Пациентки с ПНЯ вследствие эстрогенного дефицита имеют склонность к развитию нарушений углеводного обмена (предиабету) (р<0,043) и повышению уровня фолликулостимулирующего гормона (ФСГ) (р<0,001). Уровень ФСГ умеренно отрицательно (ρ=0,434) коррелирует с длиной теломер лейкоцитов у женщин (р<0,001).
ЗАКЛЮЧЕНИЕ. На фоне приема заместительной гормональной терапии у пациенток с ПНЯ в отличие от здоровых женщин репродуктивного возраста отмечаются снижение длины теломер и повышение риска развития нарушений углеводного обмена.
Ключевые слова
Для цитирования:
Михеев Р.К., Андреева Е.Н., Григорян О.Р., Шереметьева Е.В., Абсатарова Ю.С., Логинова Е.В. Репликативные и биохимические аспекты старения у женщин с преждевременной недостаточностью яичников. Проблемы Эндокринологии. 2023;69(2):92-98. https://doi.org/10.14341/probl13253
For citation:
Mikheev R.K., Andreeva E.N., Grigoryan O.R., Sheremetyeva E.V., Absatarova Yu.S., Loginova E.V. Replicative and biochemical ageing features among females with primary ovarian insufficiency. Problems of Endocrinology. 2023;69(2):92-98. (In Russ.) https://doi.org/10.14341/probl13253
ОБОСНОВАНИЕ
Одной из наиболее актуальных и наименее изученных проблем современной репродуктивной эндокринологии является лечебное диагностическое сопровождение пациенток с преждевременной недостаточностью яичников. Отличительными особенностями данного симптомокомплекса являются вторичная аменорея, симптомы дефицита эстрогенов (вазомоторные проявления, генитоуринарный синдром) и гипергонадотропный гипогонадизм (повышение уровней фолликулостимулирующего (ФСГ) и лютеинизирующего (ЛГ) гормонов) с манифестацией до 40 лет у ранее репродуктивно-сохранных женщин [1]. Лабораторная верификация данной нозологии основана на получении минимум дважды результатов уровня ФСГ >25 МЕ/л с интервалом не менее 4–6 нед у пациенток с аменореей на протяжении не менее 4 мес [2]. Несмотря на 80-летнюю историю изучения данного синдрома, начало которой было положено Albright F. и соавт. (1942) [3], этиология и патогенез развития преждевременной недостаточности (ПНЯ) остаются до сих пор не изученными. Существует множество теорий, объясняющих преждевременное истощение фолликулярного аппарата яичников, ни одна из которых не признана исчерпывающей; примером тому являются генетическая (премутация гена FMR1 [1], мутации генов BMP15, LHR, FSHR, GDF9, STAG3 [2], низкий уровень экспрессии Tet1 [4]), аутоиммунная (антитела к 21-гидроксилазе, тиреопероксидазе, рецепторам тиреотропного гормона) [5] и инфекционная (эпидемический паротит, COVID-19) [6][7] теории. Установлено, что сочетание генетической предрасположенности с экзогенными факторами (инфекционные агенты, стрессы, ионизирующее излучение) способно вызывать повреждение гонад с последующим замещением фолликулов соединительной тканью. Процесс апоптоза фолликулов лабораторно проявляется в виде снижения уровня антимюллерова гормона (АМГ) и эстрогенов с исходом в бесплодие и тотальный эстрогенный дефицит соответственно; последнее состояние даже при ранней (до 40 лет) манифестации задолго до вступления в пожилой возраст способствует развитию заболеваний, ассоциированных со старением (атеросклероз, артериальная гипертония, дислипидемия, инсулинорезистентность, сердечно-сосудистые, неврологические, костно-мышечные заболевания) [8]. Общепринятой терапевтической мерой при развитии ПНЯ является заместительная терапия половыми стероидами (в частности, эстрадиолом) [8], которая путем воздействия на эстрогеновые рецепторы ERα и ERβ [9] блокирует дегенеративные изменения старческого генеза в различных органах и системах. Однако в свете современных представлений о так называемой теломеразной теории старения большое внимание уделяется гипотезе о протективном влиянии эстрогенов на состояние «биологических часов» клетки — теломер.
Теломеры (от др.-греч. τέλος — конец + μέρος — часть) служат концевыми структурами ДНК, состоящими из тандемных повторов нуклеотидных последовательностей TTAGGG на 3’-конце в сочетании с ассоциированными белками-шелтеринами, в частности TPP1 [10]. В течение жизненного цикла клетки теломеры поддерживают стабильность ДНК за счет ревертазной активности теломеразы — фермента рибонуклеиновой природы, включающего в себя теломеразную обратную транскриптазу (hTERT), и некодирующей РНК (hTR) [11]. По данным L. Gaydosh и соавт. (2020), эстрогены показали статистически значимое протективное влияние на теломеры как in vitro, так и in vivo [12], что подтверждается достижением более выраженной длины теломер к концу пубертата у женщин по сравнению с мужчинами (исходный показатель при рождении: 7,01±0,03 kb против 6,87±0,04 kB, наблюдение (мужчины): 6,79±0,03 против 6,65±0,03, Р=0,005) [13].
Авторы настоящего исследования выдвигают гипотезу, в рамках которой утверждается способность эстрогенов в составе заместительной терапии обеспечивать длину теломер либо превышающую, либо сопоставимую с аналогичным показателем у здоровых женщин репродуктивного возраста (15–49 лет).
ЦЕЛЬ ИССЛЕДОВАНИЯ
Изучить особенности маркера репликативного клеточного старения (длина теломер) и биохимических показателей у женщин с ПНЯ на фоне заместительной терапии половыми стероидами.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Исследование проведено на базе ФГБУ «НМИЦ эндокринологии» Минздрава России совместно с МНОЦ МГУ им. М.В.Ломоносова в период с 10.01.2021 г. по 01.08.2022 г.
Изучаемые популяции
В одномоментном сравнительном исследовании всего приняли участие 57 женщин, из них:
1.33 женщины (<40 лет) с ПНЯ на гормональной заместительной терапии (ГЗТ);
2.24 здоровые женщины репродуктивного возраста (15–49 лет), не получающие ГЗТ.
Изучаемые популяции пациентов
I.Пациентки с установленным диагнозом «Преждевременная недостаточность яичников», получающие заместительную терапию половыми стероидами >5 лет (основная группа).
Критерии включения:
пациентки женского пола паспортного возраста <40 лет, находящиеся в состоянии аменореи длительностью не менее 5 лет; подтвержденный медицинской документацией факт получения ГЗТ в дозе эстрогенового компонента 2 мг в течение не менее 5 лет. Все пациентки подписывали информированное согласие на проведение обследования и консультирование.
Критерии исключения.
1.Наличие ятрогенной менопаузы в анамнезе:
1.1.после перенесенных хирургических вмешательств;
1.2.после перенесенной химиотерапии;
1.3.после перенесенной лучевой терапии;
1.4.после комбинированного лечения из вышеперечисленных выше методов.
2.Наличие сопутствующей патологии в анамнезе:
2.1.генетическая патология репродуктивной системы (синдром Тернера, кариотип 45, XO/XY);
2.2.эстроген-зависимые заболевания и патологические состояния (гиперпластические процессы эндометрия, миома матки, все формы эндометриоза);
2.3.нарушения функции щитовидной железы;
2.4.наличие официально задокументированных психических расстройств;
2.5.наличие официально задокументированных злокачественных новообразований;
2.6.нарушения углеводного обмена (нарушенная толерантность к глюкозе, нарушенная гликемия венозной плазмы натощак, сахарный диабет 1 и 2 типов);
2.7.сердечно-сосудистые заболевания (ишемическая болезнь сердца, острое нарушение мозгового кровообращения, тромбоэмболия легочной артерии).
3.Другие физиологические состояния репродуктивной системы:
3.1.беременность;
3.2.период грудного вскармливания.
Способ формирования выборки — произвольный.
II.Здоровые женщины репродуктивного возраста без заболеваний репродуктивной системы, не получающие МГТ (контрольная группа).
Критерии включения:
пациентки женского пола паспортного возраста 20–49 лет с сохраненным менструальным циклом; уровень ФСГ в фолликулярную фазу — в пределах 2,0–11,6 МЕ/л, в лютеиновую фазу — в пределах 1,4–9,6 МЕ/л. Все пациентки подписывали информированное согласие на проведение обследования и консультирование.
Критерии исключения.
1.Наличие физиологической менопаузы в анамнезе.
2.Наличие ятрогенной менопаузы в анамнезе:
2.1.после перенесенных хирургических вмешательств;
2.2.после перенесенной химиотерапии;
2.3.после перенесенной лучевой терапии;
2.4.После комбинированного лечения из вышеперечисленных выше методов.
3.Наличие сопутствующей патологии в анамнезе:
3.1.генетическая патология репродуктивной системы (синдром Тернера, кариотип 45, XO/XY);
3.2.наличие аутоиммунной менопаузы в анамнезе (в исходе первичной недостаточности яичников);
3.3.эстроген-зависимые заболевания и патологические состояния (гиперплазия эндометрия, миома матки, все формы эндометриоза);
3.4.нарушения функции щитовидной железы;
3.5.наличие официально задокументированных психических расстройств;
3.6.наличие официально задокументированных злокачественных новообразований;
3.7.нарушения углеводного обмена (нарушенная толерантность к глюкозе, нарушенная гликемия венозной плазмы натощак, сахарный диабет 1 и 2 типов);
3.8.сердечно-сосудистые заболевания ишемическая болезнь сердца, острое нарушение мозгового кровообращения, тромбоэмболия легочной артерии));
4.Другие физиологические состояния репродуктивной системы:
4.1.беременность;
4.2.период грудного вскармливания.
Способ формирования выборки — произвольный.
Описание вмешательства
Пациенткам проведены лабораторный генетический (длина теломер лейкоцитов), биохимический анализы.
Экстракция ДНК проведена набором Qiagen DNA blood mini kit (Германия).
Оценка длины теломер лейкоцитов — методом полимеразной цепной реакции (ПЦР) в реальном времени (алгоритм Flow-fish).
Дизайн исследования
Обсервационное одномоментное сравнительное активное ретроспективное.
Статистический анализ
Статистическая обработка данных выполнена с помощью программы IBM SPSS Statistics (version 26,0 for Windows).
Категориальные переменные представлены в виде абсолютных и относительных частот. Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро–Уилка. В случае отсутствия нормального распределения количественные данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1–Q3). При нормальном распределении — средними значениями и стандартным отклонением. Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна–Уитни. При нормальном распределении использовался t-критерий Стьюдента. Анализ многопольных таблиц сопряженности выполнялся с помощью точного критерия Фишера. Корреляция между переменными была проверена с помощью корреляционного анализа по методу ρ Спирмена. Прогностическая модель, характеризующая зависимость количественной переменной от факторов, разрабатывалась с помощью метода линейной регрессии.
Этическая экспертиза
Протокол исследования был одобрен этическим комитетом ФГБУ «НМИЦ эндокринологии» Минздрава России (№11 от 22.07.2021).
РЕЗУЛЬТАТЫ
Клинико-лабораторные (биохимические и генетические) данные пациенток, получающих МГТ по поводу ПНЯ, представлены в табл. 1.
С целью более наглядного сопоставления длин теломер у исследуемой группы (ПНЯ, n=33) в качестве референсных показателей мы привели аналогичные показатели здоровых женщин репродуктивного возраста (контрольная группа, n=24). Медиана возраста в данной группе составила 36 [ 30,0–40,0] лет, ИМТ=22 [ 20,0–27,0] кг/м², ФСГ=5,85 [ 4,75–8,55] мМЕд/л, длина теломер 10,8 [ 10,0–13,1] кБ.
Все пациентки с ПНЯ (n=24) с момента установления данного диагноза находились на ГЗТ, средний срок приема составил 5,5 [ 5,0–7,0] года.
Было установлена статистически достоверная умеренная обратная корреляционная связь (ρ=-0,434) между уровнем ФСГ и длиной теломер (p<0,001) (см. табл. 2), что математически подтверждает отрицательное влияние гипергонадотропного гипогонадизма на репликативный потенциал клетки. У пациенток с ПНЯ по сравнению с основной группой по данным биохимического анализа крови отмечается статистически значимая склонность к развитию нарушений углеводного обмена (в частности, предиабету) (р<0,043).
Таблица 1. Данные пациенток с ПНЯ и без репродуктивной патологии
Параметр | Группа 1 С ПНЯ и МГТ (n=33) | Группа 2 Без ПНЯ и МГТ (n=24) | р |
Возраст, лет# | 33,7±7,2 | 34,2±2,7 | < 0,001* |
Возраст, лет## | 35,5 [ 28,0–39,0] | 36 [ 30,0–40,0] | < 0,001* |
ИМТ, кг/м²# | 23,5±4,3 | 25,2±6,0 | 0,5 |
ИМТ, кг/м²## | 21,8 [ 19,9–27,8] | 22 [ 20,0–27,0] | 0,5 |
Предиабет, % | 3,8 | 0,0 | 0,043* |
Гипотиреоз, % | 15,4 | 19,2 | 0,8 |
Альбумин, г/л# | 44,4±2,5 | 44,7 ± 2,3 | 0,009* |
Креатинин, мкмоль/л## | 69,7 [ 63,7–75,9] | 67,3 [ 63,6–72,2] | < 0,001* |
Мочевина, ммоль/л## | 6,3 [ 5,0–7,4] | 5,5 [ 5,0–6,8] | 0,08 |
Билирубин общий, ммоль/л## | 10,0 [ 8,2–14,6] | 9,5 [ 7,8–14,8] | 0,2 |
Билирубин прямой, ммоль/л## | 3,9 [ 3,4–5,6] | 3,9 [ 2,6–5,2] | 0,8 |
Глюкоза натощак, ммоль/л# | 4,9±0,7 | 4,8 ± 0,6 | 0,6 |
ТГ, ммоль/л## | 0,78 [ 0,59–0,98] | 0,82 [ 0,64–1,00] | 0,003* |
ХС ЛПВП, ммоль/л## | 1,8 [ 1,6–2,1] | 1,8 [ 1,6–2,5] | 0,006* |
ОХС, ммоль/л## | 4,58 [ 4,16–5,02] | 4,86 [ 4,55–5,25] | 0,3 |
ХС ЛПНП, ммоль/л## | 2,6 [ 2,1–3,0] | 2,7 [ 2,1–3,0] | 0,1 |
Кальций общий, ммоль/л## | 2,31 [ 2,27–2,36] | 2,30 [ 2,27–2,36] | 0,7 |
Кальций ионизированный, ммоль/л## | 1,08 [ 1,05–1,11] | 1,08 [ 1,05–1,12] | 0,7 |
Фосфор, ммоль/л## | 1,17 [ 0,97–1,29] | 1,17 [ 1,10–1,31] | < 0,001* |
АЛТ, ЕД/л## | 12,00 [ 10,00–15,00] | 14,00 [ 10,00–18,00] | < 0,001* |
АСТ, ЕД/л## | 16,00 [ 14,00–19,00] | 17,00 [ 15,75–19,00] | < 0,001* |
ГГТ, Ед/л## | 16,0 [ 14,00–20,00] | 16,00 [ 13,75–20,00] | < 0,001* |
25(ОН)вит.D, нг/мл## | 30,80 [ 23,30–41,90] | 27,55 [ 22,18–35,50] | < 0,001* |
Натрий, ммоль/л# | 138,1 ± 3,0 | 138,1 ± 2,7 | 0,9 |
Калий, ммоль/л## | 4,6 [ 4,0–5,0] | 4,4 [ 4,1–5,1] | 0,007* |
Хлориды, ммоль/л# | 105,0 [ 102,0–106,0] | 105,0 [ 103,0–106,0] | 0,1 |
ФСГ, мМЕд/л## | 92,00 [ 91,00–95,00] | 5,85 [ 4,75–8,55] | < 0,001* |
ТТГ, мЕд/л## | 2,1 [ 1,4–3,6] | 1,9 [ 1,4–2,9] | 0,9 |
HbA1c, %# | 5,4 ± 0,4 | 5,4 ± 0,4 | 0,4 |
Длина теломер (кБ) ## | 10,0 [ 7,9–10,7] | 10,8 [ 10,0–13,1] | < 0,001* |
Данные представлены в виде средних и стандартного отклонения (#) и/или медианы и интерквартильного размаха (##), а также относительных частот (%).
* — различия показателей статистически значимы (p<0,05).
Алгоритм расчета данных — см. раздел «Статистический анализ».
Таблица 2. Результаты корреляционного анализа взаимосвязи ФСГ и длины теломер
Показатель | Характеристика корреляционной связи | ||
ρ | Теснота связи по шкале Чеддока | p | |
ФСГ — длина теломер | -0,434 | Умеренная | < 0,001 |
ОБСУЖДЕНИЕ
Несмотря на то что показательного улучшения репликативных (длина теломер) и биохимических маркеров у пациентов с ПНЯ на фоне заместительной терапии эстрадиолом не наблюдалось, обращает на себя внимание арифметически малая разница (вплоть до равенства) между статистически достоверными показателями как длины теломер (см. рисунок 1), так и биохимическими показателями (креатинин, фосфор, АЛТ, АСТ, ГГТ, калий) между основной и контрольной группами (см. табл. 1). Данный артефакт объясняется малым объемом выборки и ее неоднородностью (n=33+24=57). Не исключено, что в будущем для определения влияния половых стероидов на длину теломер необходим подбор пациенток с более длительной экспозицией эстрадиола, например, от 7 лет и более.
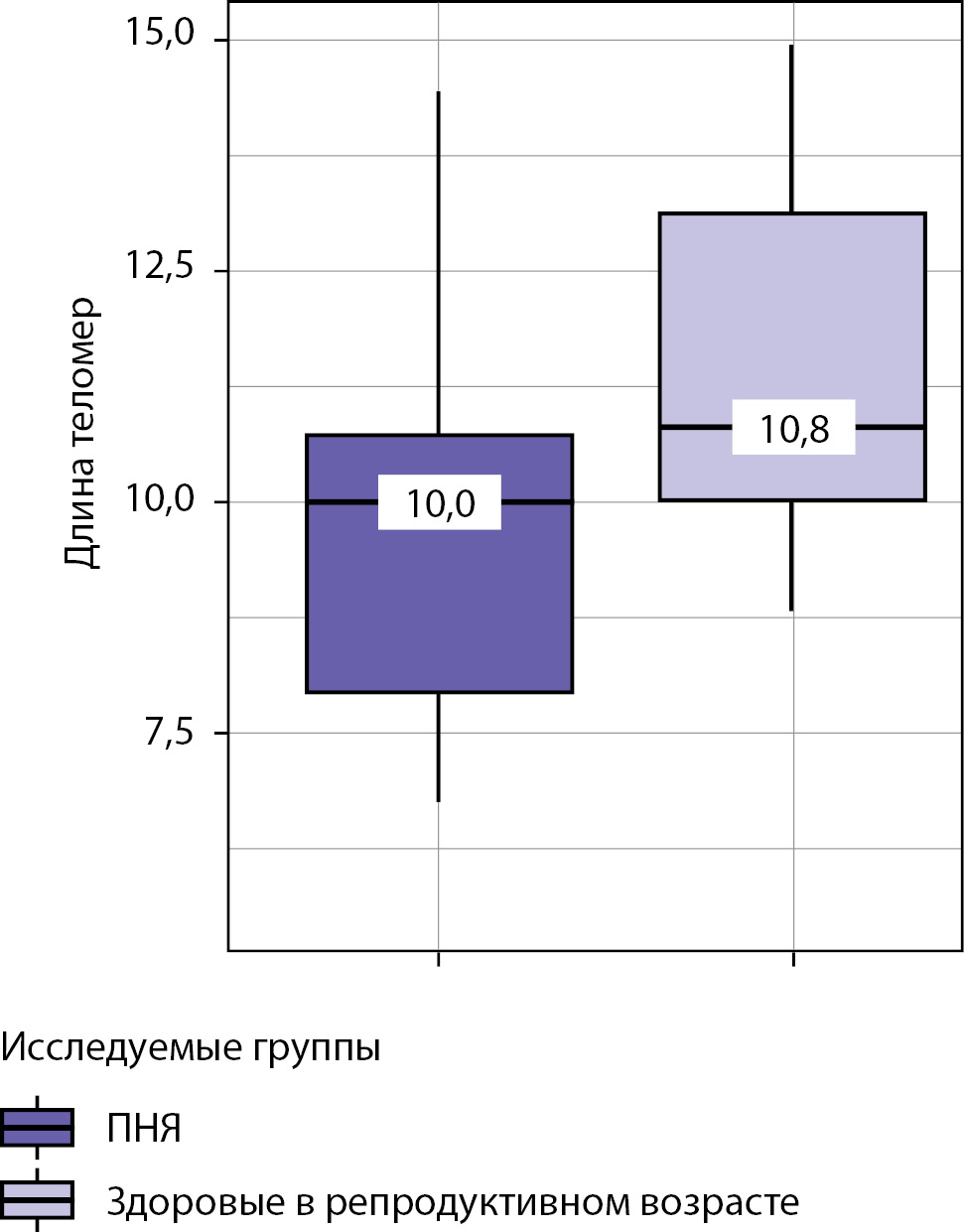
Рисунок 1. Анализ длины теломер в исследуемых группах.
Репрезентативность выборок
В оригинальном исследовании задействован относительно малый и неоднородный объем выборки контрольной и основной групп пациенток, что объясняется относительно редкой встречаемостью гипергонадотропного гипогонадизма аутоиммунного характера (ПНЯ) в общей популяции. Кроме того, на итоговый объем выборки серьезным образом повлияли финансово-техническая ограниченность исследования, принцип строгого соблюдения критериев включения и исключения (по данным анамнеза и катамнеза) во избежание искажения конечных результатов.
Сопоставление с другими публикациями
Так как ПНЯ характеризуется угрожающей тенденцией к особо стремительному развитию эстрогенного дефицита и фенотипа эстроген-дефицитной коморбидности, существует обоснованное мнение о необходимости назначения более высоких дозы эстрогенов (в отличие от пациенток в физиологической постменопаузе) для молодых больных, с поправкой на плохую переносимость (масталгия или мигрени) и патологические Эхо-признаки состояния эндометрия [2]; в этом случае должна быть произведена коррекция дозировки препарата в соответствии с индивидуальными потребностями и рисками. По мнению таких авторов, как Panay N. и соавт. [14], предпочтителен прием эстрадиола гемигидрата или эстрадиола валерата, так как они имеют более благоприятный защитный эффект на костную систему по сравнению с этинилэстрадиолом, входящим в состав комбинированных препаратов [14][15]. Для профилактики гиперплазии эндометрия у женщин, не подвергшихся гистерэктомии, эффективно использование микронизированного прогестерона или дидрогестерона [15]. Таким образом, не исключены усовершенствование и поиск других режимов заместительной терапии половыми стероидами для женщин с ПНЯ, обладающими как геро- (длина теломер), так и органопротекторными свойствами.
Клиническая значимость результатов
До последнего времени ПНЯ считалась необратимым состоянием, при котором шансы женщины как на осуществление репродуктивной функции, так и на здоровое долголетие считались практически равными нулю. Благодаря мультидисциплинарным изысканиям акушеров-гинекологов, эндокринологов в тактику ведения таких пациентов удалось внедрить заместительную терапию половыми стероидами — не только симптоматически, но и патогенетически обоснованный метод лечения. Поскольку ПНЯ сочетается с другими серьезными эндокринопатиями в составе аутоиммунного полигландулярного синдрома (1, 2 и 4 типов), то определение длины теломер само по себе является многообещающим методом скрининга, с целью определения персонализированной тактики диагностики и лечения.
Ограничения исследования
Главными факторами, ограничивающими масштаб и внешнюю валидность данного исследования, являлись относительная узость и неоднородность выборки, что объясняется высокой финансово-технической емкостью технологий определения длины теломер, доступных на настоящий момент специалистам в Российской Федерации.
Направления дальнейших исследований
В качестве показательного, статистически значимого пути получения биоматериала мы предполагаем в будущем проведение слепых плацебо-контролируемых рандомизированных клинических исследований с проведением биопсии (пункции) яичников для последующего определения длины теломер до и после многолетнего приема МГТ. Осуществление такого рода дизайна на практике пока остается затруднительным с этической и финансово-технической точки зрения.
ЗАКЛЮЧЕНИЕ
Результаты данного исследования являются показательным, но в то же время сами по себе не исчерпывающи. Окончательное решение вопроса о влиянии заместительной терапии половыми стероидами на длину теломер у женщин в рамках концепции «здорового долголетия» будет достигнуто при условии проведения многолетних двухмоментных слепых плацебо-контролируемых рандомизированных клинических исследований с применением различных модификаций и дозировок эстрадиола.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Исследование проводится в рамках Государственного задания: «Влияние эпигенетических факторов на течение менопаузы у женщин с эндокринопатиями аутоиммунного генеза в рамках формирования модели “здорового старения”», регистрационный номер АААА-121030100033-4.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Piedade KC, Spencer H, Persani L, Nelson LM. Optimizing fertility in primary ovarian insufficiency: case report and literature review. Front Genet. 2021;12. doi: https://doi.org/10.3389/fgene.2021.676262
2. Андреева Е.Н., Абсатарова Ю.С., Ахматова Р.Р., и др. Преждевременная недостаточность яичников: от основ патогенеза к перспективам в лечении // Вопросы гинекологии, акушерства и перинатологии. — 2021. — Т. 20. — №5 — С. 100-107. doi: https://doi.org/10.20953/1726-1678-2021-5-100-107
3. Albright F, Smith PH, Fraser R. A syndrome characterized by primary ovarian insufficiency and decreased stature. Am J Med Sci. 1942;204(5):625-648. doi: https://doi.org/10.1097/00000441-194211000-00001
4. Liu L, Wang H, Xu G, Liu L. Tet1 deficiency leads to premature ovarian failure. Front Cell Dev Biol. 2021;9(5):625-648. doi: https://doi.org/10.3389/fcell.2021.644135
5. Szeliga A, Calik-Ksepka A, Maciejewska-Jeske M, et al. Autoimmune Diseases in Patients with Premature Ovarian Insufficiency—Our Current State of Knowledge. Int J Mol Sci. 2021;22(5):2594. doi: https://doi.org/10.3390/ijms22052594
6. Shahabi P, Asadzadeh S, Bannazadeh Baghi H, Sadeghzadeh Oskouei B. Pregnancy after mumps: a case report. J Med Case Rep. 2019;13(1):379. doi: https://doi.org/10.1186/s13256-019-2271-9
7. Wilkins J, Al-Inizi S. Premature ovarian insufficiency secondary to COVID-19 infection: An original case report. Int J Gynaecol Obstet. 2021;154(1):179-180. doi: https://doi.org/10.1002/ijgo.13719
8. Armeni E, Paschou SA, Goulis DG, Lambrinoudaki I. Hormone therapy regimens for managing the menopause and premature ovarian insufficiency. Best Pract Res Clin Endocrinol Metab. 2021;35(6):101561. doi: https://doi.org/10.1016/j.beem.2021.101561
9. Gurrala R, Kilanowski-Doroh IM, Hutson DD, et al. Alterations in the estrogen receptor profile of cardiovascular tissues during aging. Geroscience. 2021;43(1):433-442. doi: https://doi.org/10.1007/s11357-021-00331-3
10. Liu B, He Y, Wang Y, et al. Structure of active human telomerase with telomere shelterin protein TPP1. Nature. 2022;604(7906):578-583. doi: https://doi.org/10.1038/s41586-022-04582-8
11. Roake CM, Artandi SE. Regulation of human telomerase in homeostasis and disease. Nat Rev Mol Cell Biol. 2020;21(7):384-397. doi: https://doi.org/10.1038/s41580-020-0234-z
12. Gaydosh L, Mitchell C, Notterman D, et al. Demographic and developmental patterns in telomere length across adolescence. Biodemography Soc Biol. 2020;66(3-4):208-219. doi: https://doi.org/10.1080/19485565.2021.1983758
13. Turner K, Vasu V, Griffin D. Telomere biology and human phenotype. Cells. 2019;8(1):73. doi: https://doi.org/10.3390/cells8010073
14. Panay N, Anderson RA, Nappi RE, et al. Premature ovarian insufficiency: an International Menopause Society White Paper. Climacteric. 2020;23(5):426-446. doi: https://doi.org/10.1080/13697137.2020.1804547
15. Turner K, Vasu V, Griffin D. ESHRE Guideline: management of women with premature ovarian insufficiency. Hum Reprod. 2016;31(5):926-937. doi: https://doi.org/10.1093/humrep/dew027
Об авторах
Р. К. МихеевРоссия
Михеев Роберт Константинович
117036, Москва, ул. Дмитрия Ульянова, д. 11
Конфликт интересов:
отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
Е. Н. Андреева
Россия
Андреева Елена Николаевна - доктор медицинских наук, профессор.
Москва
Конфликт интересов:
отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
О. Р. Григорян
Россия
Григорян Ольга Рафаэльевна - доктор медицинских наук, профессор.
Москва
Конфликт интересов:
отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
Е. В. Шереметьева
Россия
Шереметьева Екатерина Викторовна, кандидат медицинских наук.
Москва
Конфликт интересов:
отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
Ю. С. Абсатарова
Россия
Абсатарова Юлия Сергеевна - кандидат медицинских наук.
Москва
Конфликт интересов:
отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
Е. В. Логинова
Россия
Логинова Екатерина Владимировна - кандидат медицинских наук.
Москва
Конфликт интересов:
отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
Дополнительные файлы
|
|
1. Рисунок 1. Анализ длины теломер в исследуемых группах. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(107KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Михеев Р.К., Андреева Е.Н., Григорян О.Р., Шереметьева Е.В., Абсатарова Ю.С., Логинова Е.В. Репликативные и биохимические аспекты старения у женщин с преждевременной недостаточностью яичников. Проблемы Эндокринологии. 2023;69(2):92-98. https://doi.org/10.14341/probl13253
For citation:
Mikheev R.K., Andreeva E.N., Grigoryan O.R., Sheremetyeva E.V., Absatarova Yu.S., Loginova E.V. Replicative and biochemical ageing features among females with primary ovarian insufficiency. Problems of Endocrinology. 2023;69(2):92-98. (In Russ.) https://doi.org/10.14341/probl13253

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).








































.jpg)


