Перейти к:
Синдром первичной резистентности к глюкокортикоидам: сложности диагностики (клинический случай и краткий обзор)
https://doi.org/10.14341/probl13321
Аннотация
Синдром первичной резистентности к глюкокортикоидам (OMIM 615962) — редкое заболевание, характеризующееся генерализованной либо парциальной нечувствительностью органов-мишеней к глюкокортикоидам (ГК). Компенсаторная активация гипоталамо-гипофизарно-надпочечниковой оси приводит к развитию ряда патологических состояний, обусловленных гиперстимуляцией надпочечников. Клинические проявления варьируют от бессимптомного течения до серьезных последствий избытка минералокортикоидов и/или андрогенов. В настоящее время установлена лишь одна причина синдрома резистентности к ГК — инактивирующие мутации в гене рГК NR3C1. Мы представляем клинический случай с периодом наблюдения в 3,5 года, когда клинико-лабораторная картина соответствовала диагнозу синдрома резистентности к глюкокортикоидам, однако мутаций в гене NR3C1 не было обнаружено, а нечувствительность органов-мишеней к ГК была доказана по результатам функционального исследования.
Для цитирования:
Ларина И.И., Маказан Н.В., Иващенко К.В., Платонова Н.М., Орлова Е.М., Карева М.А., Созаева Л.С., Юкина М.Ю., Тюльпаков А.Н., Духанин А.С., Шимановский Н.Л., Трошина Е.А. Синдром первичной резистентности к глюкокортикоидам: сложности диагностики (клинический случай и краткий обзор). Проблемы Эндокринологии. 2024;70(1):30-37. https://doi.org/10.14341/probl13321
For citation:
Larina I.I., Makazan N.V., Ivashchenko K.V., Platonova N.M., Orlova E.M., Kareva M.A., Sozaeva L.S., Yukina M.Yu., Tulpakov A.N., Dukhanin A.S., Shimanovskii N.L., Troshina E.A. Primary Generalized Glucocorticoid Resistance: a case report. Problems of Endocrinology. 2024;70(1):30-37. (In Russ.) https://doi.org/10.14341/probl13321
АКТУАЛЬНОСТЬ
Синдром первичной резистентности к глюкокортикоидам (OMIM 615962) характеризуется высоким уровнем кортизола и АКТГ крови в отсутствие характерных кушингоидных черт. При этом могут возникать гипертония, гиперандрогенемия, гипокалиемия, гипогликемия. Каждое проявление синдрома само по себе неспецифично. Когда же резистентность парциальная и клиническая картина стерта, заподозрить и диагностировать это заболевание еще сложнее. При синдроме выявляется гетерозиготная мутация в гене, кодирующем рецептор к ГК (рГК), — NR3C1. Вероятно, это не единственная причина нечувствительности органов-мишеней к ГК. Мы приводим клинический случай, в котором клинико-лабораторные данные соответствовали первичной резистентности к ГК, но мутации в NR3C1 выявлено не было. Для подтверждения нечувствительности к ГК были использованы функциональные методы исследования. Это первое описание подобного случая в России.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование уровня АКТГ, кортизола, общего тестостерона: иммуноферментный анализ периферической крови.
Исследование уровня ФСГ, ЛГ, эстрадиола, общего тестостерона, АКТГ, АТ к р.ТТГ, ТТГ, свТ3, свТ4, АТ-ТПО, кортизола суточной мочи: хемилюминесцентный иммуноанализ.
Исследование уровня кортизола, АТ к р.ТТГ: электрохемилюминесцентный анализ периферической крови.
Исследование спектра стероидных гормонов и их предшественников: мультистероидный анализ периферической крови.
Молекулярно-генетическое исследование гена NR3C1: полное секвенирование гена по Сэнгеру.
Исследование взаимодействия рГК с кортизолом и дексаметазоном в лимфоцитах периферической крови: радионуклидный анализ в лаборатории нуклеиновых кислот Института молекулярной биологии РАН. Используя меченные тритием кортизол и дексаметазон (3Н-кортизол и 3Н-дексаметазон соответственно), были определены параметры глюкокортикоидной рецепторной системы (аффинность и концентрация рецепторов глюкокортикоидов в клетках), проведено сравнительное исследование взаимодействия природного кортизола и синтетического препарата дексаметазона с рецепторами глюкокортикоидов, изучено комплексообразование ГК с ядрами клеток, определено соотношение между количеством активированной (трансформированной) и неактивной форм цитозольных гормон-рецепторных комплексов (ГРК) на основе измерения доли ядерных рГК от общего пула рецепторов глюкокортикоидов в клетках. Аффинность и концентрация рецепторов глюкокортикоидов в клетках проводилась на цельных лимфоцитах. Для оценки внутриядерного связывания высокомеченных синтетических глюкокортикоидов лимфоциты подвергали гипоосмотическому лизису, затем с помощью дифференциального центрифугирования получали ядра лимфоцитов, в которых измеряли содержание гормон-рецепторных комплексов.
ОПИСАНИЕ СЛУЧАЯ И РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Пациентка — девушка 18 лет, наблюдавшаяся в ФГБУ НМИЦ эндокринологии в течение трех лет.
Пациентка была впервые направлена в ФГБУ НМИЦ эндокринологии в возрасте 15 лет с подозрением на болезнь Иценко-Кушинга. Диагноз заподозрили по месту жительства при обследовании по поводу опсоменореи. С момента менархе в 11 лет продолжительность менструального цикла варьировалась от 30 до 90 дней. Также девушку беспокоила угревая сыпь и избыточный рост волос на теле. Угревая сыпь появилась в 5 лет, а темные волосы на руках, ногах и спине — в 11 лет. Было выявлено повышение утреннего кортизола крови до 2152,9 нмоль/л на фоне высоко-нормального уровня АКТГ крови, а также повышение общего тестостерона сыворотки крови (19,4 нмоль/л) и 17-ОН-прогестерона сыворотки крови (22,5 нмоль/л). По результатам МРТ было заподозрено наличие микроаденомы гипофиза. С этими данными девушка была направлена в ФГБУ НМИЦ эндокринологии.
При первичном осмотре в ФГБУ НМИЦ эндокринологии: девушка 15 лет, ростом 163,9 см (SDS роста +0,33), массой тела 61,4 кг (SDS ИМТ +0,93), нормального телосложения. На коже лица, туловища, конечностей — диффузная угревая сыпь (элементы в различной стадии развития), на коже туловища бляшки до 2 см в диаметре, состоящие из мелкопапулезных воспалительных элементов, размещающиеся с образованием гиперпигментированных пятен, 6-й степени по шкале Кука [4]. Рост волос в андроген-зависимых зонах — 6 баллов по шкале Ферримана-Галлвея (избыточный рост волос по белой линии живота (2 балла) периареолярной области (1 балл), бедер (3 балла). Артериальное давление 105/65 мм рт.ст. На момент поступления в отделение задержка менструального цикла более 6 месяцев.
При обследовании подтверждена гиперандрогенемия и гиперкортизолемия. Электролиты крови, активность ренина плазмы и альдостерон — в пределах нормальных значений. По результатам мультистероидного анализа не было получено данных относительно дефектов стероидогенеза или избыток минералокортикоидов. Ночной подавляющий тест с 1 мг дексаметазона привел к снижению уровня кортизола в суточной моче, при этом в крови снижения кортизола достигнуто не было. На фоне большого теста с дексаметазоном секреция кортизола крови снизилась более чем на 60% от изначального. При проведении МРТ головного мозга была выявлена умеренная гиперплазия и диффузная неоднородность структуры аденогипофиза.
Результаты обследования представлены в таблице 1.
Таблица 1. Результаты обследования в возрасте 15 лет
|
Показатель |
Результат |
Референсные значения |
|
Показатели гормонального профиля |
||
|
17-ОН-прогестерон, нмоль/л |
6,5 |
0,8–7,0 |
|
ДГЭА-С, мкмоль/л |
10,00 |
0,92–7,60 |
|
Общий тестостерон, нмоль/л |
5,0 |
0,7–1,8 |
|
Эстрадиол, пмоль/л |
184,9 |
97–592 |
|
ЛГ, Ед/л |
4,2 |
2,6–12,1 |
|
ФСГ, Ед/л |
4,3 |
1,9–11,7 |
|
Суточный ритм секреции кортизола и АКТГ |
||
|
Показатель |
Результат |
|
|
07:00 |
23:00 |
|
|
Кортизол, нмоль/л |
643,6 |
46,2 |
|
АКТГ, пг/мл |
71,5 |
62,8 |
|
Ночной тест с 1 мг дексаметазона |
||
|
Базально |
На фоне дексаметазона |
|
|
Кортизол (сыворотка), нмоль/л |
643,6 |
663,8 |
|
Малая проба с дексаметазоном (2 дня 2 мг/сут) |
||
|
Базально |
На фоне дексаметазона |
|
|
Кортизол (сыворотка), нмоль/л |
663,8 |
719,0 |
|
Общий тестостерон, нмоль/л |
5,0 |
3,0 |
|
Свободный кортизол в моче, нмоль/сут |
2091,0 |
512,0 |
|
Большая проба с дексаметазоном (2 дня 8 мг/сут) |
||
|
Базально |
На фоне дексаметазона |
|
|
Кортизол (сыворотка), нмоль/л |
719,0 |
167,4 |
|
АКТГ, пг/мл |
71,5 |
44,8 |
|
Общий тестостерон, нмоль/л |
3,0 |
1,0 |
|
Свободный кортизол в моче, нмоль/сут |
567 |
156 |
Исследование минеральной плотности костей исключило наличие остеопороза. По данным УЗИ органов малого таза, размеры матки и яичников соответствовали возрастной норме. В связи с отсутствием убедительных данных относительно центрального генеза гиперкортицизма и клинических проявлений синдрома Кушинга была выбрана наблюдательная тактика.
Повторное обследование в 15,7 года не выявило изменений в клинической картине и лабораторных данных. Заподозрен синдром резистентности к глюкокортикоидам и назначено пробное лечение дексаметазоном в начальной дозе 0,5 мг. На фоне терапии дексаметазоном отмечалось снижение уровня андрогенов крови (таблица 2).
Таблица 2. Показатели андрогенов крови
на фоне назначения терапии дексаметазоном 0,5 мг в сутки
|
Показатель |
До лечения |
7 дней терапии дексаметазоном 0,5 мг/сут |
Референсный интервал |
|
ДГЭА-С, мкмоль/л |
10,39 |
5,7 |
0,92–7,60 |
|
Общий тестостерон, нмоль/л |
5,27 |
2,5 |
0,7–1,8 |
Терапия дексаметазоном продолжалась в течение года, с 15,7 до 16,7 года, суточная доза не превышала 0,75 мг в сутки. Динамика уровней общего тестостерона и ДГЭА-С на фоне терапии дексаметазоном представлена в таблице 3.
Таблица 3. Показатели андрогенов крови на фоне терапии дексаметазоном
|
Длительность терапии Показатели |
5 мес |
7 мес |
10 мес |
11 мес |
12 мес |
1 мес без лечения |
|
Тестостерон, нмоль/л |
2,5 |
18,3 |
12,3 |
6,8 |
5,4 |
24,2 |
|
ДГЭА-С, мкмоль/л |
7,70 |
- |
- |
- |
11,0 |
- |
|
Свободный кортизол в моче, нмоль/сут |
833,0 |
- |
- |
- |
4400,0 |
- |
|
Доза дексаметазона, мг/сут |
0,5 |
- |
0,75 |
- |
отмена |
При наблюдении в динамике сохранялись нарушения менструального цикла. На фоне избыточной массы тела (SDS ИМТ +1,4) овал лица округлился, что было расценено как стертое проявление синдрома Кушинга. Дексаметазон был отменен в 16,7 года.
С 16 лет, одновременно с приемом дексаметазона, был назначен нестероидный антагонист андрогеновых рецепторов — флутамид. После инициации терапии флутамидом проявления угревой сыпи значительно уменьшились. С 16,9 года менструальный цикл стал регулярным. В таблице 4 приведены сводные данные о клинических проявлениях гиперандрогении с указанием проводимого лечения.
Таблица 4. Данные менструального цикла и выраженности угревой сыпи
в период наблюдения с 15 до 17,3 года
|
Период жизни |
Терапия (мг в сутки) |
Длительность менструального цикла (д.м.ц.) в днях |
Интенсивность проявлений угревой сыпи (шкал Кука) |
|
15–15,7 года |
- |
Вторичная аменорея |
6 |
|
15,7–16,1 года |
Дексаметазон 0,5 |
Д.м.ц. с 16 лет 27 [ 24; 40] |
6 |
|
16,1–16,6 года |
Дексаметазон 0,75+ флутамид 250 |
Д.м.ц. 39 [ 29; 50] |
2 |
|
16,6–16,9 года |
Дексаметазон 0,75 |
Отсутствие менструаций в указанный период |
4 |
|
16,9–17,3 года |
Флутамид 250 |
Д.м.ц. 33 [ 31; 35] |
2 |
На протяжении всего периода наблюдения у пациентки не отмечалось клинических признаков гиперкортицизма или избытка минералокортикоидов. Вес был в пределах нормы, без патологического распределения подкожно-жировой клетчатки. Сохранялось отсутствие снижения минеральной плотности костей по данным рентгенденситометрии в динамике. Отмечались нормальные показатели АД, электролиты и глюкоза крови были в пределах референсных значений. Тонкие стрии, выявленные при первичном осмотре в 15 лет, располагались в нетипичных для синдрома Кушинга местах и не прогрессировали в динамике.
Помимо функциональных нарушений гипоталамо-гипофизарно-надпочечниковой оси с момента начала наблюдения, отмечалась еще одна особенность — тенденция к снижению тиреотропного гормона (ТТГ). Уровень свободного тироксина (свТ4) варьировал от нормальных до высоких значений, клинических признаков тиреотоксикоза не отмечалось. Значения аутоантител к тиреопероксидазе были в пределах нормы, а уровень антител к рТТГ однократно определялся в «серой зоне» — 1,18 Ед/л. Объем щитовидной железы оставался в пределах нормы. В правой доле отмечалось образование 0,5 см в диаметре без динамики в размерах. Функциональная активность образования была исключена по данным сцинтиграфии щитовидной железы с 99мТс-Технетрилом — индекс захвата технеция составил 0,3%.
В таблице 5 приведены данные о морфофункциональном состоянии щитовидной железы в динамике.
Таблица 5. Показатели морфофункционального состояния щитовидной железы в динамике
|
Данные гормонального профиля и УЗИ |
Возраст в годах |
||||||||||
|
15,5 |
16 |
16,3 |
16,5 |
16,6 |
16,7 |
16,8 |
16,9 |
17,3 |
17,4 |
23 |
|
|
ТТГ, мМЕ/л |
0,3 |
0,5 |
0,05 |
0,12 |
0,05 |
0,19 |
0,105 |
0,153 |
0,056 |
0,116 |
0,475 |
|
свТ4, пмоль/л (референсное значение 10–25) |
14,5 |
12,7 |
35 |
29,9 |
19,8 |
25,8 |
3,49 |
11,1 |
37,7 |
12,2 |
12,17 |
|
свТ3, пмоль/л (референсное значение 4–8,5) |
9,3 |
11,14 |
3,5 |
3,57 |
3,48 |
||||||
|
УЗИ щитовидной железы |
В правой доле в нижнем сегменте определяется жидкостная зона д=0,5 см |
||||||||||
|
Объем щитовидной железы, мл |
16,8 |
18,8 |
12,8 |
20,1 |
|||||||
Для подтверждения диагноза синдрома резистентности к ГК было проведено молекулярно-генетическое исследование гена NR3C1 и функциональное исследование лимфоцитов периферической крови. Секвенирование гена NR3C1 не выявило патологически значимых изменений нуклеотидной последовательности. Параметры связывания глюкокортикоидов с рГК лимфоцитами периферической крови пациентки существенно не отличались от таковых у контрольных образцов (р <0,05). Результаты радиолигандного анализа связывания 3-Н кортизола лимфоцитами представлены в таблице 6 и на рисунках 1 и 2.
Таблица 6. Параметры рецепторного связывания 3Н-кортизола (К)
и 3Н-дексаметазона (Д) лимфоцитами периферической крови (М±m)
|
Параметры специфического связывания |
||
|
Кд, нМ |
Вмакс, фмоль/10⁶клеток (среднее количество рецепторов на одну клетку) |
|
|
Резистентность |
26,0±1,3 (К) 5,1±0,6 (Д) |
13,6±1,7 (К) (9 133) 16,9±1,8 (Д) (8 988) |
|
Контроль |
24,2±0,8 (К) 5,7±0,3 (Д) |
15,7±1,4 (К) (9 133) 14,9±1,5 (Д) (8 988) |
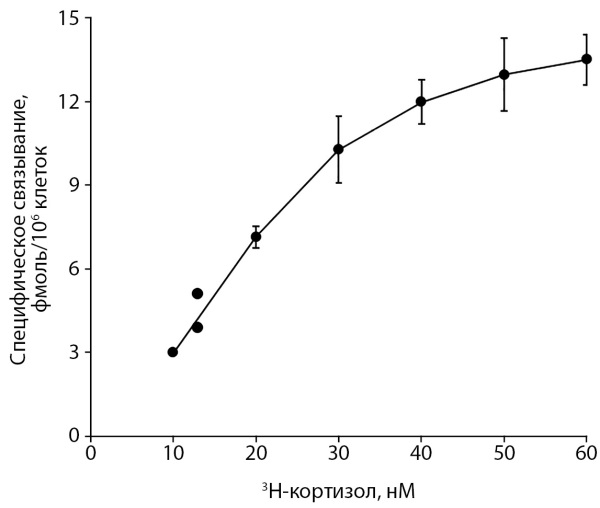
Рисунок 1. Параметры связывания рГК лимфоцитами
периферической крови пациентки
высокомеченным синтетическим глюкокортикоидом 3Н-кортизолом,
представленные в координатах Скэтчарда [5].
Кривая специфического связывания (связывание лиганда с рГК)
имеет характерный вид изотермы насыщения,
что свидетельствует о наличии в клетках
высокоспецифических участков связывания гормона.
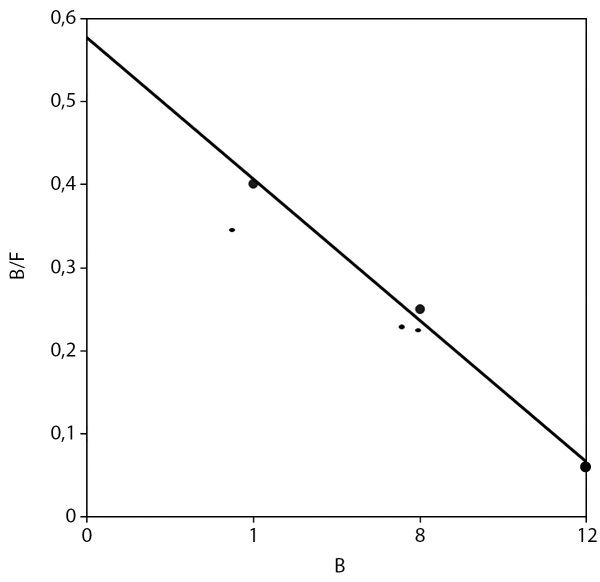
Рисунок 2. Соотношение количества связанного 3H-кортизола (B)
и количества свободного (F).
При оценке количества активных гормон-рецепторных комплексов было выявлено сниженное содержание рГК в ядрах лимфоцитов пациентки в сравнении с результатами контрольных образцов. Для 3H-дексаметазона уменьшение составило около 25%, а в случае с 3Н-кортизолом количество ядерных ГР было снижено практически в 2 раза (50%). При этом определение соотношения α-и β изоформ рГК не выявило значимых изменений в их уровне экспрессии. В таблице 7 приведены сведения о содержании цитозольных, ядерных рецепторов глюкокортикоидов в лимфоцитах, а также вычисленное значение соотношения количества ядерных/цитозольных рецепторов.
Таблица 7. Соотношение между цитозольными
и ядерными рецепторами глюкокортикоидов лимфоцитов периферической крови
|
Содержание рецепторов, фмоль/10⁵ клеток |
Соотношение |
|||
|
Цитозоль |
Ядро |
Общее |
||
|
Резистентность |
1,1±0,2 0,6±0,1 |
0,3±0,1 0,9±0,1 |
1,4±0,2 (К) 1,7±0,2 (Д) |
0,27 1,5 |
|
Контроль |
0,96±0,2 0,45±0,1 |
0,6±0,1 1,1±0,1 |
1,6±0,2 (К) 1,5±0,2 (Д) |
0,63 2,44 |
ОБСУЖДЕНИЕ
Регуляция гипоталамо-гипофизарно-надпочечниковой оси происходит по механизму отрицательной обратной связи. Снижение кортизола в крови активирует секрецию кортикотропина, тогда как гиперкортизолемия ингибирует синтез кортикотропина [6]. Резистентность к глюкокортикоидам оказывает на функцию гипоталамо-гипофизарно-надпочечниковой оси такое же действие, как низкий уровень кортизола крови — повышается секреция кортикотропина, активируется синтез АКТГ. Это приводит к гиперфункции надпочечников, повышается секреция кортизола, а также — параллельно — андрогенов и минералокортикоидов как побочных продуктов чрезмерно стимулированного стероидогенеза [1][2][7].
Синдром первичной резистентности к глюкокортикоидам был впервые описан в 1976 г. Vingerhoeds A.C. у пациента с гиперкортизолемией и высоким АКТГ. На протяжении трех лет наблюдения отмечались гипокалиемия и артериальная гипертония без характерных проявлений синдрома Кушинга [1]. В 1982 г. Chrousos G.P., Vingerhoeds A.C. et al. провели повторное обследование пациента (пациент 1) и членов его семьи. У сына пациента 1 выявили асимптоматическое повышение кортикостероидов с минералокортикоидной активностью (кортикостерона и дезоксикортикостерона). Резистентность к ГК была доказана на основании сниженного ответа фибробластов на дексаметазон и в дальнейшем подтверждена молекулярно-генетически — детекцией патогенного варианта в гене рецептора к ГК NR3C1 (nuclear receptor subfamily 3, group c, member 1, OMIM 138040) [2][3][19].
У описываемой пациентки отмечалась гиперкортизолемия и высокий уровень АКТГ без характерных для синдрома Кушинга изменений внешности и остеопороза. Не было избытка минералокортикоидов, но подобные варианты течения синдрома резистентности к ГК были описаны ранее [9]. Согласно данным литературы, достичь клинической компенсации заболевания у пациентов с резистентностью к ГК удается при назначении дексаметазона. Эффективность этой терапии у нашей пациентки была сомнительна. Возможно, это было связано с недостаточной дозой препарата. Суточная доза дексаметазона в нашем случае не превышала 0,5–0,75 мг/сут. По данным литературы, средние суточные дозы дексаметазона при синдроме резистентности к ГК варьировали от 1 до 3 мг/сут [8]. Кроме того, по данным литературы, даже легкие и субклинические варианты течения заболевания требовали больших доз дексаметазона для достижения компенсации, чем примененные у пациентки [2][8][9][20]. Мы не стали повышать дозу дексаметазона и вовсе отменили этот препарат, так как заподозрили возникновение побочных эффектов терапии (появилась округлость щек, которую расценили как матронизм).
Поскольку пациентку беспокоили проявления гиперандрогении, а электролитных расстройств и артериальной гипертонии у нее не было, пробно назначили терапию антагонистами андрогеновых рецепторов — флутамидом. На этом фоне нормализовался менструальный цикл и уменьшились проявления угревой сыпи. За два года наблюдения на фоне терапии флутамидом сохранялся хороший терапевтический эффект, осложнений терапии не отмечалось. Тем не менее рассматривается возвращение в будущем к терапии дексаметазоном. Целью такой терапии является не только нивелирование клинических проявлений, но и снижение уровня АКТГ. Известны случаи развития аденомы гипофиза у пациентов с тяжелым течением синдрома резистентности к ГК на фоне хронической гиперстимуляции секреции АКТГ [10]. Однако развитие аденом гипофиза описано у больных с тяжелой резистентностью к АКТГ, а у данной пациентки отмечаются высоконормальные или слегка повышенные уровни АКТГ, в связи с чем в настоящее время выбрана наблюдательная тактика в сочетании с терапией флутамидом.
Отказаться от дексаметазона как метода лечения в нашем случае заставили также сомнения в диагнозе — отрицательный результат молекулярно-генетического исследования, сочетание с неясным периодическим тиреотоксикозом без клинических проявлений.
В литературе есть описание пяти случаев синдрома резистентности к глюкокортикоидам без мутаций в гене NR3C1 [13]. У четырех пациентов исследовали функциональную активность рГК в моноцитарных лейкоцитах, и во всех случаях она была снижена. Отмечалось сниженное количество рецепторов, нарушенные аффинность и способность дексаметазона ингибировать митогениндуцированную клеточную пролиферацию. Мы также провели подобное исследование у нашей пациентки. В лаборатории нуклеиновых кислот Института молекулярной биологии РАН оценили показатели функциональной активности рГК в лейкоцитах периферической крови. Нормальные показатели связывания рГК с лигандом, нормальная концентрация рГК, отсутствие нарушений в соотношении α- и β-изоформ рГК исключили патологию собственно рГК как причины синдрома резистентности. В то же время были получены данные о нарушении внутриклеточной передачи сигнала от глюкокортикоидов на этапе переноса комплекса ГК-рГК из цитозоля в ядро клетки-мишени.
Сделать предположения о возможных причинах заболевания в отсутствие патологии рГК позволяют результаты исследований по оценке значимости белков-шаперонов в развитии синдрома резистентности к ГК. Эти исследования обычно проводятся у пациентов с аутоиммунными заболеваниями, нечувствительными к терапии ГК [11][12]. На этом уровне сигнальной трансдукции функционально значимыми являются молекулы, участвующие в трансмембранном переносе рецепторов и защищающие их от ферментативной деградации. В случае с рГК роль молекулярных шаперонов выполняют иммунофиллины (FK506-Binding Immunophillin) FKBP51 и FKBP52 — нарушения в их соотношении приводят к развитию либо ГК резистентности, либо гиперчувствительности [1]. Кроме иммунофиллинов, причиной синдрома резистентности к ГК может быть патология других внутриклеточных белков-шаперонов — белков теплового шока (heat shock protein — HSP90 и HSP70) [15]. Тем не менее возможно, что и в нашем клиническом случае изменение комплексообразования с перечисленными белками-партнерами стало причиной заболевания.
Данные клинических исследований свидетельствуют о супрессивном действии ГК на тиреоидную функцию путем как транс-, так и парагипофизарного взаимодействия [17][18]. Это противоречит длительно наблюдаемому транзиторному тиреотоксикозу у пациентки. Возможно предположить связь нестабильного субклинического тиреотоксикоза с основным заболеванием за счет нарушения механизмов регуляции функции щитовидной железы глюкокортикоидами. Патология белков-шаперонов, играющих роль в передаче сигнала от ТТГ к тиреоцитам [16], также могла бы объяснить связь резистентности к ГК с необычным функциональным нарушением щитовидной железы в виде гипертироксинемии при отсутствии проявлений тиреотоксикоза, однако для подтверждения этой гипотезы необходимы дальнейшие исследования.
ЗАКЛЮЧЕНИЕ
Синдром первичной резистентности к глюкокортикоидам — это крайне редкое заболевание, характеризующееся нарушением внутриклеточной передачи сигнала от глюкокортикоидов к клеткам-мишеням на уровне рГК или в другом звене передачи сигнала с рецептора. Компенсаторная активация гипоталамо-гипофизарно-надпочечниковой оси приводит к гиперандрогении и гиперсекреции кортикостероидов с минералокортикоидной активностью. Вариабельность тяжести и неспецифичность проявлений синдрома резистентности к ГК может затруднить своевременную диагностику заболевания. При соответствии клинических и лабораторных данных обследования синдрому резистентности к ГК рекомендуется проводить исследование гена рГК NR3C1 как ведущей причины развития синдрома. Отсутствие мутаций в NR3C1 не исключает диагноза, доказать нарушение чувствительности к ГК в этом случае возможно с помощью функционального исследования рГК.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена в рамках государственного задания Минздрава России «Разработка новых технологий диагностики и мониторинга опухолей коры надпочечников с использованием метаболомных и протеомных технологий», рег. No 123021300098-7.
Согласие пациента. Пациентка добровольно подписала информированное согласие на публикацию персональной медицинской информации в обезличенной форме в журнале «Проблемы эндокринологии».
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Благодарности. Выражаем благодарность Орловой Елизавете Михайловне и Каревой Марии Андреевне за помощь в подготовке научной публикации.
Список литературы
1. Vingerhoeds AC, Thijssen JH, Schwarz F. Spontaneous hypercortisolism without Cushing’s syndrome. J Clin Endocrinol Metab. 1976; 43(5):1128–33. doi: https://doi.org/10.1210/jcem-43-5-1128
2. Chrousos GP, Vingerhoeds A, Brandon D, et al. Primary cortisol resistance in man. A glucocorticoid receptor-mediated disease. J Clin Invest. 1982; 69(6):1261–9. doi: https://doi.org/10.1172/jci110565
3. Hurley DM, Accili D, Stratakis CA, et al. Point mutation causing a single amino acid substitution in the hormone binding domain of the glucocorticoid receptor in familial glucocorticoid resistance. J Clin Invest. февраль 1991; 87(2):680–6. doi: https://doi.org/110.1172/JCI115046
4. Cook CH, Centner RL, Michaels SE. An acne grading method using photographic standards. Arch Dermatol. 1979 г.; 115(5):571–5
5. Scatchard G. The attractions of proteins for small molecules and ions. Ann N Y Acad Sci. 1 May 1949 г.; 51(4):660–72. doi: https://doi.org/10.1111/j.1749-6632.1949.tb27297.x
6. Dallman MF, Akana SF, Levin N, et al. Corticosteroids and the control of function in the hypothalamo-pituitary-adrenal (HPA) axis. Ann N Y Acad Sci. 1994; 746:22-31; discussion 31-32, 64–7
7. Nicolaides NC., KinoT., ChrousosG., et al. Primary Generalized Glucocorticoid Resistance or Chrousos Syndrome. In K.R. Feingold (Eds.) et. al. Endotext. MDText.com, Inc. 2017. Available from: http://www.ncbi.nlm.nih.gov/books/NBK278930
8. Nicolaides NC, Charmandari E. Chrousos syndrome: from molecular pathogenesis to therapeutic management. Eur J Clin Invest. 2015; 45(5):504–14. doi: https://doi.org/10.1111/eci.1242
9. Lamberts SW, Poldermans D, Zweens M, et al. Familial cortisol resistance: differential diagnostic and therapeutic aspects. J Clin Endocrinol Metab. 1986; 63(6):1328–33. doi: https://doi.org/10.1210/jcem-63-6-1328
10. Karl M, Lamberts SW, Koper JW, et al. Cushing’s disease preceded by generalized glucocorticoid resistance: clinical consequences of a novel, dominant-negative glucocorticoid receptor mutation. Proc Assoc Am Physicians. 1996; 108(4):296–307
11. Теплюк Н.П., Духанин А.С., Огурцов С.И., и соавт. Влияние преднизолона на обмен вторичных мессенджеров в лимфоцитах больных при истинной акантолитической пузырчатке / В кн.: Материалы ХII Российского национального конгресса «Человек и лекарство». Москва, 18–22 апреля 2005 г. — М.; 2005: 259.
12. Духанин А.С., Теплюк Н.П., Лепехова А.А., и соавт. Биохимические аспекты стероидной резистентности при аутоиммунной пузырчатке // Российский журнал кожных и венерических болезней. — 2014; 17 (3), 25–31. doi: https://doi.org/10.17816/dv36873
13. Huizenga NA, de Lange P, Koper JW, et al. Five patients with biochemical and/or clinical generalized glucocorticoid resistance without alterations in the glucocorticoid receptor gene. J Clin Endocrinol Metab. 2000; 85(5):2076–81
14. Wochnik GM, Rüegg J, Abel GA, et al. FK506-binding proteins 51 and 52 differentially regulate dynein interaction and nuclear translocation of the glucocorticoid receptor in mammalian cells. J Biol Chem. 2005; 280(6):4609–16. doi: https://doi.org/10.1074/jbc.M407498200
15. Matysiak M, Makosa B, Walczak A, Selmaj K. Patients with multiple sclerosis resisted to glucocorticoid therapy: abnormal expression of heat-shock protein 90 in glucocorticoid receptor complex. Mult Scler Houndmills Basingstoke Engl. 2008; 14(7):919–26. doi: https://doi.org/10.1177/1352458508090666
16. Ginsberg J, Labedz T, Brindley DN. Phosphorylation of heat shock protein-90 by TSH in FRTL-5 thyroid cells. Thyroid Off J Am Thyroid Assoc. 2006; 16(8):737–42. 26. doi: https://doi.org/10.1089/thy.2006.16.737
17. Cai R, Zhou W, Jiang L, et al. Association between thyroid function and serum cortisol in cortisol-producing adenoma patients. Endocrine. 2020. 69(1):196-203. doi: https://doi.org/10.3390/ijms22063131
18. Fekete C, Lechan RM. Central regulation of hypothalamic-pituitary-thyroid axis under physiological and pathophysiological conditions. Endocr Rev. 2014; 35(2):159-194. doi: https://doi.org/10.1210/er.2013-1087
19. Vitellius G, Lombes M. Genetics in endocrinology: Glucocorticoid resistance syndrome. Eur J Endocrinol. 2020 Feb 1; 182(2): R15-R27. doi: https://doi.org/10.1530/EJE-19-0811
20. Nicolaides NC., Charmandari E. Chrousos syndrome: from molecular pathogenesis to therapeutic management. European journal of clinical investigation. 2015. 45(5): 504–514. doi: https://doi.org/10.1111/eci.12426
Об авторах
И. И. ЛаринаРоссия
Ларина Ирина Игоревна.
Москва
Конфликт интересов:
Нет
Н. В. Маказан
Россия
Маказан Надежда Викторовна - к.м.н.
Москва
Конфликт интересов:
Нет
К. В. Иващенко
Россия
Иващенко Ксения Валерьевна.
117036, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
Нет
Н. М. Платонова
Россия
Платонова Надежда Михайловна - д.м.н.
Москва
Конфликт интересов:
Нет
Е. М. Орлова
Россия
Орлова Елизавета Михайловна - к.м.н.
Москва
Конфликт интересов:
Нет
М. А. Карева
Россия
Карева Мария Андреевна - к.м.н.
Москва
Конфликт интересов:
Нет
Л. С. Созаева
Россия
Созаева Лейла Салиховна - к.м.н.
Москва
Конфликт интересов:
Нет
М. Ю. Юкина
Россия
Юкина Марина Юрьевна - к.м.н.
Москва
Конфликт интересов:
Нет
А. Н. Тюльпаков
Россия
Тюльпаков Анатолий Николаевич - д.м.н.
Москва
Конфликт интересов:
Нет
А. С. Духанин
Россия
Духанин Александр Сергеевич - д.м.н., проф.
Москва
Конфликт интересов:
Нет
Н. Л. Шимановский
Россия
Шимановский Николай Львович - д.м.н., проф., чл.-корр. РАН.
Москва
Конфликт интересов:
Нет
Е. А. Трошина
Россия
Трошина Екатерина Анатольевна - д.м.н., проф., чл.-корр. РАН.
Москва
Конфликт интересов:
Нет
Дополнительные файлы
|
|
1. Рисунок 1. Параметры связывания рГК лимфоцитами периферической крови пациентки высокомеченным синтетическим глюкокортикоидом 3Н-кортизолом, представленные в координатах Скэтчарда [5]. Кривая специфического связывания (связывание лиганда с рГК) имеет характерный вид изотермы насыщения, что свидетельствует о наличии в клетках высокоспецифических участков связывания гормона. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(80KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Соотношение количества связанного 3H-кортизола (B) и количества свободного (F) | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(78KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Ларина И.И., Маказан Н.В., Иващенко К.В., Платонова Н.М., Орлова Е.М., Карева М.А., Созаева Л.С., Юкина М.Ю., Тюльпаков А.Н., Духанин А.С., Шимановский Н.Л., Трошина Е.А. Синдром первичной резистентности к глюкокортикоидам: сложности диагностики (клинический случай и краткий обзор). Проблемы Эндокринологии. 2024;70(1):30-37. https://doi.org/10.14341/probl13321
For citation:
Larina I.I., Makazan N.V., Ivashchenko K.V., Platonova N.M., Orlova E.M., Kareva M.A., Sozaeva L.S., Yukina M.Yu., Tulpakov A.N., Dukhanin A.S., Shimanovskii N.L., Troshina E.A. Primary Generalized Glucocorticoid Resistance: a case report. Problems of Endocrinology. 2024;70(1):30-37. (In Russ.) https://doi.org/10.14341/probl13321

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).









































.jpg)


