Перейти к:
Прогнозирование наличия мутации в гене MEN1 на основании клинического фенотипа пациентов с первичным гиперпаратиреозом
https://doi.org/10.14341/probl13322
Аннотация
ОБОСНОВАНИЕ. Своевременное направление пациента на генетическое исследование с целью исключения первичного гиперпаратиреоза (ПГПТ), ассоциированного с синдромом множественных эндокринных неоплазий 1 типа (МЭН-1), — важный фактор, определяющий тактику лечения и прогноз. В условиях ограниченной доступности генетических исследований поиск клинических маркеров, указывающих на наличие мутаций в гене MEN1, остается актуальной задачей.
ЦЕЛЬ. Определить диагностическую ценность особенностей клинического течения ПГПТ у молодых пациентов в прогнозировании наличия мутации в гене MEN1.
МАТЕРИАЛЫ И МЕТОДЫ. На базе ФГБУ «НМИЦ эндокринологии» Минздрава России проведено одноцентровое одномоментное исследование с включением 273 пациентов с ПГПТ за период 2015–2022 гг. В соответствии с результатами генетического и лабораторно-инструментального исследования выделены 3 группы пациентов: с наличием мутаций в гене MEN1 (МЭН+, n=71), с отсутствием мутаций — с изолированным спорадическим ПГПТ (МЭН-, n=158) и с ПГПТ и сопутствующими образованиями эндокринных желез — фенокопии (ФК) МЭН-1 (ФК, n=32). Отдельно выделены подгруппы пациентов моложе 40 лет. Проведен сравнительный анализ независимых групп и подгрупп, с использованием метода логистической регрессии построена математическая модель прогнозирования вероятности наличия мутации в гене MEN1.
РЕЗУЛЬТАТЫ. Пациенты групп МЭН+ и МЭН- были сопоставимы по полу, возрасту манифестации, значениям показателей кальций-фосфорного обмена, а также осложнениям ПГПТ. В группе ФК ПГПТ манифестировал позже по сравнению другими группами (p<0,001 для всех), отмечались более низкие значения общего кальция и тенденция к более низким концентрациям интактного паратгормона. В группе МЭН+ по сравнению с МЭН- и ФК статистически значимо чаще выявлялись полигландулярное поражение околощитовидных желез, рецидивы ПГПТ, отягощенный семейный анамнез. В группах ФК и МЭН-, согласно результатам гистологического исследования, преобладали аденомы (92 и 94%), в то время как в группе МЭН+ — гиперплазированные околощитовидные железы (49%). В группе ФК не было пациентов с тремя «классическими» компонентами синдрома МЭН-1, клиническое течение ПГПТ было сходно с таковым в группе МЭН-. Различия сохранялись для выделенных подгрупп пациентов моложе 40 лет, что легло в основу построения математической модели. Уравнение логистической регрессии для предсказания вероятности наличия мутации в гене MEN1 включило восемь предикторов, диагностическая чувствительность модели составила 96%, специфичность — 98%.
ЗАКЛЮЧЕНИЕ. На основании проведенного анализа выделены восемь предикторов наследственного характера ПГПТ в рамках синдрома МЭН-1. Разработана математическая модель для прогнозирования у пациента мутации в гене MEN1, продемонстрировавшая высокую классификационную способность на обучающей выборке. Дальнейшее совершенствование модели будет способствовать повышению качества оказания медицинской помощи пациентам с ПГПТ.
Ключевые слова
Для цитирования:
Мокрышева Н.Г., Еремкина А.К., Милютина А.П., Салимханов Р.Х., Абойшева Е.А., Бибик Е.Е., Горбачева А.М., Елфимова А.Р., Ковалева Е.В., Попов С.В., Мельниченко Г.А. Прогнозирование наличия мутации в гене MEN1 на основании клинического фенотипа пациентов с первичным гиперпаратиреозом. Проблемы Эндокринологии. 2023;69(5):4-15. https://doi.org/10.14341/probl13322
For citation:
Mokrysheva N.G., Eremkina A.K., Miliutina A.P., Salimkhanov R.Kh., Aboishava L.A., Bibik E.E., Gorbacheva A.M., Elfimova A.R., Kovaleva E.V., Popov S.V., Melnichenko G.A. Predicting the presence of MEN1 gene mutation based on the clinical phenotype of patients with primary hyperparathyroidism. Problems of Endocrinology. 2023;69(5):4-15. (In Russ.) https://doi.org/10.14341/probl13322
ОБОСНОВАНИЕ
Первичный гиперпаратиреоз (ПГПТ) — эндокринное заболевание, характеризующееся избыточной секрецией паратиреоидного гормона (ПТГ) при высоконормальном или повышенном уровне кальция крови вследствие первичной патологии околощитовидных желез (ОЩЖ) [1]. ПГПТ наиболее часто имеет спорадический характер, однако примерно в 5% случаев обусловлен наследственным заболеванием, наиболее часто — синдромом множественных эндокринных неоплазий 1 типа (МЭН-1) [2].
МЭН-1 — заболевание с аутосомно-доминантным типом наследования, развивающееся вследствие мутации в гене менина (MEN1). «Классическими» компонентами МЭН-1 являются образования ОЩЖ, аденогипофиза и дуодено-панкреатические нейроэндокринные опухоли (НЭО) [3]. В соответствии с европейскими клиническими рекомендациями диагноз МЭН-1 устанавливается согласно следующим критериям: клиническим — при наличии 2 и более МЭН-ассоциированных образований (опухолей ОЩЖ, НЭО желудочно-кишечного тракта (ЖКТ), аденомы гипофиза); семейным — у пациентов, имеющих одно МЭН-ассоциированное образование и родственника первой линии родства с установленной мутацией в гене MEN1; генетическим — при наличии гетерозиготной мутации в гене MEN1 [4].
ПГПТ зачастую становится первым проявлением МЭН-1 и развивается до присоединения других компонентов синдрома, что определяет высокую значимость своевременной диагностики именно МЭН-1-ассоциированного ПГПТ. Для него характерны определенные клинические особенности: более молодой возраст манифестации; полигландулярный характер поражения ОЩЖ с возможным метахронным развитием образований. Имеются данные о том, что для пациентов с МЭН-1 характерно более мягкое течение заболевания, в том числе — более низкие уровни интактного паратгормона (иПТГ) и кальция крови [5–7]. В литературе описаны также отличия в развитии костных осложнений у пациентов c МЭН-1-ассоциированным ПГПТ. Так, на момент постановки диагноза при МЭН-1 синдроме показатели минеральной плотности костей (МПК), как правило, ниже по сравнению со спорадической формой заболевания. Причины этих различий пока не установлены [8]. Необходимо отметить, что в большинстве проведенных исследований, сравнивающих клинические характеристики спорадического и МЭН-1-ассоциированного ПГПТ, группы не были сопоставимы по полу и возрасту, что потенциально искажало результаты сравнения.
Несмотря на имеющиеся клинические критерии постановки диагноза синдрома МЭН-1, самым надежным вариантом диагностики в настоящее время остается генетическое исследование. И прежде всего это связано с наличием фенокопий, то есть клинического фенотипа синдрома при отсутствии мутации в гене MEN1. Наиболее часто при фенокопиях МЭН-1 обнаруживаются аденомы гипофиза (с преобладанием СТГ-продуцирующих) и опухоли ОЩЖ. Причина сочетания нескольких МЭН-1-ассоциированных образований в этом случае остается неизвестной, однако в качестве возможных причин рассматриваются мутации в других генах (например, CDKN1B), эпигенетические изменения, не исключаются ложноотрицательные результаты генетического исследования [9] Показано, что при фенокопиях возраст манифестации компонентов МЭН-1, как правило, старше, а проявление всех трех классических компонентов синдрома наблюдается крайне редко [10, 11]. В связи с этим актуальным остается вопрос об оптимальной тактике ведения таких пациентов (в частности, необходимости регулярного скрининга, рекомендуемого пациентам с генетически подтвержденным МЭН-1).
Таким образом, основная роль в постановке диагноза принадлежит врачу-клиницисту, который должен своевременно заподозрить МЭН-1 и обеспечить правильную тактику обследования, лечения и динамического наблюдения пациента. В условиях ограниченной доступности генетического исследования особую важность приобретает поиск клинических маркеров, позволяющих с высокой долей вероятности прогнозировать наличие мутаций в гене MEN1. Это позволит более персонализированно направлять на генетическое исследование, тем самым снизить финансовую нагрузку на пациента (и потенциально — на систему здравоохранения) и при этом своевременно поставить правильный диагноз.
ЦЕЛЬ ИССЛЕДОВАНИЯ
В связи с этим целью нашего исследования стала оценка диагностической ценности клинических особенностей течения ПГПТ у молодых пациентов для прогнозирования наличия мутации в гене MEN1.
МАТЕРИАЛЫ И МЕТОДЫ
Согласно поставленной цели, в период с 01.10.2015 г. по 01.07.2022 г. на базе ФГБУ «НМИЦ эндокринологии» Минздрава России (далее — НМИЦ эндокринологии) было проведено одноцентровое одномоментное исследование. Дизайн представлен на рисунке 1.
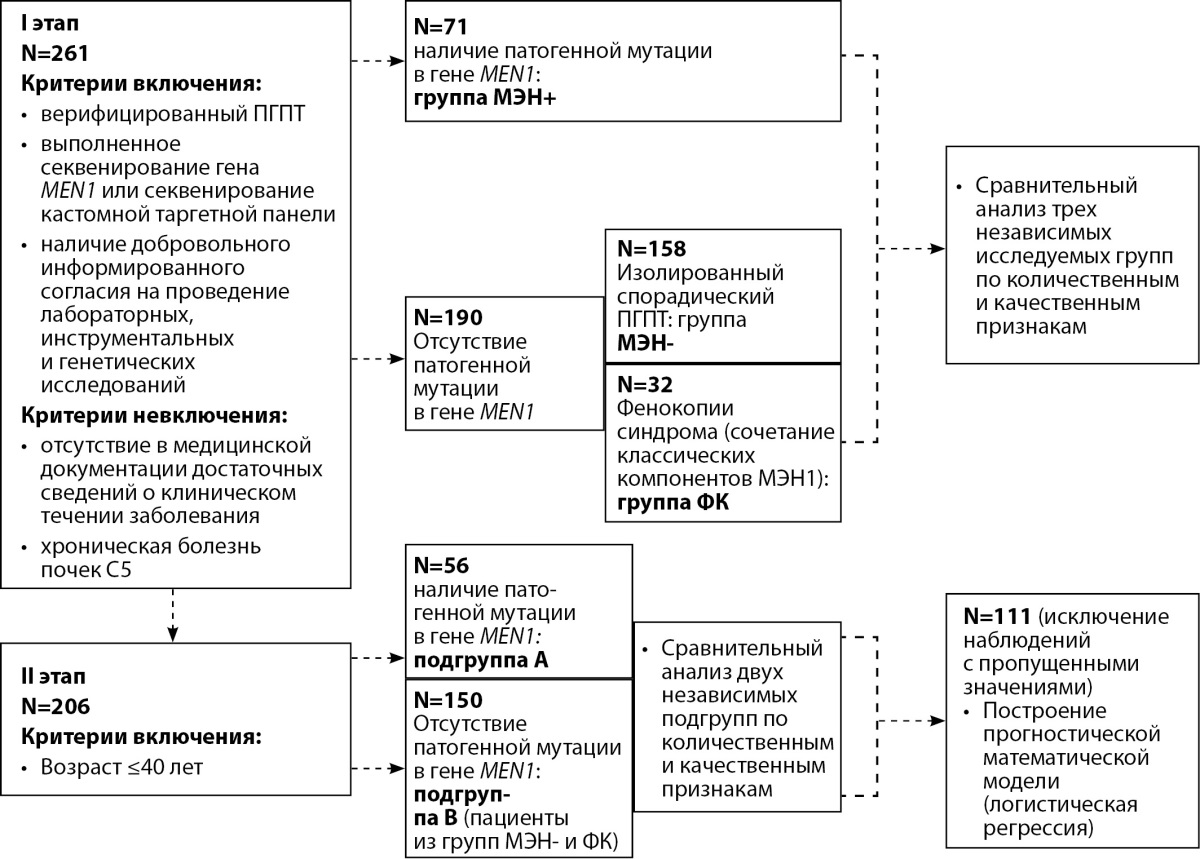
Рисунок 1. Дизайн исследования.
250 пациентам было проведено генетическое исследование в НМИЦ эндокринологии, 11 пациентам из группы МЭН+ оно выполнялось в сторонней организации. В НМИЦ эндокринологии был выполнен анализ таргетной генетической панели, включающей кодирующие регионы 378 генов, связанных с эндокринопатиями (в том числе MEN1, CASR, CDC73, RET, CDKN1B). Массивное параллельное секвенирование проводилось на платформе Illumina NextSeq 550 (Illumina, США); секвенирование по Сэнгеру осуществлялось с использованием генетического анализатора AB3500 (Thermo Fisher Scientific, США). В группе МЭН+ были получены результаты сэнгеровского секвенирования 51 пациента (секвенирование только гена MEN1), 9 пациентам был выполнен NGS-анализ кастомной панели 378 генов, связанных с эндокринопатиями. В группе МЭН- 103 пациентам было выполнено сэнгеровское секвенирование только гена MEN1, 55 пациентам — NGS-исследование панели генов. В группе ФК 15 пациентам было проведено сэнгеровское секвенирование только гена MEN1, 17 пациентам — NGS-исследование панели генов. Основаниями для назначения генетического исследования являлись подтвержденный ПГПТ у пациентов моложе 40 лет, и/или сочетание с другими компонентами синдрома МЭН-1, и/или рецидив ПГПТ, и/или наличие кровных родственников с синдромом МЭН-1 [4].
Все пациенты, включенные в представленное исследование, проходили либо амбулаторное, либо стационарное обследование и лечение в «НМИЦ эндокринологии», однако у части лабораторные и инструментальные обследования на момент манифестации ПГПТ могли быть пройдены в других медицинских учреждениях, а в карту внесены лишь их результаты. При анализе истории болезни пациентов учитывались следующие параметры: наследственный анамнез, считавшийся осложненным при наличии у родственников компонентов МЭН-1 синдрома и/или верифицированной мутации в гене MEN1; показатели минерального обмена (уровень иПТГ, кальций (Сa) общий и ионизированный, альбумин, фосфор сыворотки крови, креатинин с расчетом скорости клубочковой фильтрации (СКФ)) и суточная кальциурия на момент манифестации заболевания до проведения хирургического лечения ПГПТ, а также Ca общий, иПТГ в первые сутки после паратиреоидэктомии); результаты топической диагностики (ультразвуковое исследование (УЗИ), сцинтиграфия ОЩЖ с ОФЭКТ/КТ, компьютерная томография (КТ) ОЩЖ с контрастированием в различных комбинациях); расхождения результатов топической диагностики с интраоперационной визуализацией; наличие костных и почечных осложнений заболевания, наличие другой МЭН-1-ассоциированной эндокринной патологии. Низкоэнергетические переломы бедренных и плечевых костей, поясничных и грудных позвонков определялись по данным рентгенографии; оценка МПК проводилась по результатам рентгеновской денситометрии в поясничном отделе позвоночника, проксимальном отделе бедра и лучевой кости. Наличие осложнений со стороны почек (нефрокальциноза/нефролитиаза) устанавливалось по данным УЗИ либо КТ почек, а также по уровню СКФ (с учетом возраста и расчетной СКФ (CKD-EPI 2009)). Учитывались исходы хирургического лечения — ремиссия/рецидив/персистенция. Диагностика НЭО ЖКТ проводилась по результатам КТ или магнитно-резонансной томографии (МРТ) органов брюшной полости и забрюшинного пространства с внутривенным контрастированием, аденомы гипофиза — по результатам МРТ головного мозга, с внутривенным контрастированием при показаниях.
Статистический анализ проводился с помощью пакета прикладных программ Statistica v. 13.3 (TIBCO Software Inc., США). Сравнительный анализ трех независимых исследуемых групп по количественным признакам проведен с помощью критерия Краскела–Уоллиса с дальнейшим post-hoc анализом в случае наличия статистически значимых различий или различий на уровне статистических тенденций. Сравнительный анализ двух независимых групп по количественным признакам проведен с помощью критерия Манна–Уитни. Сравнение независимых групп по качественным признакам проводили с помощью двустороннего точного критерия Фишера. Уровень значимости (р) при проверке статистических гипотез принимался равным 0,05. Для коррекции критического уровня значимости при множественных сравнениях применялась поправка Бонферрони (р0), после чего значения р в диапазоне между рассчитанным р0 и 0,05 интерпретировались как статистическая тенденция. Для построения математической модели логистической регрессии и выполнения ROC-анализа был использован пакет прикладных программ SPSS Statistics v. 17.0 (SPSS: An IBM Company, США).
Исследования с участием людей были рассмотрены и одобрены Комитетом по этике (протокол № 1 от 17.01.2018). Письменное информированное согласие на участие в данном исследовании было предоставлено всеми участниками.
РЕЗУЛЬТАТЫ
Характеристика участников исследования
Общая характеристика участников исследования представлена в таблице 1.
Таблица 1. Общая характеристика участников исследования
|
МЭН+ Группа 1 |
МЭН- Группа 2 |
ФК Группа 3 |
р |
p, post-hoc |
||||
|
N |
Me [ Q1; Q3] /n (%) |
N |
Me [ Q1; Q3] /n (%) |
N |
Me [ Q1; Q3] /n (%) |
|||
|
Манифестация ПГПТ, лет |
71 |
30 [ 25; 39] |
158 |
33 [ 29; 37] |
32 |
49 [ 37; 55] |
<0,001¹ |
p1–2=0,210 p1–3<0,001 p2–3<0,001 |
|
Женщины |
71 |
49 (69%) |
158 |
121 (76,6%) |
32 |
29 (90,6%) |
0,052² |
p1–2=0,888 p1–3=0,082 p2–3=0,331 |
|
Мужчины |
71 |
22 (31%) |
158 |
37 (23,4%) |
32 |
3 (9,4%) |
||
|
Аденома гипофиза в анамнезе |
66 |
29 (43,9%) |
158 |
0 (0%) |
32 |
26 (79%) |
<0,001² |
p1–2<0,001 p1–3=0,024 p2–3<0,001 |
|
НЭО ЖКТ в анамнезе |
65 |
31 (47,7%) |
158 |
0 (0%) |
32 |
3 (9,4%) |
<0,001² |
p1–2<0,001 p1–3=0,006 p2–3=0,026 |
|
Отягощенная наследственность |
65 |
48 (67,6%) |
158 |
0 (0%) |
32 |
0 (0%) |
<0,001² |
p1–2<0,001 p1–3<0,001 p2–3- |
¹Критерий Краскела–Уоллиса.
²Критерий Фишера.
Поправка Бонферрони P0=0,05/23=0,002.
Пациенты из групп МЭН+ и МЭН- были сопоставимы по возрасту манифестации заболевания (p=1,000), тогда как в группе ФК пациенты были статистически значимо старше (p<0,001 при попарном сравнении групп). Во всех трех группах преобладали женщины; различия на уровне статистической тенденции по полу пациентов были выявлены только между группами МЭН+ и ФК (табл. 1).
У большинства пациентов (79%) группы ФК были диагностированы аденомы гипофиза, в то время как НЭО ЖКТ (инсулинома, гормонально-неактивное НЭО поджелудочной железы, НЭО желудка) отмечались лишь у 3 (9,4%) больных. В группе ФК не было пациентов, имевших сочетание всех трех «классических» компонентов МЭН-1. Напротив, cреди пациентов МЭН+ с сопоставимой частотой выявлялись аденомы гипофиза и НЭО ЖКТ (43,9 и 47,7% соответственно, p=0,399), и у 12 пациентов было сочетание всех трех основных компонентов синдрома МЭН1. У 69% пациентов группы МЭН+, в отличие от пациентов других групп, отмечался осложненный наследственный анамнез.
Параметры кальций-фосфорного обмена
Группы МЭН+ и МЭН- были сопоставимы по уровням иПТГ, Ca общего, ионизированного и скорректированного на альбумин, фосфора сыворотки крови и Ca суточной мочи. В группе ФК по сравнению с другими группами отмечались статистически более низкие значения кальциемии по уровню общего кальция, а также тенденции к более низким концентрациям ионизированного и скорректированного кальция, иПТГ. Статистически значимых различий в кальциурии, фосфатемии, уровне креатинина, а также послеоперационных концентрациях иПТГ и Са крови между тремя группами выявлено не было. Сравнительный анализ представлен в таблице 2.
Таблица 2. Сравнительные характеристики пациентов
по параметрам кальций-фосфорного обмена
|
Параметр, единицы измерения |
МЭН+ Группа 1 |
МЭН- Группа 2 |
ФК Группа 3 |
р |
p, post-hoc |
|||
|
N |
Me [ Q1; Q3] |
N |
Me [ Q1; Q3] |
N |
Me [ Q1; Q3] |
|||
|
Са общий, ммоль/л (2,15–2,55) |
70 |
2,83 |
158 |
2,79 |
32 |
2,68 |
<0,001¹ |
p1–2=0,551 p1–3<0,001 p2–3<0,001 |
|
Са ионизированный, ммоль/л (1,03–1,29) |
50 |
1,41 |
114 |
1,36 |
20 |
1,29 |
0,009¹ |
p1–2=0,197 p1–3=0,004 p2–3=0,010 |
|
Са, скорректированный на альбумин, ммоль/л (2,15–2,55) |
17 |
2,69 |
84 |
2,70 |
21 |
2,61 |
0,005¹ |
p1–2=0,912 p1–3=0,005 p2–3=0,002 |
|
иПТГ, пг/мл (15–65) |
70 |
144,6 |
158 |
153,2 |
32 |
110,3 |
0,019¹ |
p1–2=0,163 p1–3=0,189 p2–3=0,006 |
|
Креатинин, мкмоль/л (50–98) |
38 |
65,4 |
116 |
68,8 |
28 |
64,6 |
0,069¹ |
- |
|
Фосфор, ммоль/л (0,74–1,52) |
46 |
0,81 |
114 |
0,85 |
24 |
0,90 |
0,139¹ |
- |
|
Кальциурия, ммоль/сут (2,5–8) |
37 |
8,50 |
108 |
8,99 |
23 |
9,20 |
0,569¹ |
- |
|
Послеоперационный иПТГ*, пг/мл (15–65) |
41 |
24,52 |
122 |
20,64 |
16 |
27,25 |
0,270¹ |
- |
|
Послеоперационный Ca общий, ммоль/л (2,15–2,55) |
33 |
2,24 |
118 |
2,20 |
15 |
2,12 |
0,957¹ |
- |
¹Критерий Краскела-Уоллиса.
Поправка Бонферрони P0=0,05/23=0,002.
*Учитывался уровень иПТГ на первые сутки
после проведения хирургического лечения.
ПГПТ-ассоциированные осложнения
Между пациентами всех трех групп не было найдено статистически значимых различий по частоте низкоэнергетических переломов, нефролитиаза либо нефрокальциноза и уровню СКФ. У пациентов с МЭН-1-ассоциированным ПГПТ по сравнению с другими группами несколько чаще отмечалось клинически значимое снижение МПК, однако различия не достигли статистической значимости (табл. 3).
Таблица 3. Сравнительные характеристики пациентов
по частоте развития осложнений ПГПТ
|
Параметр, единицы измерения |
МЭН+ Группа 1 |
МЭН- Группа 2 |
ФК Группа 3 |
р |
|||
|
N |
Me [ Q1; Q3] /n (%) |
N |
Me [ Q1; Q3] /n (%) |
N |
Me [ Q1; Q3] /n (%) |
||
|
Нефрокальциноз/нефролитиаз |
40 |
25 (62,5%) |
129 |
82 (63,6%) |
29 |
17 (58,6%) |
0,864² |
|
СКФ |
38 |
107 [ 98; 118] |
116 |
101 [ 91;114] |
28 |
98,0 [ 92,8; 106,0] |
0,064 |
|
Низкоэнергетические переломы |
30 |
9 (30%) |
75 |
18 (24%) |
14 |
3 (21%) |
0,780² |
|
Z-score <2,0 SD или T-score <2,5 SD |
35 |
17 (48,5%) |
102 |
35 (33,3%) |
26 |
9 (34,6%) |
0,315² |
²Критерий Фишера.
Поправка Бонферрони P0=0,05/23=0,002.
Основные характеристики образований околощитовидных желез
При сравнении количества образований ОЩЖ, диагностированных у пациентов по результатам предоперационной топической диагностики на момент манифестации заболевания, нами были выявлены значимые различия между группой МЭН+ и группами МЭН-, ФК (p<0,001, критерий Фишера, табл. 4). В группах МЭН- и ФК у подавляющего количества пациентов было выявлено одно образование ОЩЖ, поражение нескольких желез отмечалось редко (n=9 (5,7%) и n=1 (3,2%) соответственно). У одного пациента из группы ФК отсутствовала визуализация образования по данным УЗИ и сцинтиграфии. В группе МЭН+ полигландулярные изменения с вовлечением 2 и более ОЩЖ на дооперационном этапе выявлялись в 60,5% (n=43), при этом у 2 пациентов с мягким течением патологически измененных ОЩЖ при УЗИ не визуализировалось. Примечательно, что в группах МЭН- и ФК не было расхождений по количеству образований ОЩЖ выявленных интраоперационно и по данным предоперационной топической диагностики, в то время как в группе МЭН+ данные различия определялись для всех методов (в 50% (21/42); УЗИ vs. интраоперационная визуализация, p<0,001; сцинтиграфия vs. интраоперационная визуализация, p<0,001; МСКТ vs. интраоперационная визуализация, p<0,006).
Таблица 4. Сравнительная характеристика групп
по основным характеристикам образований ОЩЖ
|
Параметр |
МЭН+ Группа 1 |
МЭН- Группа 2 |
ФК Группа 3 |
р |
p, post-hoc |
||||
|
N |
n (%) |
N |
n (%) |
N |
n (%) |
||||
|
Количество образований ≥2 по методам дооперационной топической диагностики |
71 |
43 (60,5%) |
158 |
9 (5,7%) |
32 |
1 (3,2%) |
<0,001² |
p1–2<0,001 p1–3<0,001 p2–3=1,000 |
|
|
Количество образований ≥2, выявленных интраоперационно |
45 |
40 (88,9%) |
121 |
6 (5,0%) |
17 |
1 (5,9%) |
<0,001² |
p1–2<0,001 p1–3=0,005 p2–3=1,000 |
|
|
Гистологическая характеристика образований |
Аденома |
53 |
25 (47,2%) |
123 |
113 (91,9%) |
16 |
15 (94%) |
<0,001² |
p1–2<0,001 p1–3 = 0,004 p2–3 = 1,000 |
|
Гиперплазия |
18 (34%) |
1 (0,81%) |
0 (0%) |
||||||
|
Атипическая аденома |
0 (0%) |
2 (1,6%) |
0 (0%) |
||||||
|
Карцинома |
2 (4%) |
6 (4,9%) |
0 (0%) |
||||||
|
Сочетание аденомы, гиперплазии |
8 (15%) |
1 (0,81%) |
0 (0%) |
||||||
|
Сочетание аденомы, атипической аденомы |
0 (%) |
0 (0%) |
1 (6%) |
||||||
|
Сочетание аденомы, карциномы |
0 (0%) |
1 (0,81%) |
0 (0%) |
||||||
²Критерий Фишера.
Поправка Бонферрони P0=0,05/23=0,002.
Данные о гистологических характеристиках удаленных ОЩЖ были доступны у 192 пациентов. Группы МЭН- и ФК были сопоставимы — в обеих ожидаемо преобладали аденомы ОЩЖ, составляя 92% (113/123) и 94% (15/16) соответственно. В группе МЭН+ аденомы наблюдались в 47,2% (25/53) случаев, гиперплазия (в том числе в сочетании с аденомой) отмечена у 49,1% (26/53) больных. Карциномы ОЩЖ верифицированы у 7/123 пациентов из группы МЭН- (у 4 из них проведен расширенный генетический анализ и исключено наличие мутации в гене CDC73), у 2/53 — в группе МЭН+ (наличие мутации CDC73 исключено), злокачественного поражения ОЩЖ в группе ФК отмечено не было.
В группе МЭН+ информация об объеме первичного хирургического лечения была доступна у 59 пациентов, среди них 13 пациентам (22%) была выполнена селективная паратиреоидэктомия, 33 пациентам (55,9%) — удаление двух или трех образований, 13 (22%) пациентам — тотальная паратиреоидэктомия (удаление 4 образований).
Характеристика послеоперационного периода
Данные по течению послеоперационного периода были доступны не у всех вошедших в исследование пациентов (табл. 5). Частота транзиторного гипопаратиреоза в послеоперационном периоде была сопоставимой в группах МЭН+ и МЭН- (36,0 и 36,5% соответственно), однако в группе ФК составила лишь 6,0%. В группе МЭН+ отсутствие ремиссии ПГПТ после проведенного хирургического лечения отмечалось чаще, чем в других группах (табл. 5).
Таблица 5. Сравнительный анализ послеоперационного течения заболевания
|
Параметр |
МЭН+ Группа 1 |
МЭН- Группа 2 |
ФК Группа 3 |
р |
p, post-hoc |
|||
|
N |
n (%) |
N |
n (%) |
N |
n (%) |
|||
|
Транзиторный послеоперационный гипопаратиреоз |
50 |
18 (36%) |
115 |
45 (36,5%) |
17 |
1 (6%) |
0,017² |
p1–2=1,000 p1–3=0,084 p2–3=0,027 |
|
Отсутствие ремиссии ПГПТ (рецидив + персистенция) |
51 |
19 (37%) |
102 |
1 (1%) |
16 |
1 (6%) |
<0,001² |
p1–2<0,001 p1–3=0,088 p2–3=1,000 |
²Критерий Фишера.
Поправка Бонферрони P0=0,05/23=0,002.
Характеристика пациентов молодого возраста
Для реализации второго этапа исследования из общей когорты пациентов были выделены лица молодого возраста (до 40 лет включительно). Пациенты из групп МЭН- и ФК ввиду отрицательного результата генетического анализа были объединены в одну подгруппу. Проведен сравнительный анализ подгрупп по всем основным параметрам, что и в общей когорте больных (суммарно 23 параметра) — демографические характеристики, показатели фосфорно-кальциевого обмена, осложнения ПГПТ, характеристики ОЩЖ и послеоперационного периода. Между подгруппами молодых пациентов с ПГПТ выявлены статистически значимые различия (табл. 6) по возрасту манифестации ПГПТ, наличию в анамнезе аденомы гипофиза и НЭО ЖКТ, а также отягощенной наследственности, полигландулярному поражению, гистологическим характеристикам образований ОЩЖ, отсутствию ремиссии после первичной операции. Подгруппы были сопоставимы по основным показателям фосфорно-кальциевого обмена и осложнениям ПГПТ.
Таблица 6. Сравнительный анализ подгрупп пациентов молодого возраста
|
Параметр |
Подгруппа А (МЭН+) |
Подгруппа В (МЭН- и ФК) |
р |
|||
|
N |
Me [ Q1; Q3] /n (%) |
N |
Me [ Q1; Q3] /n (%) |
|||
|
Манифестация ПГПТ, лет |
56 |
28 [ 19; 32,5] |
150 |
33 [ 28; 36] |
0,001¹ |
|
|
Аденома гипофиза в анамнезе |
52 |
23 (44,2%) |
136 |
7 (5,1%) |
<0,001² |
|
|
НЭО ЖКТ в анамнезе |
51 |
20 (39,2%) |
129 |
0 (0%) |
<0,001² |
|
|
Отягощенная наследственность |
56 |
34 (60,7%) |
144 |
0 (0%) |
<0,001² |
|
|
Количество образований ≥2 по методам дооперационной топической диагностики |
49 |
38 (77,6%) |
150 |
5 (3,3%) |
<0,001² |
|
|
Количество образований ≥2, выявленных интраоперационно |
33 |
28 (84,8%) |
112 |
4 (3,6%) |
<0,001² |
|
|
Гистологическая характеристика образований |
Аденома |
40 |
20 (50%) |
113 |
107 (94,7%) |
<0,001² |
|
Гиперплазия |
14 (35,0%) |
0 (0%) |
||||
|
Атипическая аденома |
0 (0%) |
2 (1,8%) |
||||
|
Карцинома |
1 (2,5%) |
3 (2,7%) |
||||
|
Сочетание аденомы, гиперплазии |
5 (12,5%) |
0 (0%) |
||||
|
Сочетание аденомы, атипической аденомы |
0 (0%) |
0 (0%) |
||||
|
Сочетание аденомы, карциномы |
0 (0%) |
1 (0,1%) |
||||
|
Отсутствие ремиссии ПГПТ (рецидив+персистенция) |
40 |
17 (42,5%) |
95 |
2 (2,1%) |
<0,001² |
|
¹Критерий Манна–Уитни.
²Критерий Фишера.
Поправка Бонферрони P0=0,05/23=0,002.
Построение математической модели для прогнозирования вероятности наличия МЭН-1-ассоциированного ПГПТ у молодых пациентов
По результатам сравнительного анализа пациентов молодого возраста были выделены основные факторы, отличающие подгруппы «ненаследственного» и МЭН-1-ассоциированного ПГПТ. С целью прогнозирования вероятности получения положительного результата генетического исследования была использована модель бинарного выбора — логистическая регрессия.
В качестве предикторов анализировались признаки, показавшие статистически значимые различия при сравнительном анализе: возраст манифестации ПГПТ (лет), наличие в анамнезе аденомы гипофиза (да — 1/нет — 0) и НЭО ЖКТ (да — 1/нет — 0), отягощенная наследственность (да — 1/нет — 0); количество образований, выявленных с помощью методов дооперационной топической диагностики (≥2–1/1–0) и количество образований, выявленных интраоперационно (≥2–1/1–0); гистологическая характеристика образований (аденома, гиперплазия, атипическая аденома, карцинома, сочетание аденомы и гиперплазии, сочетание аденомы и атипической аденомы, сочетание аденомы и карциномы), отсутствие ремиссии ПГПТ (да — 1/нет — 0). В качестве отклика (прогнозируемого признака) использовалось наличие положительного или отрицательного результата генетического исследования MEN1. После исключения наблюдений с пропущенными значениями указанных предикторов размер выборки составил 111 пациентов (22 пациента МЭН+, 89 ФК и МЭН-).
В результате было получено уравнение логистической регрессии, включающее восемь предикторов:
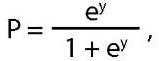 (1)
(1)
где P — вероятность того, что произойдет интересующее событие, e — основание натурального логарифма 2,71,
y = -0,052x1-13,830x2+58,038x3+79,415x4-37,322x5+20,907x6-5,816x7-6,415x8+19,489
где х1–х8 — независимые признаки (x1 — возраст манифестации ПГПТ, x2 — наличие в анамнезе аденомы гипофиза, x3 — наличие в анамнезе НЭО ЖКТ, x4 — отягощенная наследственность; x5 — количество образований, выявленных с помощью методов дооперационной топической диагностики ≥2; x6 — количество образований, выявленных интраоперационно ≥2; x7 — гистологическая характеристика образований, x8 — отсутствие ремиссии ПГПТ).
Матрица классификации пациентов с генетически подтвержденным синдромом МЭН-1 с использованием полученной модели представлена в таблице 7.
Таблица 7. Матрица классификации пациентов
с генетически подтвержденным синдромом МЭН-1
с использованием полученной модели (n=111)
|
Результат генетического исследования |
|||
|
МЭН+ |
МЭН - и ФК |
||
|
Результат предсказания моделью |
МЭН+ |
21 |
2 |
|
МЭН- и ФК |
1 |
87 |
|
Операционные характеристики модели показали высокую классификационную способность: диагностическая чувствительность (ДЧ) 96%, 95% ДИ [ 80%; 100%]; диагностическая специфичность (ДС) 98%, 95% ДИ [ 94%; 99%]; прогностическая ценность положительного результата (ПЦПР) 91%, 95% ДИ [ 77%; 95%]; прогностическая ценность отрицательного результата (ПЦОР) 99%, 95% ДИ [ 95%; 100%].
Для графического изображения диагностической способности модели была построена ROC-кривая (рис. 2), которая отображает чувствительность и специфичность модели логистической регрессии. Площадь под кривой составила AUC = 0,983.
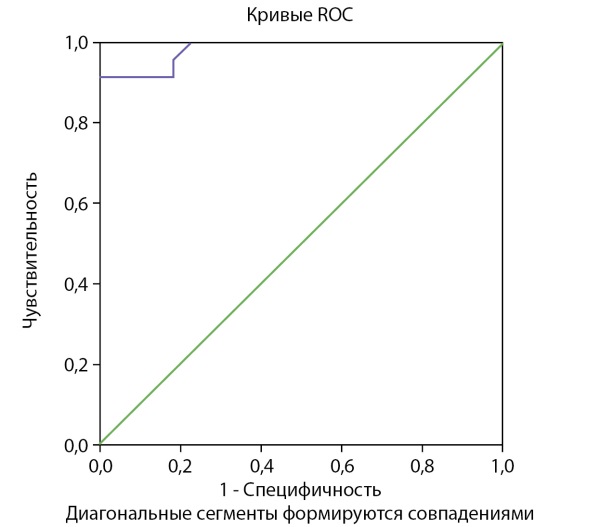
Рисунок 2. ROC-кривая полученной модели логистической регрессии.
ОБСУЖДЕНИЕ
Для молодых пациентов с ПГПТ, ассоциированным с МЭН-1, характерно длительное бессимптомное течение. В ряде случаев умеренная гиперкальциемия может проявляться у детей и подростков, частота ее увеличивается с возрастом и уже к 50 годам повышение уровня кальция в сыворотке крови ожидается практически у всех пациентов с МЭН-1 [11]. Тем не менее при сопоставлении уровней иПТГ и кальциемии как основных показателей минерального обмена, в случае МЭН-1-ассоциированного ПГПТ наблюдались как более мягкие отклонения от референсного диапазона [12][13], так и аналогичные спорадической форме изменения [14][15]. По данным литературы, у пациентов с МЭН фиксировалось постепенное нарастание уровня иПТГ, наиболее заметное после 40 лет, в то время как для пациентов со спорадическим ПГПТ с возрастом отмечалось снижение уровней кальция крови [16][17]. В отличие от представленных работ, в нашем исследовании пациенты из групп МЭН+ и МЭН- были сопоставимы по полу и возрасту, что позволило создать оптимальные условия для сравнительного анализа именно молодой когорты больных с ПГПТ. Мы не выявили статистически значимых различий в группах МЭН+ и МЭН- по показателям фосфорно-кальциевого обмена. Однако для пациентов из группы ФК по сравнению с МЭН+ и МЭН- были характерны более низкие значения общего кальция и тенденция к более низким концентрациям иПТГ. Если принимать во внимание результаты работ Eller-Vainicher C. и соавт. и Katai M. и соавт., это могло быть обусловлено более старшим возрастом пациентов из группы ФК в сочетании с сохранной функцией почек.
Нами не было получено различий и в отношении частоты осложнений ПГПТ. Хотя у пациентов с МЭН-1-ассоциированным ПГПТ несколько чаще отмечалось снижение МПК относительно показателей, ожидаемых по возрасту, различия между группами не достигли статистической значимости (p=0,315). Наши результаты расходятся с данными других работ, где было продемонстрировано более тяжелое течение остеопороза вследствие ПГПТ у пациентов с МЭН-1 по сравнению со спорадической формой и, в ряде случаев, худшее восстановление костной ткани после хирургического лечения [18–21]. Хроническая гиперсекреция ПТГ обуславливает усиление метаболизма костной ткани, что приводит к обратимой потере массы кортикальной и трабекулярной кости из-за увеличения пространства ремоделирования и необратимой потере кортикальной кости из-за повышенной эндокортикальной резорбции [22]. Данные процессы у пациентов с МЭН-1-ассоциированным ПГПТ нередко запускаются в период набора костной массы, что и может быть причиной более ранних и тяжелых переломов в данной группе. Обсуждается вклад мутации в гене MEN1 как фактора, влияющего на созревание и функцию клеток остеогенного ряда [23]. Все три группы пациентов в нашем исследовании не различались по частоте нефролитиаза/нефрокальциноза. Lourenco D.M. и соавт. описали высокую распространенность раннего дебюта нефролитиаза у пациентов с МЭН-1 (до 86,2% у лиц моложе 30 лет), в других работах частота структурных изменений в почках была сопоставима с спорадическим ПГПТ [24][25]. Различные стадии хронической болезни почек были зарегистрированы в 19,4% случаев МЭН-1-ассоциированного ПГПТ [26].
Результаты нашей работы подтверждают, что полигландулярное поражение является одним из наиболее значимых признаков, отличающих спорадический и МЭН-1-ассоциированный ПГПТ [27]. По данным литературы, распространенность множественного поражения ОЩЖ при спорадическом ПГПТ варьирует от 7 до 33% наблюдений. Тем не менее ввиду необходимости учета ряда факторов, способных приводить к вторичному гиперпаратиреозу (ВГПТ) и гиперплазии нескольких ОЩЖ (ХБП, дефицит витамина D, мальабсорбция и др.), а также отсутствия широкого распространения скрининга генетических причин ПГПТ частота полигландулярного поражения при спорадическом ПГПТ может быть переоценена. В представленных исследованиях в морфологической структуре преобладали гиперплазии нескольких или всех ОЩЖ, реже регистрировались аденомы двух или крайне редко — трех желез [28] По нашим данным, вовлечение в патологический процесс двух и более ОЩЖ отмечалось лишь в 5,7 и 3,2% случаев в группах МЭН- и ФК соответственно и у 60,5% пациентов с МЭН-1. При этом у всех пациентов был известен генетический статус, исключались лица с ХБП С5. В группах ФК и МЭН- ожидаемо преобладали аденомы, в том числе среди лиц со множественным поражением ОЩЖ. В группе МЭН+ гиперплазии отмечались чаще, чем в двух других группах, составляя 49% случаев. Таким образом, характер поражения и гистологические характеристики образований ОЩЖ подтверждают отличия группы ФК от пациентов с МЭН-1-ассоциированным ПГПТ, и наоборот, их сходство со спорадическим заболеванием. Кроме того, в группе ФК не было пациентов со всеми тремя «классическими» компонентами синдрома МЭН-1, частота рецидивов по сравнению с МЭН+ была также меньше. Результаты нашего исследования согласуются с данными J. de Laat и др., в работе которых было проведено сравнение клинической картины у пациентов с отрицательным и положительным генетическим исследованием мутаций в гене MEN1 [29] Было установлено, что у пациентов без мутации гена менина компоненты МЭН-1 возникали в более позднем возрасте и в течение периода динамического наблюдения не отмечалось развития третьего компонента синдрома. В данном исследовании также было выявлено отсутствие снижения продолжительности жизни у пациентов, относящихся к фенокопиям МЭН-1, по сравнению с общей в популяции.
Генетическое исследование остается наиболее значимым инструментом для верификации МЭН-1 при наличии признаков, подозрительных в отношении наследственного генеза заболевания [30], однако его доступность лимитирована. Согласно проведенным исследованиям, вероятность генетической природы ПГПТ тем выше, чем меньше возраст дебюта заболевания, однако рекомендаций о генетическом скрининге в возрасте до 30, 35 или 40 лет не сформулировано. [30] Особый интерес представляет группа пациентов с ПГПТ моложе 40 лет с сочетанным полигландулярным поражением ОЩЖ и отягощенным семейным анамнезом, так как вероятность наличия синдрома при данных условиях достаточно высока [31] Учитывая данные факторы, нами была создана математическая модель, позволяющая рассчитать риск наличия мутации MEN1 именно у молодых пациентов с ПГПТ. Такая модель могла бы использоваться в клинической практике, способствуя принятию более взвешенного решения о проведении генетического анализа в ситуациях его ограниченной доступности и высокой стоимости.
Ранее модель для предсказания риска мутации в гене MEN1, разработанная на основании данных регистров МЭН-1 Нидерландов и Швеции, была предложена J. de Laat и соавт [32] В качестве факторов риска исследователи учитывали возраст пациента, ПГПТ, наличие НЭО поджелудочной железы, желудка, легких и тимуса, а также осложненный наследственный анамнез. Модель была разработана на основе анализа данных 365 пациентов с проведенным исследованием гена MEN1 и валидирована на когорте из 144 пациентов. Показатель c-statistic, отражающий предиктивную способность модели, составил 0,86 (95% ДИ 0,81–0,90) и 0,77 (95% ДИ 0,66–0,88) на тестовой и валидационной выборках соответственно, что соответствует достаточно высокой предсказательной значимости.
Предикторы в предложенной нами модели во многом схожи с моделью J. de Laat и соавт., тем не менее они были расширены за счет наличия множественного поражения ОЩЖ (≥2), выявленных до- и/или интраоперационно; гистологических характеристик и данных по рецидиву/персистенции заболевания. В нашу модель вошли дополнительные данные, которые могут быть получены у уже прооперированных пациентов, ведь нередко вопрос о возможной генетической природе заболевания возникает после операции. Как и в случае модели de Laat, нами не было получено различий по лабораторным параметрам и осложнениям ПГПТ, таким образом, они не могут быть использованы для дифференциальной диагностики наследственных и ненаследственных форм заболевания. Операционные характеристики разработанной нами модели показали достаточно высокую классификационную способность (ДЧ 96%, ДС 98%, ПЦПР 91%, ПЦОР 99%). Ввиду наличия пропусков по ряду значимых маркеров нам пришлось сократить финальную выборку пациентов до 111 человек. Однако бесспорным преимуществом стало наличие результатов генетического тестирования у всех включенных в исследование пациентов. Учитывая полученные перспективные результаты, в дальнейшем планируются расширение тестовой выборки и валидация модели.
Ограничения исследования
Ввиду различного объема хирургического лечения возможна погрешность в результатах анализа частоты возникновения послеоперационного гипопаратиреоза и рецидива/персистенции заболевания у пациентов с МЭН-1. В ограничения нашего исследования входит недоступность данных по некоторым анализируемым параметрам в ряде случаев, у части больных — проведение инструментального и лабораторного обследования в других медицинских учреждениях.
ЗАКЛЮЧЕНИЕ
Основными клиническими признаками, позволяющими дифференцировать МЭН-1-ассоциированный ПГПТ, являются возраст пациентов, осложненный наследственный анамнез, количество образований ОЩЖ и их гистологические характеристики, а также наличие в анамнезе рецидива ПГПТ после хирургического лечения. Данные характеристики использовались при разработке математической модели для предсказания наличия у пациента мутации в гене MEN1, продемонстрировавшей высокую классификационную способность на обучающей выборке. Дальнейшее совершенствование модели будет способствовать принятию более взвешенного решения при направлении на генетическое исследование и, таким образом, повышению качества оказания медицинской помощи пациентам с ПГПТ.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Статья опубликована в рамках выполнения государственного задания «Оптимизация Российского электронного реестра пациентов с первичным гиперпаратиреозом» № НИОКТР 121030100032-7 при финансовой поддержке Министерства здравоохранения Российской Федерации.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Мокрышева Н.Г. — существенный вклад в концепцию, дизайн исследования, внесение в рукопись существенной правки с целью повышения научной ценности статьи; Еремкина А.К. — существенный вклад в концепцию, дизайн исследования, получение, анализ данных и интерпретацию результатов, финальное редактирование текста статьи; Милютина А.П. — существенный вклад в анализ данных и интерпретацию результатов, написание статьи; Салимханов Р.Х. — существенный вклад в получение, анализ данных, написание статьи; Абойшева Е.А. — существенный вклад в получение, анализ данных, написание статьи; Бибик Е.Е. — существенный вклад в получение, анализ данных, написание статьи; Горбачева А.М. — существенный вклад в получение, анализ данных, написание статьи; Елфимова А.Р. — существенный вклад в получение, анализ данных, написание статьи; Ковалева Е.В. — существенный вклад в получение, анализ данных, написание статьи; Попов С.В. — существенный вклад в получение, анализ данных, написание статьи; Мельниченко Г.А. — существенный вклад в концепцию, дизайн исследования, внесение в рукопись существенной правки с целью повышения научной ценности статьи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Мокрышева Н.Г., Еремкина А.К., Крупинова Ю.А., и др. Клинические рекомендации по первичному гиперпаратиреозу, краткая версия // Проблемы Эндокринологии. — 2021. — Т. 67.. — №4. — С. 94-124. doi: https://doi.org/10.14341/probl12801
2. Cetani F, Saponaro F, Borsari S, Marcocci C. Familial and hereditary forms of primary hyperparathyroidism. Front Horm Res. 2018;(51):40-51. doi: https://doi.org/10.1159/000491037
3. Горбачева A.M., Еремкина А.К., Мокрышева Н.Г. Наследственные cиндромальные и несиндромальные формы первичного гиперпаратиреоза // Проблемы Эндокринологии. — 2020. — Т. 66.. — №1. — С. 23-34. doi: https://doi.org/10.14341/probl10357
4. Thakker RV, Newey PJ, Walls GV, et al. Clinical practice guidelines for Multiple Endocrine Neoplasia Type 1 (MEN1). J Clin Endocrinol Metab. 2012;97(9):2990-3011. doi: https://doi.org/10.1210/JC.2012-1230
5. Twigt BA, Scholten A, Valk GD, et al. Differences between sporadic and MEN related primary hyperparathyroidism; Clinical expression, preoperative workup, operative strategy and follow-up. Orphanet J Rare Dis. 2013;8(1):1-8. doi: https://doi.org/10.1186/1750-1172-8-50/FIGURES/1
6. Marini F, Giusti F, Cioppi F, et al. Bone and mineral metabolism phenotypes in MEN1-related and sporadic primary hyperparathyroidism, before and after parathyroidectomy. Cells. 2021;10(8):1895. doi: https://doi.org/10.3390/CELLS10081895
7. Eller‐Vainicher C, Chiodini I, Battista C, et al. Sporadic and MEN1‐related primary hyperparathyroidism: Differences in clinical expression and severity. J Bone Miner Res. 2009;24(8):1404-1410. doi: https://doi.org/10.1359/jbmr.090304
8. Еремкина А.К., Сазонова Д.В., Бибик Е.Е., и др. Тяжелые костные осложнения первичного гиперпаратиреоза у молодого пациента с верифицированной мутацией в гене MEN1 // Проблемы Эндокринологии. — 2022. — Т. 68. — №1. — С. 81-93. doi: https://doi.org/10.14341/probl12864
9. Nachtigall LB, Guarda FJ, Lines KE, et al. Clinical MEN-1 among a large cohort of patients with acromegaly. J Clin Endocrinol Metab. 2020;105(6):e2271-e2281. doi: https://doi.org/10.1210/clinem/dgaa142
10. Pieterman CRC, Hyde SM, Wu SY, et al. Understanding the clinical course of genotype-negative MEN1 patients can inform management strategies. Surgery. 2021;169(1):175-184. doi: https://doi.org/10.1016/J.SURG.2020.04.067
11. de Laat JM, van der Luijt RB, Pieterman CRC, et al. MEN1 redefined, a clinical comparison of mutation-positive and mutation-negative patients. BMC Med. 2016;14(1):1-9. doi: https://doi.org/10.1186/S12916-016-0708-1/FIGURES/3
12. Eller‐Vainicher C, Chiodini I, Battista C, et al. Sporadic and MEN1‐related primary hyperparathyroidism: differences in clinical expression and severity. J Bone Miner Res. 2009;24(8):1404-1410. doi: https://doi.org/10.1359/jbmr.090304
13. Twigt BA, Scholten A, Valk GD, et al. Differences between sporadic and MEN related primary hyperparathyroidism; Clinical expression, preoperative workup, operative strategy and follow-up. Orphanet J Rare Dis. 2013;8(1):1-8. doi: https://doi.org/10.1186/1750-1172-8-50/FIGURES/1
14. Marini F, Giusti F, Cioppi F, et al. Bone and mineral metabolism phenotypes in MEN1-related and sporadic primary hyperparathyroidism, before and after parathyroidectomy. Cells. 2021;10(8):1895. doi: https://doi.org/10.3390/cells10081895
15. Sato M, Miyauchi A, Takahara J. Clinical aspects of hyperparathyroidism in Japanese multiple endocrine neoplasia type 1. Biomed Pharmacother. 2000;(54):86s-89s. doi: https://doi.org/10.1016/S0753-3322(00)80020-7
16. Katai M, Sakurai A, Ikeo Y, Hashizume K. Primary hyperparathyroidism in patients with multiple endocrine neoplasia type 1: comparison with sporadic parathyroid adenomas. Horm Metab Res. 2001;33(8):499-503. doi: https://doi.org/10.1055/S-2001-16944
17. Eller‐Vainicher C, Chiodini I, Battista C, et al. Sporadic and MEN1‐related primary hyperparathyroidism: differences in clinical expression and severity. J Bone Miner Res. 2009;24(8):1404-1410. doi: https://doi.org/10.1359/jbmr.090304
18. Lourenço DM, Toledo RA, Mackowiak II, et al. Multiple endocrine neoplasia type 1 in Brazil: MEN1 founding mutation, clinical features, and bone mineral density profile. Eur J Endocrinol. 2008;159(3):259-274. doi: https://doi.org/10.1530/EJE-08-0153
19. Balsalobre Salmeron M, Rodriguez Gonzalez JM, Ríos A, et al. Hiperparatiroidismo primario asociado a neoplasia endocrina múltiple tipo 1 (MEN 1). Experiencia en 71 casos. Cir Esp. 2018;96(10):627-633. doi: https://doi.org/10.1016/J.CIRESP.2018.06.014
20. Wang W, Nie M, Jiang Y, et al. Impaired geometry, volumetric density, and microstructure of cortical and trabecular bone assessed by HR-pQCT in both sporadic and MEN1-related primary hyperparathyroidism. Osteoporosis International. 2019;31(1):165-173. doi: https://doi.org/10.1007/S00198-019-05186-1
21. Marini F, Giusti F, Cioppi F, et al. Bone and mineral metabolism phenotypes in MEN1-related and sporadic primary hyperparathyroidism, before and after parathyroidectomy. Cells. 2021;10(8):1895. doi: https://doi.org/10.3390/CELLS10081895
22. Publishing Ltd B, Mosekilde L. Primary hyperparathyroidism and the skeleton. Clin Endocrinol (Oxf). 2008;69(1):1-19. doi: https://doi.org/10.1111/J.1365-2265.2007.03162.X
23. Gorbacheva A, Eremkina A, Goliusova D, et al. The role of menin in bone pathology. Endocr Connect. 2022;11(3):1404-1410. doi: https://doi.org/10.1530/EC-21-0494
24. Eller‐Vainicher C, Chiodini I, Battista C, et al. Sporadic and MEN1‐related primary hyperparathyroidism: Differences in clinical expression and severity. J Bone Miner Res. 2009;24(8):1404-1410. doi: https://doi.org/10.1359/jbmr.090304
25. Twigt BA, Scholten A, Valk GD, et al. Differences between sporadic and MEN related primary hyperparathyroidism; Clinical expression, preoperative workup, operative strategy and follow-up. Orphanet J Rare Dis. 2013;8(1):1-8. doi: https://doi.org/10.1186/1750-1172-8-50/FIGURES/1
26. Lourenço DM, Coutinho FL, Toledo RA, et al. Early‐onset, progressive, frequent, extensive, and severe bone mineral and renal complications in multiple endocrine neoplasia type 1–associated primary hyperparathyroidism. J Bone Miner Res. 2010;25(11):2382-2391. doi: https://doi.org/10.1002/jbmr.125
27. Thakker R V. Multiple endocrine neoplasia type 1 (MEN1) and type 4 (MEN4). Mol Cell Endocrinol. 2014;386(1-2):2-15. doi: https://doi.org/10.1016/J.MCE.2013.08.002
28. Бибик E.E., Еремкина А.К., Князева О.А., Мокрышева Н.Г. Спорадический первичный гиперпаратиреоз с множественной трансформацией околощитовидных желез // Проблемы Эндокринологии. — 2021. — Т. 67. — №6. — С. 31-38. doi: https://doi.org/10.14341/probl12798
29. de Laat JM, van der Luijt RB, Pieterman CRC, et al. MEN1 redefined, a clinical comparison of mutation-positive and mutation-negative patients. BMC Med. 2016;14(1):1-9. doi: https://doi.org/10.1186/S12916-016-0708-1/FIGURES/3
30. Дедов И.И., Мельниченко Г.А., Мокрышева Н.Г., и др. Проект клинических рекомендаций по диагностике и лечению первичного гиперпаратиреоза у взрослых пациентов // Эндокринная хирургия. — 2023. — Т. 16. — №4. — С. 5-54. doi: https://doi.org/10.14341/serg12790
31. Skandarajah A, Barlier A, Morlet-Barlat N, et al. Should routine analysis of the MEN1 gene be performed in all patients with primary hyperparathyroidism under 40 years of age? World J Surg. 2010;34(6):1294-1298. doi: https://doi.org/10.1007/S00268-009-0388-5
32. De Laat JM, Tham E, Pieterman CRC, et al. Predicting the risk of multiple endocrine neoplasia type 1 for patients with commonly occurring endocrine tumors. Eur J Endocrinol. 2012;167(2):181-187. doi: https://doi.org/10.1530/EJE-12-0210
Об авторах
Н. Г. МокрышеваРоссия
Мокрышева Наталья Георгиевна, д.м.н., профессор
SPIN-код: 5624-3875
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
А. К. Еремкина
Россия
Еремкина Анна Константиновна, к.м.н.
SPIN-код: 8848-2660
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
А. П. Милютина
Россия
Милютина Анастасия Павловна
SPIN-код: 6392-5111
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Р. Х. Салимханов
Россия
Салимханов Рустам Халилович
SPIN-код: 3988-3140
117036, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Е. А. Абойшева
Россия
Абойшева Елизавета Андреевна
SPIN-код: 3828-3502
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Е. Е. Бибик
Россия
Бибик Екатерина Евгеньевна
SPIN-код: 8522-9466
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
А. М. Горбачева
Россия
Горбачева Анна Максимовна
SPIN-код: 9815-7509
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
А. Р. Елфимова
Россия
Елфимова Алина Ринатовна
SPIN-код: 9617-7460
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Е. В. Ковалева
Россия
Ковалева Елена Владимировна
SPIN-код: 7387-6791
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
С. В. Попов
Россия
Попов Сергей Владимирович
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Г. А. Мельниченко
Россия
Мельниченко Галина Афанасьевна, д.м.н., профессор, академик РАН
SPIN-код: 8615-0038
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Дополнительные файлы
|
|
1. Рисунок 1. Дизайн исследования | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(503KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. ROC-кривая полученной модели логистической регрессии | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(112KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Мокрышева Н.Г., Еремкина А.К., Милютина А.П., Салимханов Р.Х., Абойшева Е.А., Бибик Е.Е., Горбачева А.М., Елфимова А.Р., Ковалева Е.В., Попов С.В., Мельниченко Г.А. Прогнозирование наличия мутации в гене MEN1 на основании клинического фенотипа пациентов с первичным гиперпаратиреозом. Проблемы Эндокринологии. 2023;69(5):4-15. https://doi.org/10.14341/probl13322
For citation:
Mokrysheva N.G., Eremkina A.K., Miliutina A.P., Salimkhanov R.Kh., Aboishava L.A., Bibik E.E., Gorbacheva A.M., Elfimova A.R., Kovaleva E.V., Popov S.V., Melnichenko G.A. Predicting the presence of MEN1 gene mutation based on the clinical phenotype of patients with primary hyperparathyroidism. Problems of Endocrinology. 2023;69(5):4-15. (In Russ.) https://doi.org/10.14341/probl13322

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).









































.jpg)


