Перейти к:
Гипергликемия, как побочный эффект алпелисиба: методы профилактики и лечения
https://doi.org/10.14341/probl13337
Аннотация
Рак молочной железы (РМЖ) является серьезным заболеванием, считается важной проблемой здравоохранения во всем мире. Распространенность заболевания у женщин, по данным Росстата, составила в РФ — 64 951 случай в 2020 г., (21,7% среди всех видов рака). На долю гормонозависимого эстроген-рецептор-положительного (ЭР+), отрицательного по рецептору эпидермального фактора роста человека 2-го типа (HER2-) метастатического рака молочной железы (мРМЖ) приходится 70% от всех случаев. Около 40% пациентов с ЭР+/HER2- мРМЖ имеют мутации в гене PIK3CA, приводящие к гиперактивации альфа-изоформы (p110α) фосфатидилинозитол-3-киназы (PI3K). Гормональная терапия с использованием или без использования ингибитора циклин-зависимых киназ 4 и 6 (CDK4/6) считается стандартным лечением пациентов с ЭР+/HER2- мРМЖ. Однако приобретенная резистентность к данной терапии остается проблемой. Инновационным методом лечения рака молочной железы является применение таргетных терапевтических агентов, направленных на прямое ингибирование пути PI3K в сочетании с гормонотерапией. Алпелисиб представляет собой PI3Kα-специфический ингибитор.
Гипергликемия выступает в качестве наиболее частого побочного явления при лечении алпелисибом. В настоящее время существует консенсус по профилактике и коррекции гипергликемии у пациентов, получающих терапию препаратом алпелисиб, в котором рекомендуется до начала терапии, с целью диагностики нарушений углеводного обмена и оценки степени риска развития гипергликемии, определять всем пациентам: уровень гликированного гемоглобина (HbA1c), глюкозы плазмы натощак (ГПН), индекс массы тела (ИМТ). А также оценивать такие факторы риска, как наличие семейного анамнеза по сахарному диабету 2 типа (СД2), наличие гестационного СД в анамнезе пациента или факт рождения детей с массой тела более 4 килограммов.
В последнее время активно применяются новые комбинации препаратов для лечения нарушений углеводного обмена, такие как пиоглитазон + метформин. В данной работе обсуждается механизм действия ингибиторов PI3K, новые лечебные комбинации и их нежелательные эффекты, представляется терапевтический опыт.
Для цитирования:
Кудаева Л.М., Кожедуб Е.Е., Купрышина В.О., Алиев Т.З., Трошина Е.А. Гипергликемия, как побочный эффект алпелисиба: методы профилактики и лечения. Проблемы Эндокринологии. 2024;70(2):70-77. https://doi.org/10.14341/probl13337
For citation:
Kudaeva L.M., Kozhedub E.E., Kupryshina V.O., Aliyev T.Z., Troshina E.A. Toxic manifestations of alpelisib in endocrinology. Description of the clinical case. Problems of Endocrinology. 2024;70(2):70-77. (In Russ.) https://doi.org/10.14341/probl13337
АКТУАЛЬНОСТЬ
Рак молочной железы (РМЖ) — наиболее распространенное злокачественное новообразование (ЗНО) у женщин в мире. Распространенность заболевания у женщин, по данным Росстата, составила в РФ 64 951 случай в 2020 г., (21,7% среди всех видов рака). На долю гормонозависимого эстроген-рецептор-положительного (ЭР+), отрицательного по рецептору эпидермального фактора роста человека 2 типа (HER2-) метастатического рака молочной железы (мРМЖ) приходится 70% от всех случаев. Около 40% пациентов с ЭР+/HER2- мРМЖ имеют мутации в гене PIK3CA, приводящие к гиперактивации альфа-изоформы (p110α) фосфатидилинозитол-3-киназы (PI3K). Гормональная терапия с использованием или без использования ингибитора циклин-зависимых киназ 4 и 6 (CDK4/6) является стандартным лечением пациентов с ЭР+/HER2- распространенным раком молочной железы [1].
Инновационным методом лечения рака молочной железы является применение таргетных терапевтических агентов, направленных на прямое ингибирование пути PI3K в сочетании с гормонотерапией [2]. Алпелисиб представляет собой PI3Kα-специфический ингибитор, одобренный управлением по контролю качества пищевых продуктов и лекарственных средств (Food and Drug Administration — FDA). Данный ингибитор используется в сочетании с фулвестрантом для лечения женщин в постменопаузе и мужчин с гормоноположительным ЭР+/HER2-, мутированным PIK3CA, мРМЖ [3]. Фулвестрант является антагонистом рецепторов эстрогенов, который в синергии с ингибиторами PI3K блокирует наиболее распространенный путь устойчивости к лечению [4]. Эта комбинация была утверждена на основании результатов рандомизированного двойного слепого плацебо-контролируемого исследования III фазы, проводимого для оценки эффективности и безопасности ингибитора PI3K: алпелисиба в комбинации с фулвестрантом у пациентов с ЭР+/HER2- мРМЖ с мутацией гена PIK3CA (SOLAR-1) [5].
У пациентов с РМЖ с мутированной формой PIK3CA, участвовавших в испытании, выживаемость без прогрессирования была почти удвоена в группе «алпелисиб — фулвестрант» по сравнению с группой «плацебо — фулвестрант» (11,0 вместо 5,7 месяца). Средняя общая выживаемость также была увеличена на 7,9 месяца в алпелисиб-фулвестрантной группе; однако этот анализ не пересекал заранее определенную границу статистической значимости [4].
Одна из важных проблем онкологических и эндокринологических сообществ — побочные проявления на фоне терапии ингибиторами, причем гипергликемия — это наиболее частое побочное проявление при лечении алпелисибом.
Известно, что действие инсулина осуществляется путем связывания с инсулиновым рецептором на поверхности клетки, что в свою очередь активирует внутриклеточные пути, например такие, как путь PI3K (рис. 1). Изоформа p110α PI3K опосредует реакции инсулина в мышцах, печени и жировых тканях [6].
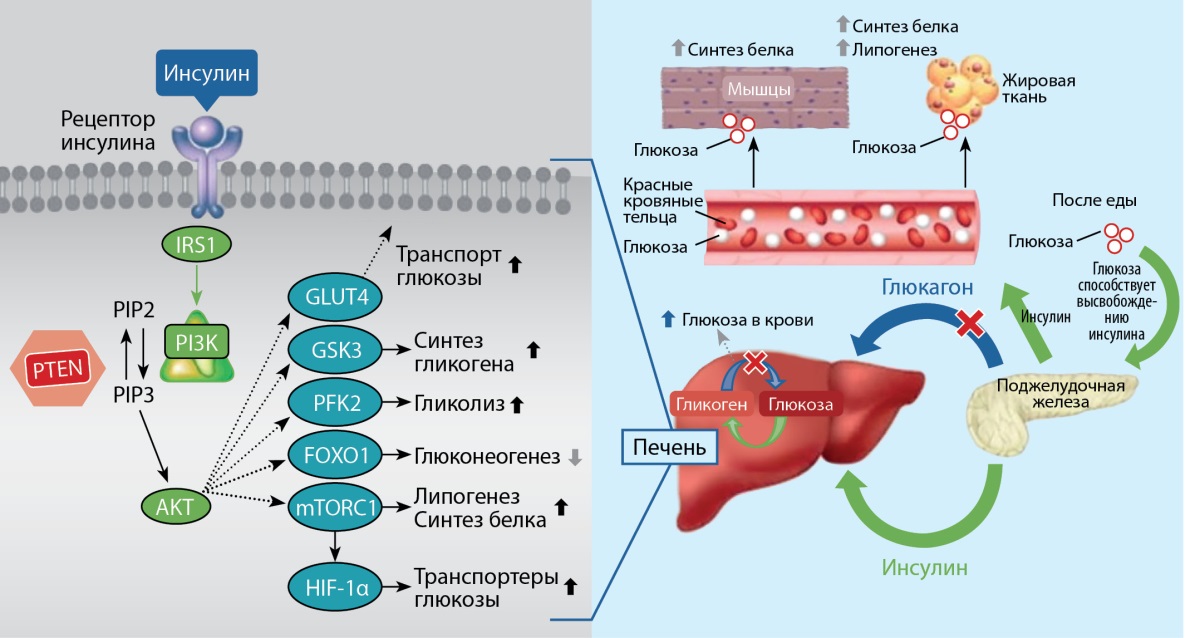
Рисунок 1. Роль инсулина и пути PI3K в нормальном гомеостазе глюкозы [8].
AKT протеинкиназа B,
GLUT4 — транспортер глюкозы 4 типа,
GS — гликогенсинтаза,
IRS1 — субстрат рецептора инсулина 1,
PFK2 — фосфофруктокиназа-2,
mTORC1 — мишень рапамицинового комплекса 1 у млекопитающих,
FOXO1 — фактор транскрипции PI3K фосфоинозитид-3-киназа,
PIP2 — фосфатидилинозитол 4, 5-бисфосфат,
PIP3 — фосфатидилинозитол 3, 4, 5-трифосфат,
PTEN — фосфатаза с двойной субстратной специфичностью,
S6K1 — рибосомальная протеинкиназа S6 бета-1,
HIF-1a — индуцированный гипоксией фактор 1α.
Figure 1. Role of insulin and the PI3K pathway in normal glucose homeostasis. [8]
AKT protein kinase B,
GLUT4 glucose transporter type 4,
GS glycogen synthase,
IRS1 substrate of insulin receptor 1,
PFK2 phosphofructokinase-2,
mTORC1 target of rapamycin complex 1 in mammals,
FOXO1 transcription factor PI3K phosphoinositide-3-kinase,
PIP2 phosphatidylinositol 4, 5-bisphosphate,
PIP3 phosphatidylinositol 3, 4, 5-triphosphate,
PTEN phosphatase with double substrate specificity,
S6K1 ribosomal protein kinase S6 beta-1,
HIF-1a hypoxia-induced factor 1α.
Механизм ингибирования пути PI3K/AKT/mTOR предназначен для вмешательства в рост и выживание раковых клеток; но также ингибирование этого пути приводит к гипергликемии, нарушая внутриклеточный ответ на инсулин, вызывая снижение транспорта глюкозы, снижение синтеза гликогена и увеличение распада глюкозы [7].
Мутация гена PIK3CA является причиной повышенной активации PI3K, которая стимулирует рост и деление раковых клеток [8]. Блокада PI3K с помощью препарата алпелисиб позволяет контролировать этот процесс, однако сопровождается развитием нежелательных явлений (НЯ), наиболее частым из которых отмечается гипергликемия [9]. По данным регистрационного исследования, гипергликемия различной степени выраженности развивается у 64% пациентов, получающих алпелисиб, а у 33% пациентов уровень гликемии достигает 14–28 ммоль/л, что приводит к развитию гиперинсулинемии и может снижать эффективность противоопухолевой терапии [9, 10]. Развитие гипергликемии на фоне применения препарата алпелисиб выступает в качестве физиологической реакции в ответ на блокирование белка PI3K, который регулирует передачу сигнала от рецепторов инсулина [11]. Гипергликемия, развивающаяся на фоне применения препарата алпелисиб, носит характер временного нежелательного явления, которое разрешается после отмены лечения, не формируя хронического нарушения метаболизма.
Согласно консенсусу по профилактике и коррекции гипергликемии, у пациентов, получающих терапию препаратом алпелисиб, пациент может быть отнесен к группе низкого риска при соответствии всех перечисленных критериев: ИМТ<25 кг/м², ГПН<6,1 ммоль/л, HbA1c<5,7%. Пациент может быть отнесен к группе умеренного риска при сочетании нормального уровня ГПН (<6,1 ммоль/л) с HbA1c 5,7–5,9% и/или наличием избыточной массы тела и хотя бы одного из дополнительных факторов риска. К группе высокого риска относят пациентов с избыточной массой тела или ожирением в сочетании с уровнем HbA1c 6,0–6,4% и/или диагностированным ранее преддиабетом (нарушенная гликемия натощак, нарушенная толерантность к глюкозе) [3].
В настоящее время актуально применение инсулин-сенситайзеров — к которым относят группы препаратов бигуаниды (метформин) и тиазолидиндионы (пиоглитазон), — с целью борьбы с инсулинорезистентностью, вызванной терапией алпелисибом. Взаимодополняющие действия пиоглитазона и метформина дают возможность лучше контролировать уровень глюкозы в крови. Эффективность заключается не только в улучшении контроля глюкозы, но и в снижении метаболического риска.
Мы представляем клинический случай развития гипергликемии у пациентки 60 лет с РМЖ на фоне специального лечения.
ОПИСАНИЕ СЛУЧАЯ
Пациентка Н. 60 лет. Впервые в 2011 г. поступила с предварительным диагнозом: «рак молочной железы» для дообследования и проведения специального лечения.
Анамнез жизни не отягощен. Семейный анамнез — отягощенный: сахарный диабет 2 типа у отца.
Пациентке, по результатам комплексного обследования, выставлен заключительный клинический диагноз: «рак левой молочной железы T1N2M0» и инициировано комплексное лечение в объеме: оперативное лечение — субтотальная радикальная резекция левой молочной железы (гистологическое заключение: инфильтрирующий дольковый рак); 5 курсов полихимиотерапии (ПХТ) по схеме CAF (циклофосфамид, метотрексат, 5-фторурацил); дистанционная лучевая терапия на шейно-надключичные л/у, парастернальные подмышечные л/у; суммарная очаговая доза (СОД) — 45 Гр, на ложе удаленной опухоли СОД — 50 Гр. По окончании ранее описанного комплексного лечения активирована антигормональная терапия препаратом Летрозол до 2016 г. включительно.
В начале 2021 г., по результатам контрольного обследования, у пациентки диагностировано прогрессирование основного заболевания в виде метастатического поражения костной структуры 12 грудного позвонка (согласно результатам ПЭТ КТ). Выполнено оперативное вмешательство в объеме: трепан-биопсия 12 грудного позвонка. По данным гистологического (Г/И) и иммуногистохимического (ИГХ) заключений: метастаз рака молочной железы, РЭ 4 балла, РП 0 баллов, HER2/neu отриц, Ki-67 4%.
Согласно результатам Г/И и ИГХ, с середины 2021 г., инициирована вторая линия специфической терапии в объеме: палбоциклиб, летрозол. При динамическом контроле (ПЭТ КТ от сентября 2022 г.) — прогрессирование заболевания в виде появления очагов в печени, новых очагов — в телах позвонков, подвздошных костях, крестце.
С октября 2022 г. начата терапия антиэстрогенным препаратом с противоопухолевым действием — фулвестрант, с декабря терапия дополнена PI3Kα-специфическим ингибитором — алпелисиб в дозировке 300 мг/сут. На момент лечения у пациентки отмечалось нарушение гликемии натощак в течение последних 2 лет (гликемия в диапазоне 6-6,5 ммоль/л). Постоянная гипогликемическая терапия не проводилась. Из объективного статуса известно: масса тела — 66 кг, рост — 158 см, ИМТ — 26,4 кг/м². Из лабораторных данных отмечается гликированный гемоглобин — 6,2%. Пациентке начата терапия метформином пролонгированного действия в дозировке 2000 мг/сут, алоглиптином — 25 мг/сут, пиоглитазоном — 30 мг/сут. Также прописана диета с ограничением углеводов с высоким гликемическим индексом и умеренная физическая активность. Повышение гликемии отмечалось со второго дня приема алпелисиба, препрандиальная гликемия до 7,5 ммоль/л, постпрандиальная гликемия до 11 ммоль/л (рис. 2).
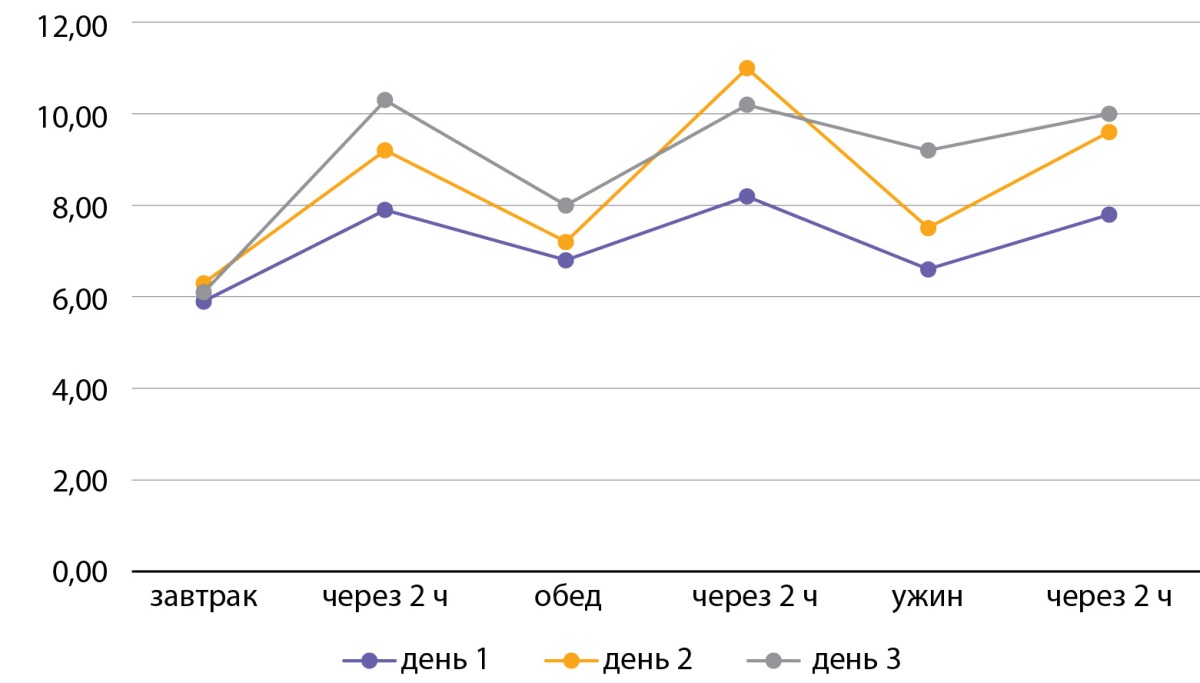
Рисунок 2. Контроль глюкозы в крови на фоне терапии (первые 72 часа).
Figure 2. Blood control for immune therapy (first 72 hours).
На 7-е сутки терапии отмечалась стойкая гипергликемия, максимально до 17,5 ммоль/л (рис. 3).
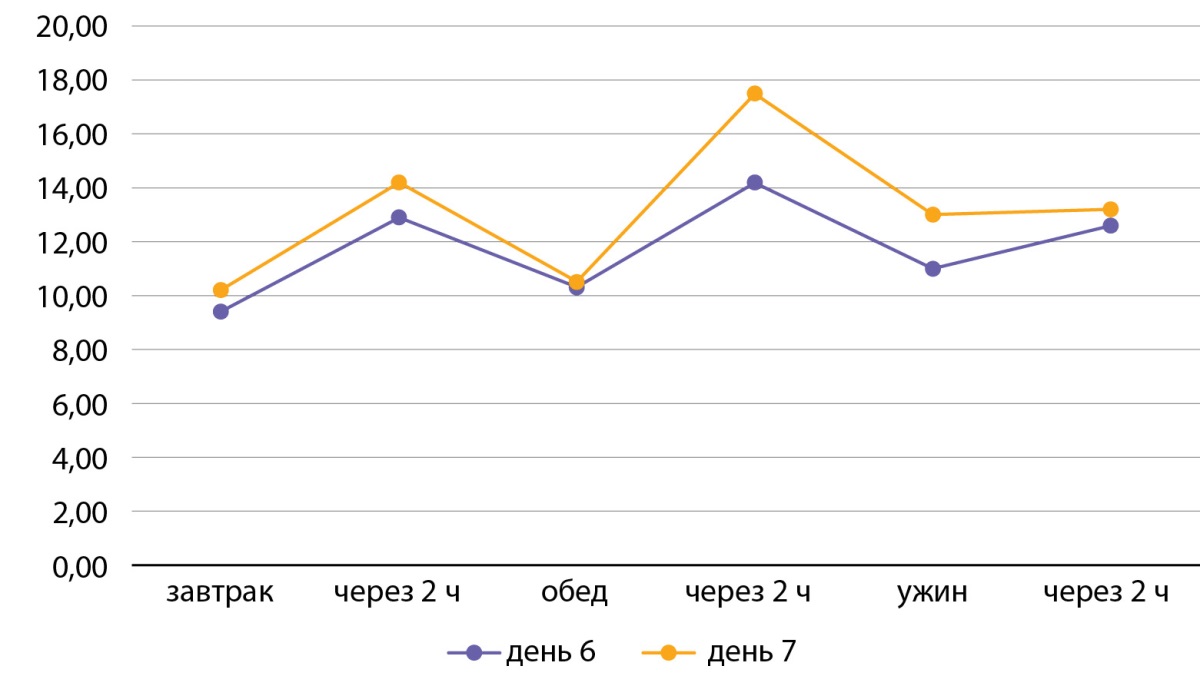
Рисунок 3. Контроль глюкозы в крови на фоне терапии (на 6-е и 7-е сутки).
Figure 3. Blood control for immune therapy (for 6 and 7 days).
В гипогликемическую терапию добавлен дапаглифлозин 10 мг/сут. На фоне данной терапии отмечалась положительная динамика к 10–11-м суткам в виде снижения гликемии (рис. 4).
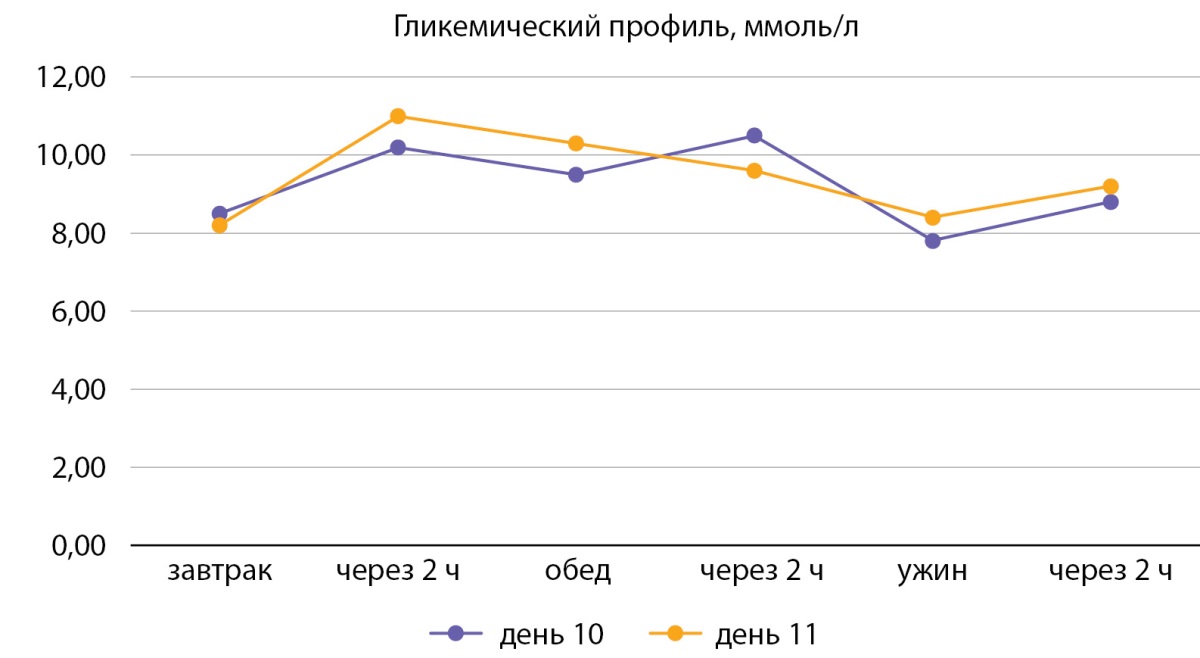
Рисунок 4. Контроль глюкозы в крови на фоне терапии (на 10-е и 11-е сутки).
Figure 4. Blood control for immune therapy (for 10 and 11 days).
На 15-е сутки лечения алпелесибом пациентка стала отмечать резко сниженный аппетит и кожный зуд. Для контроля за кетонурией ежедневно использовались тест-полоски. На 17-е сутки регистрировалось ухудшение состояния в виде усиления кожного зуда и появления болей в области живота. По результатам обследований у пациентки диагностирован холестатический синдром (ГГТ — 125 ед/л, ЩФ — 150 ед/л, АЛТ — 50 ед/л, АСТ — 15 ед/л), в клиническом анализе мочи определялись кетоновые тела (+++). Терапия алпелисибом временно прекращена. Дапаглифлозин, алоглиптин и пиоглитазон отменены, в терапию добавлен инсулин изофан (Протафан НМ) по 10 ед. 2 раза в сутки, инсулин короткого действия аспарт (новорапид) по 5–7 ед. перед приемами пищи и дополнительно — на коррекцию гипергликемии. Пациентка осмотрена гастроэнтерологом, назначена терапия урсодезоксихолевой кислотой.
Через 10 дней от начала инсулинотерапии отмечается стабилизация показателей гликемии, при контрольном анализе мочи кетоны не обнаружены. Возобновлена терапия алпелисибом в редуцированной дозе 250 мг/сут. Гипогликемическая терапия: инсулин изофан 12 ед. 2 раза в день, дапаглифлозин 10 мг/сут, метформин пролонгированного действия 2000 мг/сут, алоглиптин 25 мг/сут, пиоглитазон 30 мг/сут. Целевые показатели гликемии достигнуты при общей суточной дозе инсулина изофан 24 ед/сут. Препрандиальная гликемия до 8 ммоль/л, постпрандиальная гликемия до 11 ммоль/л (рис. 5).
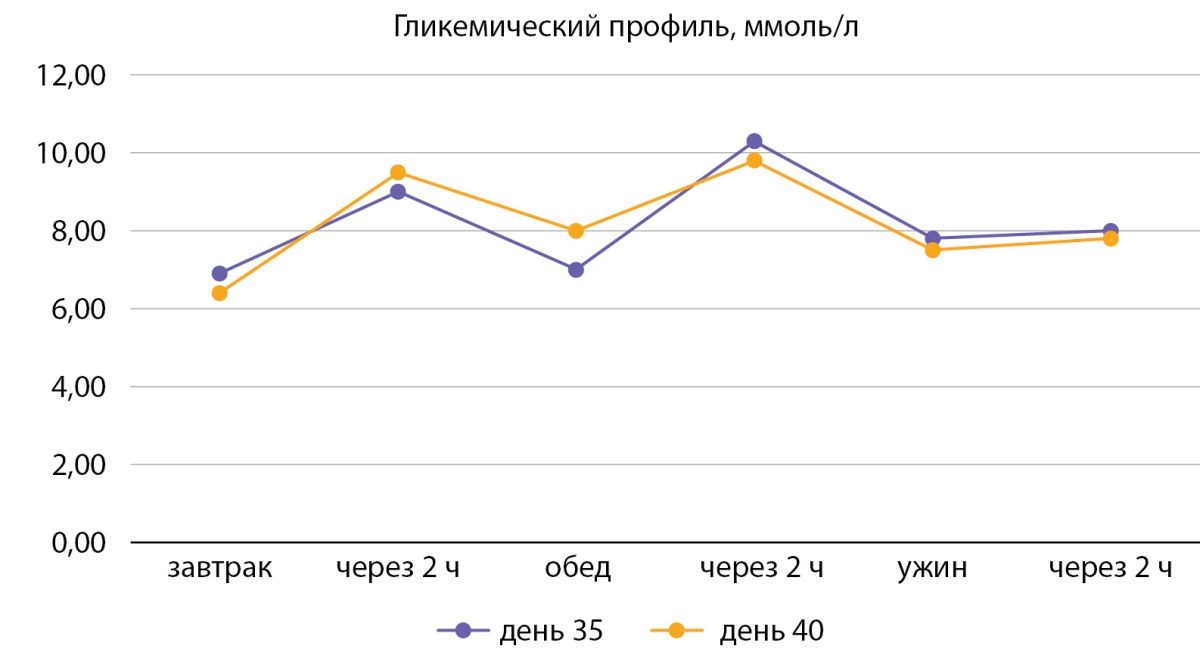
Рисунок 5. Контроль глюкозы в крови на фоне терапии (на 35–40-е сутки).
Figure 5. Blood control for immune therapy (for 35–40 days).
На фоне совместного использования пиоглитазона и инсулина средней длительности отечный синдром не отмечался. Кетоновые тела в динамике отрицательные. По данным контрольных инструментальных исследований (ПЭТ КТ) от марта 2023 г.: положительная динамика в виде уменьшения метаболической активности очагов в печени. Гликированный гемоглобин через 3 месяца лечения составлял 8,5%, что свидетельствует о декомпенсации углеводного обмена. В настоящий момент пациентка продолжает специальное лечение алпелесибом 250 мг/сут (редуцированная доза); гипогликемическая терапия в объеме: инсулин изофан 24 ед/сут, дапаглифлозин 10 мг/сут, метформин пролонгированного действия 2000 мг/сут, алоглиптин 25 мг/сут, пиоглитазон 30 мг/сут.
ОБСУЖДЕНИЕ
В исследовании SOLAR-1 более высокая частота гипергликемии наблюдалась у пожилых пациентов (≥75 лет) и пациентов с избыточным весом и ожирением на базовом уровне, получавших алпелисиб [12].
В настоящее время существует консенсус по профилактике и коррекции гипергликемии у пациентов, получающих терапию препаратом алпелисиб, составленный экспертами Российской ассоциации эндокринологов и Российского общества клинической онкологии. В нем рекомендуется до начала терапии, с целью диагностики нарушений углеводного обмена и оценки степени риска развития гипергликемии, определять всем пациентам: уровень гликированного гемоглобина (HbA1c), глюкозы плазмы натощак (ГПН), индекс массы тела (ИМТ). А также оценивать такие факторы риска, как наличие семейного анамнеза по СД2, наличие гестационного СД в анамнезе пациента или факт рождения детей с массой тела более 4 килограммов.
Согласно данному консенсусу выделяют 3 группы пациентов.
Группа низкого риска: ИМТ<25 кг/м², ГПН<6,1 ммоль/л, HbA1c<5,7%. Группа умеренного риска: ГПН (<6,1 ммоль/л), HbA1c 5,7–5,9% и/или наличие избыточной массы тела или хотя бы одного из дополнительных факторов риска. К группе высокого риска относят пациентов с избыточной массой тела или ожирением в сочетании с уровнем HbA1c 6,0–6,4% и/или диагностированным ранее предиабетом (нарушенная гликемия натощак, нарушенная толерантность к глюкозе). В качестве профилактики рекомендуется диета с исключением легкоусвояемых углеводов и умеренным ограничением медленноусвояемых углеводов, а также прием метформина в дозе, соответствующей группе риска.
Начальная доза метформина в группе низкого риска при ГПН выше 6,5 ммоль/л — 500 мг/сут с постепенным повышением дозы до 2000 мг/сут. Для группы умеренного риска рекомендуется профилактический прием метформина в суточной дозе 500–1000 мг до начала терапии алпелисибом, при ГПН>6,5 ммоль/л на фоне лечения —увеличение дозы до 2000 мг/сут, при необходимости назначается комбинация с другими сахароснижающими препаратами. В группе высокого риска всем пациентам до начала терапии алпелисибом назначается метформин в дозе 2000 мг/сут. При ГПН>7 ммоль/л рекомендуется комбинация метформина с другими сахароснижающими препаратами.
Также согласно консенсусу, в качестве препаратов 2-й линии сахароснижающей терапии рекомендуется назначать ингибиторы натрий-глюкозного котранспортера 2-го типа — НГЛТ-2. При необходимости усиления сахароснижающей терапии рекомендуется назначение комбинации 3–5 препаратов, предпочтительным является выбор лекарственных средств, улучшающих чувствительность к инсулину [2].
Blow T., Hyde P.N., Falcone J.N. et al. в 2021 г. определили 2 стратегии, которые эффективно отменили эти целевые неблагоприятные эффекты у пациентов: низкоуглеводная диета, благодаря которой истощаются запасы гликогена в печени и повышение выведения глюкозы мочой с помощью ингибиторов НГЛТ-2. В данной работе коллеги описали 3 клинических случая — пациенты с ЭР+/HER2−, мРМЖ, которые использовали в лечении алпелисиб, вызвавший гипергликемию. В первом клиническом случае пациент с сахарным диабетом первого типа держал под контролем сахар с помощью системы непрерывного мониторинга глюкозы (НМГ) и подкожной инсулиновой помпы. Благодаря полученным данным непрерывного мониторирования, удалось зафиксировать влияние алпелисиба на гомеостаз глюкозы. Наблюдалась острая, обратимая и глубокая резистентность к инсулину при введении алпелисиба, а также суточная потребность в инсулине увеличилась в 4,5 раза. Но если придерживаться низкоуглеводной диеты, можно понизить потребность. Во втором клиническом случае у пациента в анамнезе — нарушение гликемии натощак, и с началом приема алпелисиба развилась неконтролируемая гипергликимия. Для коррекции глюкозы был использован метформин и сенсибилизатор инсулина — пиоглитазон. Между тем скорректировать уровень глюкозы удалось только после назначения ингибитора НГЛТ-2, что позволило пациенту продолжить лечение алпелисибом еще 88 дней. У пациента с сахарным диабетом второго типа, описанного в третьем киническом случае, нарастала гипергликемия, несмотря на то что он придерживался низкоуглеводной диеты. Для регуляции глюкозы был использован ингибитор НГЛТ-2, и значения быстро скорректировались [13].
Инсулинорезистентность влечет за собой многочисленные нарушения в системах организма, участвующих в гомеостазе глюкозы. Таким образом, терапия, понижающая уровень глюкозы и устраняющая резистентность к инсулину, должна включать комбинации механизмов действия. Различие заключается в разном воздействии на гомеостаз печени и периферической глюкозы. Механизм действия метформина направлен на повышение скорости утилизации глюкозы мышцами за счет активации анаэробного гликолиза, а также угнетение глюконеогенеза, а пиоглизатон улучшает чувствительность к инсулину непосредственно за счет активации рецепторов PPARγ (peroxisome proliferator-activated receptor (рецепторы, активируемые пероксисомными пролифераторами)), которые экспрессируются в адипоцитах, печени и скелетных мышцах. Их активация обуславливает повышение экспрессии транспортеров глюкозы GLUT-1 и GLUT-4 на мембранах клеток печени и скелетной мускулатуры, что приводит к увеличению поглощения свободных жирных кислот и отложению их в подкожной жировой ткани [14].
Пиоглитазон в комбинации с инсулином может вызывать отечный синдром, это связанно с тем, что препарат стимулирует инсулиновые рецепторы PPARγ, которые при взаимодействии с инсулином вызывают задержку свободной жидкости в организме. В нашем клиническом случае у пациентки не наблюдался отечный синдром, ввиду выраженной инсулинорезистентности, а также интенсивной терапии ингибиторами НГЛТ-2, которые обладают диуретическим свойством.
Таким образом, алгоритм лечения гипергликемии, вызванной алпелисибом, следующий: препаратами первой линии являются сенситайзеры рецепторов инсулина — метформин и пиоглитазон, так как основная причина гипергликемии при лечении алпелисибом — резистентность к инсулину, ввиду того, что блокируется сам путь PI3K, который регулирует передачу сигнала от рецепторов инсулина. В качестве второй линии — ингибиторы НГЛТ-2, поскольку эти препараты действуют инсулин-независимо и посредством угнетения реабсорбции глюкозы в проксимальных почечных канальцах увеличивают ее экскрецию с мочой, в результате за счет гликозурии снижается уровень глюкозы в плазме. Однако следует контролировать кетоновые тела в моче по причине возможного развития кетоацидоза. Препараты, стимулирующие выработку инсулина, либо непосредственно сам инсулин не рекомендуется использовать, так как снижается эффективность алпелисиба. Но в некоторых случаях, например как в нашем, применение инсулина необходимо, чтобы вывести пациента из состояния кетоацидоза.
Начальная доза алпелисиба составляет 300 мг/сут. При необходимости она может быть снижена до 250, а затем до 200 мг/сут. Временная приостановка приема алпелисиба и возобновление приема в меньшей дозе из-за гипергликемии требуется при: развитии гипергликемии 3-й и 4-й степени (уровень ГПН>13,9 ммоль/л и ГПН>27,8 ммоль/л), а также при невозможности компенсировать показатели углеводного обмена на фоне комбинированной сахароснижающей терапии, включая инсулинотерапию. Алпелисиб повторно инициируется в более низкой дозе при достижении уровня ГПН<8,9 ммоль/л. Отмена алпелисиба из-за гипергликемии требуется при развитии диабетического кетоацидоза или невозможности компенсировать показатели углеводного обмена на фоне комбинированной сахароснижающей терапии, включая инсулинотерапию, после снижения дозы алпелисиба до 200 мг/сут [3].
В связи с основным побочным проявлением, гипергликимией, требуется тщательное изучение терапевтических комбинаций с алпелисибом, что позволит достичь значительной эффективности от антионкогенных свойств препарата без необходимости прерывания терапии.
ЗАКЛЮЧЕНИЕ
Терапия осложнений на фоне лечения алпелисибом РМЖ является одной из важных проблем, требующей дальнейшего изучения и проведения дополнительных перспективных клинических исследований для определения оптимальной стратегии лечения гипергликемии в целях предотвращения снижения дозы алпелисиба и прекращения лечения. Новые комбинации ингибиторов, используемые в терапии пациентов с раком молочной железы, могут открыть широкие терапевтические перспективы, особенно в случаях резистентности к гормональной монотерапии.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Кудаева Л.М. — обзор публикаций по теме статьи, анализ полученных данных, написание текста статьи; Кудаева Л.М., Кожедуб Е.Е. — разработка дизайна статьи, подготовка списка литературы, составление резюме; Купрышина В.О., Кожедуб Е.Е., Алиев Т.З. — обзор публикаций по теме статьи, написание текста статьи, изучение разных групп пациентов, анализ полученных данных, подготовка списка литературы; Трошина Е.А.— научное редактирование статьи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Согласие пациента. Информированное согласие от пациента добровольно получено и подписано на публикацию персональной медицинской информации в обезличенной форме (именно в этом журнале).
Благодарности. Выражаем благодарность своему научному руководителю Трошиной Екатерине Анатольевне за ценные советы при планировании научной работы и рекомендации по оформлению статьи.
Список литературы
1. Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2020 году (заболеваемость и смертность). М.: МНИОИ им. П.А. Герцена филиал ФГБУ «НМИРЦ» Минздрава России, 2020
2. Стенина М.Б., Жукова Л.Г., Королева И.А. и др. Практические рекомендации по лекарственному лечению рака молочной железы. Злокачественные опухоли. 2020. — 10(3s2). https://rosoncoweb.ru/standarts/RUSSCO/2020/2020-09.pdf
3. Mazurina NV, Artamonova EV, Beloyartseva MF, et al. The consensus on the prevention and correction of hyperglycemia in patients with HR+ HER2- metastatic breast cancer treated with alpelisib. Journal of Modern Oncology. 2020;22(4):56-59. doi: https://doi.org/10.26442/18151434.2020.4.200566
4. André F, Ciruelos EM, Juric D, et al. Alpelisib plus fulvestrant for PIK3CA-mutated, hormone receptorpositive, human epidermal growth factor receptor-2- negative advanced breast cancer: final overall survival results from SOLAR-1. Ann Oncol. 2021;32:208-217. doi: https://doi.org/10.1016/j.annonc.2020.11.011
5. Miller TW, Balko JM, Arteaga CL. Phosphatidylinositol 3-kinase and antiestrogen resistance in breast cancer. J Clin Oncol. 2011 Nov 20;29(33):4452-61. doi: https://doi.org/10.1200/JCO.2010.34.4879
6. Goncalves MD, Farooki A. Management of Phosphatidylinositol-3-Kinase Inhibitor-Associated Hyperglycemia. Integrative Cancer Therapies. 2022;21. doi: https://doi.org/10.1177/15347354211073163
7. Goldman JW, Mendenhall MA, Rettinger SR. Hyperglycemia Associated With Targeted Oncologic Treatment: Mechanisms and Management. Oncologist. 2016 Nov;21(11):1326-1336. doi: https://doi.org/10.1634/theoncologist.2015-0519
8. Семиглазова Т.Ю., Семиглазов В.В., Клименко В.В. и др. Применение алпелисиба для лечения HR+ HER2-метастатического рака молочной железы у пациентов с мутацией PIK3CA: результаты исследования SOLAR-1 // Фарматека. — 2020. — Т. 27. — №7. — С. 15-23. doi: https://doi.org/10.18565/pharmateca.2020.7.15-23
9. Andre F, Ciruelos E, Rubovszky G, et al. Alpelisib for PIK3CA-Mutated, Hormone Receptor-Positive Advanced Breast Cancer. N Engl J Med 2019;380:1929–40. doi: https://doi.org/10.1056/NEJMoa1813904
10. Rugo HS, André F, Yamashita T, et al. Time course and management of key adverse events during the randomized phase III SOLAR-1 study of PI3K inhibitor alpelisib plus fulvestrant in patients with HR-positive advanced breast cancer. Ann Oncol 2020;31(8):1001-10. doi: https://doi.org/10.1016/j.annonc.2020.05.001
11. Świderska E, Strycharz J, Wroblewski A, et al. Role of PI3K/AKT Pathway in Insulin-Mediated Glucose Uptake. 2018. doi: https://doi.org/10.5772/intechopen.80402
12. Rugo HS, André F, Yamashita T, et al. Time course and management of key adverse events during the randomized phase III SOLAR-1 study of PI3K inhibitor alpelisib plus fulvestrant in patients with HR-positive advanced breast cancer. Ann Oncol. 2020;31(8):1001-1010. doi: https://doi.org/10.1016/j.annonc.2020.05.001
13. Blow T, Hyde PN, Falcone JN, et al. Treating Alpelisib-Induced Hyperglycemia with Very Low Carbohydrate Diets and Sodium-Glucose Co-Transporter 2 Inhibitors: A Case Series. Integr Cancer Ther. 2021 Jan-Dec;20:15347354211032283. doi: https://doi.org/10.1177/15347354211032283
14. Pesheva ED, Fadeev VV. Pioglitazone is a forgotten hypoglycemic drug with proven cardioprotective and nephroprotective properties. Consilium Medicum. 2021;23(4):366–371. doi: https://doi.org/10.26442/20751753.2021.4.200892
Об авторах
Л. М. КудаеваРоссия
Кудаева Лана Муратовна
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Е. Е. Кожедуб
Россия
Кожедуб Евгений Евгеньевич
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
В. О. Купрышина
Россия
Купрышина Виктория Олеговна
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Т. З. Алиев
Россия
Алиев Теймур Зейнал оглы
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Е. А. Трошина
Россия
Трошина Екатерина Анатольевна, д.м.н., член-корр. РАН, профессор
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Дополнительные файлы
|
|
1. Рисунок 1. Роль инсулина и пути PI3K в нормальном гомеостазе глюкозы [8]. AKT протеинкиназа B, GLUT4 — транспортер глюкозы 4 типа, GS — гликогенсинтаза, IRS1 — субстрат рецептора инсулина 1, PFK2 — фосфофруктокиназа-2, mTORC1 — мишень рапамицинового комплекса 1 у млекопитающих, FOXO1 — фактор транскрипции PI3K фосфоинозитид-3-киназа, PIP2 — фосфатидилинозитол 4, 5-бисфосфат, PIP3 — фосфатидилинозитол 3, 4, 5-трифосфат, PTEN — фосфатаза с двойной субстратной специфичностью, S6K1 — рибосомальная протеинкиназа S6 бета-1, HIF-1a — индуцированный гипоксией фактор 1α. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(375KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Контроль глюкозы в крови на фоне терапии (первые 72 часа). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(134KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Контроль глюкозы в крови на фоне терапии (на 6-е и 7-е сутки). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(136KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Контроль глюкозы в крови на фоне терапии (на 10-е и 11-е сутки). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(121KB)
|
Метаданные ▾ | |
|
|
5. Рисунок 5. Контроль глюкозы в крови на фоне терапии (на 35–40-е сутки). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(125KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Кудаева Л.М., Кожедуб Е.Е., Купрышина В.О., Алиев Т.З., Трошина Е.А. Гипергликемия, как побочный эффект алпелисиба: методы профилактики и лечения. Проблемы Эндокринологии. 2024;70(2):70-77. https://doi.org/10.14341/probl13337
For citation:
Kudaeva L.M., Kozhedub E.E., Kupryshina V.O., Aliyev T.Z., Troshina E.A. Toxic manifestations of alpelisib in endocrinology. Description of the clinical case. Problems of Endocrinology. 2024;70(2):70-77. (In Russ.) https://doi.org/10.14341/probl13337

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).









































.jpg)


