Перейти к:
Эктопическая акромегалия вследствие нейроэндокринных опухолей легких: первое описание в России трех клинических случаев
https://doi.org/10.14341/probl13346
Аннотация
Акромегалия — нейроэндокринное заболевание, возникающее вследствие избыточной продукции гормона роста (соматотропного гормона, СТГ). В большинстве случаев причиной акромегалии являются аденомы гипофиза, продуцирующие СТГ. Гораздо реже встречаются случаи эктопической акромегалии. Последняя возникает вследствие опухолей, продуцирующих гормон роста-рилизинг гормон (ГРРГ), или опухолей внегипофизарной локализации, продуцирующих СТГ. Основными источниками секреции ГРРГ являются нейроэндокринные опухоли (НЭО) легких и поджелудочной железы. Лечение эктопической акромегалии заключается в хирургическом удалении источника гиперпродукции ГРРГ, а в случае невозможности радикального удаления используют аналоги соматостатина длительного действия, пэгвисомант, химиотерапию, иммунотерапию, лучевую терапию.
В данной статье приведено описание трех клинических случаев эктопической акромегалии вследствие ГРРГ-продуцирующих НЭО легких, каждый из которых примечателен рядом особенностей. В первых двух случаях акромегалия имела мягкое течение и неяркие клинические проявления, при этом во 2 случае имелось сочетание эктопической акромегалии и первичного гиперпаратиреоза. В 3 случае эктопическая акромегалия сочеталась с макроаденомой гипофиза, и после хирургического лечения НЭО ремиссия акромегалии не наступила. Во всех трех случаях НЭО легких были обнаружены случайно при проведении рентгенологического обследовании грудной клетки по поводу других состояний.
Ключевые слова
Для цитирования:
Мамедова Е.О., Пржиялковская Е.Г., Бурякина С.А., Бондаренко Е.В., Лапшина А.М., Пикунов М.Ю., Белая Ж.Е., Мельниченко Г.А. Эктопическая акромегалия вследствие нейроэндокринных опухолей легких: первое описание в России трех клинических случаев. Проблемы Эндокринологии. 2024;70(1):66-80. https://doi.org/10.14341/probl13346
For citation:
Mamedova E.O., Przhiyalkovskaya E.G., Buryakina S.A., Bondarenko E.V., Lapshina A.M., Pikunov M.Yu., Belaya Zh.E., Melnichenko G.A. Ectopic acromegaly due to bronchial neuroendocrine tumors: the first description in Russia of three clinical cases. Problems of Endocrinology. 2024;70(1):66-80. https://doi.org/10.14341/probl13346
АКТУАЛЬНОСТЬ
Акромегалия — тяжелое хроническое нейроэндокринное заболевание, возникающее вследствие избыточной продукции гормона роста (соматотропного гормона, СТГ) [1]. Более чем в 95% случаев причиной акромегалии являются аденомы гипофиза, продуцирующие СТГ (как спорадические, так и семейные формы) [2][3]. Гораздо реже (менее 5%) встречаются случаи эктопической акромегалии [4]. Термин «эктопическая акромегалия», по сути, объединяет три понятия. Во-первых, это опухоли, продуцирующие гормон роста-рилизинг гормон (соматолиберин, ГРРГ), который, в свою очередь, стимулирует избыточную продукцию СТГ интактным гипофизом. К ним относятся как опухоли гипоталамуса (гамартомы, глиомы, ганглиоцитомы), при которых может развиваться гиперплазия, а затем СТГ-продуцирующая аденома гипофиза, так и нейроэндокринные опухоли (НЭО) или, редко, опухоли не нейроэндокринной природы различной локализации, продуцирующие ГРРГ [5]. Во-вторых, эктопические аденомы гипофиза, продуцирующие СТГ, располагающиеся за пределами турецкого седла — в клиновидной пазухе, пирамиде височной кости, полости носоглотки [6]. В-третьих, экстракраниальные опухоли, продуцирующие СТГ (например, НЭО поджелудочной железы [7], неходжкинская лимфома [8]). Первое описание эктопической акромегалии относится к 1949 г., когда Goldman описал пациента с сочетанием НЭО легкого, опухоли гипофиза и двусторонних образований надпочечников, предположив, что опухоль легкого вырабатывает фактор, стимулирующий рост опухолей в других органах [цитируется по 5]. Роль опухоли легкого как причины акромегалии была впервые доказана Altmann и Schütz, которые в 1959 г. сообщили о пациенте с клиническими проявлениями акромегалии, у которого не наступила ремиссия заболевания после облучения гипофиза, но заметно улучшилось состояние после резекции опухоли легкого [цитируется по 9]. В 1982 г. две независимые группы выделили белок, стимулирующий выработку СТГ (названный ГРРГ), из ткани опухоли поджелудочной железы у двух пациентов с акромегалией [10][11], что позволило установить причинно-следственную связь между развитием акромегалии и наличием опухоли внегипофизарной локализации.
К 2012 г. Garby и соавт. опубликовали обзор литературы, суммировавший данные о 53 известных случаях эктопической акромегалии [12], а Ghazy и соавт. — данные о 98 случаях [13]. В 2022 г. Zendran и соавт. опубликовали обзор, суммировавший данные о 127 известных случаях [14]. В целом в 2/3 случаях эктопическая акромегалия выявляется у женщин [13], а основными источниками секреции ГРРГ при эктопической акромегалии являются НЭО легких (типичные и атипичные карционоиды легких) (до 43%) и поджелудочной железы (до 35%) [14]. В единичных случаях могут встречаться феохромоцитомы, параганглиомы, лимфомы, тимомы и некоторые другие опухоли [12–14]. Только в двух случаях ГРРГ-продуцирующие опухоли имели не нейроэндокринную природу (диффузная крупная В-клеточная лимфома [15] и аденокистозная карцинома легкого [16]). Среди интракраниальных источников эктопической продукции ГРРГ чаще встречаются смешанные ганглиоцитомы-аденомы гипофиза [14].
Клиническая картина эктопической акромегалии не отличается от таковой при типичной акромегалии, а заподозрить ее можно при отсутствии визуализации аденомы гипофиза по данным магнитно-резонансной томографии (МРТ) головного мозга или при выявлении диффузной гиперплазии гипофиза [17]. Сложность диагностики эктопической акромегалии заключается в поиске источника продукции ГРРГ, а основным методом лечения является удаление первичной опухоли [13][14]. В случае невозможности радикального удаления опухоли могут быть назначены аналоги соматостатина длительного действия, пэгвисомант, химиотерапия, иммунотерапия, лучевая терапия [13][14].
В статье приведено описание трех клинических случаев эктопической акромегалии вследствие ГРРГ-продуцирующих НЭО легких, каждый из которых примечателен рядом особенностей. В России клинические случаи эктопической акромегалии ранее описаны не были.
ОПИСАНИЕ СЛУЧАЕВ
Случай 1
Пациентка С.Н.Ю. 1962 г.р., впервые госпитализирована в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России в возрасте 58 лет. Считала себя больной в течение 6–7 лет, когда стала отмечать изменение внешности (отечность лица, увеличение размера стоп), снижение веса, общую слабость, раздражительность. При плановом осмотре гинекологом в 2014 г. заподозрена акромегалия, рекомендовано проведение МРТ головного мозга, в ходе которой визуализирована микроаденома гипофиза. В гормональном анализе крови выявлена гиперпролактинемия (исходные данные не предоставлены), была назначена терапия каберголином в дозе 0,25 мг один раз в неделю, на фоне чего достигнута нормализация уровня пролактина. В 2015 г. впервые определены повышенные концентрации инсулиноподобного фактора роста 1 (ИФР-1) и СТГ, установлен диагноз «Акромегалия». При контрольном обследовании по МРТ в 2016 г. сохранялась микроаденома гипофиза размерами 5х5 мм. С сентября 2016 г. в связи со стойкой нормопролактинемией каберголин отменен, начата медикаментозная терапия акромегалии аналогами соматостатина — октреотидом пролонгированного действия 20 мг 1 раз в 28 дней внутримышечно, который она получала в течение 6 месяцев. На фоне лечения пациентка отмечала улучшение самочувствия, однако ИФР-1 сохранялся повышенным. В связи с плохой переносимостью октреотида (уплотнение и гиперемия в местах инъекций) терапия была отменена. В декабре 2016 г. вновь выявлена гиперпролактинемия до 1098 мЕд/л, периодически возобновлялась и отменялась терапия каберголином. Динамики размеров аденомы гипофиза на фоне проводимого медикаментозного лечения аналогами соматостатина и каберголином отмечено не было.
В феврале 2017 г. во время плановой флюорографии у пациентки впервые выявлено объемное образование левого легкого. При проведении мультиспиральной компьютерной томографии (МСКТ) описано образование в корне левого легкого с четкими ровными контурами размерами 44х42х50 мм, неоднородной плотности с мелкими включениями кальция, плотностью 32–30 ед.Н. Образование было подозрительно в отношении злокачественного роста, поэтому в мае 2017 г. в онкологическом диспансере по месту жительства выполнена типичная сегментэктомия S4-5 слева, лимфаденэктомия. По данным иммуногистохимического (ИГХ) исследования удаленной опухоли, верифицирована высокодифференцированная НЭО легкого, Grade 1, индекс пролиферации Ki-67 менее 2%, что характерно для типичного карциноида. В послеоперационном периоде пациентка отметила значительное улучшение самочувствия: возвращение исходного веса (набор массы тела на 18 кг), исчезновение отеков лица, уменьшение общей слабости. При динамическом контроле гормональных показателей достигнута нормализация уровня ИФР-1 и гормона роста. После проведения МСКТ данных за рецидив опухоли не получено. У пациентки сохранялась гиперпролактинемия: уровень мономерного пролактина составил 1897 мЕд/л, микроаденома гипофиза размерами 4х5х5 мм, пациентка периодически получала терапию каберголином с положительным эффектом и продолжала наблюдаться у эндокринолога с диагнозом «Акромегалия», так как связи между удалением опухоли легкого и достижением ремиссии акромегалии установлено не было.
В 2020 г. у пациентки с акромегалией, микроаденомой гипофиза, НЭО легкого, повышением уровня хромогранина А до 169,12 мкг/л (0–100) был заподозрен синдром множественных эндокринных неоплазий 1 типа (МЭН-1), в связи чем она направлена на госпитализацию в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России. В ходе стационарного обследования подтверждена ремиссия акромегалии: ИФР-1 — 177,2 нг/мл (17–238), минимальный уровень гормона роста в ходе перорального глюкозо-толерантного теста (ПГТТ) — 0,274 нг/мл. При физикальном обследовании отмечались мягкие проявления акромегалии (рис. 1). По данным МРТ головного мозга, на границе адено- и нейрогипофиза определялась слабо гиперинтенсивная на Т2 и гипоинтенсивная на Т1 ВИ структура, убедительно не накапливающая контрастный препарат, шириной 14,4 мм, высотой — до 7,3 мм, передне-задний размер — 2 мм. Образование наиболее соответствовало кисте кармана Ратке. В передне-правом отделе аденогипофиза по контуру дна и правого кавернозного синуса определялся участок слабо сниженного накопления контрастного препарата размерами 5х5,7 мм (микроаденома). Воронка не смещена. Отмечался диффузно сниженный МР-сигнал на Т2 ВИ (рис. 2). По данным дополнительного ИГХ-исследования, в удаленном карциноиде легкого экспрессии СТГ не обнаружено, выявлена диффузная экспрессия ГРРГ (рис. 3 А, Б).
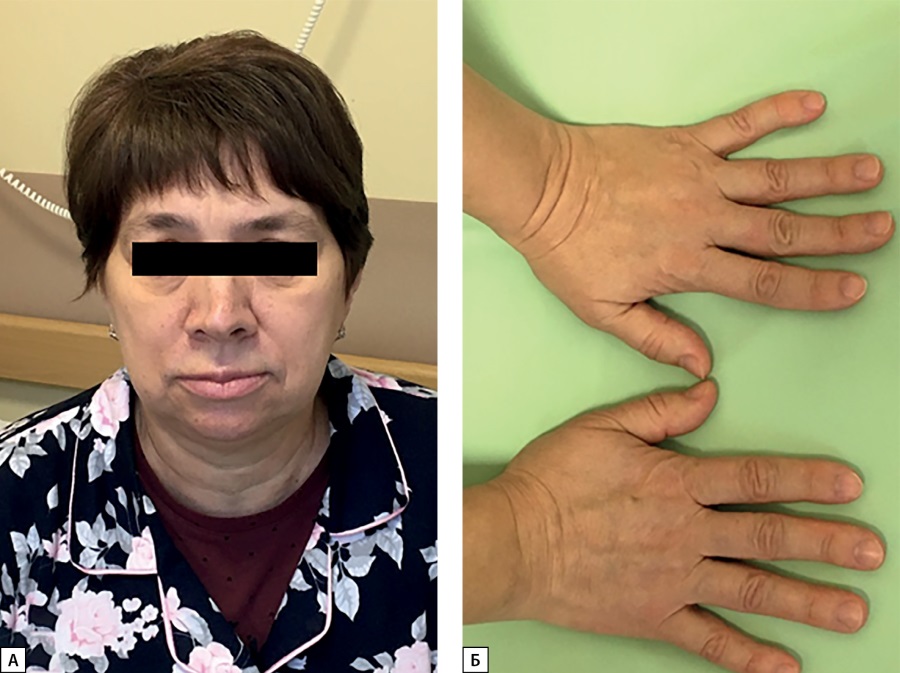
Рисунок 1. Пациентка С.Н.Ю. Типичные изменения внешности
при мягкой форме акромегалии в пожилом возрасте:
небольшое укрупнение черт лица (А), увеличение кистей (Б).
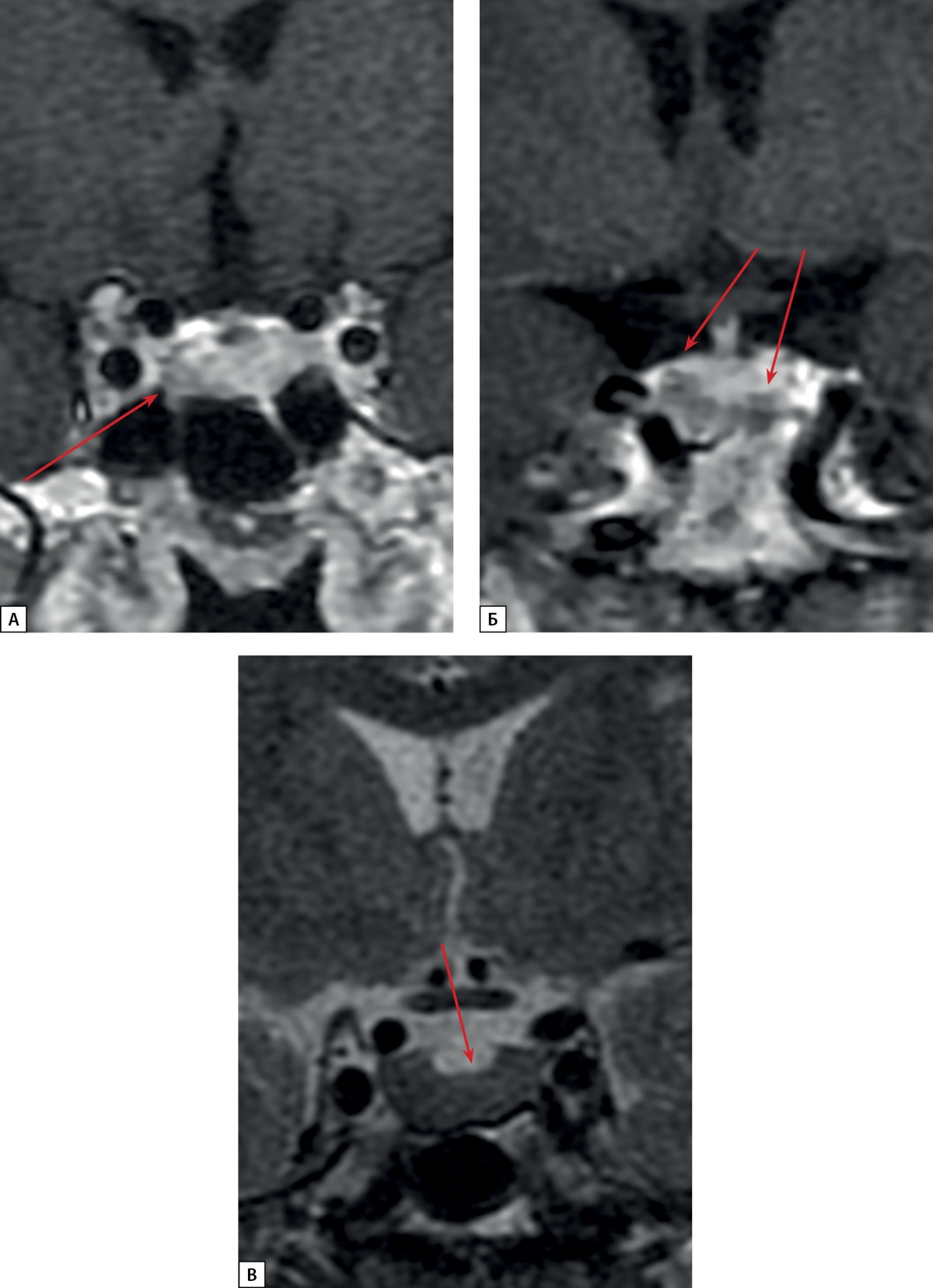
Рисунок 2. МРТ гипофиза пациентки С.Н.Ю., корональная проекция:
А. Т1 ВИ с контрастном усилением.
Микроаденома в левом отделе аденогипофиза (стрелка)
Б. Т1 ВИ с контрастным усилением. Киста кармана Ратке (стрелки)
В. Т2 ВИ. Диффузно-сниженный МР-сигнал
на Т2 ВИ от ткани аденогипофиза (стрелка).
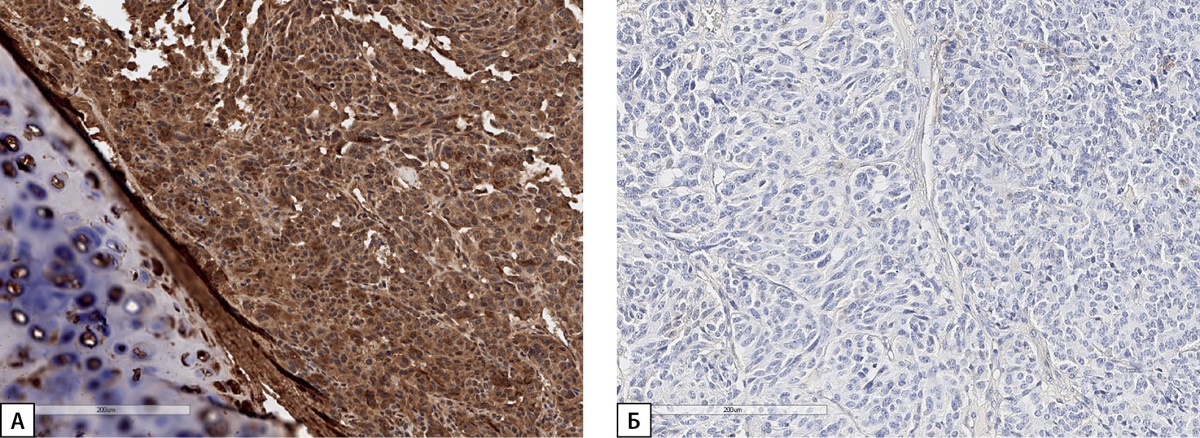
Рисунок 3. Иммуногистохимическое исследование карциноида легкого
пациентки С.Н.Ю.
(А) — диффузная экспрессия ГРРГ;
(Б) — отсутствие экспрессии СТГ. Гистосканы.
В рамках обследования на предмет осложнений акромегалии данных за нарушение углеводного обмена не получено (глюкоза крови натощак — 4,88 ммоль/л, через 2 часа после нагрузки — 5,8 ммоль/л). Учитывая наличие многоузлового зоба в анамнезе, проведено ультразвуковое исследование щитовидной железы, в ходе которого выявлено увеличение объема до 27,7 мл с множественными узловыми образованиями размерами максимально до 3,8 см в диаметре в правой доле и до 1,3 см — в левой доле щитовидной железы. По данным тонкоигольной пункционной биопсии, подтвержден коллоидный в разной степени пролиферирующий зоб (Bethesda II). При гормональном обследовании — эутиреоз (ТТГ — 0,565 мМЕ/л, Т4св — 14,1 пмоль/л (9,0–19,0), Т3св — 3,5 пмоль/л (2,6–5,7), кальцитонин — 3,41 пг/мл (0–4,8). Осложнений со стороны сердечно-сосудистой системы у пациентки не обнаружено. В ходе колоноскопии исключены новообразования толстой кишки. В связи с жалобами на боли в спине выполнена рентгенография позвоночника, выявлен компрессионный перелом 12-го грудного позвонка, установлен диагноз: «Остеопороз смешанного генеза» и назначена антирезорбтивная терапия.
На фоне отмены каберголина и достижения ремиссии акромегалии обращало внимание сохранение повышения мономерного пролактина до 1116 мЕд/л (64–395). Для исключения возможных вторичных причин повышения уровня пролактина пациентка обследована на предмет гинекологических заболеваний — патологии не обнаружено. Из возможных причин гиперпролактинемии у пациентки имеется фиброзно-кистозная мастопатия. Учитывая умеренное повышение уровня пролактина, достижение нормопролактинемии на фоне приема небольшой дозы каберголина, отсутствие положительной динамики роста аденомы гипофиза, микроаденома гипофиза расценена как гормонально-неактивная. Учитывая сочетание микроаденомы гипофиза и НЭО легкого, проведено скрининговое обследование на предмет возможных компонентов синдрома МЭН-1: данных за первичный гиперпаратиреоз (ПГПТ), объемные образования поджелудочной железы, надпочечников не получено. Анализ крови на хромогранин А — 2,1 нмоль/л (менее 2).
В 2022 г. пациентка продолжила наблюдение в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России: сохранялась стойкая ремиссия акромегалии, наблюдалась положительная динамика минеральной плотности костной ткани после введения золедроновой кислоты.
Случай 2
Пациентка Д.И.Е. 1959 г.р., впервые госпитализирована в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России в возрасте 60 лет с жалобами на выраженную общую слабость, головные боли, боли в суставах, потливость, снижение массы тела, отеки лица. Пациентка считала себя больной в течение последних двух лет, когда при обследовании после перенесенного гриппа было выявлено повышение глюкозы в крови до 9,3 ммоль/л, в последующем показатели гликемии нормализовались и была рекомендована диетотерапия. В связи с общим недомоганием пациентка обратилась к эндокринологу по месту жительства, и при обследовании было выявлено повышение уровня ИФР-1 до 349 нг/мл (норма до 200). По МРТ головного мозга отмечалась выраженная неоднородность структуры аденогипофиза слева, где нельзя было исключить аденому гипофиза. Центрально отмечалась гиперинтенсивная на Т2 ВИ структура размерами 3,8х1,5 мм, не накапливающая контрастный препарат (киста кармана Ратке). МР сигнал от аденогипофиза был нерезко снижен на Т2 ВИ (рис. 4 а, б).
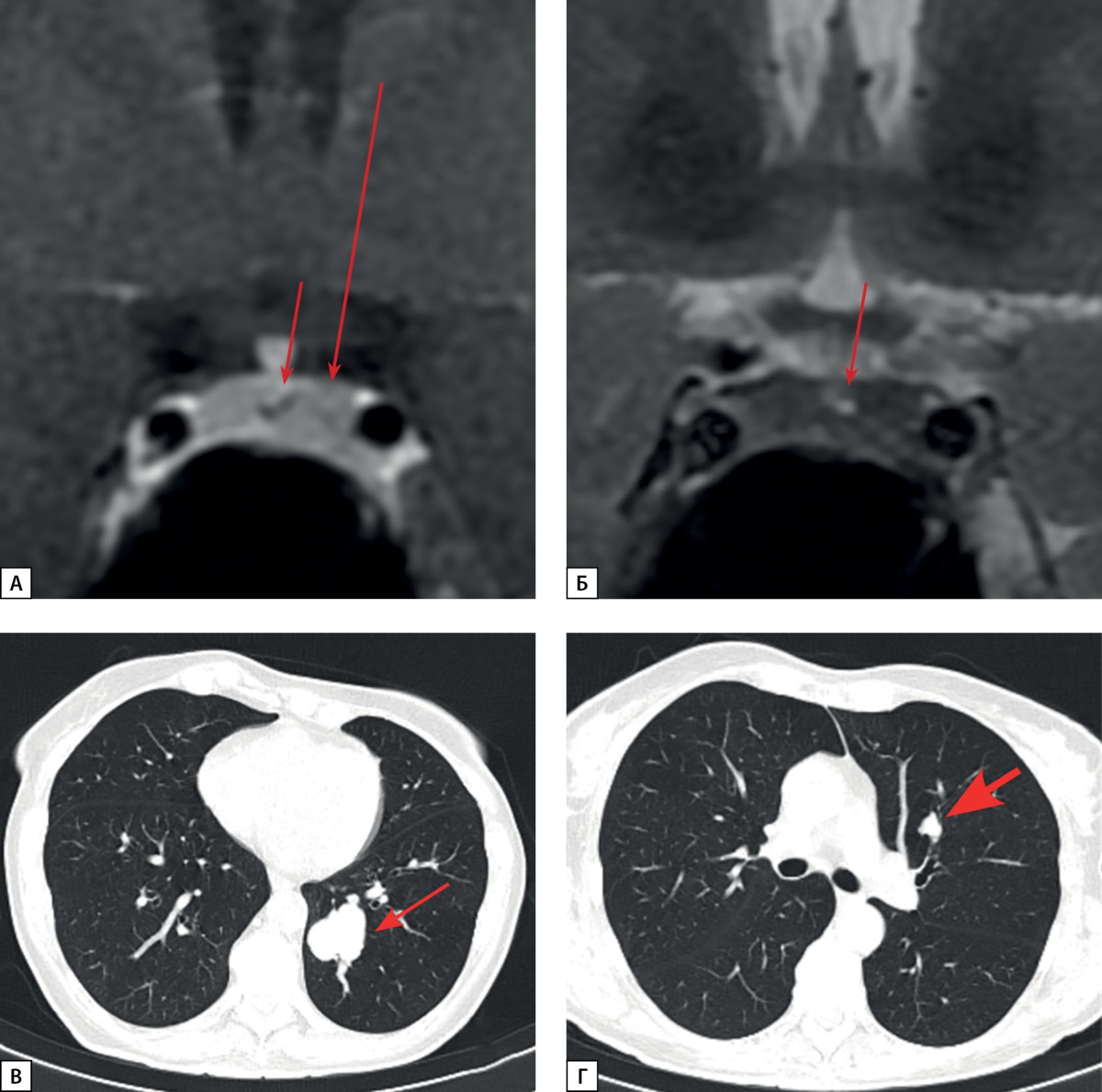
Рисунок 4. МРТ и КТ исследования пациентки Д.И.Е.
а) МРТ гипофиза, корональная проекция, Т1 ВИ с контрастным усилением.
Киста кармана Ратке (стрелка).
Зона слабо сниженного накопления контрастного препарата
в левом отделе аденогипофиза (длинная стрелка);
б) Киста кармана Ратке (стрелка).
Диффузно сниженный МР сигнал на Т2 ВИ от ткани аденогипофиза;
в) МСКТ легких, легочный режим, нативная фаза, аксиальная проекция.
Нейроэндокринная опухоль в S10 левого легкого (короткая стрелка);
г) МСКТ легких, легочный режим, нативная фаза, аксиальная проекция.
Образование в S3 левого легкого с внутри- и перибронхиальным
распространением — очаг отсева (толстая стрелка).
При госпитализации в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России подтверждена активная стадия акромегалии: ИФР-1 591,1 нг/мл (15–230), при проведении СТГ в ходе ПГТТ минимальное значение СТГ 2,53 нг/мл. Примечательно, что клинические признаки акромегалии были неярко выражены: небольшая отечность лица и укрупнение носа и пальцев рук. Также при обследовании впервые верифицирован диагноз ПГПТ: выявлено повышение уровня паратгормона до 78,8 пг/мл (15–65), кальций общий 2,51 ммоль/л (2,15–2,55), при ультразвуковом исследовании околощитовидных желез выявлено образование правой нижней околощитовидной железы 1,2х0,5х0,7 см. Из осложнений ПГПТ выявлена остеопения в 33% лучевой кости до -2,0 SD по Т-критерию. В феврале 2019 г. проведена трансназальная транссфеноидальная аденомэктомия. При проведении СТГ в ходе ПГТТ в раннем послеоперационном периоде максимальное подавление СТГ составило 0,89 нг/мл. После проведенного нейрохирургического вмешательства на гипофизе доставленный операционный материал был представлен тканью аденогипофиза с обширными полями оксифильных клеток, заподозрено наличие опухоли гипофиза. Однако на дополнительных срезах с импрегнацией серебром была обнаружена сохранная сеть ретикулиновых волокон с микрофокусами расширенных ацинусов, что соответствует гиперплазии аденогипофиза. При иммуногистохимическом исследовании большинство клеток были иммунопозитивные к СТГ (рис. 5).

Рисунок 5. Гистологическое и иммуногистохимическое исследование
операционного материала гипофиза пациентки Д.И.Е.
(А) — ткань аденогипофиза с обширными полями оксифильных клеток
(гемотоксилин-эозин).
(Б) — сохранная сеть ретикулиновых волокон с расширенными ацинусами
(импрегнация серебром).
(В) — диффузное окрашивание клеток аденогипофиза СТГ
(иммуногистохимическая реакция с антителами к СТГ).
Гистосканы.
С учетом сочетания акромегалии и ПГПТ, с целью исключения синдрома МЭН-1, проведено высокопроизводительное параллельное секвенирование панели генов-кандидатов (AIP, CASR, CDKN1A, CDKN1B, CDKN1C, CDKN2A, CDKN2C, CDKN2D, DICER1, GNAS, CDC73, MEN1, POU1F1, PRKAR1A, PRKCA, PTTG2, SDHA, SDHB, SDHC, SDHD (общее покрытие кодирующих экзонов: 96,7%)), по результатам которого патологически значимых изменений выявлено не было.
При контроле ИФР-1 через 3 месяца после оперативного вмешательства сохранялось его повышение до 389,2 нг/мл (89–255). При повторной госпитализации в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России через год после оперативного вмешательства подтверждено отсутствие ремиссии акромегалии: ИФР-1 414,5 нг/мл (17–238). Однако по МРТ головного мозга с контрастом убедительных данных за наличие остаточной ткани аденомы гипофиза получено не было. Была рекомендована терапия октреотидом пролонгированного действия, на фоне чего отмечалась нормализация уровня ИФР-1 до 196,6 нг/мл (93–224).
В возрасте 61 года пациентка перенесла новую коронавирусную инфекцию, и при проведении МСКТ органов грудной клетки в S10 левого легкого было выявлено объемное образование неправильной формы с четкими, полицикличными контурами размерами 32х32 мм, плотностью 34 ед.Н (рис. 4 в, г). Образование располагалось в просвете заднего базального бронха, а также перибронхиально в паренхиме S10. Определялась частичная консолидация паренхимы сегмента дистальнее образования (субсегментарные ателектазы). В S3 левого легкого определялось второе образование, с четкими неровными контурами, размерами 16х13 мм, плотностью 56 ед.Н. Образование также было расположено в просвете переднего бронха и в паренхиме S3. Регионарные лимфатические узлы не увеличены. По заключению: образование в S10 левого легкого наиболее соответствует НЭО. Субсегментарные ателектазы в S10 левого легкого дистальнее образования. Образование в S3 — очаг отсева. По месту жительства выполнена видеоторакоскопическая нижняя лобэктомия слева, лимфодиссекция слева. По результатам гистологического исследования: атипичный карциноид, Grade 2, максимальный размер опухоли 30 мм. В крае резекции бронха, краях резекции сосудов, висцеральной плевре, а также ни в одном из исследованных образцов опухолевый рост не обнаружен.
В связи с подозрением на эктопическую акромегалию, в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России были пересмотрены гистологические препараты и проведено ИГХ-исследование удаленной опухоли. По заключению: в готовых гистологических препаратах, окрашенных гематоксилином и эозином, в ткани легкого обнаружена опухоль с признаками нейроэндокринной дифференцировки с 2 митозами, признаками инвазивного роста в бронх, 7 лимфоузлов с реактивными изменениями, без элементов опухолевого роста. В готовых гистологических препаратах, окрашенных с антителами к Ki-67, TTF-1, цитокератину АЕ1/3, CD56, обнаружена экспрессия TTF-1, цитокератина АЕ1/3, CD56 в клетках опухоли, индекс метки Ki-67=13,2%. При ИГХ исследовании с антителами к ГРРГ наблюдается его очаговая экспрессия в большинстве клеток опухоли умеренной или выраженной интенсивности, реакция к СТГ отрицательная (рис. 6).
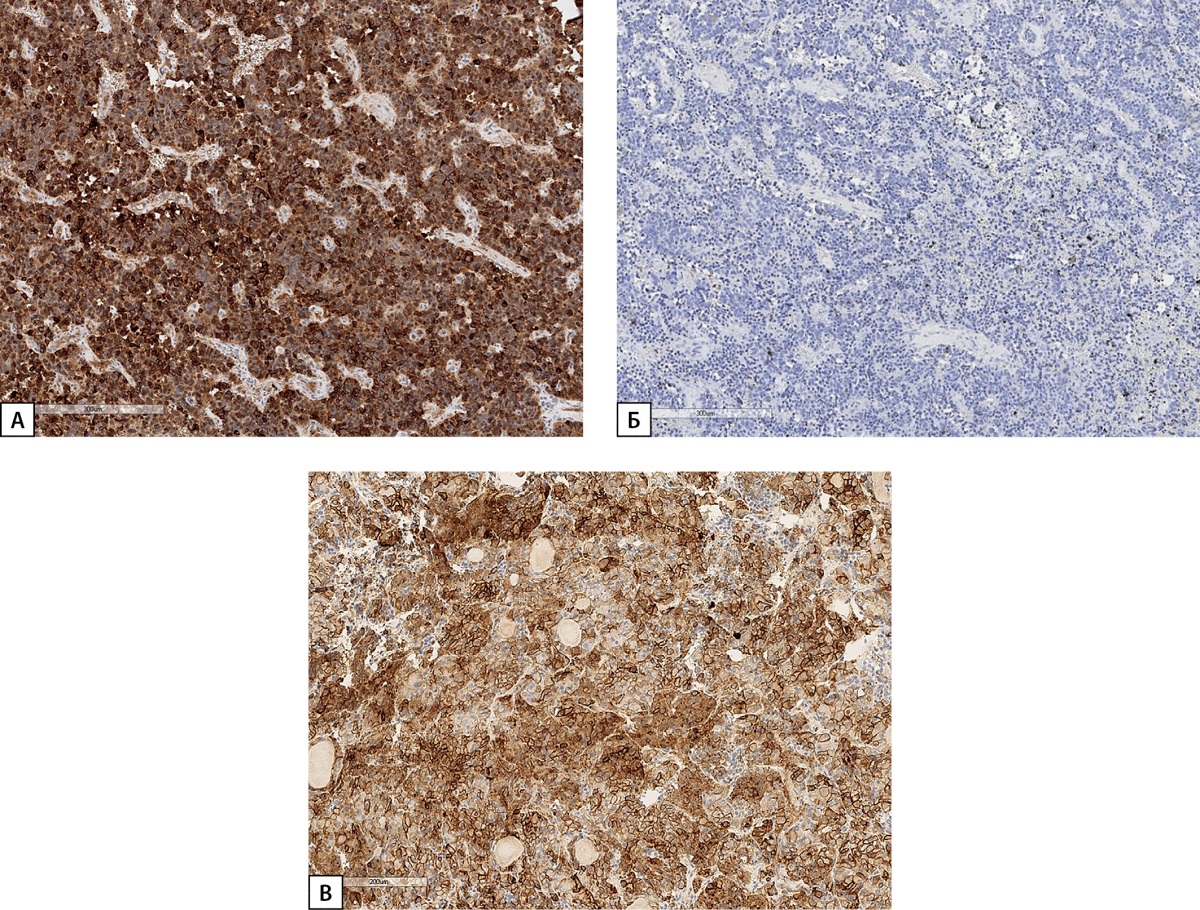
Рисунок 6. Иммуногистохимическое исследование карциноида легкого
пациентки Д.И.Е.
а) диффузная экспрессия ГРРГ;
б) отсутствие экспрессии СТГ;
в) положительная экспрессия
рецепторов соматостатина 2А типа (SSTR 2A) (3 балла).
Гистосканы
Таким образом, на основании результатов гистологического и ИГХ-исследования был установлен диагноз эктопической акромегалии. Было принято решение о пробной отмене аналогов соматостатина, на фоне чего показатель ИФР-1 оставался в пределах референсных значений (136 нг/мл (17–238)). При позитронно-эмиссионной КТ с 68Ga-DOTATAТЕ/DOTANOC, проведенной через 9 месяцев после оперативного вмешательства, признаков опухолевого роста не выявлено. Спустя 2,5 года после оперативного вмешательства у пациентки сохраняется ремиссия акромегалии. При контрольных обследованиях сохранялось повышение паратгормона до 102,5 пг/мл (15–65), при общем кальции 2,52 ммоль/л (2,15–2,55) и ионизированном кальции 1,33 ммоль/л (1,03–1,29), отсутствии вторичных причин повышения паратгормона. С учетом мягкого течения первичного гиперпаратиреоза (отсутствие остеопороза, мочекаменной болезни, отсутствие снижения скорости клубочковой фильтрации, нормокальциурия), выбрана тактика динамического наблюдения.
Случай 3
Пациентка С.Н.А. 1978 г.р., впервые госпитализирована в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России в возрасте 41 года с жалобами на головную боль, боли в спине, суставах, отечность лица, выпадение волос, увеличение веса, нарушения менструального цикла по типу задержек. Пациентка считала себя больной с возраста 37 лет, когда стала отмечать увеличение стоп и кистей, носа, онемение кончиков пальцев рук, задержки менструального цикла. В возрасте 40 лет обратилась к эндокринологу по месту жительства, при обследовании заподозрена акромегалия. Отмечено повышение уровня СТГ 8,29 нг/мл (0,5–7), однако данные уровня ИФР-1 на тот момент отсутствовали. По МРТ головного мозга с контрастным усилением выявлена макроаденома гипофиза с эндо-, супра-анте-, инфра-, латеро- (в левый кавернозный синус, KNOSP III) селлярным ростом, размерами 25х30х33 мм, компримирующая хиазму зрительных нервов (рис. 7а). Тогда же была выявлена железодефицитная анемия, ассоциированная с обильными менструациями на фоне миомы матки. По месту жительства в возрасте 41 года проведена трансназальная транссфеноидальная аденомэктомия. По результатам гистологического исследования — «крупноклеточная аденома гипофиза». После операции развился вторичный гипотиреоз, однако ремиссия акромегалии не была достигнута, и пациентка была направлена в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России. Перед госпитализацией в связи с жалобами на хронический кашель пациентке была выполнена МСКТ органов грудной клетки, где было обнаружено образование верхней доли левого легкого 15х12 мм, расцененное онкологом как доброкачественное на основании КТ-фенотипа.

Рисунок 7. МРТ и КТ исследования пациентки С.Н.А.
а) МРТ гипофиза до оперативного вмешательства, корональная проекция,
Т1 ВИ с контрастным усилением. Макроаденома гипофиза (стрелка);
б) МРТ гипофиза после оперативного вмешательства, корональная проекция,
Т1 ВИ с контрастным усилением. Макроаденома гипофиза (стрелка),
уменьшение размеров;
в) МСКТ легких, легочный режим, артериальная фаза, аксиальная проекция.
Нейроэндокринная опухоль в S4 левого легкого (стрелка).
При госпитализации в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России во время обследования подтверждена активная стадия акромегалии: ИФР-1 538,9 нг/мл (64–395), отсутствовало подавление СТГ в ходе ПГТТ (минимальное значение — 1,03 нг/мл). По МРТ головного мозга с контрастным усилением в полости турецкого седла (слева), в клиновидных пазухах, больше слева, в левом кавернозном синусе (Knosp III) имеется кистозно-солидное объемное образование, неоднородно накапливающее контрастный препарат, размерами вертикальный — 25 мм, поперечный — 25 мм, переднезадний — 30 мм. При сравнении с МР-изображениями до проведения трансназальной транссфеноидальной аденомэктомии — умеренное уменьшение вертикального размера (расстояние до хиазмы 5 мм), распространение в латеральную часть клиновидной пазухи. По заключению: картина макроаденомы гипофиза с эндо-, инфра-, латеро- (S) селлярным ростом. Пациентка проконсультирована нейрохирургом, выполнена повторная трансназальная транссфеноидальная аденомэктомия. В операционном материале получена ткань опухоли гипофиза с иммунофенотипом плотногранулированной соматотропиномы (рис. 8). При проведении СТГ в ходе ПГТТ в раннем послеоперационном периоде отмечено подавление СТГ максимально до 0,6 нг/мл. В последующем по месту жительства в связи с отсутствием подавления СТГ в ходе ПГТТ был назначен октреотид пролонгированного действия в дозе 20 мг 1 раз в 28 дней внутримышечно. При повторном обследовании в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России через год после операции, на фоне терапии октреотидом пролонгированного действия, сохранялось повышение ИФР-1 до 332,4 нг/мл (51–271). По МРТ головного мозга с контрастным усилением в полости турецкого седла, с распространением инфраселлярно в клиновидную пазуху, латероселлярно в левый кавернозный синус (KNOSP III), антеселлярно до клеток решетчатого лабиринта имеется кистозно-солидное образование неоднородной структуры, неравномерно накапливающее контрастный препарат, максимальными размерами: вертикальный — 18 мм, поперечный — 25 мм, переднезадний — 28 мм. Супраселлярная цистерна не сужена, хиазма зрительных нервов не компримирована. По сравнению с ранее выполненным исследованием — уменьшение объема опухоли (рис. 7б). С учетом отсутствия эффекта от двух проведенных оперативных вмешательств, пациентке было рекомендовано увеличение дозы октреотида пролонгированного действия до 30 мг 1 раз в 28 дней внутримышечно.
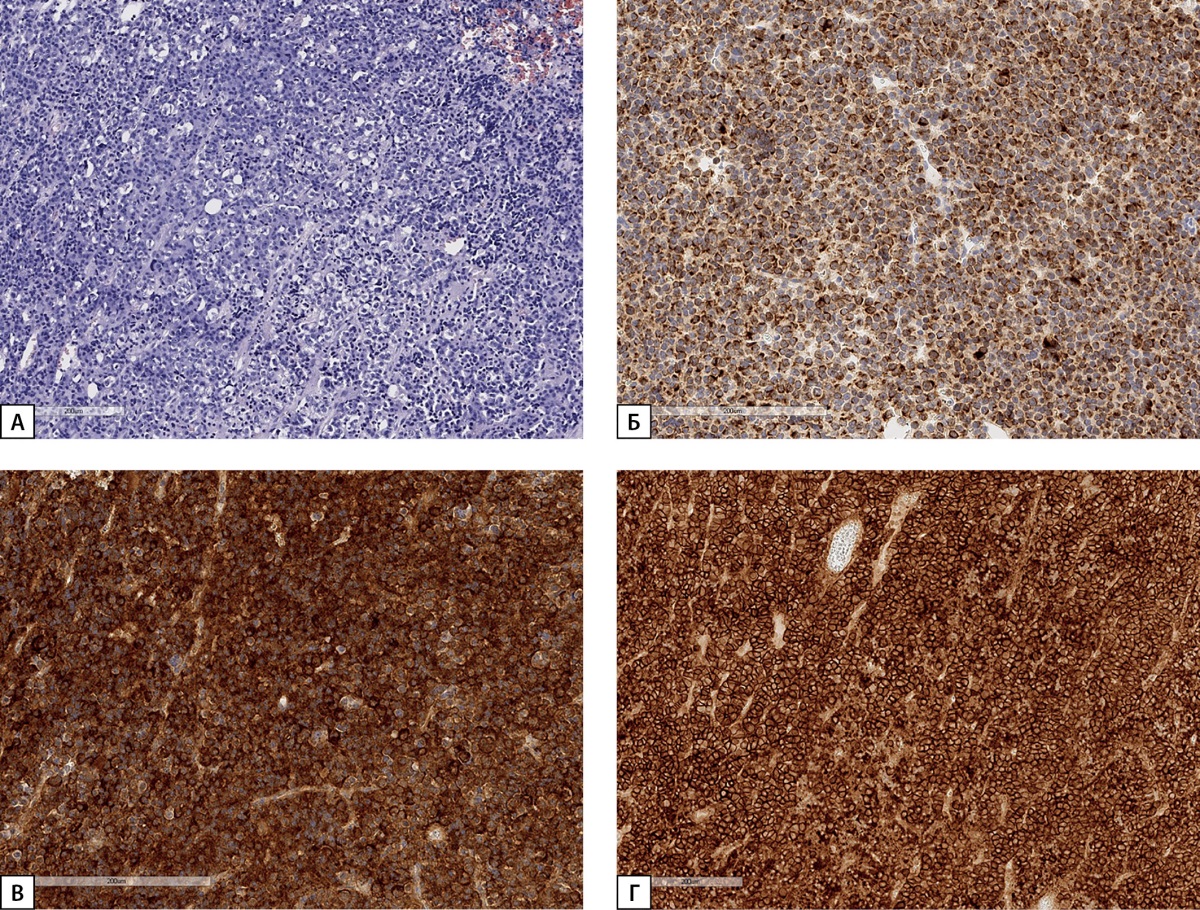
Рисунок 8. Гистологическое и иммуногистохимическое исследование
операционного материала опухоли гипофиза пациентки С.Н.А.
а) опухоль солидного строения из хромофобных клеток (гематоксилин-эозин);
б) неравномерное цитоплазматическое окрашивание
низкомолекулярным цитокератином,
клон САМ 5.2 (иммуногистохимическая реакция);
в) диффузная выраженная экспрессия СТГ в клетках опухоли
(иммуногистохимическая реакция);
г) выраженная экспрессия рецепторов соматостатина 2А типа
12 баллов по IRS (иммуногистохимическая реакция).
Гистосканы.
В возрасте 44 лет пациентка была вновь госпитализирована в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России для динамического наблюдения. На момент госпитализации получала октреотид пролонгированного действия в дозе 40 мг 1 раз в 28 дней (доза была увеличена по месту жительства в связи с отсутствием нормализации уровня ИФР-1). При обследовании подтверждено отсутствие медикаментозной ремиссии акромегалии: ИФР-1 300,8 нг/мл (51–271). По МРТ головного мозга с контрастом: в полости турецкого седла, в клиновидных пазухах (с распространением до задних отделов лабиринта), в левом кавернозном синусе сохраняется исходящее из аденогипофиза, неоднородно накапливающее контрастный препарат кистозно-солидное объемное образование неоднородной структуры, прежних размеров, размерами вертикальный — 18 мм, поперечный — 21 мм, переднезадний — 25 мм, без динамики по сравнению с предыдущим исследованием. Учитывая наличие в анамнезе объемного образования легкого, проведена МСКТ органов грудной клетки с контрастным усилением: в паренхиме S4 левого легкого периваскулярно визуализируется солидное образование с ровными несколько бугристыми контурами, размерами до 15х12х19 мм, умеренно накапливающее контрастный препарат (нативая/артериальная/венозная/отсроченная фазы исследования 13/15/69/79 ед.Н). По заключению: образование наиболее соответствует НЭО (рис. 7в). Проведена бисегментэктомия S4-5 слева с лимфодиссекцией 3, 5, 7, 9 групп. По результатам гистологического исследования: макроскопически на разрезах в толще ткани доли легкого определяется плотный, однородный, бледно-желтый опухолевый узел 1,6х1,5х1,3 см. Микроскопически опухолевый узел представлен плотноклеточным образованием из клеток со скудной слабо эозинофильной, нечетко контурированной цитоплазмой и мелкими овальными однотипными ядрами. Клетки формируют солидно-альвеолярные структуры, очаги некроза отсутствуют. Обнаруживается 3 митоза в 50 полях зрения при увеличении х400. Опухоль вовлекает стенку бронха, подрастает под эпителий его слизистой оболочки, суживает просвет бронха. Узел имеет четкую границу с окружающей легочной тканью, без сформированной псевдокапсулы. При ИГХ-исследовании в клетках опухоли диффузная экспрессия хромогранина А (клон DAK-A3, DAKO), Ki67 (клон SP6, Cell Marque) — ядерная экспрессия менее чем в 1% клеток. По заключению: типичный карциноид левого легкого, Grade 1, с поражением стенки субсегментарного бронха верхней доли, без элементов инвазии в краях резекции и без метастазов в 7 регионарных лимфатических узлах.
С учетом полученных результатов у пациентки была заподозрена эктопическая акромегалия. При проведении ИГХ-исследования выявлена диффузная экспрессия ГРРГ, что подтвердило диагноз эктопической акромегалии (рис. 9).
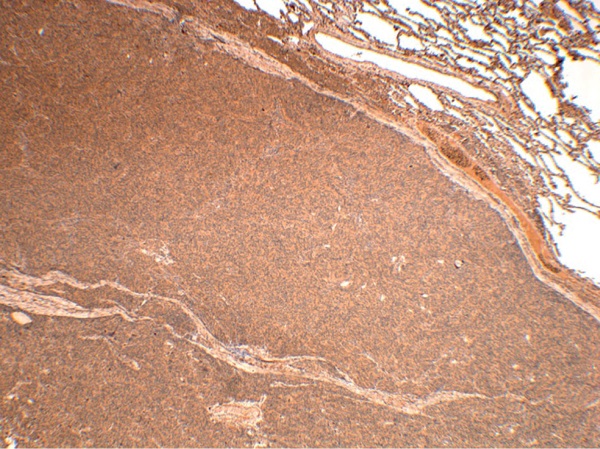
Рисунок 9. Иммуногистохимическое исследование карциноида легкого
пациентки С.Н.А.
Диффузная экспрессия ГРРГ. Ув 40.
Однако в послеоперационном периоде сохранялось повышение уровня ИФР-1, что потребовало продолжения терапии аналогами соматостатина. Сравнительные характеристики описанных случаев с эктопической акромегалией представлены в таблице 1.
Таблица 1. Сравнительная характеристика пациентов с эктопической акромегалией
|
Случай 1 |
Случай 2 |
Случай 3 |
|
|
Возраст на момент установления диагноза, лет |
58 |
60 |
41 |
|
Пол |
Женский |
Женский |
Женский |
|
ИФР-1 |
Нет данных |
591,1 нг/мл (15–230) |
538,9 нг/мл (64–395) |
|
СТГ базальный |
Нет данных |
Нет данных |
8,29 нг/мл (0,5–7) |
|
Максимальное подавление СТГ в ходе ПГТТ (менее 0,4 нг/мл) |
Нет данных |
2,53 нг/мл |
1,03 нг/мл |
|
Данные МРТ головного мозга |
Новообразование гипофиза, соответствует микроаденоме гипофиза и кисте кармана Ратке |
Выраженная неоднородность структуры аденогипофиза, подозрение на микроаденому гипофиза, киста кармана Ратке размерами 3,8х1,5 мм |
Макроаденома гипофиза с эндо-, супра-, анте-, инфра-, латеро- (в левый кавернозный синус, KNOSP III) селлярным ростом, размерами 25х30х33 мм, компримирующая хиазму |
|
Источник эктопии |
Образование в корне левого легкого 44х42х50 мм. Гистологически: высокодифференцированная НЭО легкого, Grade 1, индекс пролиферации Ki-67 менее 2%, что характерно для типичного карциноида |
Образование S10 левого легкого 32х32 мм, плотностью 34 ед.Н. В S3 левого легкого очаг отсева с четкими неровными контурами, размерами 16х13 мм, плотностью 56 ед.Н. Гистологически: атипичный карциноид, G2 |
Образование верхней доли левого легкого 15х12 мм. Гистологически: типичный карциноид левого легкого, Grade 1, с поражением стенки субсегментарного бронха верхней доли, без элементов инвазии в краях резекции и без метастазов в 7 регионарных лимфатических узлах |
ОБСУЖДЕНИЕ
В данной статье описаны три клинических случая эктопической акромегалии у женщин вследствие НЭО легких, что согласуется с данными литературы о том, что они являются самой частой локализацией НЭО, продуцирующих ГРРГ, и что чаще заболевание встречается у женщин [13][14]. Каждый случай примечателен рядом особенностей. В случае 1 отмечалось снижение веса, что нехарактерно для акромегалии, но может быть симптомом НЭО. Случай 2 характеризовался мягкими клиническими проявлениями акромегалии, хотя, как было указано выше, считается, что клинические проявления классической и эктопической акромегалии схожи [17]. У всех трех пациенток диагноз эктопической акромегалии был поставлен постфактум: в первом случае при ретроспективном анализе анамнеза пациентки, во втором и третьем — после ненаступления ремиссии акромегалии после трансназальной аденомэктомии и при случайном выявлении объемных образований легких по поводу других состояний.
Актуальным остается вопрос, на основании каких данных эндокринолог может заподозрить эктопическую продукцию ГРРГ у пациента с клинической картиной акромегалии. В 2022 г. Potorac и соавт. ретроспективно проанализировали данные МРТ головного мозга у 30 пациентов с эктопической акромегалией с целью выявления отличительных особенностей визуализации гипофиза в таких случаях [17]. По результатам у 24 пациентов была выявлена гиперплазия гипофиза, в двух случаях вертикальный размер гипофиза был несколько увеличен относительно нормы, в четырех случаях размер гипофиза был в норме. На основании анализа снимков МРТ авторы делают вывод, что гипофиз у пациентов с эктопической акромегалией слегка или умеренно увеличен в размерах, гипофиз гипоинтенсивен на Т2-взвешенных изображениях, при этом нормальная ткань гипофиза на МРТ не визуализируется. Кроме того, отсутствует инвазия в кавернозные синусы и компрессия хиазмы. Авторы выделяют следующие факторы, на основании которых можно заподозрить эктопическую акромегалию: гипоинтенсивное изображение гипофиза на Т2-взвешенных снимках (в 83,3% случаев), гиперплазия гипофиза (80%), средняя высота гипофиза — около 9,5 мм (редко — более 18 мм), нормальная ткань гипофиза не визуализируется, отсутствие инвазии в кавернозные синусы/клиновидную пазуху, отсутствие отклонения ножки гипофиза, отсутствие изменений в дне турецкого седла. Помимо МРТ-характеристик, авторы отмечают, что эктопическая акромегалия чаще встречается у женщин (73,3%), у мужчин заболевание проявляется в более молодом возрасте. Кроме того, в 50% случаев диагноз акромегалии был установлен раньше диагноза НЭО, самые частые локализации — легкие (56,7%) и поджелудочная железа (33,3%) [17].
Таким образом, отсутствие визуализации аденомы гипофиза у пациента с акромегалией, по данным МРТ, позволяет заподозрить эктопическую акромегалию. Тем не менее ряд работ указывают на то, что это не всегда так. В работе Lonser и соавт. среди 190 пациентов с акромегалией у 6 (3 мужчин и 3 женщин), по данным МРТ головного мозга, не визуализировалась аденома гипофиза, при этом трем пациентам была проведена МРТ по методике VIBE (volumetric interpolated breath-hold examination), что позволило обнаружить аденому гипофиза 4 мм в диаметре у одного из них. Всем пациентам была проведена эндоскопическая трансназальная ревизия гипофиза, позволившая обнаружить микроаденомы во всех случаях. Морфологическое и ИГХ-исследования подтвердили диагноз соматотропиномы во всех случаях, и у всех пациентов после операции была достигнута биохимическая ремиссия акромегалии [18]. Подобные наблюдения приведены и другими авторами [19].
В описанных нами случаях в первом имелась микроаденома гипофиза (наиболее вероятно, гормонально-неактивная), во втором случае — гиперплазия гипофиза, которая была исходно расценена как микроаденома гипофиза. Только в случае 3 имела место макроаденома гипофиза, что не типично для эктопической акромегалии. Возможно, макроаденома гипофиза сформировалась под длительным воздействием на гипофиз ГРРГ, и это послужило тому, что после хирургического удаления НЭО легкого не наступила ремиссия акромегалии. Случаев сочетания эктопической акромегалии с СТГ-продуцирующими макроаденомами гипофиза у одного пациента нами найдено не было.
Исследование уровня ГРРГ в плазме крови может иметь диагностическую значимость при подозрении на эктопическую акромегалию. Различными исследователями предлагаются следующие уровни концентрации ГРРГ в плазме, при которых можно ее заподозрить: более 300 нг/л [20] или более 250 нг/л [12]. В целом, существуют коммерческие наборы для определения ГРРГ, наиболее часто используемым из которых является ELISA [14]. Однако, учитывая редкость заболевания, небольшую доступность таких наборов, представляется целесообразным проводить топическую диагностику (исследование грудной и брюшной полости) при отсутствии визуализации аденомы гипофиза по МРТ головного мозга исходно, а также при отсутствии послеоперационной ремиссии акромегалии и отсутствии визуализации остаточной опухолевой ткани по МРТ головного мозга после операции.
В двух из трех описанных случаев (случаи 1 и 2) хирургическое лечение (удаление НЭО легких) привело к ремиссии акромегалии. В целом хирургическое лечение является лечением первой линии при эктопической акромегалии, поскольку позволяет полностью удалить источник гиперпродукции ГРРГ. При невозможности радикального удаления опухоли применяют различные другие виды лечения. Аналоги соматостатина длительного действия могут быть использованы в связи с наличием экспрессии соматостатиновых рецепторов 2 типа в НЭО [21]. При отсутствии экспрессии этих рецепторов в ткани опухоли аналоги соматостатина также могут давать частичный эффект в связи с воздействием на соматотрофы гипофиза, уменьшая выработку СТГ. В некоторых случаях прибегали к лучевой терапии на область гипофиза, а также химиотерапии, иммунотерапии, эмболизации метастазов, назначению пэгвисоманта [14].
Примечательно сочетание эктопической акромегалии и ПГПТ в случае 2. На основании сочетания акромегалии и ПГПТ у пациентки клинически был заподозрен синдром МЭН-1. В обзорной работе Zendran и соавт. указано, что в литературе описано 23 пациента с эктопической акромегалией и синдромом МЭН-1, при этом генетический анализ, подтверждающий диагноз, был проведен у 19 пациентов [14]. Примечательно, что в 18 случаях НЭО локализовалась в поджелудочной железе, в 1 случае — в тимусе, но не в легких. Помимо НЭО поджелудочной железы у большинства пациентов был ПГПТ [14], а у некоторых пациентов также имелись аденомы гипофиза (гонадотропинома [20], СТГ/пролактин-секретирующая аденома гипофиза [12], ноль-клеточная аденома [23]). Таким образом, у пациентов с МЭН-1 диагноз эктопической акромегалии вследствие ГРРГ-продуцирующей НЭО поджелудочной железы может быть затруднен ввиду возможного сочетания с аденомой гипофиза (гормонально-неактивной или с другим типом гормональной активности) в рамках этого синдрома. В целом, сочетание аденомы гипофиза и ПГПТ у одного пациента позволяет клинически верифицировать диагноз синдрома МЭН-1 [24]. При отсутствии выявления мутации в гене MEN1 данный случай может быть рассмотрен как фенокопия синдрома МЭН-1, и крайне редко у таких пациентов могут выявляться мутации в гене CDKN1B (синдром множественных эндокринных неоплазий 4 типа (МЭН-4)) [25]. У нашей пациентки (случай 2) мутации в генах MEN1 и CDKN1B не были выявлены. Учитывая отсутствие у нее отягощенного семейного анамнеза, а также тот факт, что при акромегалии повышена частота развития некоторых новообразований, возможно предположить либо что аденома околощитовидной железы развилась вследствие избыточного воздействия ИФР-1, либо случайное сочетание нескольких эндокринных опухолей у одного пациента.
По состоянию на 1 мая 2023 г. во Всероссийском регистре опухолей гипоталамо-гипофизарной области состоят 5726 пациентов с акромегалией. Исходя из эпидемиологических данных других стран, согласно которым 5% пациентов с акромегалией имеют внегипофизарную причину заболевания [4], более 250 человек, проживающих на территории Российской Федерации, должны иметь акромегалию, обусловленную эктопической секрецией СТГ или ГРРГ. Однако описаний таких пациентов в литературе российских авторов не найдено. К причинам несвоевременной (ретроспективной) диагностики эктопической акромегалии можено отнести низкую осведомленность врачей, в том числе эндокринологов, отсутствие специфических клинических проявлений, недоступность лабораторного измерения ГРРГ, высокую чувствительность НЭО к терапии аналогами соматостатина, отсутствие настороженности врачей в отношении пациентов с акромегалией, не достигших ремиссии заболевания после нейрохирургического лечения при радикальном удалении аденомы гипофиза.
ЗАКЛЮЧЕНИЕ
Акромегалия встречается относительно редко в общей популяции, а эктопическая акромегалия в ее структуре — лишь в около 5% случаев. Тем не менее врачам-эндокринологам необходимо заподозрить наличие эктопической акромегалии при отсутствии визуализации аденомы гипофиза или при выявлении диффузной гиперплазии гипофиза, гипоинтенсивной на Т2-ВИ, по данным МРТ головного мозга. Диагностический поиск следует начинать с исключения НЭО легких и поджелудочной железы, а в случае выявления НЭО поджелудочной железы следует заподозрить синдром МЭН-1. Хирургическое лечение является методом выбора, поскольку потенциально позволяет полностью удалить источник гиперпродукции ГРРГ и привести к ремиссии акромегалии. В случае отсутствия ремиссии эктопической акромегалии после хирургического лечения целесообразно назначение различных вариантов медикаментозного лечения.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Поисково-аналитическая работа и подготовка статьи проведены за счет гранта Российского научного фонда (проект №19-15-00398).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Согласие пациента. Пациенты добровольно подписали информированное согласие на публикацию персональной медицинской информации в обезличенной форме в журнале «Проблемы эндокринологии».
Список литературы
1. Белая Ж.Е., Голоунина О.О., Рожинская Л.Я. и др. Эпидемиология, клинические проявления и эффективность различных методов лечения акромегалии по данным единого российского регистра опухолей гипоталамо-гипофизарной системы // Проблемы Эндокринологии. 2020; 66(1):93-103. doi: https://doi.org/10.14341/probl10333
2. Сахнова Е.Е., Пржиялковская Е.Г., Белая Ж.Е., Мельниченко Г.А. Дискордантные показатели инсулиноподобного фактора роста 1 (ИФР-1) и соматотропина (СТГ) в диагностике и мониторинге акромегалии // Проблемы Эндокринологии. 2022; 68(1):40-48. doi: https://doi.org/10.14341/probl12791
3. Mamedova E, Vasilyev E, Petrov V, et al. Familial acromegaly and bilateral asynchronous pheochromocytomas in a female patient with a MAX mutation: a case report. Front Endocrinol (Lausanne). 12:683492. doi: https://doi.org/10.3389/fendo.2021.683492
4. Chanson P, Salenave S. Acromegaly. Orphanet J Rare Dis. 2008; 3:17. doi: https://doi.org/10.1186/1750-1172-3-17
5. Sano T, Asa SL, Kovacs K. Growth hormone-releasing hormone-producing tumors: clinical, biochemical, and morphological manifestations. Endocr Rev. 1988; 9(3):357-373. doi: https://doi.org/10.1210/edrv-9-3-357
6. Ramírez C, Hernández-Ramirez LC, Espinosa-de-los-Monteros AL, et al. Ectopic acromegaly due to a GH-secreting pituitary adenoma in the sphenoid sinus: a case report and review of the literature. BMC Res Notes. 2013; 6:411. Published 2013 Oct 12. doi: https://doi.org/10.1186/1756-0500-6-411
7. Melmed S, Ezrin C, Kovacs K, et al. Acromegaly due to secretion of growth hormone by an ectopic pancreatic islet-cell tumor. N Engl J Med. 1985; 312(1):9-17. doi: https://doi.org/10.1056/NEJM198501033120103
8. Beuschlein F, Strasburger CJ, Siegerstetter V, et al. Acromegaly caused by secretion of growth hormone by a non-Hodgkin’s lymphoma. N Engl J Med. 2000; 342(25):1871-1876. doi: https://doi.org/10.1056/NEJM200006223422504
9. Faglia G, Arosio M, Bazzoni N. Ectopic acromegaly. Endocrinol Metab Clin North Am. 1992; 21(3):575-595
10. Guillemin R, Brazeau P, Böhlen P, et al. Growth hormone-releasing factor from a human pancreatic tumor that caused acromegaly. Science. 1982; 218(4572):585-587. doi: https://doi.org/10.1126/science.6812220
11. Rivier J, Spiess J, Thorner M, Vale W. Characterization of a growth hormone-releasing factor from a human pancreatic islet tumour. Nature. 1982; 300(5889):276-278. doi: https://doi.org/10.1038/300276a0
12. Garby L, Caron P, Claustrat F, et al. Clinical characteristics and outcome of acromegaly induced by ectopic secretion of growth hormone-releasing hormone (GHRH): a French nationwide series of 21 cases. J Clin Endocrinol Metab. 2012; 97(6):2093-2104. doi: https://doi.org/10.1210/jc.2011-2930
13. Ghazi AA, Amirbaigloo A, Dezfooli AA, et al. Ectopic acromegaly due to growth hormone releasing hormone. Endocrine. 2013; 43(2):293-302. doi: https://doi.org/10.1007/s12020-012-9790-0
14. Zendran I, Gut G, Kałużny M, et al. Acromegaly caused by ectopic growth hormone releasing hormone secretion: a review. Front Endocrinol (Lausanne). 2022; 13:867965. doi: https://doi.org/10.3389/fendo.2022.867965
15. Ravindra VM, Raheja A, Corn H, et al. Primary pituitary diffuse large B-cell lymphoma with somatotroph hyperplasia and acromegaly: case report. J Neurosurg. 2017; 126(5):1725-1730. doi: https://doi.org/10.3171/2016.5.JNS16828
16. Southgate HJ, Archbold GP, el-Sayed ME, et al. Ectopic release of GHRH and ACTH from an adenoid cystic carcinoma resulting in acromegaly and complicated by pituitary infarction. Postgrad Med J. 1988; 64(748):145-148. doi: https://doi.org/10.1136/pgmj.64.748.145
17. Potorac I, Bonneville JF, Daly AF, et al. Pituitary MRI Features in Acromegaly Resulting From Ectopic GHRH Secretion From a Neuroendocrine Tumor: Analysis of 30 Cases [published correction appears in J Clin Endocrinol Metab. 2022 Nov 23;107(11):e4332]. J Clin Endocrinol Metab. 2022;107(8):e3313-e3320. doi: https://doi.org/10.1210/clinem/dgac274
18. Lonser RR, Kindzelski BA, Mehta GU, et al. Acromegaly without imaging evidence of pituitary adenoma. J Clin Endocrinol Metab. 2010; 95(9):4192-4196. doi: https://doi.org/10.1210/jc.2010-0570
19. Khandelwal D, Khadgawat R, Mukund A, Suri A. Acromegaly with no pituitary adenoma and no evidence of ectopic source. Indian J Endocrinol Metab. 2011; 15 Suppl 3(Suppl3):S250-S252. doi: https://doi.org/10.4103/2230-8210.84878
20. Scheithauer BW, Carpenter PC, Bloch B, Brazeau P. Ectopic secretion of a growth hormone-releasing factor. Report of a case of acromegaly with bronchial carcinoid tumor. Am J Med. 1984;76(4):605-616. doi: https://doi.org/10.1016/0002-9343(84)90284-5
21. Gola M, Doga M, Bonadonna S, et al. Neuroendocrine tumors secreting growth hormone-releasing hormone: Pathophysiological and clinical aspects. Pituitary. 2006; 9(3):221-229. doi: https://doi.org/10.1007/s11102-006-0267-0
22. Bertherat J, Turpin G, Rauch C, et al. Presence of somatostatin receptors negatively coupled to adenylate cyclase in ectopic growth hormone-releasing hormone- and alpha-subunit-secreting tumors from acromegalic patients responsive to octreotide. J Clin Endocrinol Metab. 1994; 79(5):1457-1464. doi: https://doi.org/10.1210/jcem.79.5.7962343
23. Shintani Y, Yoshimoto K, Horie H, et al. Two different pituitary adenomas in a patient with multiple endocrine neoplasia type 1 associated with growth hormone-releasing hormone-producing pancreatic tumor: clinical and genetic features. Endocr J. 1995; 42(3):331-340. doi: https://doi.org/10.1507/endocrj.42.331
24. Thakker RV, Newey PJ, Walls GV, et al. Clinical practice guidelines for multiple endocrine neoplasia type 1 (MEN1). J Clin Endocrinol Metab. 2012; 97(9):2990-3011. doi: https://doi.org/10.1210/jc.2012-1230
25. Мамедова Е.О., Мокрышева Н.Г., Пржиялковская Е.Г. и соавт. Варианты и фенокопии синдрома множественных эндокринных неоплазий 1-го типа. Терапевтический архив. 2014; 86(10):87-91.
26. Князева О.В. Предикторы и частота развития новообразований щитовидной железы и желудочно-кишечного тракта у пациентов с акромегалией: Дис. ... канд. мед. наук. — Москва; 2016 г. Доступно по: https://www.endocrincentr.ru/sites/default/files/specialists/science/dissertation/1diss_kniazeva_v2.pdf?ysclid=lky09llvkf123399757 Ссылка активна на 10.08.2023 г.
Об авторах
Е. О. МамедоваРоссия
Мамедова Елизавета Октаевна - к.м.н., старший научный сотрудник отделения остеопороза и остеопатий.
117036, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
Конфликт интересов отсутствует
Е. Г. Пржиялковская
Россия
Пржиялковская Елена Георгиевна - к.м.н.
Москва
Конфликт интересов:
Конфликт интересов отсутствует
С. А. Бурякина
Россия
Бурякина Светлана Алексеевна - к.м.н.
Москва
Конфликт интересов:
Конфликт интересов отсутствует
Е. В. Бондаренко
Россия
Бондаренко Екатерина Владимировна - к.м.н.
Москва
Конфликт интересов:
Конфликт интересов отсутствует
А. М. Лапшина
Россия
Лапшина Анастасия Михайловна - к.м.н.
Москва
Конфликт интересов:
Конфликт интересов отсутствует
М. Ю. Пикунов
Россия
Пикунов Михаил Юрьевич - к.м.н.
Москва
Конфликт интересов:
Конфликт интересов отсутствует
Ж. Е. Белая
Россия
Белая Жанна Евгеньевна - д.м.н., заведующая отделением остеопороза и остеопатий.
Москва
Конфликт интересов:
Конфликт интересов отсутствует
Г. А. Мельниченко
Россия
Мельниченко Галина Афанасьевна - д.м.н., профессор.
Москва
Конфликт интересов:
Конфликт интересов отсутствует
Дополнительные файлы
|
|
1. Рисунок 1. Пациентка С.Н.Ю. Типичные изменения внешности при мягкой форме акромегалии в пожилом возрасте: небольшое укрупнение черт лица (А), увеличение кистей (Б) | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(388KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. МРТ гипофиза пациентки С.Н.Ю., корональная проекция: А. Т1 ВИ с контрастном усилением. Микроаденома в левом отделе аденогипофиза (стрелка) Б. Т1 ВИ с контрастным усилением. Киста кармана Ратке (стрелки) В. Т2 ВИ. Диффузно-сниженный МР-сигнал на Т2 ВИ от ткани аденогипофиза (стрелка) | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(430KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Иммуногистохимическое исследование карциноида легкого пациентки С.Н.Ю. (А) — диффузная экспрессия ГРРГ; (Б) — отсутствие экспрессии СТГ. Гистосканы | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(697KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. МРТ и КТ исследования пациентки Д.И.Е. а) МРТ гипофиза, корональная проекция, Т1 ВИ с контрастным усилением. Киста кармана Ратке (стрелка). Зона слабо сниженного накопления контрастного препарата в левом отделе аденогипофиза (длинная стрелка); б) Киста кармана Ратке (стрелка). Диффузно сниженный МР сигнал на Т2 ВИ от ткани аденогипофиза; в) МСКТ легких, легочный режим, нативная фаза, аксиальная проекция. Нейроэндокринная опухоль в S10 левого легкого (короткая стрелка); г) МСКТ легких, легочный режим, нативная фаза, аксиальная проекция. Образование в S3 левого легкого с внутри- и перибронхиальным распространением — очаг отсева (толстая стрелка). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(397KB)
|
Метаданные ▾ | |
|
|
5. Рисунок 5. Гистологическое и иммуногистохимическое исследование операционного материала гипофиза пациентки Д.И.Е. (А) — ткань аденогипофиза с обширными полями оксифильных клеток (гемотоксилин-эозин). (Б) — сохранная сеть ретикулиновых волокон с расширенными ацинусами (импрегнация серебром). (В) — диффузное окрашивание клеток аденогипофиза СТГ (иммуногистохимическая реакция с антителами к СТГ). Гистосканы. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(1MB)
|
Метаданные ▾ | |
|
|
6. Рисунок 6. Иммуногистохимическое исследование карциноида легкого пациентки Д.И.Е. а) диффузная экспрессия ГРРГ; б) отсутствие экспрессии СТГ; в) положительная экспрессия рецепторов соматостатина 2А типа (SSTR 2A) (3 балла). Гистосканы | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(1MB)
|
Метаданные ▾ | |
|
|
7. Рисунок 7. МРТ и КТ исследования пациентки С.Н.А. а) МРТ гипофиза до оперативного вмешательства, корональная проекция, Т1 ВИ с контрастным усилением. Макроаденома гипофиза (стрелка); б) МРТ гипофиза после оперативного вмешательства, корональная проекция, Т1 ВИ с контрастным усилением. Макроаденома гипофиза (стрелка), уменьшение размеров; в) МСКТ легких, легочный режим, артериальная фаза, аксиальная проекция. Нейроэндокринная опухоль в S4 левого легкого (стрелка). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(404KB)
|
Метаданные ▾ | |
|
|
8. Рисунок 8. Гистологическое и иммуногистохимическое исследование операционного материала опухоли гипофиза пациентки С.Н.А. а) опухоль солидного строения из хромофобных клеток (гематоксилин-эозин); б) неравномерное цитоплазматическое окрашивание низкомолекулярным цитокератином, клон САМ 5.2 (иммуногистохимическая реакция); в) диффузная выраженная экспрессия СТГ в клетках опухоли (иммуногистохимическая реакция); г) выраженная экспрессия рецепторов соматостатина 2А типа 12 баллов по IRS (иммуногистохимическая реакция). Гистосканы. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(1MB)
|
Метаданные ▾ | |
|
|
9. Рисунок 9. Иммуногистохимическое исследование карциноида легкого пациентки С.Н.А. Диффузная экспрессия ГРРГ. Ув 40. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(642KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Мамедова Е.О., Пржиялковская Е.Г., Бурякина С.А., Бондаренко Е.В., Лапшина А.М., Пикунов М.Ю., Белая Ж.Е., Мельниченко Г.А. Эктопическая акромегалия вследствие нейроэндокринных опухолей легких: первое описание в России трех клинических случаев. Проблемы Эндокринологии. 2024;70(1):66-80. https://doi.org/10.14341/probl13346
For citation:
Mamedova E.O., Przhiyalkovskaya E.G., Buryakina S.A., Bondarenko E.V., Lapshina A.M., Pikunov M.Yu., Belaya Zh.E., Melnichenko G.A. Ectopic acromegaly due to bronchial neuroendocrine tumors: the first description in Russia of three clinical cases. Problems of Endocrinology. 2024;70(1):66-80. https://doi.org/10.14341/probl13346

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).









































.jpg)


