Перейти к:
Амиодарон-индуцированный тиреотоксикоз 2 типа: распространенность, сроки и предикторы развития
https://doi.org/10.14341/probl13348
Аннотация
ОБОСНОВАНИЕ. Амиодарон занимает ведущую позицию в аритмологической практике в профилактике и купировании различных нарушений ритма сердца. Амиодарон — индуцированный тиреотоксикоз 2 типа — нередкое осложнение терапии препаратом, наиболее сложный вид дисфункции щитовидной железы как по тяжести клинических проявлений, так и с точки зрения понимания механизмов патогенеза, возможности дифференциальной диагностики и обеспечения эффективного лечения. В связи с увеличивающейся продолжительностью жизни населения, соответствующим ростом частоты нарушений ритма сердца проблема не теряет актуальности. Выявление предикторов, оценка и прогнозирование индивидуального риска развития данной патологии щитовидной железы — необходимость в повседневной клинической практике для принятия взвешенного решения при назначении антиаритмика, определении алгоритма дальнейшего динамического наблюдения пациента.
ЦЕЛЬ. Оценить структуру амиодарон-индуцированной дисфункции щитовидной железы, распространенность, сроки и предикторы развития амиодарон-индуцированного тиреотоксикоза 2 типа в проспективном когортном исследовании.
МАТЕРИАЛЫ И МЕТОДЫ. В исследовании приняли участие 124 пациента без нарушения функции щитовидной железы, впервые получившие терапию амиодароном. Оценка функционального состояния щитовидной железы производилась исходно, после назначения препарата первые 3 месяца 1 раз в месяц, в дальнейшем — каждые 3 месяца. Период наблюдения в среднем составил от 12 до 24 месяцев. Завершение наблюдения происходило при развитии амиодарон-индуцированной дисфункции щитовидной железы или отказе пациента от дальнейшего участия в исследовании. Для дифференциальной диагностики типа амиодарон-индуцированного тиреотоксикоза проводилось определение уровня антител к рецептору тиреотропного гормона, ультразвуковое исследование с доплерографией и сцинтиграфия щитовидной железы с пертехнетатом технеция. Оценивались вид и частота дисфункции щитовидной железы, время возникновения и предикторы амиодарон-индуцированного тиреотоксикоза 2 типа.
РЕЗУЛЬТАТЫ. Структура амиодарон-индуцированной дисфункции щитовидной железы была представлена: в 19,3% (n=24) гипотиреозом, в 1,6% (n=2) тиреотоксикозом 1 типа, в 23,4% (n=29) тиреотоксикозом 2 типа. Медиана времени его развития составила 92,0 [69,0; 116,0] недель; средний срок бессобытийной выживаемости — 150,2±12,6 недель (95% ДИ: 125,5–175,0), медиана — 144±21,7 недель (95% ДИ: 101,4–186,6). Основными предикторами амиодарон-индуцированного тиреотоксикоза 2 типа являлись: возраст (ОШ=0,931, 95% ДИ: 0,895–0,968, р<0,001), ИМТ (ОШ=0,859, 95% ДИ: 0,762–0,967, р=0,012), время от начала терапии (ОШ=1,023, 95% ДИ: 1,008–1,038, р=0,003). Возраст ≤60 лет сопряжен с увеличением риска возникновения дисфункции в 2,4 раза (ОШ=2,352, 95% ДИ: 1,053–5,253, р=0,037), ИМТ≤26,6 кг/м2 — в 2,3 раза (ОШ=2,301, 95% ДИ: 1,025–5,165, р=0,043).
ЗАКЛЮЧЕНИЕ. Полученные результаты позволяют персонализировано оценить риск развития амиодарон-индуцированного тиреотоксикоза 2 типа и определить адекватную тактику ведения пациента.
Ключевые слова
Для цитирования:
Ермолаева А.С., Фадеев В.В. Амиодарон-индуцированный тиреотоксикоз 2 типа: распространенность, сроки и предикторы развития. Проблемы Эндокринологии. 2024;70(3):9-22. https://doi.org/10.14341/probl13348
For citation:
Ermolaeva A.S., Fadeev V.V. Type 2 amiodarone-induced thyrotoxicosis: prevalence, time and predictors of development. Problems of Endocrinology. 2024;70(3):9-22. (In Russ.) https://doi.org/10.14341/probl13348
Обоснование
Нарушения ритма сердца — важная проблема здравоохранения, значительно увеличивающая риск сердечно-сосудистых осложнений и внезапной смерти, приводящая к снижению качества жизни, инвалидизации, высокой смертности, существенным экономическим затратам. Ведущая роль принадлежит фибрилляции предсердий, предполагаемая распространенность составляет 2–4%. В ближайшие десятилетия ожидается дальнейший ее рост, в основном в связи с увеличением продолжительности жизни населения и активизации поиска недиагностированных форм [1–3].
Амиодарон — высокоэффективный препарат для купирования жизнеугрожающих наджелудочковых и желудочковых аритмий, длительного поддержания синусового ритма. Считается фармакотерапией первой линии у пациентов со структурной патологией сердца, хронической сердечной недостаточностью, низкой фракцией выброса левого желудочка, имплантированными ресинхронизаторами, кардиоверторами-дефибрилляторами [2–5]. Частота его назначения среди других антиаритмических препаратов составляет: в России до 24% [6], США до 38% [7], Нидерландах до 41,8% [8], Китае до 53% [9], Великобритании до 61,8% [10].
Амиодарон — антиаритмический препарат III класса с высоким содержанием йода: 1 таблетка (200 мг) препарата содержит 74 мг йода, при метаболизме которого высвобождается около 7 мг йода в сутки, что во много раз превышает суточную потребность в элементе. Диспозиционная кинетика антиаритмика достаточно сложна. Ему свойственна вариабельная биодоступность (22–86%), биотрансформация с образованием фармакологически активного метаболита — дезэтиламиодарона, экстремально высокая липофильность, широкое распределение во многие органы и ткани (66 л/кг массы тела), высокая аффинность к ним. Амиодарон и дезэтиламиодарон обладают способностью активно накапливаться некоторыми тканями организма (жировой тканью, печенью, легкими, в меньшей степени скелетной мускулатурой, почками, сердцем, мозгом). Характерна очень медленная элиминация, в основном с желчью с некоторой степенью кишечно-печеночной рециркуляции и незначительной почечной экскрецией, период полувыведения составляет от 22 до 100 дней. Таким образом, сам антиаритмик и йодированные продукты его метаболизма могут сохраняться в организме долгое время после отмены препарата [11–15].
Влияние амиодарона на функцию щитовидной железы происходит в двух направлениях: нарушение синтеза и метаболизма тиреоидных гормонов (блок органификации йода (эффект Вольффа-Чайкоффа) [16], ингибирование 5-дейодинирования тироксина и реверсивного трийодтиронина [17], взаимодействие с ядерными рецепторами [18]) и прямое цитотоксическое действие на тиреоциты [19]. Первые 3 месяца терапии часто наблюдается обычно преходящее повышение уровня тиреотропного гормона (ТТГ) в сыворотке крови. Верхнереференсный/повышенный уровень общего и свободного тироксина (свТ4), реверсивный Т3, низкореференсный/пониженный уровень общего и свободного трийодтиронина (свТ3) может сохраняться длительно, даже в течение нескольких месяцев после отмены препарата, что обусловлено подавлением активности 5-дейодиназы I типа [20].
Наиболее тяжелым видом дисфункции щитовидной железы является амиодарон-индуцированный тиреотоксикоз (АмИТ): АмИТ1 — результат феномена Йод-Базедова, как правило возникает у пациентов с латентной патологией щитовидной железы (болезнь Грейвса, функциональная автономия), характеризуется гиперпродукцией тиреоидных гормонов; АмИТ2 — деструктивный тиреоидит, развивающийся в основном при интактной щитовидной железе, при котором происходит высвобождение ранее синтезированных гормонов в кровоток [21][22]. Дифференциация на патогенетические типы важна для адекватного терапевтического подхода. Для АмИТ2, как правило, характерен низкий уровень антител к рецептору тиреотропного гормона (АТ-рТТГ), отсутствие гиперваскуляризации по данным цветового доплеровского картирования, низкий захват пертехнетата (99mTcO4) или технетрила (99mTc-sestaMIBI) по результатам сцинтиграфии. В последние годы предпочтение отдается технетрилу поскольку отсутствует искажение захвата при дефекте йодидной органификации (диффузия осуществляется через клеточную мембрану, минуя натрий-йодидный симпортер), а накопление радиофармпрепарата происходит при высоком митохондриальном потенциале клеток [11][23][24].
В большинстве ретроспективных исследований представлена суммарная распространенность АмИТ с указанием преобладания тиреотоксикоза 2 типа, варьирующая в широких пределах от 4,0–13,6% [25–28] до 20,5–43,9% с учетом субклинических форм [29–31]. Возможно, она обусловлена различиями в диагностических критериях АмИТ, частоте мониторинга функции щитовидной железы, географических различиях потребления йода, включением пациентов с умеренными функциональными нарушениями щитовидной железы [26][33]. Увеличение распространенности АмИТ2 за последние десятилетия обусловлено большим вниманием к данной проблеме, тщательным обследованием и отбором кандидатов на лечение, избеганием назначения препарата пациентам с латентными нарушениями функции щитовидной железы, а также ориентированием пациентов на регулярный мониторинг [34]. Распространенность манифестного АмИТ в России составляет 5,8–15,8%, по АмИТ2 статистики практически не существует [35–38].
В настоящее время специфические предикторы АмИТ2 не известны [27]. Данные о влиянии дозы амиодарона и длительности терапии противоречивы [29][39]. Наличие дилатационной кардиомиопатии, саркоидоза сердца, тяжелого врожденного порока, хронической сердечной недостаточности III–IV функционального класса (NYHA) сопряжено с большей частотой амиодарон-индуцированной тиреопатии, однако у данной категории пациентов высока вероятность получения и большей накопительной дозы препарата. Возможно, долгосрочный риск дисфункции щитовидной железы зависит от кумулятивной дозы антиаритмика в течение первого года лечения [28][33][40][41]. Прогностическими факторами развития АмИТ2 могут служить возраст [24][27], низкий индекс массы тела [28], а также наличие хронической обструктивной болезни легких [42]. Несоблюдение алгоритма наблюдения при приеме амиодарона — определение функционального состояния щитовидной железы до назначения препарата, каждые 6 месяцев во время лечения и в течение 12–24 месяцев после его отмены затрудняет своевременную диагностику и лечение дисфункции щитовидной железы [2][22][43].
ЦЕЛЬ ИССЛЕДОВАНИЯ
Оценить структуру амиодарон-индуцированной дисфункции щитовидной железы, распространенность, сроки и предикторы развития АмИТ2 в проспективном когортном исследовании у пациентов, впервые получивших антиаритмическую терапию амиодароном.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения. Исследование проведено на базе клиник ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет).
Время исследования. Наблюдение пациентов осуществлялось с января 2009 по август 2013 гг.
Изучаемые популяции (одна или несколько)
Использовался сплошной способ формирования выборки. Изучалась одна популяция: пациенты, проживающие в Москве и Московской области, без нарушения функции щитовидной железы, с наличием или отсутствием структурных изменений, впервые получившие терапию амиодароном.
Критериями включения являлись: возраст 18–85 лет, эутиреоз до назначения амиодарона, минимальный период наблюдения на фоне приема амиодарона — 12 месяцев, при замене антиаритмика раньше этого времени (минимальный срок приема амиодарона 1 месяц) — дальнейший мониторинг функционального состояния щитовидной железы в течение 12 месяцев, отсутствие в анамнезе нарушений функции щитовидной железы, подписанное информированное согласие на участие в исследовании.
Критерии невключения: терапия амиодароном в анамнезе, ангиография с использованием йодсодержащего контрастного вещества в течение последних 6 месяцев, прием препаратов лития, интерферона, интерлейкина-2, моноклональных антител, ингибиторов протеинкиназ, выраженная почечная и печеночная недостаточность, психические расстройства, беременность, период лактации.
Дизайн исследования
Проведено проспективное исследование, включавшее 124 пациента (69 мужчин и 55 женщин) без нарушения функции щитовидной железы, которым впервые был назначен амиодарон. Исходно и после назначения первые 3 месяца 1 раз в месяц и далее каждые 3 месяца проводилось исследование уровней: ТТГ, свТ4 и свТ3, антител к тиреоидной пероксидазе (АТ-ТПО); выполнялось УЗИ щитовидной железы с доплерогафией — исходно и далее с интервалом 12 месяцев. Период наблюдения в среднем составил от 12 до 24 месяцев. Пациентам с АмИТ проводилось исследование уровня АТ-рТТГ и сцинтиграфия щитовидной железы с пертехнетатом технеция. Пациенты с АмИТ2 стали участниками проспективного исследования по оценке эффективности различных вариантов терапии глюкокортикоидами.
Описание медицинского вмешательства (для интервенционных исследований)
Клинические методы обследования включали сбор анамнеза (сердечно-сосудистая и сопутствующая патологии, отсутствие/наличие курения), антропометрических данных, определение функционального состояния щитовидной железы до назначения амиодарона: исследование уровней ТТГ, свТ4, свТ3, АТ-ТПО; проведение УЗИ щитовидной железы с доплерографией; в дальнейшем — на фоне приема препарата согласно дизайну исследования; регистрация суточной дозы амиодарона и длительности приема. Для морфологической верификации узловых образований проводилась тонкоигольная аспирационная биопсия. При развитии АмИТ — определение уровня АТ-рТТГ и сцинтиграфия щитовидной железы с технецием-99м-пертехнетатом. Йодный статус пациентов был определен по данным Глобальной сети по йоду (Iodine Global Network) и литературных источников [44–46], медианная концентрация йода в моче не определялась.
Методы
Уровни ТТГ (референс 0,4–4,0 мкМЕ/мл), свТ4 (референс 11,5–23,2 пмоль/л) определялись иммунохемилюминесцентным методом с помощью набора Immulite (США), свТ3 (референс 3,5–6,5 пмоль/л) — иммунохемилюминесцентным методом с помощью набора Вayer-ACS:180 (Германия). АТ-ТПО — иммуноферментным методом с помощью набора «Хема-Медика» (Россия), референс 0–60 МЕ/мл; АТ-рТТГ — радиорецепторным методом с помощью набора “CIS Bio International” (Франция), референс 0–1 МЕ/л. УЗИ щитовидной железы проводили аппаратом Voluson 730 Pro (General Electric, США). Увеличенным считался объем >18 мл у женщин и >25 мл у мужчин. Тонкоигольная аспирационная биопсия узловых образований выполнялась иглой для внутримышечных инъекций 21G под контролем УЗИ c последующим цитологическим исследованием в патоморфологическом отделении: окрашиванием мазков по методу Май-Грюнвальда-Гимзы и микроскопическим исследованием на аппарате Leica DM 2500 (Leica Microsystems GmbH, Германия). Сцинтиграфия щитовидной железы с пертехнетатом технеция-99mTcO4 производилась с помощью вращающейся гамма-камеры GE 400T (General Electric, Бостон, Массачусетс, США).
Эутиреоидная гипертироксинемия регистрировалась при повышенном уровне свТ4 в сочетании с низкореференсным/пониженным значением свТ3 и референсным уровнем ТТГ. Транзиторный гипотиреоз устанавливался при временном (не более 6 месяцев) повышении уровня ТТГ>4,0 мкМЕ/мл с последующим возвращением в референсный диапазон; субклинический — при значениях ТТГ>4,0<10,0 мкМЕ/мл и манифестный — при значениях ТТГ>10,0 мкМЕ/мл, сохраняющихся более 6 месяцев. Манифестный АмИТ регистрировался при снижении уровня ТТГ<0,4 мкМЕ/мл, превышении значений свТ4>23,2 пмоль/л, референсном или свТ3>6,5 пмоль/л в сыворотке крови; субклинический АмИТ — снижении уровня ТТГ<0,4 мкМЕ/мл и референсных значениях свТ4 и свТ3. АмИТ1 подтверждался наличием гиперваскуляризации при доплерографии, повышенным захватом пертехнетата технеция по данным сцинтиграфии (>1,8%); АмИТ2 — отсутствием гиперваскуляризации, АТ-рТТГ (<1 МЕ/л) и низким захватом пертехнетата технеция (<1%).
Наблюдение завершалось при развитии амиодарон-индуцированной дисфункции щитовидной железы или отказе пациента от дальнейшего участия в исследовании. Оценивались вид и частота дисфункции, время возникновения и предикторы АмИТ2.
Статистический анализ
Проверка количественных данных на нормальность распределения произведена с помощью критерия Колмогорова-Смирнова и по величине асимметрии и эксцесса. Описательные статистики для количественных переменных представлены в виде медианы, интерквартильного диапазона (Mе [Q1; Q3]), для категориальных переменных — в процентах. Статистическая значимость различий между группами для количественных данных определялась с помощью критерия Краскела-Уоллиса и последующим роst-hос анализом с применением поправки Бонферрони; апостериорные парные сравнения — с помощью критерия Манна-Уитни. Изменения количественных показателей в связанных выборках оценивались с помощью критерия Уилкоксона и Фридмана с последующим post-hoc анализом с поправкой на множественность сравнений. Анализ номинальных данных производился с использованием χ² Пирсона и точного критерия Фишера. Для оценки влияния факторов на выживаемость применялся метод Каплана-Мейера с использованием лог-ранк критерия Мантеля-Кокса. Построение прогностических моделей производилось методом бинарной логистической регрессии с последующим ROC-анализом и регрессии Кокса. Различия считались статистически значимыми при значении p<0,05. Статистический анализ данных осуществлен при помощи пакета статистических программ SPSS v. 26 (SPSS, Chicago, IL, USA).
Этическая экспертиза
Протокол исследования рассмотрен и одобрен на заседании комитета по этике при ассоциации медфармвузов при ПМГМУ им. И.М. Сеченова (протокол №10-08 от 11 декабря 2008 г.).
Результаты
В исследовании приняли участие 124 пациента: 69 (55,6%) мужчин и 55 (44,4%) женщин в возрасте от 23 до 85 лет, госпитализированных по поводу нарушений ритма сердца. В 46% (n=57) случаев регистрировалась фибрилляция предсердий (рис. 1), у трети пациентов (43% (n=53)) отмечалась декомпенсация хронической сердечной недостаточности, у 21% (n=26) — сниженная фракция выброса левого желудочка, у 19,4% (n=24) — легочная гипертензия.
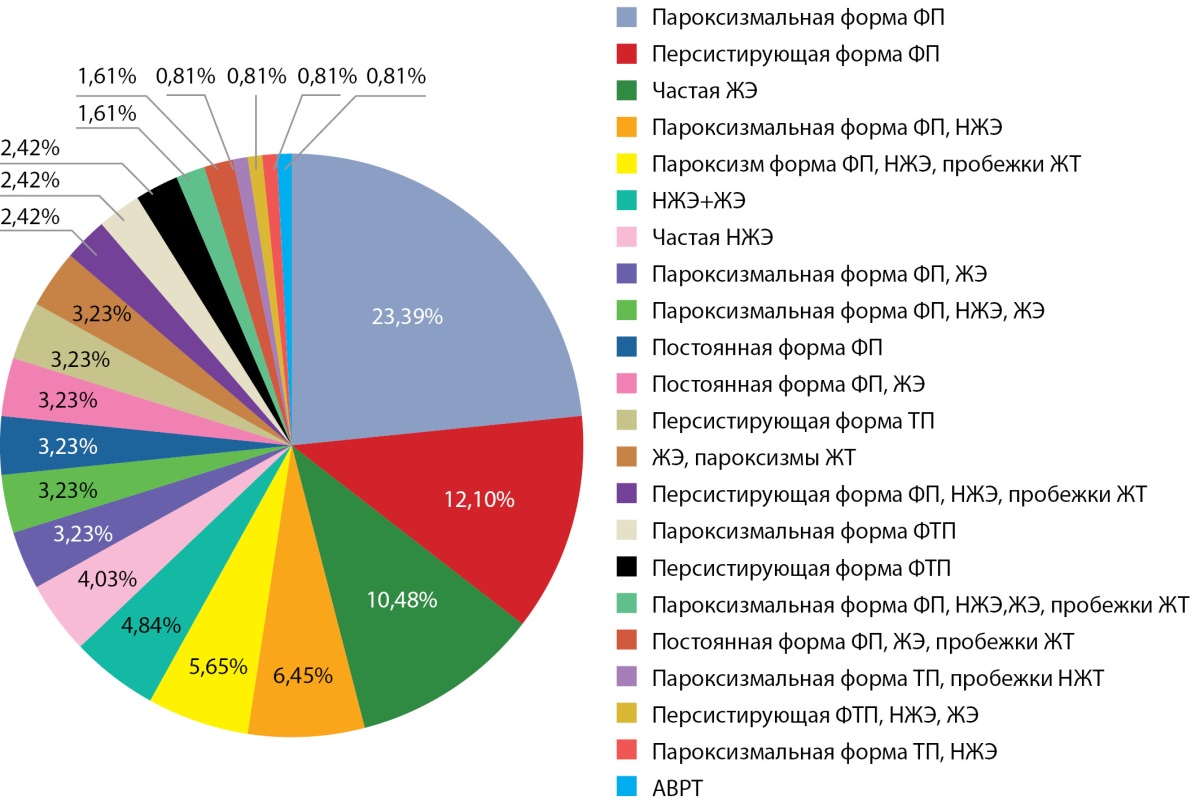
Рисунок 1. Виды нарушений ритма сердца при назначении амиодарона.
Примечание: НЖЭ — наджелудочковая экстрасистолия; ФП — фибрилляция предсердий; ТП — трепетание предсердий; ФТП — фибрилляция и трепетание предсердий, ЖЭ — желудочковая экстрасистолия; ЖТ — желудочковая тахикардия; АВРТ — атриовентрикулярная реципрокная тахикардия.
Гендерных различий по возрасту, индексу массы тела (ИМТ), скорости клубочковой фильтрации, суточной и кумулятивной дозе амиодарона, длительности приема, имеющейся сердечно-сосудистой патологии выявлено не было. Большая частота узлового/многоузлового коллоидного зоба встречалась у женщин (р=0,002), однако различия по частоте амиодарон-индуцированной дисфункции по сравнению с мужчинами отсутствовали.
По приему амиодарона и соответствующему периоду наблюдения пациенты были распределены на 5 групп: группа 1 — длительность приема менее 12 месяцев с заменой на другой антиаритмический препарат и дальнейшим наблюдением в течение года; группа 2 — прием и наблюдение в течение 12 месяцев; группа 3 — прием и наблюдение в течение 18 месяцев; группа 4 — прием и наблюдение в течение 24 месяцев; группа 5 — прием и наблюдение более 24 месяцев. Характеристика пациентов по группам представлена в табл. 1.
Таблица 1. Характеристика пациентов
|
Параметр |
Все |
Замена Ам (1) |
12 мес (2) |
18 мес (3) |
24 мес (4) |
более 24 мес (5) |
р1-5-value |
|
Число пациентов, n (%): |
124 |
11 (8,9) |
47 (37,9) |
16 (12,9) |
37 (29,8) |
13 (10,5) |
|
|
Пол: |
0,794 |
||||||
|
мужской |
69 (55,6) |
6 (54,5) |
29 (61,7) |
7 (43,7) |
20 (54,1) |
7 (53,8) |
|
|
женский |
55 (44,4) |
5 (45,5) |
18 (38,3) |
9 (56,3) |
17 (45,9) |
6 (46,2) |
|
|
Возраст |
62,0 |
54,0 |
61,0 |
63,5 |
69,8 |
60,0 |
0,389 |
|
Курение |
33 (26,6) |
6 (54,5) |
15 (31,9) |
3 (18,8) |
8 (21,6) |
1 (7,7) |
0,094 |
|
Заболевание легких (ХНЗЛ) |
18 (14,5) |
9 (20,0) |
3 (18,8) |
4 (10,8) |
2 (15,4) |
0,536 |
|
|
ИМТ, кг/м² |
28,4 |
26,5 |
30,1 |
28,3 |
28,5 |
26,6 |
0,209 |
|
СД 2 типа |
25 (20,2) |
2 (18,2) |
11 (23,4) |
4 (25) |
5 (13,5) |
3 (23,1) |
0,800 |
|
Повышение трансаминаз |
23 (18,5) |
1 (9,1) |
8 (17,0) |
4 (25) |
8 (21,6) |
2 (15,4) |
0,830 |
|
СКФCKD-EPI, мл/мин/1,73 м² |
69,6 |
76,6 |
65,8 |
73,7 |
68,8 |
71,8 |
0,555 |
|
Нарушения ритма: |
0,039* |
||||||
|
предсердные |
75 (60,5) |
6 (54,5) |
24 (51,1) |
9 (56,3) |
29 (78,4) |
7 (53,8) |
|
|
желудочковые |
16 (12,9) |
4 (36,4) |
5 (10,6) |
2 (12,5) |
4 (10,8) |
1 (7,7) |
|
|
комбинированные |
33 (26,6) |
1 (9,1) |
18 (38,3) |
5 (31,3) |
4 (10,8) |
5 (38,5) |
|
|
ХСН, NYHA: |
0,227 |
||||||
|
II ФК |
47 (37,9) |
5 (45,5) |
18 (38,3) |
7 (43,8) |
12 (32,4) |
5 (38,5) |
|
|
III ФК |
6 (4,8) |
2 (18,2) |
3 (6,4) |
1 (6,3) |
|||
|
ФВЛЖ, % |
57,0 |
53,0 |
58,0 |
54,5 |
59,0 |
59,0 |
0,055 |
|
ХСНФВЛЖ: |
0,388 |
||||||
|
c промежуточной |
14 (11,3) |
7 (14,9) |
2 (12,5) |
3 (8,1) |
2 (15,4) |
||
|
c низкой |
12 (9,7) |
4 (36,4) |
5 (10,6) |
1 (6,3) |
2 (5,4) |
||
|
СДЛА, мм рт.ст. |
26,0 |
28,0 |
28,0 |
26,5 |
25,0 |
25,0 |
0,187 |
|
Порок сердца |
21 (16,9) |
2 (18,2) |
7 (14,9) |
1 (6,3) |
7 (18,9) |
4 (30,8) |
0,515 |
|
Миокардит |
14 (11,3) |
3 (27,3) |
4 (8,5) |
2 (12,5) |
1 (2,7) |
4 (30,8) |
0,028* |
|
Кардиомиопатия |
10 (8,1) |
1 (9,1) |
5 (10,6) |
3 (8,1) |
1 (7,7) |
0,765 |
|
|
ТТГисходно, мкМЕ/мл |
2,2 |
2,1 |
2,3 |
1,9 |
2,3 |
2,8 |
0,728 |
|
свТ4исходно, пмоль/л |
16,6 |
16,4 |
16,6 |
16,6 |
16,4 |
17,8 |
0,795 |
|
свТ3исходно, пмоль/л |
4,7 |
4,8 |
4,7 |
4,4 |
4,8 |
4,8 |
0,816 |
|
АТ-ТПО, МЕ/мл |
14,0 |
11,0 |
16,0 |
12,0 |
14,0 |
14,0 |
0,057 |
|
Исходная структурная патология ЩЖ: |
0,903 |
||||||
|
нет |
94 (75,8) |
9 (81,8) |
36 (76,6) |
25 (67,6) |
1 (7,7) |
||
|
узловой зоб |
10 (8,1) |
5 (10,6) |
14 (87,5) |
3 (8,1) |
1 (7,7) |
||
|
многоузловой зоб |
15 (12,1) |
2 (18,2) |
4 (8,5) |
1 (6,3) |
7 (18,9) |
1 (7,7) |
|
|
диффузный зоб |
5 (4,0) |
2 (4,3) |
1 (6,3) |
2 (5,4) |
1 (7,7) |
||
|
Объем ЩЖ, мл |
15,4 |
15,0 |
15,8 |
14,9 |
15,9 |
12,0 |
0,317 |
|
Длительность приема Ам, недели |
73,5 |
21,0 |
52,0 |
78,0 |
104,0 |
153,0 |
<0,001* |
|
Суточная доза Ам, мг |
200 |
200 |
200 |
250 |
200 |
200 |
0,099 |
|
Кумулятивная доза Ам, г |
135,8 |
36,4 |
73,0 |
118,7 |
145,6 |
203,8 |
<0,001* |
|
Время развития АмИТ2 от начала приема Ам, недели |
92,0 |
86,0 |
43,0 |
69,0 |
98,0 |
156,0 |
<0,001* |
|
свТ4максАмИТ2, пмоль/л |
30,9 |
27,8 |
34,2 |
27,6 |
41,8 |
31,2 |
0,789 |
|
свТ3максАмИТ2, пмоль/л |
7,2 |
6,6 |
7,1 |
6,9 |
9,1 |
7,9 |
0,617 |
|
свТ4макс/свТ3макс |
4,0 |
4,2 |
4,8 |
3,8 |
4,1 |
3,9 |
0,260 |
|
АТ-рТТГАмИТ2, МЕ/л |
0,6 |
0,4 |
0,4 |
0,6 |
0,4 |
0,6 |
0,411 |
|
Объем ЩЖАмИТ2, мл |
17,0 |
9,7 |
21,8 |
15,5 |
19,3 |
13,8 |
0,249 |
|
ИЗ99mTcO4, % |
0,4 |
0,6 |
0,5 |
0,6 |
0,2 |
0,4 |
0,208 |
|
Эутиреоз |
75 (60,5) |
7 (63,6) |
32 (68,1) |
8 (50,0) |
24 (64,9) |
4 (30,8) |
0,142 |
|
Эутиреоидная гипертироксинемия |
8 (6,5) |
3 (6,4) |
3 (8,1) |
2 (15,4) |
0,490 |
||
|
Транзиторный гипотиреоз |
27 (21,8) |
4 (36,4) |
11 (23,4) |
3 (18,8) |
8 (21,6) |
2 (15,4) |
0,385 |
|
АмИГсубклинический |
18 (14,5) |
1 (9,1) |
4 (8,5) |
3 (18,8) |
8 (21,6) |
2 (15,4) |
0,399 |
|
АмИГманифестный |
6 (4,8) |
5 (10,6) |
1 (2,7) |
0,425 |
|||
|
АмИТ1 |
2 (1,6) |
1 (9,1) |
1 (2,1) |
0,287 |
|||
|
АмИT2субклинический |
7 (5,6) |
1 (9,1) |
1 (2,1) |
2 (12,5) |
1 (2,7) |
2 (15,4) |
0,930 |
|
АмИТ2манифестный |
22 (17,7) |
2 (18,2) |
3 (6,4) |
4 (25,0) |
6 (16,2) |
7 (53,8) |
0,938 |
|
АмИТ2 |
29 (23,4) |
3 (27,3) |
4 (8,5) |
6 (37,5) |
7 (18,9) |
9 (69,2) |
<0,001* |
Примечание: ХНЗЛ — хронические неспецифические заболевания легких; СКФ — скорость клубочковой фильтрации; ХСН — хроническая сердечная недостаточность; ФВЛЖ — фракция выброса левого желудочка; СДЛА — систолическое давление в легочной артерии; ЩЖ — щитовидная железа; Ам — амиодарон; свТ4максАмИТ2 — максимальный уровень свТ4 при АмИТ2; свТ3максАмИТ2 — максимальный уровень свТ3 при АмИТ2; свТ4макс/свТ3макс — соотношение максимальных значений свободных фракций Т4 и Т3 при АмИТ2; ИЗ99mTcO4 — индекс захвата пертехнетата технеция; АмИГ — амиодарон-индуцированный гипотиреоз.
*различия показателей между группами статистически значимы (р<0,05).
Различия между группами отмечались по виду и частоте нарушений сердечного ритма (p=0,041): преобладание комбинированных (предсердные и желудочковые) нарушений в группе 2 по сравнению с группой 4 (р=0,044); частоте миокардита (р=0,028): меньшее число случаев в группе 4 по сравнению с группами 1 и 5 (р1-4=0,048, р4-5=0,037); длительности приема амиодарона (р<0,001): меньшая в группах 1 и 2 по сравнению с группами 3–5 (р1-3,4,5<0,001, р2-3=0,017, р2-4,5<0,001), в группе 3 по сравнению с группой 5 (р=0,001); кумулятивной дозе (р<0,001): меньшая в группах 1 и 2 по сравнению с группами 3–5 (р1-3,4,5<0,001, р2-3=0,035, р2-4,5<0,001), в группе 3 по сравнению с группой 5 (р=0,048); времени развития АмИТ2 от начала приема антиаритмика (р<0,001): меньшее в группах 2 и 3 по сравнению с группой 5 (р2-5<0,001, р3-5=0,001); а также по частоте развития АмИТ2 (p<0,001): меньшая в группе 2 по сравнению с группами 3 и 5 (р2-3=0,020, р2-5<0,001), в группе 4 по сравнению с группой 5 (р=0,004).
Наименьшая длительность приема амиодарона была в группе 1, медиана составила 21,0 [ 13,0; 26,0] неделю, время возникновения АмИТ2 от отмены препарата — 47,0 [ 42,5; 49,5] недель. Зависимость риска развития АмИТ2 от отмены амиодарона оценена с помощью лог-ранк критерия Мантеля-Кокса была статистически незначимой (р=0,062): медиана срока возникновения АмИТ2 в 1 группе составила 86,0±9,5 недели (95% ДИ: 67,4–104,6), среднее время — 86,3±3,7 недели (95% ДИ: 79,1–93,6), у продолжавших прием антиаритмика медиана составила 144±21,8 недели (95% ДИ: 101,2–186,7), среднее время — 152,9±13,1 недели (95% ДИ: 127,3–178,5) (рис. 2). Медиана срока общей выживаемости составила 144±21,7 недели (95% ДИ: 101,4–186,6), среднее время — 150,2±12,6 недели (95% ДИ: 125,5–175,0) (рис. 3).
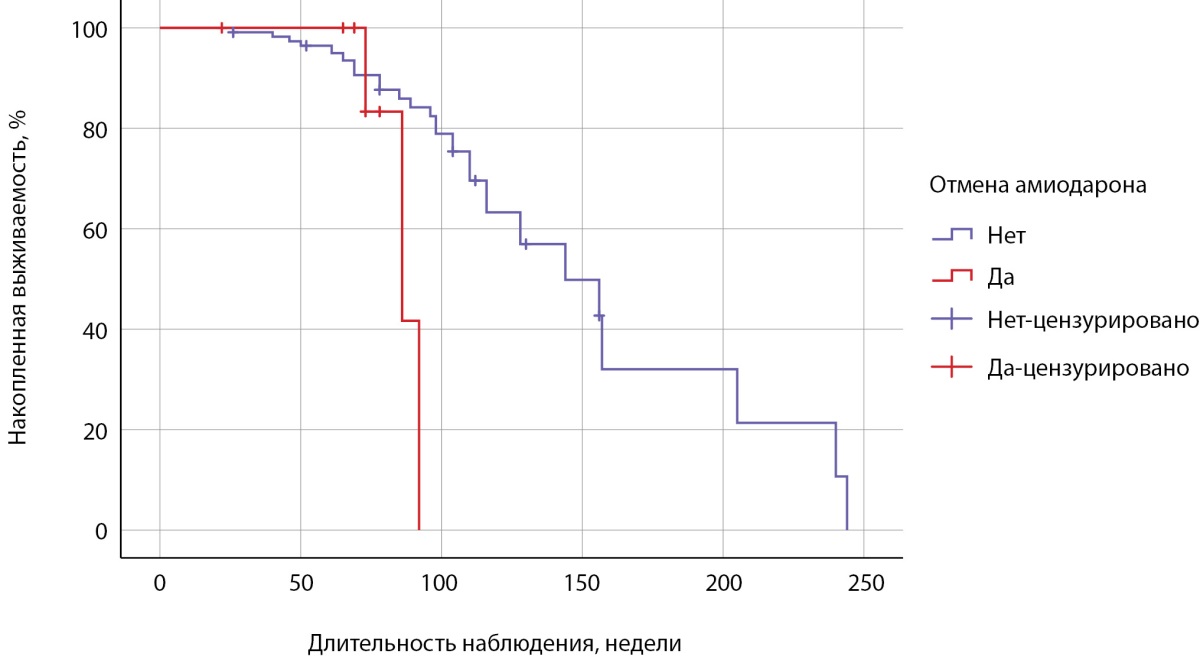
Рисунок 2. Кривая Каплана-Мейера,
характеризующая бессобытийную выживаемость при отмене амиодарона.
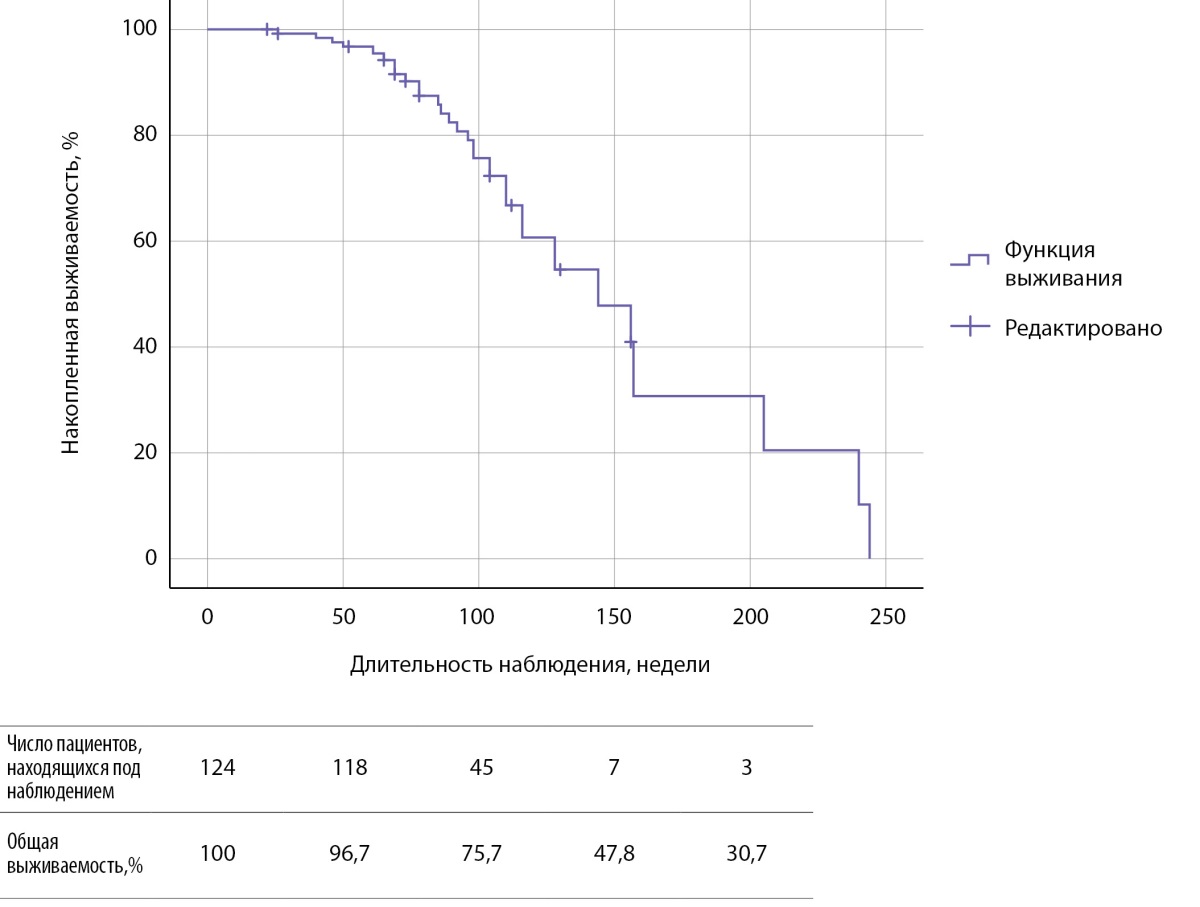
Рисунок 3. Кривая Каплана-Мейера, характеризующая общую выживаемость пациентов.
Динамика уровня ТТГ, свободных фракций тиреоидных гормонов и АТ-ТПО на фоне приема амиодарона представлена в табл. 2. Исходный низкореференсный уровень ТТГ (<1 мкМЕ/мл) отмечался в 4,0% (5/124) случаев, не влиял на развитие АмИТ2 (р=0,333). 87,1% (108/124) пациентов принимали амиодарон в течение года, 36,3% (46/124) — в течение двух лет. Статистически значимое увеличение уровня ТТГ, свТ4 и снижение свТ3 по сравнению с исходным значением в этих периодах наблюдения регистрировалось во всех временных точках мониторинга (р<0,001). Изменение объема щитовидной железы на фоне приема амиодарона не отмечалось (р0-12мес=0,378; р0-12-24мес=0,218).
Таблица 2. Динамика уровня ТТГ, свободных фракций тиреоидных гормонов, АТ-ТПО
на фоне приема амиодарона
|
Параметр |
Исходно n=124 |
1 мес n=124 |
2 мес n=123 |
3 мес n=123 |
6 мес n=117 |
9 мес n=111 |
12 мес n=108 |
15 мес n=66 |
18 мес n=62 |
21 мес n=49 |
24 мес n=46 |
|
ТТГ, мкМЕ/мл |
2,2 0,5–3,9 |
3,1 0,4–20,0 |
3,2 0,5–24,1 |
3,0 0,6–39,3 |
3,0 0,03–43,3 |
3,1 0,05–10,1 |
3,1 0,01–9,5 |
3,0 0,01–9,3 |
3,1 0,01–8,7 |
3,1 0,01–7,6 |
3,1 0,02–8,1 |
|
свТ4, пмоль/л |
16,5 11,4–22,9 |
18,5 9,7–27,2 |
18,6 9,4–25,3 |
18,8 5,0–27,0 |
19,0 5,8–37,3 |
18,8 10,7–29,0 |
18,8 8,32–38,6 |
19,2 12,6–62,8 |
19,2 12,3–34,63 |
18,6 13,2–100,0 |
18,6 13,0–21,0 |
|
свТ3, пмоль/л |
5,1 3,6–6,0 |
4,7 3,5–5,4 |
4,4 3,4-5,6 |
4,4 3,4–5,6 |
4,4 3,3–7,9 |
4,4 3,4–6,7 |
4,3 3,5–8,3 |
4,5 3,5–12,4 |
4,5 3,7–7,6 |
4,4 3,4–27,8 |
4,5 3,5–5,4 |
|
АТ-ТПО, МЕ/мл |
14,0 4,0–662,0 |
15,0 6,0–820,0 |
16,0 4,0–1077,0 |
15,0 6,0–580,0 |
16,0 6,0–616,0 |
16,5 8,0–1000,0 |
16,0 8,0–814,0 |
16,5 5,0–736,0 |
17,0 10,0–627,0 |
16,5 11,0–753,0 |
18,0 10,0–658,0 |
Частота развития АмИТ2 в течение первого года наблюдения составила 3,2% (4/124), второго — 12,9% (16/24), третьего — 4,0% (5/124). Исходная структурная патология щитовидной железы регистрировалась в 27,6% (8/29) случаев: в 13,8% (4/29) — узловой коллоидный зоб, в 3,4% (1/29 — многоузловой коллоидный зоб, в 10,3% (3/29) — диффузный зоб. При цветовом доплеровском картировании отсутствовала гиперваскуляризация паренхимы, интранодулярный кровоток; у трех пациентов отмечался перинодулярный кровоток. Длительность приема амиодарона в группе АмИТ2 варьировала от 26 до 244 недель (89,0 [ 61,0; 110]). Кумулятивная доза статистически значимо была меньшей у пациентов с ХСН II–III ФК (11/29) по сравнению с пациентами без ХСН (р=0,021), диапазон вариабельности составил 36,4–512,4 г (137,2 [ 109,2; 168,0]). Медиана максимальных значений свТ4 составила 31,2 [ 25,3; 42,3], минимум 19,7, максимум 124,7 пмоль/л; свТ3 — 7,3 [ 6,5; 10,1], минимум 5,3, максимум 30,8 пмоль/л. Тяжесть тиреотоксикоза условно оценивалась по максимальным значениям свободных фракций тиреоидных гормонов. У 69,0% (20/29) пациентов отмечалось легкое течение АмИТ2 (свТ4<40; свТ3<10 пмоль/л), 24,1% (7/29) — умеренное (свТ4 40–80; свТ3 10–15 пмоль/л), 6,9% (2/29) — тяжелое (свТ4>80; свТ3>15 пмоль/л).
При оценке факторов риска развития АмИТ2 (параметры, указанные в табл. 1) статистически значимыми являлись: возраст начала терапии амиодароном (ОШ=0,945, 95% ДИ: 0,913–0,979; R²=0,129; р=0,001), ИМТ (ОШ=0,869, 95% ДИ: 0,785–0,963; R²=0,098 р=0,004), длительность приема препарата (ОШ=1,015, 95% ДИ: 1,003–1,026; R²=0,102; р=0,003), время от начала терапии (ОШ=1,020, 95% ДИ: 1,007–1,033; R²=0,138; р<0,001), наличие миокардита (ОШ=8,1, 95% ДИ: 2,450–26,780; R²=0,143; р<0,001).
Согласно полученной многофакторной модели бинарной логистической регрессии (R²=0,358, р<0,001) увеличение возраста на 1 год уменьшает шансы АмИТ2 в 1,07 раза, увеличение ИМТ на 1 кг/м² уменьшает шансы АмИТ2 в 1,16 раза, увеличение времени от начала терапии антиаритмиком увеличивает шансы АмИТ2 в 1,02 раза. Статистическая значимость длительности приема препарата (р=0,994) и миокардита (р=0,428) как предикторов АмИТ2 не подтвердилась. Характеристика предикторов представлена в табл. 3. Диагностическая значимость прогностической модели оценена с помощью метода ROC-кривых: площадь под ROC-кривой составила 0,818±0,049 с 95% ДИ: 0,722–0,913, пороговое значение функции в точке cut-off составило 0,195. Значения функции, равные или превышающие данное значение, соответствовали прогнозу развития АмИТ2, чувствительность — 79,3%, специфичность — 70,5% (рис. 4).
Таблица 3. Предикторы АмИТ2, результаты бинарной логистической регрессии
(метод исключения по Вальду)
|
Параметр |
ОШ |
95% ДИ |
р |
|
Возраст |
0,931 |
0,895–0,968 |
<0,001* |
|
ИМТ |
0,859 |
0,762–0,967 |
0,012* |
|
Время от начала терапии амиодароном |
1,023 |
1,008–1,038 |
0,003* |
* влияние предиктора статистически значимо (р <0,05).
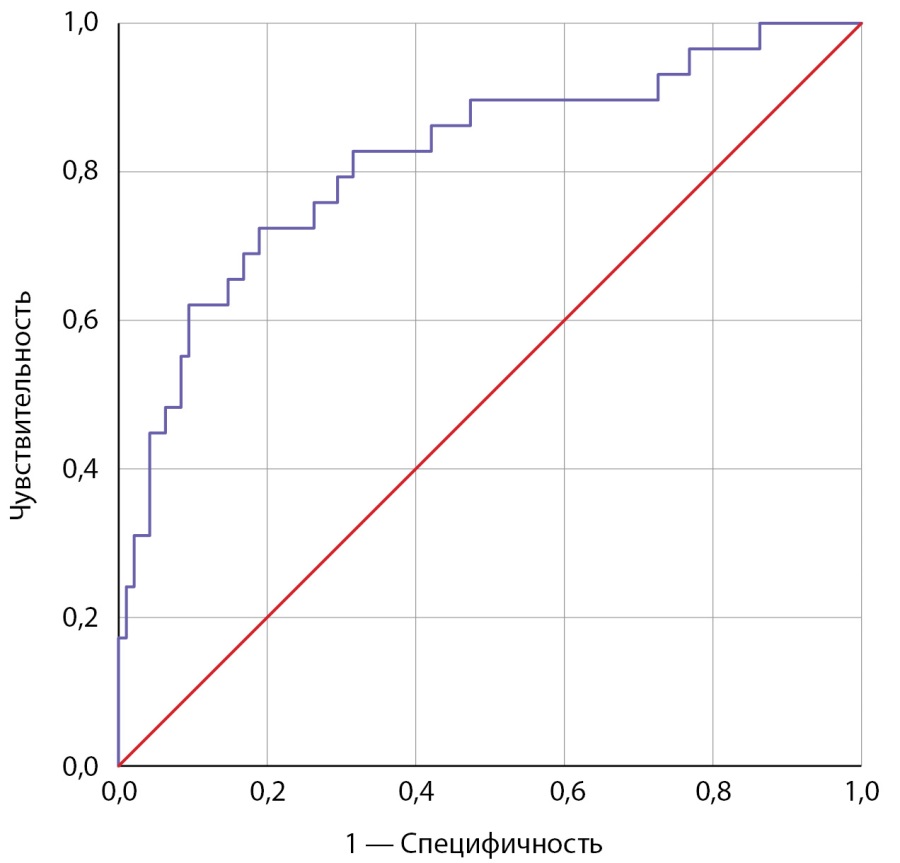
Рисунок 4. ROC-кривая вероятности развития АмИТ2 в зависимости от возраста,
индекса массы тела, времени от начала терапии амиодароном.
Определено пороговое значение для возраста: при ≤60 лет прогнозировался высокий риск развития АмИТ2 (AUC 0,715±0,055 с 95% ДИ: 0,607–0,822; р<0,001; чувствительность 69%, специфичность 64,2%). Оптимальным разделяющим значением для ИМТ стал ≤26,6 кг/м² (AUC 0,681±0,058 с 95% ДИ: 0,568–0,793; р=0,003; чувствительность 69%, специфичность 69,5%). Для времени возникновения АмИТ2 от начала терапии Ам определено ≥75,5 недели (AUC 0,643±0,063 с 95% ДИ: 0,519–0,767; р=0,020; чувствительность — 69%, специфичность — 51,6%).
Оценка комплексного влияния факторов на риск развития АмИТ2 произведена с помощью регрессии Кокса. Получена статистически значимая модель пропорциональных рисков (р=0,009), согласно которой возраст ≤60 лет сопровождается ростом риска возникновения АмИТ2 в 2,4 раза (ОШ=2,352, 95% ДИ: 1,053–5,253; р=0,037), ИМТ≤26,6 кг/м² — в 2,3 раза (ОШ=2,301, 95% ДИ: 1,025–5,165; р=0,043). Значения базового риска развития АмИТ2 для разных временных периодов наблюдения представлены в табл. 4.
Таблица 4. Значения базового риска развития АмИТ2 для разных временных периодов
(максимальный срок – 240 недель)
|
Временные периоды, недели |
Значения базового риска h0(t) |
|
26 недель |
0,003 |
|
52 недели |
0,014 |
|
78 недель |
0,053 |
|
104 недели |
0,134 |
|
156 недель |
0,325 |
|
182 недели |
0,405 |
|
208 недель |
0,518 |
|
240 недель |
0,672 |
Обсуждение
Исследование было направлено на изучение распространенности и факторов риска развития АмИТ2 у пациентов с подтвержденным эутиреозом до начала терапии амиодароном, проживающих в районе легкого и умеренного йодного дефицита (медианная концентрация йода в моче в Москве — 67,0 мкг/л, в Московской области — 52,5 мкг/л) [45][46]. В полученной структуре амиодарон-индуцированной дисфункции отмечено преобладание АмИТ2. В представленной выборке за период наблюдения 1–4,6 года частота развития тиреотоксикоза составила 23,4% (29/124) с учетом субклинических форм (5,6% (7/124)), что соответствует высоким значениям диапазона, встречаемого в научных публикациях [30][32][41][47]. АмИТ1 в нашем исследовании развился только у двух пациентов (1,6%): в одном случае — субклинический вариант, через 6 месяцев от начала терапии у пациента с исходно низкореференсным значением ТТГ (0,94 мкМЕ/мл), многоузловым зобом и отсутствием гиперваскуляризации при доплерографии. Длительность приема препарата составила 1 месяц, замена произведена по кардиологическим показаниям. По результатам сцинтиграфии выявлены очаги гиперфиксации пертехнетата (индекс захвата 2,8%), в дальнейшем пациенту выполнена радиойодтерапия. Во втором случае у пациентки с интактной щитовидной железой через 6 месяцев развилась болезнь Грейвса, в течение 1,5 года проводилась тиреостатическая терапия тиамазолом с сохранением ремиссии в течение последующего двухлетнего периода наблюдения, прием амиодарона продолжался по кардиологическим показаниям. Частота амиодарон-индуцированного гипотиреоза составила 19,4% (24/124), сопоставима с предыдущими российскими исследованиями 19,2–19,5% [35][37]. Манифестная форма гипотиреоза, потребовавшая назначение левотироксина, зарегистрирована в 4,8% (6/124) случаев.
Влияние йодного статуса на превалирование АмИТ (йододефицитные регионы) или АмИГ (регионы с адекватным потреблением йода) дискутабельно. Согласно различным исследованиям, отмечается сходная частота АмИТ в йододефицитных 6,9–20,5% [29][30][36] и районах с достаточным обеспечением йода 5,8–30% [26][48][49], что предполагает преобладание других патогенетических механизмов (изменение ауторегуляции щитовидной железы, прямой цитотоксический эффект на тиреоциты, полиморфизм генов, участвующих в биосинтезе и метаболизме тиреоидных гормонов) [19][50].
Отраженная в публикациях частота развития АмИТ в течение первого года приема амиодарона 4,0–5,8% [25][35][40] сопоставима с результатами нашего исследования — 4,8% (6/124). Выявленная высокая частота АмИТ2, наиболее вероятно, обусловлена отбором пациентов на терапию антиаритмиком (определение исходной функциональной и структурной патологии щитовидной железы, строгие критерии включения), проспективным характером исследования, частотой проводимого мониторинга (сокращение интервала оценки тиреоидного профиля с 6 до 3 месяцев).
Несмотря на внушительные выборки в ретроспективных исследованиях иностранных коллег, данные о распространенности АмИТ2 достаточно скудные, в большинстве работ представлены обобщенные результаты, отсутствует разделение по типам АмИТ [30][31][43][47][51]. Зарегистрированная частота манифестного АмИТ2 варьирует от 5,8 до 18,3% [26][29][41]. Возможно, занижение данных истинной распространенности АмИТ2 обусловлено ретроспективным характером исследований. Отсутствие активного регулярного мониторинга функции щитовидной железы приводит к потере части информации — пропуску субклинических и вариантов легкого, реже умеренного течения в связи с нередкой стертостью клинических проявлений, отсутствием классических симптомов тиреотоксикоза (антиадренергическая активность амиодарона и его блокирующее влияние на конверсию Т4 в Т3), доминированием сердечно-сосудистых расстройств (рецидивирование нарушений ритма сердца, учащение ангинозных приступов, появление или усиление признаков хронической сердечной недостаточности) и психоэмоциональной лабильности, не всегда выражена корреляция между уровнями циркулирующих тиреоидных гормонов и клинической тяжестью тиреотоксикоза [40][51][52].
Анализ структуры имеющихся российских ретроспективных исследований случай-контроль показывает включение значительного количества пациентов со структурными изменениями щитовидной железы (50–62,5%), отсутствием данных доплерографии до назначения амиодарона [38][53][54], возможно, с латентными нарушениями функции (исходный уровень ТТГ 1,9±0,1 (0,19-4,5)) [55] и соответствующее превалирование АмИТ1. Распространенность АмИТ2 составила 1,7–9,0% [37][47][55]. Существующие проспективные исследования с частым мониторингом тиреоидного профиля характеризуются небольшой выборкой (до 50 человек), недлительным периодом наблюдения (6–12 месяцев) [53][55], которого недостаточно для представления об истинной распространенности АмИТ2 в связи с нелинейным ее изменением с течением времени, достижением максимума ко 2–3 году и снижением до очень низких показателей после 5-го года приема амиодарона [28][32][41][48]. Медиана развития АмИТ2 в нашем исследовании 92,0 [ 69,0; 116,0] недели сопоставима с результатами Bogazzi F. с соавт. 26,1±24 месяцев [34]; Tomisti L. с соавт. 28,7±16,1, 95% ДИ 27–32 месяцев [32]; среднее время бессобытийной выживаемости 150,2±12,6 недель (95% ДИ 125,5–175,0) недели с результатами Takeuchi D. с соавт. 39 месяцев (диапазон 18–110) [41].
Преобладание в структуре АмИТ 2 типа было продемонстрировано Bogazzi F. с соавт.: в ретроспективной выборке 215 пациентов увеличение среднегодового числа новых случаев АмИТ2 за 27-летний период с 2,4 до 12,5, составляя 89% случаев АмИТ, изменение АмИТ1 с 3,6 в начале периода исследования до 2,5 в последующие годы [34]; Tomisti L. с соавт. в когорте, включавшей 200 пациентов, 79% случаев АмИТ [32]; Takeuchi D. С соавт. при наблюдении 131 пациента все случаи АмИТ были обусловлены деструкцией щитовидной железы [41], и другими авторами [26][28][29].
Неожиданная, непредсказуемая манифестация тиреотоксикоза без предшествующего субклинического нарушения функции щитовидной железы [30][31] имела отражение и в нашей выборке. У 7/29 (24,1%) пациентов развитие тиреотоксикоза произошло между интервалами динамического контроля тиреоидного профиля. Умеренное и тяжелое течение тиреотоксикоза отмечалось у трети пациентов — 31,0% (9/29). Зарегистрированные максимальные значения свободных фракций тиреоидных гормонов сопоставимы с данными Tomisti L. с соавт. 41,7±16,4 и 10,2±5,2 пг/мл [32]; Takeuchi D. С с соавт. 8,02 (2,61–19,2) пг/мл и 4,82 (2,21–7,77) нг/дл [41] для свТ4 и свТ3 соответственно. Клиническую значимость субклинического тиреотоксикоза необходимо учитывать в когорте тяжелых коморбидных пациентов, в связи с увеличением риска нежелательных сердечно-сосудистых событий [56–58].
Молодой возраст как предиктор АмИТ указывается в значительном количестве исследований [25–27][37][59]. Точные пороговые значения были определены лишь в двух: Uchida T. с соавт. — менее 63,5 лет, чувствительность 70,3%, специфичность 69,2% (225 пациентов) [26] и Ahmed S. с соавт. — менее 62 лет (303 пациента) [27]. В нашей выборке также подтверждена зависимость развития АмИТ2 от возраста, разделяющим значением стал менее или равный 60 лет.
Липофильностью и концентрационно-зависимой цитотоксичностью амиодарона объясняется высокий риск развития АмИТ при низком ИМТ. Stan M. с соавт. при разработке индекса прогнозирования риска АмИТ у пациентов с врожденным пороком сердца в качестве предиктора определен ИМТ<21 кг/м² [28]. В нашем исследовании статистическая значимость получена при более высоком значении ИМТ≤26,6 кг/м².
Тяжесть ХСН (II–III ФК NYHA), порока сердца предполагает усиление роли хронической гипоксии в клиническом развитии АмИТ2 в дополнение к непосредственному цитотоксическому действию амиодарона [51]. Однако эти факторы не оказались значимыми в нашей выборке, вероятно, в связи с низкой репрезентативностью данных нарушений в представленной когорте, достаточной компенсацией имеющейся сердечно-сосудистой патологии у большей части пациентов. Наличием хронического воспалительного процесса в миокарде, при котором повышается восприимчивость к окислительному стрессу, вызванному приемом амиодарона [33], можно объяснить большую частоту развития АмИТ2 при миокардите. Не наблюдалось кумулятивное дозозависимое увеличение частоты тиреотоксикоза [60], как и «доза-эффект» у пациентов с ХСН [39]. Патогенетическая взаимосвязь высокой частоты АмИТ с гипотиреозом, развившимся на фоне терапии амиодароном, остается неясной [60], также не прослеживалась в нашей выборке.
АмИТ2 остается важной клинической проблемой, способной вызвать серьезные неблагоприятные сердечно-сосудистые события и быть резистентной к терапии. Предварительное прогнозирование, ранняя диагностика позволят обеспечить превентивные меры по предотвращению клинического ухудшения, затратив дополнительные усилия на контроль ритма и частоты сердечных сокращений [2][61].
Клиническая значимость результатов
Полученные результаты позволяют определить адекватную тактику ведения пациента.
Ограничения исследования
Ограничения исследования связаны с недостаточным объемом выборки, необходимостью более длительного периода мониторинга функции щитовидной железы на фоне приема и после отмены амиодарона для повышения релевантности данных, диагностической эффективности полученных прогностических моделей.
Направления дальнейших исследований
В дальнейшем планируется доработка результатов на большей выборке и валидация.
Заключение
В проведенном исследовании впервые произведен обширный комплексный анализ факторов, являющихся триггерами развития АмИТ2. Получены новые данные о структуре причин и ключевых конфаундерах. Впервые установлено, что развитию АмИТ2 предрасполагает комбинация клинических предикторов, наиболее значимыми из которых являются возраст, индекс массы тела, а также время от начала терапии амиодароном, детерминирующее реализацию эффекта. Определены сроки развития и распространенность, показана большая частота и преобладание АмИТ2 над другими типами АмИТ.
Получены данные фундаментального характера, расширяющие представления о патогенезе и понимание тематики, обосновывающие возможность использования выявленного сочетания для персонифицированной предикции и оптимизации профилактических и лечебных мероприятий. Предложена новая научная концепция быстрого и доступного прогнозирования риска развития АмИТ2, имеющей огромное значение у пациентов с тяжелой сердечно-сосудистой патологией, позволяющая взвешенно, рационально подойти к выбору антиаритмической терапии и определению адекватного алгоритма мониторинга функции щитовидной железы в каждом конкретном случае.
Дополнительная информация
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Ермолаева А.С. — сбор и обработка материала, формирование электронной базы данных, статистическая обработка данных, анализ полученных результатов, написание основного текста статьи; Фадеев В.В. — научное руководство проводимого исследования, редактирование и финальное утверждение рукописи. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Затонская Е.В., Матюшин Г.В., Гоголашвили Н.Г., Новгородцева Н.Н. Эпидемиология аритмий (обзор данных литературы) // Сибирское медицинское обозрение. — 2016. — Т.3. — №3(99). — С. 5-16. doi: https://doi.org/10.20333/25000136-2016-3-5-16
2. Аракелян М.Г., Бокерия Л.А., Васильева Е.Ю., и др. Фибрилляция и трепетание предсердий. Клинические рекомендации 2020 // Российский кардиологический журнал. — 2021. — Т.26. — №7 — С. 190–260. doi: https://doi.org/10.15829/1560-4071-2021-4701
3. Hindricks G, Potpara T, Dagres N, et al. ESC Scientific Document Group. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J. 2021 Feb 1;42(5):373-498. doi: https://doi.org/10.1093/eurheartj/ehaa612
4. Лебедев Д.С., Михайлов Е.Н., Неминущий Н.М., и др. Желудочковые нарушения ритма. Желудочковые тахикардии и внезапная сердечная смерть. Клинические рекомендации 2020 // Российский кардиологический журнал. — 2021. — Т.26. — №7 — С. 128–189. doi: https://doi.org/10.15829/1560-4071-2021-4600
5. Zeppenfeld K, Tfelt-Hansen J, de Riva M, et al. ESC Scientific Document Group. 2022 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Eur Heart J. 202221;43(40):3997-4126. doi: https://doi.org/10.1093/eurheartj/ehac262
6. Голицын С.П. Амиодарон десятилетия спустя // Терапевтический архив. — 2011. — Т.83. — №8. — С. 25–33.
7. Field ME, Holmes DN, Page RL, et al. Get With The Guidelines-AFIB Clinical Working Group and Hospitals. Guideline-Concordant Antiarrhythmic Drug Use in the Get With The Guidelines-Atrial Fibrillation Registry. Circ Arrhythm Electrophysiol. 2021;14(2):e008961. doi: https://doi.org/10.1161/CIRCEP.120.008961
8. Hempenius M, Groenwold RHH, de Boer A, et al. Amiodarone use and the risk of acute pancreatitis: Influence of different exposure definitions. Pharmacoepidemiol. Drug Saf. 2019;28(12):1563-1571. doi: https://doi.org/10.1002/pds.4851
9. Sun LJ, Du X, Liu SW, He R, Zeng H, et al. [Current status of the clinical practice and analysis on the ratioanl prescription of antiarrhythmic drugs in Chinese patients with atrial fibrillation: Results from the Chinese Atrial Fibrillation Registry (CAFR) trial]. Zhonghua Xin Xue Guan Bing Za Zhi. 2020;48(9):740-747. Chinese. doi: https://doi.org/10.3760/cma.j.cn112148-20200103-00004
10. Chung SC, Lai A, Lip GYH, et al. Impact of anti-arrhythmic drugs and catheter ablation on the survival of patients with atrial fibrillation: a population study based on 199 433 new-onset atrial fibrillation patients in the UK. Europace. 2023;25(2):351-359. doi: https://doi.org/10.1093/europace/euac155
11. Трошина Е.А., Панфилова Е.А., Михина М.С., и др. Клинические рекомендации «Острые и хронические тиреоидиты (исключая аутоиммунный тиреоидит)» // Проблемы эндокринологии. — 2021. — Т.67. — №2 — С. 57-83. doi: https://doi.org/10.14341/probl12747
12. Trohman RG, Sharma PS, McAninch EA, Bianco AC. Amiodarone and thyroid physiology, pathophysiology, diagnosis and management. Trends Cardiovasc Med. 2019;29(5):285-295. doi: https://doi.org/10.1016/j.tcm.2018.09.005
13. Клиническая фармакология. / Под ред. Кукеса В.Г., Сычева Д.А. — М.: Изд-во ГЭОТАР-Медиа; 2022.
14. Mujović N, Dobrev D, Marinković M, et al. The role of amiodarone in contemporary management of complex cardiac arrhythmias. Pharmacol Res. 2020;151:104521. doi: https://doi.org/10.1016/j.phrs.2019.104521
15. Rodríguez-Fernández K, Gras-Colomer E, Climente-Martí M, et al. Pharmacometric characterization of entero-hepatic circulation processes of orally administered formulations of amiodarone under complex binding kinetics. Eur J Pharm Sci. 2022;174:106198. doi: https://doi.org/10.1016/j.ejps.2022.106198
16. Ylli D, Wartofsky L, Burman KD. Evaluation and Treatment of Amiodarone-Induced Thyroid Disorders. J Clin Endocrinol Metab. 2021;106(1):226-236. doi: https://doi.org/10.1210/clinem/dgaa686
17. Sabatino L, Vassalle C, Del Seppia C, Iervasi G. Deiodinases and the Three Types of Thyroid Hormone Deiodination Reactions. Endocrinol Metab (Seoul). 2021;36(5):952-964. doi: https://doi.org/10.3803/EnM.2021.1198
18. Sanoh S, Hanada H, Kashiwagi K, et al. Amiodarone bioconcentration and suppression of metamorphosis in Xenopus. Aquat Toxicol. 2020;228:105623. doi: https://doi.org/10.1016/j.aquatox.2020
19. Bețiu AM, Chamkha I, Gustafsson E, Meijer E, et al. Cell-Permeable Succinate Rescues Mitochondrial Respiration in Cellular Models of Amiodarone Toxicity. Int J Mol Sci. 2021;22(21):11786. doi: https://doi.org/10.3390/ijms222111786
20. Sugiyama K, Kobayashi S, Kurihara I, et al. Effect of long-term amiodarone treatment on thyroid function in euthyroid Japanese patients: a 12-month retrospective analysis. Endocr J. 2020;67(12):1247-1252. doi: https://doi.org/10.1507/endocrj.EJ20-0307
21. Bartalena L, Bogazzi F, Chiovato L, et al. 2018 European Thyroid Association (ETA) Guidelines for the Management of Amiodarone-Associated Thyroid Dysfunction. Eur Thyroid J. 2018;7(2): 55–66. doi: https://doi.org/10.1159/000486957
22. Гринева Е.Н., Цой У.А., Каронова Т.Л., Андрейченко Т.В., и др. Проект Федеральных клинических рекомендаций по диагностике и лечению амиодарон-индуцированной дисфункции щитовидной железы. Клиническая и экспериментальная тиреоидология. — 2020. — Т.16. — №2. — С. 12-24. doi: https://doi.org/10.14341/ket12693
23. Elshimy G, Alsayed M, Targovnik J, et al. The Use of 99mTc-Methoxy-isobutyl-isonitrile (sestaMIBI) Uptake on Scintigraphy (99m-STS) in Amiodarone-Induced Thyrotoxicosis: Case Series and Review of the Literature. Case Rep Endocrinol. 2020;2020:2493460. doi: https://doi.org/10.1155/2020/2493460
24. Wang R, Better N, Sivaratnam D, et al. 99m Tc-Sestamibi Thyroid Scintigraphy in Amiodarone-Induced Thyrotoxicosis: Functional Imaging-Histopathologic Correlation. Clin Nucl Med. 2022;47(9):e582-e584. doi: https://doi.org/10.1097/RLU.0000000000004332
25. Huang CJ, Chen PJ, Chang JW, et al. Amiodarone-induced thyroid dysfunction in Taiwan: a retrospective cohort study. Int J Clin Pharm. 2014;36(2):405-11. doi: https://doi.org/10.1007/s11096-013-9910-9
26. Uchida T, Kasai T, Takagi A, et al. Prevalence of amiodarone-induced thyrotoxicosis and associated risk factors in Japanese patients. Int J Endocrinol. 2014; 2014:534904. doi: https://doi.org/10.1155/2014/534904
27. Ahmed S, Van Gelder IC, Wiesfeld AC, et al. Determinants and outcome of amiodarone-associated thyroid dysfunction. Clin Endocrinol (Oxf). 2011;75(3):388–94. doi: https://doi.org/10.1111/j.1365-2265.2011.04087.x
28. Stan MN, Ammash NM, Warnes CA, et al. Body mass index and the development of amiodarone-induced thyrotoxicosis in adults with congenital heart disease – a cohort study. Int J Cardiol. 2013;167(3):821–6. doi: https://doi.org/10.1016/j.ijcard.2012.02.015
29. Zosin I, Balaş M. Amiodarone-induced thyroid dysfunction in an iodine-replete area: epidemiological and clinical data. Endokrynol Pol. 2012;63(1):2–9
30. Benjamens S, Dullaart RPF, Sluiter WJ, et al. The clinical value of regular thyroid function tests during amiodarone treatment. Eur J Endocrinol. 2017;177(1):9-14. doi: https://doi.org/10.1530/EJE-17-0018
31. Hofmann A, Nawara C, Ofluoglu S, et al. Incidence and predictability of amiodarone-induced thyrotoxicosis and hypothyroidism. Wien Klin Wochenschr. 2008;120(15-16):493-8. doi: https://doi.org/10.1007/s00508-008-1017-2
32. Tomisti L, Rossi G, Bartalena L, et al. The onset time of amiodarone-induced thyrotoxicosis (AIT) depends on AIT type. Eur J Endocrinol. 2014;171(3):363-8. doi: https://doi.org/10.1530/EJE-14-0267
33. Kinoshita S, Hayashi T, Wada K, et al. Risk factors for amiodarone-induced thyroid dysfunction in Japan. J Arrhythm. 2016;32(6):474-80. doi: https://doi.org/10.1016/j.joa.2016.03.008
34. Bogazzi F, Bartalena L, Dell’Unto E, Tomisti L, et al. Proportion of type 1 and type 2 amiodarone-induced thyrotoxicosis has changed over a 27-year period in Italy. Clin Endocrinol (Oxf). 2007;67(4):533-7. doi: https://doi.org/10.1111/j.1365-2265.2007.02920.x
35. Сердюк С.Е., Бакалов С.А., Голицын С.П., и др. Частота возникновения и предикторы развития амиодарон-ассоциированных дисфункций щитовидной железы, вызванных длительным приемом амиодарона // Терапевтический архив. — 2005. — Т.77. — №10. — С. 33–38.
36. Крюков Е.В., Потехин Н.П., Фурсов А.Н., и др. Алгоритм ведения пациентов, получающих амиодарон, в зависимости от функционального состояния щитовидной железы // Клиническая медицина. — 2017. — Т. 95. — №10 — С. 901–5. doi: https://doi.org/10.18821/0023-2149-2017-95-10-901-905
37. Дедов И.И., Мельниченко Г.А., Свириденко Н.Ю., и др. Диагностика, лечение и профилактика ятрогенных йодиндуцированных заболеваний щитовидной железы // Вестник РАМН. — 2006. — №2 — С. 15–21.
38. Чернавский С.В., Потехин Н.П., Фурсов А.Н., и др. Особенности структурно-функционального состояния щитовидной железы больных ишемической болезнью сердца и амиодарон-ассоциированным тиреоидитом // Фарматека. — 2020. — №14. — С. 68–72.
39. Gopalan M, Burks J, Talavera F, et al. Thyroid dysfunction induced by amiodarone. 2022. [Internet]. Available from: https://emedicine.medscape.com/article/129033-overview
40. Ali SA, Ersbøll M, Vinding NE, Butt JH, et al. Incidence of thyroid dysfunction following initiation of amiodarone treatment in patients with and without heart failure: a nationwide cohort study. Europace. 2023;25(2):291-299. doi: https://doi.org/10.1093/europace/euac217
41. Takeuchi D, Honda K, Shinohara T, et al. Incidence, Clinical Course, and Risk Factors of Amiodarone-Induced Thyroid Dysfunction in Japanese Adults With Congenital Heart Disease. Circ J. 2015;79(8):1828-34. doi: https://doi.org/10.1253/circj.CJ-15-0042
42. Tsadok MA, Jackevicius CA, Rahme E, et al. Amiodarone-induced thyroid dysfunction: brand-name versus generic formulations. CMAJ. 2011;183(12):E817–23. doi: https://doi.org/10.1503/cmaj.101800
43. Shinohara T, Takahashi N. How long should we check thyroid function after amiodarone withdrawal? Circ J. 2013;77(12):2875–6. doi: https://doi.org/10.1253/circj.CJ-13-1242
44. Iodine Global Network (IGN) [Internet]. Orleans, Ontario, Canada. Available from: https://ign.org/regions/eastern-europe-and-central-asia-countries-iodine-status/
45. Кекина Е.Г., Голубкина Н.А., Тульчинская О.В. Значение рыбы для обеспеченности йодом и селеном жителей Москвы и Московской области. // Вопросы питания. — 2014. — Т. 83. — №5. — С. 51-57. doi: https://doi.org/10.24411/0042-8833-2014-00049
46. Алфёрова В.И., Мустафина С.В., Рымар О.Д. Йодная обеспеченность в России и мире: что мы имеем на 2019 год? Клиническая и экспериментальная тиреоидология. — 2019.— Т. 15. — №2. — С. 73-82. doi: https://doi.org/10.14341/ket10353
47. Lu YT, Chao HJ, Chiang YC, Chen HY. Explainable Machine Learning Techniques To Predict Amiodarone-Induced Thyroid Dysfunction Risk: Multicenter, Retrospective Study With External Validation. J Med Internet Res. 20237;25:e43734. doi: https://doi.org/10.2196/43734
48. Kinoshita S, Hosomi K, Yokoyama S, Takada M. Time-to-onset analysis of amiodarone-associated thyroid dysfunction. J Clin Pharm Ther. 2020;45(1):65-71. doi: https://doi.org/10.1111/jcpt.13024
49. Moore BM, Cordina RL, McGuire MA, Celermajer DS. Adverse effects of amiodarone therapy in adults with congenital heart disease. Congenit Heart Dis. 2018;13(6):944-951. doi: https://doi.org/10.1111/chd.12657
50. Biakina O, Mitina Y, Gognieva D, et al. DUOX1 Gene Missense Mutation Confers Susceptibility on Type 2 Amiodarone-Induced Thyrotoxicosis. Int J Mol Sci. 2023;24(4):4016. doi: https://doi.org/10.3390/ijms24044016
51. Fischer AJ, Enders D, Eckardt L, et al. Thyroid Dysfunction under Amiodarone in Patients with and without Congenital Heart Disease: Results of a Nationwide Analysis. J Clin Med. 2022;11(7):2027. doi: https://doi.org/10.3390/jcm11072027
52. Medić F, Bakula M, Alfirević M, et al. AMIODARONE AND THYROID DYSFUNCTION. Acta Clin Croat. 2022;61(2):327-341. doi: https://doi.org/10.20471/acc.2022.61.02.20
53. Молашенко Н.В. Функциональные нарушения щитовидной железы на фоне приема кордарона. Методы их коррекции. Дис. на соискание ученой степени канд. мед. наук. — Москва; 2004. Доступно по: https://medical-diss.com/medicina/funktsionalnye-narusheniya-schitovidnoy-zhelezy-na-fone-priema-kordarona-metody-ih-korrektsii. Ссылка активна на 15.08.2023.
54. Есина М.В., Ямашкина Е.И., Ямбаева Ю.Р., и др. // Огарёв-Online. — 2019. — №2(123). Доступно по: https://cyberleninka.ru/article/n/kliniko-laboratornye-osobennosti-amiodaron-indutsirovannyh-tireopatiy-u-patsientov-s-narusheniyami-serdechnogo-ritma Ссылка активна на 15.08.2023.
55. Дора С.В. Функциональное и структурное состояние щитовидной железы у больных, получающих лечение кордароном. Дис. на соискание ученой степени канд. мед. наук. – Санкт-Петербург; 2006. Доступно по: https://www.dissercat.com/content/funktsionalnoe-i-strukturnoe-sostoyaniya-shchitovidnoi-zhelezy-u-bolnykh-poluchayushchikh-le. Ссылка активна на 15.08.2023.
56. Maqdasy S, Benichou T, Dallel S, et al. Issues in amiodarone-induced thyrotoxicosis: Update and review of the literature. Ann Endocrinol (Paris). 2019;80(1):54-60. doi: https://doi.org/10.1016/j.ando.2018.05.001
57. Yang G, Wang Y, Ma A, Wang T. Subclinical thyroid dysfunction is associated with adverse prognosis in heart failure patients with reduced ejection fraction. BMC Cardiovasc Disord. 2019;19(1):83. doi: https://doi.org/10.1186/s12872-019-1055-x
58. Yamamoto JM, Katz PM, Bras JAF, et al. Amiodarone-induced thyrotoxicosis in heart failure with a reduced ejection fraction: A retrospective cohort study. Health Sci Rep. 2018;1(5):e36. doi: https://doi.org/10.1002/hsr2.36
59. Lee KF, Lee KM, Fung TT. Amiodarone-induced thyroid dysfunction in the Hong Kong Chinese population. Hong Kong Med J. 2010;16(6):434-9
60. Yagishita A, Hachiya H, Kawabata M, et al. Amiodarone-induced thyrotoxicosis late after amiodarone withdrawal. Circ J. 2013;77(12):2898-903. doi: https://doi.org/10.1253/circj.cj-13-0220
61. Goundan PN, Lee SL. Thyroid effects of amiodarone: clinical update. Curr Opin Endocrinol Diabetes Obes. 2020;27(5):329-334. doi: https://doi.org/10.1097/MED.0000000000000562
Об авторах
А. С. ЕрмолаеваРоссия
Ермолаева Александра Сергеевна
119991, Москва, ул. Трубецкая, д. 8, стр. 2
В. В. Фадеев
Россия
Фадеев Валентин Викторович, д.м.н., проф., член-корр. РАН
Москва
Дополнительные файлы
|
|
1. Рисунок 1. Виды нарушений ритма сердца при назначении амиодарона. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(432KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Кривая Каплана-Мейера, характеризующая бессобытийную выживаемость при отмене амиодарона | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(169KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Кривая Каплана-Мейера, характеризующая общую выживаемость пациентов. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(219KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. ROC-кривая вероятности развития АмИТ2 в зависимости от возраста, индекса массы тела, времени от начала терапии амиодароном | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(127KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Ермолаева А.С., Фадеев В.В. Амиодарон-индуцированный тиреотоксикоз 2 типа: распространенность, сроки и предикторы развития. Проблемы Эндокринологии. 2024;70(3):9-22. https://doi.org/10.14341/probl13348
For citation:
Ermolaeva A.S., Fadeev V.V. Type 2 amiodarone-induced thyrotoxicosis: prevalence, time and predictors of development. Problems of Endocrinology. 2024;70(3):9-22. (In Russ.) https://doi.org/10.14341/probl13348

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).









































.jpg)


