Перейти к:
Российские критерии приемлемости назначения менопаузальной гормональной терапии пациенткам с сердечно-сосудистыми и метаболическими заболеваниями. Согласительный документ РКО, РОАГ, РАЭ, ЕАТ, РАФ
https://doi.org/10.14341/probl13394
Аннотация
Климактерические симптомы могут нарушать ход жизни женщин на пике карьеры и семейной жизни. В настоящее время самым эффективным методом лечения этих проявлений является менопаузальная гормональная терапия (МГТ). Наличие сердечно-сосудистых и метаболических заболеваний само по себе не исключает возможность назначения МГТ с целью купирования климактерических симптомов и улучшения качества жизни. Однако нередко препятствием для использования этого вида гормональной терапии являются опасения врачей, боящихся принести пациенткам больше вреда, чем пользы. Осторожность особенно важна, когда речь идет о женщинах, страдающих сопутствующими заболеваниями. Более того, следует признать, что качественных исследований относительно безопасности МГТ при основных хронических неинфекционных заболеваниях и часто встречаемых коморбидных состояниях недостаточно. В представленном согласительном документе проведен анализ всех доступных в настоящее время данных, полученных в ходе клинических исследований различного дизайна, и создан свод критериев приемлемости назначения МГТ женщинам с сопутствующими сердечно-сосудистыми и метаболическими заболеваниями. Опираясь на представленный документ, врачи различных специальностей, консультирующие женщин в климактерии, получат доступный алгоритм, позволяющий избегать потенциально опасных ситуаций и обоснованно назначать МГТ в реальной практике.
Ключевые слова
Для цитирования:
Шляхто Е.В., Сухих Г.Т., Серов В.Н., Дедов И.И., Арутюнов Г.П., Сучков И.А., Орлова Я.А., Андреева Е.Н., Юренева С.В., Явелов И.С., Ярмолинская М.И., Виллевальде С.В., Григорян О.Р., Дудинская Е.Н., Илюхин Е.А., Козиолова Н.А., Сергиенко И.В., Сметник А.А., Тапильская Н.И. Российские критерии приемлемости назначения менопаузальной гормональной терапии пациенткам с сердечно-сосудистыми и метаболическими заболеваниями. Согласительный документ РКО, РОАГ, РАЭ, ЕАТ, РАФ. Проблемы Эндокринологии. 2023;69(5):115-136. https://doi.org/10.14341/probl13394
For citation:
Shlyakhto E.V., Sukhikh G.T., Serov V.N., Dedov I.I., Arutyunov G.P., Suchkov I.A., Orlova Ya.A., Andreeva E.N., Yureneva S.V., Yavelov I.S., Yarmolinskaya M.I., Villevalde S.V., Grigoryan O.R., Dudinskaya E.N., Ilyukhin E.A., Koziolova N.A., Sergienko I.V., Smetnik A.A., Tapilskaya N.I. Russian eligibility criteria prescribing menopausal hormonal hormones therapy for patients with cardiovascular and metabolic diseases. Consensus document of the Russian Cardiological Society, Russian Society of Obstetricians and Gynecologists, Russian Association of Endocrinologists, Eurasian Association of Therapists, Association of Phlebologists of Russia. Problems of Endocrinology. 2023;69(5):115-136. (In Russ.) https://doi.org/10.14341/probl13394
Сопредседатели: Е.В. Шляхто, Г.Т. Сухих, В.Н. Серов, И.И. Дедов, Г.П. Арутюнов, И.А. Сучков
Ответственный секретарь рабочей группы: Я.А. Орлова
Рабочая группа: Е.Н. Андреева, С.В. Юренева, И.С. Явелов, М.И. Ярмолинская, С.В. Виллевальде, О.Р. Григорян, Е.Н. Дудинская, Е.А. Илюхин, Н.А. Козиолова, И.В. Сергиенко, А.А. Сметник, Н.И. Тапильская
Эксперты: Н.В. Артымук, А.Г. Арутюнов, В.Е. Балан, И.И. Баранов, С.А. Бобров, Р.И. Габидуллина, Н.Ю. Григорьева, И.В. Губарева, О.В. Дженина, Ю.Э. Доброхотова, С.О. Дубровина, Е.В. Енькова, Е.И. Ермакова, С.К. Зырянов, Н.Ю. Каткова, Л.Ю. Карахалис, Т.В. Кирсанова, Т.Ю. Кузнецова, Т.А. Макаренко, Л.И. Мальцева, С.В. Мальчикова, С.В. Недогода, С.Ю. Никулина, Т.А. Обоскалова, М.М. Петрова, А.Г. Плисюк, В.И. Подзолков, Н.М. Подзолкова, А.Э. Протасова, И.В. Савельева, Е.А. Сандакова, И.В. Сахаутдинова, М.С. Селихова, Т.М. Соколова, Л.С. Сотникова, Н.В. Спиридонова, Е.И. Тарловская, И.В. Фомин, М.Б. Хамошина, А.И. Чесникова, Г.А. Чумакова, И.И. Шапошник
СПИСОК СОКРАЩЕНИЙ
- АГ — артериальная гипертония
- АД — артериальное давление
- АСБ — атеросклеротическая бляшка
- ВВА — вульвовагинальная атрофия
- ВМС — внутриматочная система
- ВТЭО — венозные тромбоэмболические осложнения, включающие ТГВ и/или ТЭЛА
- Г — гестагены
- ГТ — гормональная терапия
- ГУМС — генитоуринарный менопаузальный синдром
- ДАД — диастолическое артериальное давление
- ДИД — дидрогестерон
- ДРСП — дроспиренон
- ЗПА — заболевания периферических артерий
- Е — эстрадиол
- ИБС — ишемическая болезнь сердца
- ИМ — инфаркт миокарда
- КЭЭ — конъюгированные эквин эстрогены
- КС — климактерический синдром
- ЛНГ — левоноргестрел
- Лп(а) — липопротеин а
- ЛС — лекарственное средство
- МГТ — менопаузальная гормональная терапия
- МП — микронизированный прогестерон
- MПA — медроксипрогестерона ацетат
- МС — метаболический синдром
- НП — неприменимо
- НПВП — нестероидные противовоспалительные препараты
- ОКС — острый коронарный синдром
- ОНМК — острое нарушение мозгового кровообращения
- ОР — относительный риск
- ПНЯ — преждевременная недостаточность яичников
- ПО — пероральное введение
- ПОАК — пероральные антикоагулянты прямого действия
- РКИ — рандомизированное контролируемое исследование
- РМЖ — рак молочной железы
- САД — систолическое артериальное давление
- СД — сахарный диабет
- СПЯ — синдром поликистозных яичников
- ССЗ — сердечно-сосудистые заболевания
- СЭ — системные эмболии
- ТГ — триглицериды
- ТГВ — тромбоз глубоких вен
- ТД — трансдермальное введение
- ТИА — транзиторная ишемическая атака
- ТПВ — тромбоз поверхностных вен (тромбофлебит), включает тромбоз варикозных и неварикозных поверхностных вен
- ТЭЛА — тромбоэмболия легочной артерии
- ФВ ЛЖ — фракция выброса левого желудочка
- ФП — фибрилляция предсердий
- ХБП — хроническая болезнь почек
- ХС-ЛПНП — холестерин липопротеинов низкой плотности
- ХСН — хроническая сердечная недостаточность
- Э — эстрогены
- НОМА-IR (Homeostasis Model Assessment of Insulin Resistance) — индекс инсулинорезистентости
- MAGE (mean amplitude of glycemic excursions) — средняя амплитуда гликемических экскурсий
ВВЕДЕНИЕ
Распоряжением Правительства РФ от 29.12.2022 г. № 4356-р утверждена Национальная стратегия действий в интересах женщин на 2023–2030 гг. Одной из важных задач государственной политики становится сохранение здоровья женщин всех возрастов, улучшение качества жизни и увеличение периода активного долголетия [1]. Для реализации этой стратегии в здравоохранении крайне важен междисциплинарный подход. Врачам-интернистам совместно с врачами акушерами-гинекологами необходимо выявлять женщин, вступивших в период менопаузального перехода, для своевременного оказания им необходимой помощи.
Климактерические симптомы могут нарушать ход жизни женщин на пике карьеры и семейной жизни: 75% женщин 45–55 лет предъявляют жалобы на приливы; в 28,5% случаев это приливы средней или тяжелой степени выраженности; продолжительность симптомов может составлять 3–15 лет [2]. В настоящее время самым эффективным методом лечения этих проявлений является МГТ [3][4].
Наличие сердечно-сосудистых и метаболических заболеваний само по себе не исключает возможность назначения МГТ с целью купирования климактерических симптомов и улучшения качества жизни. Однако нередко препятствием для использования этого вида гормональной терапии являются опасения врачей, боящихся принести пациенткам больше вреда, чем пользы.
Осторожность особенно важна, когда речь идет о женщинах, страдающих сопутствующими заболеваниями. Более того, следует признать, что качественных исследований относительно безопасности МГТ при основных хронических неинфекционных заболеваниях и часто встречаемых коморбидных состояниях недостаточно.
Таким образом, цель согласительного документа:
провести анализ всех доступных в настоящее время данных, полученных в ходе клинических исследований различного дизайна, и создать свод критериев приемлемости назначения МГТ женщинам с сопутствующими сердечно-сосудистыми и метаболическими заболеваниями.
Опираясь на представленный документ, врачи различных специальностей, консультирующие женщин в климактерии, получат доступный алгоритм, позволяющий избегать потенциально опасных ситуаций и обоснованно назначать МГТ в реальной практике.
РАЗДЕЛ 1. ОСНОВНЫЕ ОПРЕДЕЛЕНИЯ, СИМПТОМЫ И КЛАССИФИКАЦИЯ МЕНОПАУЗЫ
Менструальный цикл является одним из важнейших показателей здоровья женщины, и его регулярность может меняться в зависимости от стадии репродуктивного старения.
Рабочая Группа по изучению стадий старения репродуктивной системы женщин (Stages of Reproductive Aging Workshop — STRAW) [5] выделяет три стадии репродуктивного старения: репродуктивная стадия, менопаузальный переход и постменопауза. Классификация этапов старения репродуктивной системы женщин STRAW+10 представлена на рисунке 1.1.

Рисунок 1.1. Классификация этапов старения
репродуктивной системы женщин (STRAW+10).
При ПНЯ, СПЯ, после гистерэктомии, на фоне приема КОК,
ВМС-ЛНГ- критерии STRAW+10 неприменимы.
Менопаузальный переход характеризуется нарушением регулярности менструальных циклов, являющимся отражением вариабельности гормональной секреции и овуляторной функции.
Менопауза — стойкое прекращение менструаций, это последняя самостоятельная менструация, обусловленная возрастным снижением гормональной активности и «выключением» репродуктивной функции яичников. Дата наступления менопаузы оценивается ретроспективно: спустя 12 мес. отсутствия менструации [6][7].
Перименопауза включает период менопаузального перехода + 1 год после последней менструации.
Перименопауза начинается с нарушения регулярности менструального цикла («фаза менопаузального перехода») и длится до 1 года после полного прекращения менструаций. Эта фаза репродуктивного старения может наступать в широком возрастном диапазоне (от 42 до 58 лет) и длиться до 4–8 лет [8].
Постменопауза — период жизни после последней менструации.
Климактерический синдром — комплекс вегетативно-сосудистых, психических и обменно-эндокринных нарушений, возникающих у женщин на фоне угасания (или резкой потери) гормональной функции яичников и общего старения организма [9].
Средний возраст наступления менопаузы во всем мире составляет 48,8 года (95% ДИ 48,3–49,2) со значительными колебаниями этого показателя в зависимости от географического региона проживания женщин [10], в РФ он находится в диапазоне от 49 до 51 года [9]. Распространенность климактерических симптомов вариативна и зависит от ряда обстоятельств.
Вазомоторные симптомы чаще возникают в позднем периоде менопаузального перехода и особенно выражены в перименопаузе и первые годы постменопаузы [11][12]. Вазомоторными симптомами страдают до 80% женщин в перименопаузе [13]. Нарушения сна встречаются 39–47% у женщин в перименопаузе и в 35–60% в постменопаузе [14]. Среди лиц в возрасте 50 лет и старше в РФ остеопороз выявляется у 34% женщин, а частота остеопении составляет 43% [15].
Вазомоторные симптомы и другие проявления климактерического синдрома не только ухудшают качество жизни женщин и ограничивают их функциональные возможности, но и ассоциированы с повышением риска развития ИБС в 1,34 раза, риска любых ССЗ — в 1,48 раза [16].
У 15% женщин в перименопаузе и до 80% женщин в постменопаузе отмечаются симптомы генитоуринарного менопаузального синдрома (ГУМС) или вульвовагинальной атрофии (ВВА) [17]. У 41% женщин в возрасте 50–79 лет есть хотя бы один из симптомов ВВА. Распространенность нарушений мочеиспускания (внезапное и непреодолимое желание помочиться, которое невозможно отсрочить, недержание мочи) у женщин зависит от длительности постменопаузы и увеличивается с 15.5% при постменопаузе до 5 лет и до 41,4% при длительности постменопаузы более 20 лет [17].
Классификация менопаузы
По времени наступления выделяют:
- преждевременную менопаузу или преждевременную недостаточность яичников (до 40 лет),
- раннюю (40–44 лет),
- своевременную (45–55 лет) и
- позднюю (старше 55 лет).
По причине наступления выделяют естественную и ятрогенную (в том числе хирургическую менопаузу).
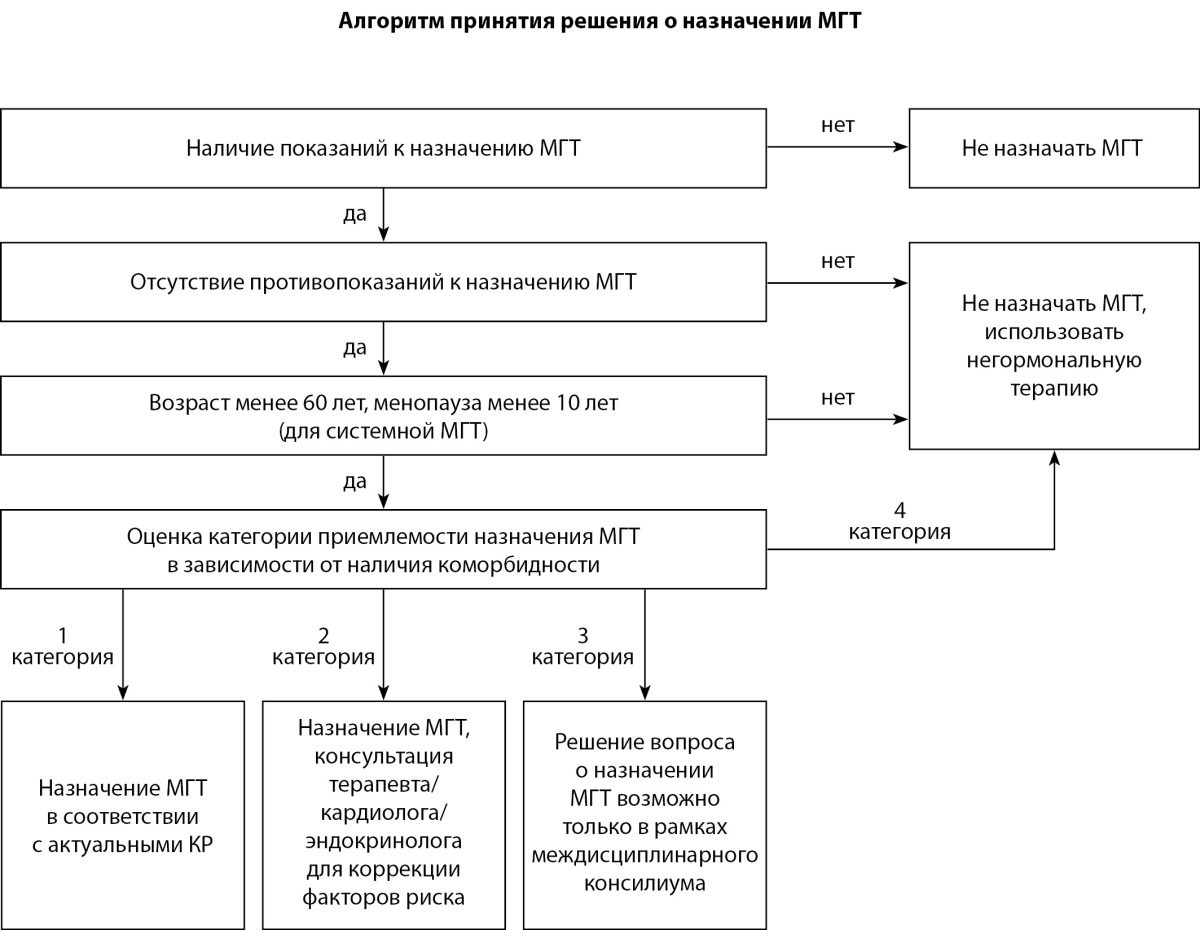
РАЗДЕЛ 2. ПОКАЗАНИЯ И ПРОТИВОПОКАЗАНИЯ К МГТ
Показания и противопоказания к назначению МГТ определяются актуальными Клиническими рекомендациями и инструкциями к конкретным препаратам.
Показания к назначению МГТ [4].
- Лечение вазомоторных симптомов умеренной и тяжелой степени, существенно снижающих качество жизни.
- Лечение симптомов ГУМС, сексуальной дисфункции.
- Профилактика постменопаузального остеопороза.
- Восполнение дефицита эстрогенов при преждевременной недостаточности яичников (ПНЯ) и ранней менопаузе; при двусторонней овариэктомии.
Противопоказания к назначению МГТ [4].
- Кровотечение из половых путей неясного генеза.
- Рак молочной железы (диагностированный, подозреваемый или в анамнезе).
- Диагностированные или подозреваемые эстрогензависимые злокачественные новообразования (эндометрия, яичников, матки).
- Острые и хронические заболевания печени в настоящее время или в анамнезе (до нормализации функциональных проб печени), в том числе злокачественные опухоли печени.
- Тромбозы (артериальные и венозные) и тромбоэмболии в настоящее время или в анамнезе (в том числе тромбоз глубоких вен; тромбоэмболия легочной артерии).
- Инфаркт миокарда.
- Ишемические или геморрагические цереброваскулярные нарушения.
- Наличие миомы матки с субмукозным расположением узла.
- Наличие полипа эндометрия.
- Аллергия к компонентам МГТ.
- Кожная порфирия (для эстрогенного компонента).
- Прогестагензависимые новообразования (например, менингиома) (для гестагенов).
РАЗДЕЛ 3. ВИДЫ МГТ И ОСНОВНЫЕ ПРИНЦИПЫ ЕЕ НАЗНАЧЕНИЯ
Системная МГТ
Системная МГТ является наиболее эффективным методом лечения вазомоторных симптомов и других климактерических проявлений, включая ГУМС. Большинство лекарственных препаратов МГТ одобрены для профилактики постменопаузального остеопороза, за исключением ультранизкодозированных форм.
В таблице 3.1 представлены зарегистрированные на территории РФ препараты для системной МГТ.
Таблица 3.1. Зарегистрированные в РФ лекарственные препараты
и их комбинации для системной МГТ
|
Комбинированная терапия эстроген/гестаген в циклическом режиме |
|
|
Фиксированные комбинации (эстроген/гестаген) |
|
|
Эстрадиол/Дидрогестерон (1 мг/10 мг; 2 мг/10 мг) |
|
|
Эстрадиола валерат (2 мг)/Левоноргестрел (150 мкг) |
|
|
Эстрадиола валерат (2 мг)/Норгестрел (500 мкг) |
|
|
Эстрадиола валерат (2 мг)/Ципротерона ацетат (1 мг) |
|
|
Свободные комбинации 2 препаратов (эстроген/гестаген) |
|
|
Эстрадиола валерат 2 мг |
Микронизированный прогестерон 200 мг |
|
Дидрогестерон 10 мг |
|
|
Эстрадиола гемигидрат гель трансдермальный 0,6 мг/г |
Микронизированный прогестерон 200–400 мг Дидрогестерон 10–20 мг |
|
Эстрадиола гемигидрат гель трансдермальный 0,1% — 0,5 г; 1,0 г; 1,5 г |
Дидрогестерон 10 мг |
|
Монофазная комбинированная терапия эстроген/гестаген в непрерывном режиме |
|
|
Фиксированные комбинации |
|
|
Эстрадиол/Дидрогестерон (0,5 мг/2,5 мг; 1 мг/5 мг) |
|
|
Эстрадиол/Дроспиренон (0,5 мг/0,25 мг, 1 мг/2 мг) |
|
|
Свободные комбинации 2 препаратов (эстроген/гестаген) |
|
|
Эстрадиола валерат 2 мг |
Внутриматочная система, содержащая 52 мг левоноргестрела микронизированного (ЛНГ-ВМС) |
|
Эстрадиола гемигидрат гель трансдермальный 0,6 мг/г |
Микронизированный прогестерон (100–200 мг) |
|
Внутриматочная система, содержащая 52 мг левоноргестрела микронизированного (ЛНГ-ВМС) |
|
|
Прогестерон гель вагинальный 8% 90 мг/доза |
|
|
Эстрадиола гемигидрат гель трансдермальный 0,1% — 0,5 г; 1,0 г; 1,5 г |
Микронизированный прогестерон (100–200 мг) |
|
Внутриматочная система, содержащая 52 мг левоноргестрела микронизированного (ЛНГ-ВМС) |
|
|
Прогестерон гель вагинальный 8% 90 мг/доза |
|
|
Прочие эстрогены |
|
|
Тиболон 2,5 мг |
|
|
Монотерапия эстрогенами |
|
|
Эстрадиола валерат 2 мг |
|
|
Эстрадиола гемигидрат гель трансдермальный 0,6 мг/г |
|
|
Эстрадиола гемигидрат гель трансдермальный 0,1% — 0,5 г; 1,0 г; 1,5 г |
|
Локальная МГТ
Локальная терапия эстрогенами (эстриолом) используется у женщин пери- и постменопаузального периода с жалобами только на симптомы ГУМС: сухость влагалища, диспареунию или дискомфорт при половой жизни, связанные с этим состоянием.
Длительные наблюдения (6–24 мес) показывают отсутствие влияния локальных эстрогенов на эндометрий, поэтому не требуется дополнительного использования прогестагенов. Локальные эстрогены не повышают риск ВТЭО, РМЖ, ССЗ, гиперплазии и рака эндометрия по данным наблюдательных исследований [18]. В таблице 3.2 представлены зарегистрированные на территории РФ препараты для локальной МГТ.
Таблица 3.2. Зарегистрированные в РФ лекарственные препараты
для локальной МГТ
|
Эстриол (крем вагинальный 1 мг/г, суппозитории вагинальные 0,5 мг) |
|
Эстриол микронизированный 0,2 мг / прогестерон микронизированный 2 мг/лактобактерии (капсулы вагинальные) |
|
Эстриол 50 мкг/г (гель вагинальный) |
|
Эстриол 0,03 мг/лактобактерии (таблетки вагинальные) |
Основные принципы назначения МГТ
- Начало системной МГТ необходимо рассматривать у женщин в возрасте менее 60 лет и с длительностью постменопаузы менее 10 лет. Оптимальное время для старта МГТ — период пери- и ранней постменопаузы. Отсутствуют возрастные ограничения при назначении локальной терапии эстрогенами (эстриолом) симптомов ГУМС.
- Терапевтическая цель должна заключаться в использовании наиболее подходящей минимальной эффективной дозы МГТ в соответствии с целями лечения.
- Индивидуализация МГТ проводится с учетом факторов риска рака молочной железы, сердечно-сосудистых заболеваний, остеопороза и переломов. Выбор дозы и лекарственной формы препарата, его состава, режима использования проводят с учетом возраста пациентки, стадии репродуктивного старения, гинекологических заболеваний (ПНЯ (первичная/вторичная), СПЯ, наличия интактной матки/гистерэктомии, эндометриоз), коморбидных состояний, ее предпочтений и потребностей.
- Наличие показаний к назначению МГТ и отсутствие противопоказаний.
- Применение МГТ требует периодической коррекции дозировок в зависимости от стадии репродуктивного старения, возраста, эффективности и переносимости лечения. По мере увеличения возраста пациентки и длительности постменопаузы целесообразно снижать дозу МГТ.
- Мониторинг лечения и регулярная (не реже 1 раз в год) переоценка польза/риск. Длительность терапии определяется целью терапии и балансом польза/риск.
- При выборе МГТ учитывается профиль безопасности составляющих компонентов. Персонифицировать дозировку МГТ с учетом факторов риска со стороны пациентки (ССЗ, риск РМЖ, остеопороза, коморбидные состояния и проч.) позволяет подбор минимальной эффективной дозировки и способа доставки лекарственных препаратов [14][15].
- Назначение, коррекция или отмена МГТ, а также динамический контроль за эффективностью и переносимостью лечения лежит в зоне ответственности врача акушера-гинеколога.
РАЗДЕЛ 4. МГТ У ПАЦИЕНТОК С ОЖИРЕНИЕМ И НАРУШЕНИЯМИ УГЛЕВОДНОГО ОБМЕНА
Инсулинорезистентность, дислипидемия, артериальная гипертензия и абдоминальное ожирение — основные маркеры менопаузального метаболического синдрома [19]. По сравнению с репродуктивным периодом, женщины в период перименопаузы и ранней постменопаузы подвержены более высокому риску прогрессирования инсулинорезистентности [20]. С возрастом риск развития метаболического синдрома (МС) увеличивается у женщин в 5 раз. Частота ССЗ повышается у женщин с нарушениями углеводного обмена в 5 раз [21].
Ожирение, особенно абдоминальное, тесно ассоциировано с МС, значительно повышает кардиометаболический риск и отражается на заболеваемости, прогнозе и продолжительности жизни больных [22].
Ожирение является независимым фактором риска развития ВТЭО. В рандомизированном исследовании «Инициатива во имя здоровья женщин» (WHI) у женщин с ожирением (ИМТ >30 кг/м²) было отмечено 3-кратное увеличение риска ВТЭО по сравнении с женщинами с нормальным ИМТ даже в группе плацебо [23].
При ожирении нежелательно назначать препараты, содержащие гестагены с остаточной андрогенной и глюкокортикоидной активностью, предпочтение отдается метаболически нейтральным прогестагенам [24]. После обнаружения связи минералокортикоидных рецепторов с дифференциацией жировой ткани установлена потенциальная роль прогестерона и прогестинов с антиминералокортикоидными свойствами в контроле массы тела и пролиферации жировой ткани [25]. По данным сравнительного исследования назначения комбинированной МГТ, содержащей дроспиренон или дидрогестерон, у пациенток с менопаузальным метаболическим синдромом было показано достоверное снижение веса через 6 мес терапии (c 74,2 до 72,4 кг в группе Э/ДДГ (p=0,03) и с 74,5 до 72,7 кг в группе Э/ДРСП (p=0,05)). Было отмечено улучшение показателей уровня глюкозы натощак (p<0,05) в обеих группах, улучшение показателей HOMA-IR (p=0,03) и MAGE было отмечено в группе Э/ДРСП (p<0,001) [26].
Частота СД 2 типа в популяции женщин составляет: в 40–44 года — 1,2%, в 45–49 лет — 2,4%, в 50–54 года — 4,2%,в 55–59 лет — 9,4% [27]. Своевременное начало МГТ может отложить риск развития СД 2 типа. По данным WHI, терапия КЭЭ + MПA статистически значимо снижала заболеваемость СД 2 типа — на 19% (ОР 0,81; 95% ДИ 0,70–0,94; P=0,005), что соответствует снижению на 16 случаев в пересчете на 10 000 женщин-лет. В когорте монотерапии КЭЭ число новых диагнозов СД 2 типа сократилось на 14% (ОР 0,86; 95% ДИ 0,76–0,98), что соответствует снижению на 21 случай в пересчете на 10 000 женщин-лет [28].
По данным метаанализа 107 исследований, МГТ снижает риск развития СД 2 типа на 30% (ОР=0,7; ДИ 95%=0,6–0,9), а при уже имеющемся СД на фоне МГТ происходит снижение уровня глюкозы натощак и HOMA-IR, а также наблюдается улучшение липидного профиля и снижение АД, наряду со снижением степени абдоминального ожирения. На фоне монотерапии эстрогенами или комбинированной МГТ у женщин с СД2 типа не было отмечено увеличение риска сердечно-сосудистой смертности [29].
При СД 2 типа предпочтителен пероральный вид МГТ, при отсутствии противопоказаний. При назначении комбинированной МГТ важно учитывать метаболические эффекты гестагена, входящего в состав комбинированной МГТ: следует остановить выбор на прогестагенах с нейтральным воздействием на метаболические процессы [30].
Благоприятный эффект МГТ на углеводный обмен прекращается при отмене терапии.
Таким образом, МГТ может быть рассмотрена в качестве терапией менопаузальных симптомов у пациенток с СД 2 типа.
Совместимость сахароснижающей терапии с МГТ, заместительной терапии левотироксином натрия (L-T4), тиреостатической и дофаминергической терапией с учетом путей введения отражена в табл. 4.1 [31].
Таблица 4.1. Совместимость МГТ и других фармакологических групп в эндокринологии
|
Группа препаратов |
Комбинированная МГТ |
Только эстроген-содержащая МГТ |
Тиболон |
Локальная МГТ |
||
|
ПО Э/Г |
ТД Э/Г |
ПО Э |
ТД Э |
|||
|
Пероральная сахароснижающая терапия |
1 |
1 |
1 |
1 |
1 |
1 |
|
Инсулинотерапия |
1 |
1 |
1 |
1 |
1 |
1 |
|
L-T4* |
1 |
1 |
1 |
1 |
1 |
1 |
|
Тиреостатики |
1 |
1 |
1 |
1 |
1 |
1 |
|
Агонисты дофамина** |
2 |
2 |
2 |
2 |
2 |
1 |
Примечание: цифра 1 — прием данной терапии на фоне МГТ безопасен,
противопоказаний не имеет.
Цифра 2 — прием данной терапии на фоне МГТ в целом безопасен,
может потребоваться титрация одного/двух компонентов.
*При инициации терапии L-T4 может потребоваться коррекция его дозировки
во избежание фибрилляции предсердий и остеопороза.
**Прием МГТ не влияет на размер микро/макропролактиномы.
Ключевые положения
- Своевременно начатая МГТ может отсрочить развитие СД 2 типа.
- Совместно с применением МГТ у женщин с ожирением рекомендуется проводить образовательные беседы с целью коррекции привычного образа жизни.
- У пациенток с СД 2 типа предпочтительна пероральная МГТ. При наличии противопоказаний к пероральному приему или повышенного риска тромбозов возможно использовать трансдермальные формы МГТ.
- У женщин с сохраненной маткой следует остановить выбор на прогестагенах с нейтральным воздействием на метаболические процессы.
- МГТ имеет положительный эффект на гликемический профиль как у женщин без СД, так и у женщин с СД 2 типа.
РАЗДЕЛ 5. МГТ У ПАЦИЕНТОК С ТРОМБОФИЛИЯМИ, ЗАБОЛЕВАНИЯМИ ВЕН, ВЕНОЗНЫМИ ЭМБОЛИЯМИ
5.1. Состав МГТ и риск венозных тромбоэмболических осложнений
Считается, что МГТ с использованием в ее составе пероральных эстрогенов повышает риск венозных тромбоэмболических осложнений (ВТЭО) — тромбоза глубоких вен (ТГВ) и тромбоэмболии легочных артерий (ТЭЛА) [32][33]. Однако этот эффект, отмеченный в рандомизированных контролируемых исследованиях и выполненных на их основе метаанализах, может быть во многом связан с назначением достаточно «тромбогенных» препаратов на основе КЭЭ и МПА, а также с несвоевременным началом МГТ.
Так, по данным анализа крупных баз данных QResearch и CPRD, выполненного с использованием метода «случай-контроль», назначение комбинированной МГТ КЭЭ в сочетании с МПА ассоциировалось с наиболее высоким риском ВТЭО. Для перорального эстрадиола было отмечено достоверное повышение риска ВТЭО, и этот эффект был дозозависимым. В то же время для комбинации перорального эстрадиола с дидрогестероном риск ВТЭО не увеличивался ни при циклическом, ни при монофазном комбинированном режимах МГТ вне зависимости от дозы эстрадиола. Назначение трансдермального эстрадиола не было связано с увеличением риска ВТЭО как при монотерапии, так и в составе комбинированной МГТ. Вне зависимости от ИМТ, назначение комбинации перорального эстрадиола с дидрогестероном, трансдермального эстрадиола как в монотерапии, так и в комбинации с гестагеном не было связано с увеличением риска ВТЭО. В когорте женщин, имевших в анамнезе эпизоды ВТЭО и/или получающих терапию антикоагулянтами, отмечены достоверное снижение риска ВТЭО при назначении трансдермального эстрадиола в монорежиме, а также отсутствие увеличения риска ВТЭО при комбинированном использовании трансдермального эстрадиола с гестагеном и перорального эстрадиола с дидрогестероном [34].
По данным наблюдательных исследований, на фоне применения трансдермального эстрадиола в низких (<50 мкг/сут) и более высоких дозах в монорежиме, а также его сочетания с гестагеном в циклическом или непрерывном режимах риск ВТЭО не увеличивался [34–37]. При этом, с одной стороны, есть свидетельства, что трансдермальный путь поступления эстрогенов ассоциируется с более низким риском ВТЭО, чем его пероральный прием, с другой — есть указание на отсутствие различий [34][35][38–40]. Надлежащие рандомизированные контролируемые или иные клинические исследования по сопоставлению этих подходов пока отсутствуют.
В крупном исследовании реальной клинической практики EURAS-HRT (более 30 000 женщин) был подтвержден долгосрочный профиль безопасности дроспиренон-содержащих препаратов для МГТ в отношении ВТЭО. Риск ВТЭО на фоне МГТ с дроспиреноном был сопоставим, а риск серьезных артериальных тромбоэмболических событий (главным образом острого инфаркта миокарда и ишемического инсульта) был достоверно ниже, чем при приеме другой МГТ (детального сопоставления по составу и особенностям другой МГТ не проводилось) [41].
В целом современная низкодозированная и ультранизкодозированная комбинированная пероральная МГТ с использованием эстрадиола представляется безопасной в отношении ВТЭО и по риску венозных тромбозов сопоставимой с трансдермальной МГТ [34][40]. Однако оценка пользы и риска назначения МГТ, выбор лекарственного препарата, его состава и пути введения должны проводиться индивидуально, с учетом особенностей клинической картины и наличия факторов риска ВТЭО.
По данным анализа крупных баз данных QResearch и CPRD, выполненного с использованием метода «случай-контроль», не было отмечено увеличения риска ВТЭО для тиболона [34].
Локальная терапия эстрадиолом симптомов ГУМС не приводит к увеличению риска венозных тромбозов и может использоваться у всех категорий пациенток [31].
ЛНГ-ВМС, содержащая 52 мг микронизированного левоноргестрела, также может быть использована как компонент МГТ. По данным исследований, применение ЛНГ-ВМС не приводило к повышению риска ВТЭО [41][42].
При принятии решения о возможности и составе МГТ следует учитывать, что риск ВТЭО нельзя рассматривать отдельно от других тромботических рисков. Так что даже в случаях, когда не исключено некоторое повышение риска ВТЭО, этот эффект может нивелироваться снижением частоты артериальных тромбозов и других сердечно-сосудистых осложнений, что в итоге обеспечит нейтральное или положительное воздействие на смертность [32][43][44].
5.2 МГТ в различных клинических ситуациях, связанных с тромбозами.
Венозные тромбозы
При остром ТГВ и/или ТЭЛА МГТ противопоказана.
Большинство экспертов рекомендуют отказаться от МГТ и у пациенток с ВТЭО в анамнезе [31][45][46]. Есть свидетельства отсутствия увеличения риска рецидива ВТЭО при трансдермальной МГТ на фоне лечения антикоагулянтами, однако данные о безопасности такого подхода после ВТЭО ограничены [37][39].
При тяжелых менопаузальных симптомах помимо локального применения эстрогенов не исключается возможность использования наименьшей эффективной дозы трансдермального эстрадиола (≤50 мкг/сут) или ультранизкодозированной (0,5 мг эстрадиола) пероральной комбинированной МГТ при соответствующей антикоагулянтной терапии [36][37][45][46]. Также не исключено, что современная МГТ достаточно безопасна после планового прекращения использования антикоагулянтов у отдельных категорий больных с низким риском рецидива венозных тромбозов [37].
Имеющиеся данные не позволяют однозначно судить о риске МГТ при остром тромбозе поверхностных вен (ТПВ) и ТПВ в анамнезе [47]. Решение о возможности применения современной пероральной и трансдермальной МГТ при ТПВ должно приниматься индивидуально, с учетом особенностей клинической ситуации, наличия факторов риска ВТЭО, а также наличия ТПВ в анамнезе как противопоказания к применению в инструкции к конкретному препарату.
В исследованиях по оценке риска ТГВ и/или ТЭЛА после перенесенного ТПВ не проводится разделение между тромбозом неварикозных и тромбозом варикозных поверхностных вен (варикотромбофлебитом). Варикотромбофлебит в первую очередь обусловлен наличием варикозного расширения вен, которое может быть устранено задолго до назначения МГТ.
Варикотромбофлебит в анамнезе следует считать ограничением для назначения МГТ при прямом указании на ТПВ в анамнезе как на противопоказание к применению в инструкции к конкретному препарату для МГТ.
Варикозное расширение вен
Наличие варикозного расширения вен не является противопоказанием к МГТ и не должно влиять на принятие решения о назначении МГТ. На сегодняшний день нет данных, что МГТ увеличивает риск развития тромбоза варикозно измененных вен (варикотромбофлебита). Проведение ультразвукового исследования вен нижних конечностей перед назначением МГТ не требуется.
Тромбофилии
Данных о безопасности МГТ при антифосфолипидном синдроме очень мало [39]. Из-за высокого риска венозных и/или артериальных тромбозов пероральная и трансдермальная МГТ у больных с антифосфолипидным синдромом не рекомендуется. Потенциально ее возможность не исключена у женщин с невысокой активностью заболевания или бессимптомными изменениями отдельных лабораторных показателей, не имеющих дополнительных факторов риска тромбозов [47].
Данные о безопасности МГТ при бессимптомных тромбофилиях ограничены. В некоторых исследованиях установлен повышенный риск развития ВТЭО при пероральной МГТ на фоне ряда тромбофилий (дефицит протеина С, дефицит протеина S, дефицит антитромбина, фактор V Лейден, мутация гена протромбина G20210A, высокий уровень фактора свертывания крови VIII) [48][49]. Однако этого недостаточно для однозначного запрета на проведение пероральной МГТ на фоне бессимптомной тромбофилии, требуются дополнительные исследования данного вопроса.
Решение о возможности и составе МГТ следует принимать индивидуально с учетом сведений о наличии ранее выявленной бессимптомной тромбофилии, тяжести менопаузальных симптомов, наличия дополнительных факторов риска ВТЭО, а также указания определенных тромбофилий в перечне противопоказаний в инструкции к конкретному препарату для МГТ [31][40][50]. Обследование на наличие тромбофилий перед началом МГТ не рекомендуется.
Семейный анамнез тромбозов (венозный или артериальный тромбоз у родственников 1 степени родства в возрасте до 50 лет) указывает на повышенный риск ВТЭО, однако не является основанием для запрета МГТ [17][37][51].
По имеющимся данным, трансдермальная МГТ не увеличивает риск ВТЭО у женщин с бессимптомной тромбофилией, однако свидетельства в пользу ее безопасности в этой клинической ситуации ограничены [37][39][49].
Ограничением для применения конкретного препарата является указание на семейный тромботический анамнез и/или наличие определенных тромбофилий как противопоказание к применению в инструкции.
5.3 МГТ при хирургических вмешательствах и госпитализации с острым нехирургическим заболеванием
В настоящее время нет доказательств пользы от отмены МГТ перед хирургическими вмешательствами или при госпитализации по поводу острого нехирургического заболевания (кроме тех, при которых МГТ противопоказана) [52]. При повышенном риске ВТЭО профилактика антикоагулянтами нивелирует потенциальный протромботический эффект гормональных препаратов. При стратификации риска ВТЭО у подобных больных продолжение МГТ рекомендуется рассматривать как дополнительный фактор риска ВТЭО.
РАЗДЕЛ 6. МГТ У ПАЦИЕНТОК С АТЕРОСКЛЕРОТИЧЕСКИМИ СЕРДЕЧНО-СОСУДИСТЫМИ ЗАБОЛЕВАНИЯМИ
В 1998 г. исследование HERS, первое рандомизированное плацебо-контролируемое исследование гормональной терапии (ГТ) эстрогенами и прогестином для вторичной профилактики ишемической болезни сердца (ИБС) среди женщин в постменопаузе с установленной ИБС, не выявило пользы в отношении развития сердечно-сосудистых осложнений и общей смертности при использовании ГТ. Результаты этого исследования являются аргументом против начала ГТ для вторичной профилактики ИБС [53].
Более поздний метаанализ 19 рандомизированных контролируемых исследований с участием 40 410 женщин в постменопаузе, получавших МГТ (большинство из которых принимали перорально), не выявил значительного увеличения смертности от всех причин, смертности от ССЗ или ИМ на фоне МГТ как в рамках первичной, так и в рамках вторичной профилактики сердечно-сосудистых осложнений.
Анализ подгрупп, основанный на сроках начала МГТ, показал:
- у женщин, начавших МГТ в течение 10 лет после менопаузы, были более низкая смертность (ОР=0,70; 95% ДИ=0,52–0,95) и меньшее количество сердечно-сосудистых событий (комбинация сердечно-сосудистой смерти и несмертельного ИМ) (ОР=0,52; 95% ДИ=0,29–0,96) [33];
- у женщин, начавших МГТ >10 лет от начала менопаузы, риск инсульта повышался без какого-либо влияния на смертность или другие исходы ССЗ [33].
В настоящее время старт МГТ не рекомендован женщинам с установленным диагнозом ИБС, включая стенокардию [40], а ИМ является противопоказанием к МГТ.
Манифестация ИБС на фоне приема МГТ, как правило, предполагает ее отмену. Хотя авторы уже упомянутого исследования HERS по его результатам заключают, что, учитывая благоприятную картину ишемических событий после нескольких лет МГТ, женщинам с ИБС, уже получающим это лечение, может быть целесообразно продолжить его [53]. Метаанализ, включивший 5766 пациенток с уже имеющимися ССЗ, показал, что абсолютный риск смерти, ИМ, стенокардии или реваскуляризации у этой категории больных на фоне МГТ был низок (табл. 6.1). Таким образом, у пациенток с развившейся в процессе терапии ИБС, настроенных на продолжение МГТ, вопрос о ее отмене должен быть решен индивидуально совместно кардиологом и гинекологом [33].
Таблица 6.1. Риск сердечно-сосудистых осложнений и смерти
при гормональной терапии
у пациенток в постменопаузе с сердечно-сосудистыми заболеваниями
(данные метаанализа рандомизированных контролируемых исследований)
|
Результаты |
Вторичная профилактика |
|
Смерть от всех причин |
ОР=1,04 (95% ДИ=0,87–1,24) |
|
Смерть от сердечно-сосудистых заболеваний |
ОР=1,00 (95% ДИ=0,78–1,29) |
|
Инфаркт миокарда |
ОР=0,98 (95% ДИ=0,81–1,18) |
|
Стенокардия |
ОР=0,91 (95% ДИ=0,74–1,12) |
|
Реваскуляризация |
ОР=0,98 (95% ДИ=0,63–1,53) |
|
Инсульт |
ОР=1,09 (95% ДИ=0,89–1,33) |
Пациенткам с инсультом в анамнезе рекомендуется избегать системной МГТ и требуется рассмотреть альтернативное (негормональное) лечение. В исследовании WHI повышенный риск ишемического инсульта был отмечен как в группе комбинированной МГТ (ОР=1,37; 95% ДИ=1,07–1,76), так и в группе монотерапии эстрогенами (ОР=1,35; 95% ДИ=1,07–1,70), независимо от исходного риска пациента [54][55]. В метаанализе 4 исследований, включивших 719 участниц без сердечно-сосудистых заболеваний, риск инсульта повышался (ОР =1,32; 95% ДИ =1,12–1,56) по сравнению с плацебо. В метаанализе исследований, выполненных в рамках вторичной профилактики ССЗ (5172 участницы в 5 исследованиях), была отмечена тенденция к увеличению риска инсульта (табл. 6.1) [33].
Неатеросклеротическая/нетромботическая ИБС чаще встречается у женщин, однако в настоящее время недостаточно данных для стратификации риска применения МГТ по подтипам заболевания. Для женщин 50–59 лет с ИМ в анамнезе без обструктивной болезни коронарных артерий, спонтанной диссекции коронарных артерий, коронарной микрососудистой дисфункции или коронарного вазоспазма требуется индивидуальный подход к назначению МГТ. Рекомендуется избегать системной МГТ при спонтанной диссекции коронарных артерий из-за предполагаемой патофизиологической связи с уровнем женских половых гормонов. Эта рекомендация исходит из того факта, что >90% пациентов со спонтанной диссекцией коронарных артерий — женщины.
При симптомах ГУМС женщинам с сердечно-сосудистыми заболеваниями может применяться локальная терапия эстриолом [4][18][56]. Необходимо обратить внимание, что в инструкциях эстрогенов для локального применения содержатся те же противопоказания, что и у эстрогенов для системной МГТ. Это предупреждение основано не на данных научных исследований, а связано с международными требованиями обязательного указания единых противопоказаний для препарата, независимо от путей его введения [45]. Эстриол при локальном применении имеет минимальную системную абсорбцию и не метаболизируется в более активные формы эстрогенов (эстрадиол и эстрон), а уровни циркулирующего эстриола, эстрадиола и эстрона сохраняются в пределах нормальных значений для постменопаузы [57][58]. Несколько крупных обсервационных исследований подтвердили отсутствие повышенного риска неблагоприятных последствий для здоровья, включая ССЗ, ВТЭО и рак при использовании локальной МГТ эстриолом [59][60].
Ключевые положения
- МГТ не рекомендована пациенткам с ИБС, а также с перенесенным острым нарушением мозгового кровообращения или транзиторной ишемической атакой. Для лечения вазомоторных симптомов у этих пациенток должна применяться негормональная терапия.
- У пациенток с развившейся в процессе МГТ ИБС, настроенных на ее продолжение, вопрос об отмене МГТ должен быть решен индивидуально в рамках консилиума, включающего кардиолога и гинеколога.
РАЗДЕЛ 7. МГТ У ПАЦИЕНТОК С ФАКТОРАМИ СЕРДЕЧНО-СОСУДИСТОГО РИСКА
7.1 Дислипидемии
Клинические исследования показали, что по сравнению с плацебо или отсутствием лечения МГТ может значительно повысить уровень ЛВП, а также снизить уровень ОХС, ХС-ЛНП и Лп(а) [61–63]. Следует отметить, что Лп(а) является независимым фактором риска ССЗ, и в частности повторного ишемического инсульта [64][65]. Статинотерапия оказывает слабое влияние на уровень этого проатерогенного липопротеида, тогда как МГТ достоверно его снижает [66]. Противоречивые данные имеются в отношении действия МГТ на уровень триглицеридов (ТГ). В части исследований имело место достоверное повышение уровня ТГ [67], а в других работах не было обнаружено существенной разницы в ТГ между двумя группами принимающих плацебо и МГТ [62][68–76].
В целом МГТ рассматривается как терапия, связанная с благоприятными изменениями параметров липидов как при кратковременном, так и при длительном применении у женщин в постменопаузе. Однако есть особенности, связанные с дозами препаратов и способом их доставки.
Показано, что пероральная МГТ увеличивает концентрацию ТГ по сравнению с трансдермальной МГТ [63]. Умеренное, но достоверное повышение уровня ТГ даже на фоне терапии фенофибратом и/или полиненасыщенными жирными кислотами может оказать клинически значимое воздействие как на прогрессирование атеросклероза, так и на развитие панкреатита. Таким образом, для женщин с гипертриглицеридемией более безопасным выбором являются трансдермальная или низкодозированная МГТ или тиболон.
В то же время пероральная МГТ связана с положительным влиянием на уровень ХС-ЛНП, а концентрация именно этого проатерогенного фактора в наибольшей степени влияет на развитие атеросклероза и дестабилизацию атеросклеротических бляшек (АСБ).
Вопрос о том, может ли МГТ в низких дозах оказывать такое же влияние на липидный профиль, как и стандартные дозы МГТ, все еще остается неясным. Одно исследование показало, что низкие дозы МГТ были связаны с более высокими уровнями ОХС и ХС-ЛНП, более низким уровнем ТГ, чем стандартные дозы [77]. Другие исследования показали аналогичное преимущество в отношении ТГ в группе низких доз эстрогенов в составе МГТ, но не выявили существенных различий в уровнях ОХС и ХС-ЛНП между двумя группами (высоких и низких доз).
Кроме того, было обнаружено, что низкие дозы эстрадиола в составе МГТ могут снижать уровень ХС-ЛВП. Эпидемиологически низкий уровень ХС-ЛПВП в плазме был связан с повышенным риском ишемических ССЗ [78]. В совокупности преимущество низких доз МГТ и трансдермального пути введения эстрадиола в отношении липидного профиля, возможно, ограничивается только уровнем ТГ.
Существуют противоречивые данные в отношении влияния тиболона на липидный профиль. Метаанализ, проведенный в 2021 г., показал, что тиболон снижает уровни ОХС, ХС-ЛВП и ТГ. Концентрации ЛНП значительно снижаются, если прием тиболона длится ≥26 нед [79]. В отношении влияния на Лп(а) различий между обычной МГТ и тиболоном не наблюдалось [80].
Имеются данные о повышенном риске ИБС у женщин, получавших комбинированную эстроген-гестагенную терапию, но не у женщин, получавших монотерапию эстрогенами [81]. К сожалению, ни в одном крупномасштабном РКИ липидный профиль не оценивался в зависимости от типа используемого прогестагена. Одно из обсервационных исследований показало, что добавление прогестагенов ослабляет благоприятный эффект эстрогена на липидный профиль [82], а метаанализ, проведенный в 2017 г., показал, что не было существенной разницы в снижении концентрации Лп(a) [80].
Хотя результаты ряда исследований продемонстрировали положительное влияние МГТ на липидный профиль, необходимо подчеркнуть, что МГТ не рекомендуется для терапии дислипидемии и снижения риска сердечно-сосудистых заболеваний [83].
Ключевые положения
- МГТ положительно влияет на липидный профиль у женщин в пери- и постменопаузе.
- МГТ не рекомендуется в качестве терапии дислипидемии, поскольку изменения липидного профиля на фоне МГТ минимальны и не сопоставимы с эффектами гиполипидемических препаратов.
- Пероральная МГТ является более эффективной в снижении уровня ХС-ЛНП, чем трансдермальная.
- Для женщин с гипертриглицеридемией более безопасным выбором являются трансдермальная или низкодозовая МГТ или тиболон.
7.2. Артериальная гипертензия
Специфичные для женщин факторы риска АГ и ССЗ в более позднем возрасте включают время наступления менархе, указания в анамнезе на нарушения менструального цикла и репродуктивной функции, миому матки, синдром поликистозных яичников, эндометриоз, неблагоприятные исходы беременности, преждевременную недостаточность яичников и менопаузу. Повышенный риск в течение репродуктивного периода жизни может способствовать более значительному увеличению риска ССЗ в пери- и постменопаузе [84–88].
При АГ, как и при других заболеваниях, выделяют половые и гендерные различия, которые оказывают влияние на эпидемиологию, патофизиологию и клиническое ведение.
В 2019 г. стандартизированная по возрасту распространенность АГ (САД ≥140 мм рт.ст., и/или ДАД ≥90 мм рт.ст., или прием антигипертензивной терапии) во всем мире составила у женщин 32% [89]. При этом в Восточной Европе распространенность АГ у женщин в возрасте 30–79 лет колебалась между 34 и 46% [89]. Распространенность АГ увеличивается с возрастом [90], но имеет более выраженную тенденцию к снижению до наступления менопаузы у женщин, чем у мужчин того же возраста, с заметным повышением у женщин после наступления менопаузы [14]. После 65 лет распространенность АГ у женщин выше, чем у мужчин [89–91].
Траектории АД в течение жизни у мужчин и женщин объясняются различиями механизмов регуляции АД, сочетанием половых и гендерных факторов [89][90]. У женщин до наступления менопаузы эстрогены способствуют снижению АД в контексте их общего вазопротекторного действия. Защита опосредована различными механизмами, в том числе эндотелиальной вазодилатацией за счет усиления пути выработки оксида азота и ингибирования активности симпатической нервной системы и ренин-ангиотензиновой системы. Более того, эстрогены уменьшают выработку эндотелина, окислительный стресс и воспаление [88]. Прекращение функции яичников в результате естественного старения или медицинских вмешательств связано с повышенным бременем кардиометаболических факторов риска, включая увеличение массы тела, уровней глюкозы и холестерина в плазме крови, АД, что приводит к повышению риска ССЗ [87][88][92][93]. После менопаузы заметное снижение уровня эстрогена частично объясняет, почему уровень АД и риск АГ увеличиваются [88][89]. Также в связи с резким снижением уровня прогестерона (природного антагониста альдостерона) происходит реактивация ренин-ангиотензин-альдостероновой системы (РААС) с такими последствиями, как задержка жидкости, повышение артериального давления (АД) [94].
Выделяют следующие специфичные для женщин патофизиологические характеристики АГ [95]:
- тесная связь ожирения с АГ;
- связь гинекологических нарушений (ановуляция, пролиферативные гинекологические заболевания) и неблагоприятного течения беременности (преэклампсия, гестационный сахарный диабет) с кардиометаболическим риском и АГ;
- кардиовазопротективный эффект (в том числе вазодилатирующий) физиологического для репродуктивного возраста уровня эстрогена;
- фармакологическое использование эстрогена при наличии сформировавшейся эндотелиальной дисфункции может способствовать увеличению АД и риска ССЗ, введение экзогенных эстрогенов в дозировках, применяемых для МГТ, не оказывает негативного влияния на АД;
- прогестерон способствует лептин-опосредованной эндотелиальной дисфункции у женщин с ожирением до наступления менопаузы;
- более выраженная чувствительность к натрию;
- более высокая частота воспалительных заболеваний, связанных с АГ и ССЗ.
В постменопаузе у женщин наблюдается более быстрое (по сравнению с мужчинами такого же возраста) увеличение артериальной жесткости. У женщин пожилого возраста отмечается более высокая ригидность аорты, чем у мужчин, что, по-видимому, способствует развитию изолированной систолической АГ, неконтролируемой АГ, сердечной недостаточности с сохраненной фракцией выброса левого желудочка, аортальному стенозу, что чаще встречается у женщин [96][97].
Установлено, что менопауза удваивает риск развития АГ даже после поправки на возраст и индекс массы тела [98]. Хотя МГТ содержит эстрогены, нет убедительных доказательств того, что АД будет значительно повышаться у женщин в менопаузе с АГ или без нее [99]. Однако после начала МГТ необходимо рекомендовать регулярное измерение АД для подтверждения сохраняющегося нормального АД или контроля уровня АД при антигипертензивной терапии [100][101]. В случае неконтролируемой АГ МГТ следует прекратить. Решение от отмене МГТ целесообразно принимать совместно с кардиологом.
Ключевые положения
- МГТ может быть назначена при условии контроля АД.
- МГТ не назначается для первичной или вторичной сердечно-сосудистой профилактики.
7.3. Курение
Курение значительно увеличивает опасность артериальных сердечно-сосудистых событий и является фактором риска злокачественных новообразований.
Курение не является фактором риска ВТЭО при МГТ (включая комбинированную пероральную МГТ). Несмотря на то что курение само по себе не является основанием для отказа от МГТ, в том числе комбинированными пероральными препаратами, необходимо соблюдать осторожность при назначении пероральной МГТ курильщицам, информировать их о рисках для здоровья, связанных с курением, и настаивать на прекращении курения [23][102][103].
Ключевые положения
- Необходимо информировать женщин о рисках для здоровья, связанных с курением, и настаивать на его прекращении.
- У курящих женщин решение о возможности применения МГТ следует принимать с учетом совокупности всех факторов риска.
РАЗДЕЛ 8. МГТ В ОСОБЫХ КЛИНИЧЕСКИХ СИТУАЦИЯХ
8.1. Атеросклероз периферических артерий
Среди женщин в возрасте 45–49 лет распространенность атеросклероза периферических артерий составляет 4,89%, в возрасте 50–55 лет — 5,73%, в возрасте 56–60 лет — 6,73%. Менопауза увеличивает риск развития каротидного атеросклероза в 2 раза [104]. Преждевременная и ранняя менопауза связана с увеличением объема и распространенности АСБ [105].
Применение монотерапии эстрогенами у женщин в постменопаузе в течение года снижает риск атеросклероза периферических артерий на 52%, как было показано в наблюдательном исследовании Rotterdam study [106]. У больных ишемической болезнью сердца в РКИ HERS и HERSII комбинированная пероральная МГТ не обеспечила статистически значимого снижения количества событий, связанных с атеросклерозом периферических артерий [53][107]. В одном из наблюдательных исследований было определено, что МГТ независимо от ее выбора снижает риск развития атеросклероза периферических артерий на 20% [108]. В описательном обзоре Davies R.S. и соавт. в качестве механизма положительного влияния МГТ на течение периферического атеросклероза обсуждается снижение уровня циркулирующих ЛПНП, повышение уровня ЛПВП и положительное воздействие на функцию эндотелия [109].
8.2. Хроническая сердечная недостаточность
В Российской Федерации, по данным популяционного исследования ЭПОХА-ХСН, распространенность ХСН у женщин в возрасте 50 лет составляет 12,2%, в возрасте 60 лет — 26,2%, преимущественно с сохраненной фракцией выброса левого желудочка (ФВ ЛЖ) [112]. Пятилетняя выживаемость больных с ХСН составляет не более 50% [113].
Ранняя менопауза увеличивает риск развития ХСН на 33%, как было выявлено в метаанализе 3 наблюдательных исследований [114].
В РКИ после 10 лет лечения было выявлено, что женщины, получающие пероральную терапию эстрогенами или комбинированную МГТ, назначенную в первые 7 мес в среднем после менопаузы, имели значительно ниже риск смерти, ХСН, инфаркта миокарда без какого-либо увеличения риска рака, ВТЭО или инсульта [115].
Пероральная терапия эстрогенами и комбинированная МГТ у пациенток 50 лет и старше с ХСН III–IV функционального класса и ФВ ЛЖ ≤35% неишемической этиологии обеспечила статистически значимое снижение риска общей смертности на 40%, как было продемонстрировано в субанализе РКИ BEST (Beta-Blocker Evaluation of Survival Trial) [116].
Субанализ РКИ WHI (Women’s Health Initiative) показал, что монотерапия пероральными эстрогенами и комбинированная МГТ не увеличивает риск госпитализаций, связанных с ХСН, независимо от ФВ ЛЖ и возраста женщины при назначении МГТ [117].
8.3. Фибрилляция предсердий
Известно, что женщины во всех возрастных группах имеют более низкую распространенность фибрилляции предсердий (ФП) по сравнению с мужчинами, но смертность от всех причин у женщин выше: ФП независимо связана с 2-кратным увеличением риска смерти у женщин по сравнению с 1,5-кратным увеличением риска смерти у мужчин [118]. В наблюдательном исследовании ATRIA ежегодная частота тромбоэмболических осложнений у пациентов с ФП, не принимающих варфарин, составила 3,5% для женщин по сравнению с 1,8% для мужчин [119]. Женщины с дополнительными факторами риска инсульта, особенно в старшем возрасте (>65 лет), подвергаются большему риску инсульта, даже если они принимают антикоагулянтную терапию, в то время как риск кровотечения при антикоагуляции был одинаков у обоих полов [120]. У женщины с ФП более выражена симптоматика и более тяжелые инсульты. В клинической практике женщины с ФП реже получают специализированную помощь, чаще применяется более консервативный подход [121][122].
Наличие менопаузы увеличивает риск ФП на 82% [123].
Данные наблюдательного исследования BiomarCaRE Consortium в Европе продемонстрировали, что у женщин в постменопаузе (средний возраст 49,2 года) распространенность ФП составила 4,4%, что было взаимосвязано с увеличением риска инсульта на 42%, инфаркта миокарда на 78%, а частота смертельных исходов возрастала более, чем в 3,5 раза [124].
По данным субанализа РКИ WHI и наблюдательных исследований комбинированная МГТ, монотерапия пероральными эстрогенами, применение тиболона увеличивают риск развития ФП [123][125–127].
Вклад трансдермальных и локальных форм эстрогенов в развитие ФП у женщин в период менопаузы не определен.
8.4. Патология клапанов сердца
Возможность назначения пероральной МГТ у женщин в пери- и постменопаузе с патологией клапанов определяется наличием осложнений:
- при фибрилляции предсердий и тромбах в камерах сердца — МГТ противопоказана;
- при ХСН неишемической этиологии и отсутствии осложнений — МГТ может быть назначена в рамках междисциплинарного консилиума [128].
ЗАКЛЮЧЕНИЕ
Показания и противопоказания к назначению МГТ определяются актуальными Клиническими рекомендациями и инструкциями к конкретным препаратам.
- Свод критериев приемлемости назначения менопаузальной гормональной терапии пациенткам с сердечно-сосудистыми и метаболическими заболеваниями приведен в Приложении 1. Для унификации рекомендаций были определены следующие категории в соответствии с международной номенклатурой ВОЗ [31]:
КАТЕГОРИЯ 1 — нет ограничений для использования МГТ;
КАТЕГОРИЯ 2 — польза от применения МГТ превышает риски;
КАТЕГОРИЯ 3 — возможные риски превышают пользу;
КАТЕГОРИЯ 4 — не рекомендуется применение МГТ. - При обращении женщины с жалобами на приливы, потливость, сердцебиения врачу-интернисту необходимо провести опрос с целью выявления взаимосвязи жалоб с возможными климактерическими нарушениями. Опрос должен включать сведения о дате последней самостоятельной менструации, нарушении регулярности менструального цикла и текущем приеме гормональной контрацепции или МГТ. В случае подозрения на связь жалоб с климактерическими расстройствами необходимо направить женщину на консультацию к акушеру-гинекологу.
- Назначение МГТ, коррекция дозы, смена ЛС, прекращение МГТ, ежегодный динамический контроль за эффективностью/переносимостью лечения, актуализацию целей терапии и оценку баланса польза/риск проводит врач акушер-гинеколог (Приложения 2 и 3).
- При выявлении/подозрении на наличие нежелательных явлений МГТ врачом негинекологического профиля пациентке должна быть рекомендована консультация акушера-гинеколога.
- При выявлении/подозрении на наличие факторов сердечно-сосудистого риска и сердечно-сосудистых и метаболических заболеваний врачами акушерами-гинекологами пациентке должна быть рекомендована консультация врача терапевтического профиля.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
ПРИЛОЖЕНИЕ 1.
Таблица. Критерии приемлемости назначения МГТ
|
Комбинированная МГТ |
Монотерапия эстрогенами |
Тиболон |
Локальная МГТ |
Примечания |
|||
|
Перорально |
Трансдермально |
Перорально |
Трансдермально |
||||
|
Нарушения углеводного обмена |
|||||||
|
СД |
1 |
1 |
2 |
1 |
НП |
1 |
|
|
Венозные тромбозы и/или ТЭЛА |
|||||||
|
Острый ТГВ/ТЭЛА |
4 |
4 |
4 |
4 |
4 |
1 |
Под острыми ТГВ/ТЭЛА понимается период, требующий использования полной лечебной дозы антикоагулянта (основная фаза антикоагулянтной терапии, первые 3–6 мес). |
|
ТГВ/ТЭЛА в анамнезе |
4 |
3 |
4 |
3 |
4 |
1 |
При тяжелых менопаузальных симптомах во время лечения антикоагулянтами у отдельных больных можно рассмотреть трансдермальную или ультранизкодозированную пероральную МГТ; в большинстве случаев МГТ не следует использовать после отмены антикоагулянтов. |
|
Тромбоз поверхностных вен (острый или в анамнезе) |
3 |
3 |
3 |
3 |
НП |
1 |
|
|
Нетромботические хронические заболевания вен |
|||||||
|
Нетромботические хронические заболевания вен (варикозное расширение вен, ретикулярные вены, телангиэктазы нижних конечностей) |
1 |
1 |
1 |
1 |
1 |
1 |
|
|
Тромбофилии |
|||||||
|
Бессимптомная тромбофилия с высоким риском ВТЭО (дефицит протеина S, дефицит протеина С, дефицит антитромбина, фактор V Лейден, мутация гена протромбинa G20210A, высокий уровень фактора свертывания крови VIII) |
3 |
2 |
3 |
2 |
НП |
1 |
Необходимо учитывать ранее выявленную тромбофилию, рутинное обследование на тромбофилию перед назначением МГТ не требуется. Решение о возможности и составе МГТ следует принимать индивидуально на основании сведений о наличии ранее выявленной бессимптомной тромбофилии, тяжести менопаузальных симптомов, дополнительных факторов риска ВТЭО, а также указания определенных тромбофилий в перечне противопоказаний в инструкции к конкретному препарату для МГТ. По имеющимся данным, трансдермальные препараты для МГТ не повышают риск венозных тромбозов у пациенток с бессимптомной тромбофилией. |
|
Антифосфолипидный синдром |
4 |
3 |
4 |
3 |
4 |
1 |
Возможность МГТ не исключена у женщин с низкой или умеренной активностью заболевания, не имеющих дополнительных факторов риска венозных тромбозов. |
|
Семейный анамнез тромбозов |
2 |
2 |
2 |
2 |
2 |
1 |
Наличие родственника 1 степени родства, перенесшего венозный или антериальный тромбоз в возрасте до 50 лет. |
|
Хирургические вмешательства и острые нехирургические заболевания с госпитализацией |
|||||||
|
Хирургическое вмешательство |
1 |
1 |
1 |
1 |
1 |
1 |
Перед проведением хирургического вмешательства необходима оценка риска развития ТГВ/ТЭЛА в послеоперационном периоде по шкале Каприни. Рекомендуется при оценке риска развития послеоперационных ТГВ/ТЭЛА учитывать проведение МГТ как 1 дополнительный балл по шкале Каприни. Отмена МГТ при хирургических вмешательствах не требуется. Профилактика венозных тромбозов антикоагулянтами должна проводиться в соответствии с определенной по шкале Каприни категорией риска развития ТГВ/ТЭЛА. |
|
Острые нехирургические заболевания, требующие госпитализации |
1 |
1 |
1 |
1 |
1 |
1 |
При госпитализации необходима оценка риска развития ТГВ/ТЭЛА по рекомендуемым шкалам (например, шкала Padua). Рекомендуется при оценке риска развития послеоперационных ТГВ/ТЭЛА учитывать проведение МГТ как 1 дополнительный балл. Отмена МГТ при острых нехирургических заболеваниях, требующих госпитализации, не входящих в состав противопоказаний к МГТ, не требуется. Профилактика венозных тромбозов антикоагулянтами должна проводиться в соответствии с определенной по шкале категорией риска развития ТГВ/ТЭЛА. |
|
Атеросклеротические сердечно-сосудистые заболевания |
|||||||
|
ИБС |
3 |
3 |
3 |
3 |
НП |
1 |
При наличии ИБС старт МГТ не рекомендован. У пациенток с развившейся в процессе терапии ИБС, настроенных на продолжение МГТ, вопрос о ее отмене должен быть решен индивидуально кардиологом и гинекологом совместно. |
|
Инфаркт миокарда (острый или в анамнезе) |
4 |
4 |
4 |
4 |
4 |
1 |
|
|
Нарушение мозгового кровообращения, включая транзиторную ишемическую атаку (острое или в анамнезе) |
4 |
4 |
4 |
4 |
4 |
1 |
|
|
Факторы риска ССЗ |
|||||||
|
Гиперлипидемия (кроме гипертриглицеридемии) |
1 |
1 |
1 |
1 |
1 |
1 |
|
|
Гипертриглицеридемия |
3 |
2 |
3 |
2 |
2 |
1 |
При уровне ТГ>4,5 ммоль/л не рекомендован старт МГТ, требуется коррекция уровня ТГ. |
|
Артериальная гипертония |
1 |
1 |
1 |
1 |
1 |
1 |
МГТ может быть назначена при условии контроля АД. |
|
Курение |
2 |
2 |
2 |
2 |
НП |
1 |
У курящих особое внимание необходимо уделять совокупности факторов риска и с их учетом решение принимать индивидуально. |
|
Другие заболевания/состояния |
|||||||
|
Атеросклероз периферических артерий |
2 |
2 |
2 |
НП |
НП |
НП |
|
|
Хроническая сердечная недостаточность (неишемического генеза) |
2 |
2 |
2 |
НП |
НП |
НП |
|
|
Фибрилляция предсердий |
4 |
4 |
4 |
4 |
4 |
НП |
|
Категория 1 — отсутствие ограничений на использование МГТ;
Категория 2 — преимущества перевешивают риски;
Категория 3 — риски, как правило, перевешивают преимущества;
Категория 4 — МГТ не должна использоваться.
НП — неприменимо из-за отсутствия данных.
ПРИЛОЖЕНИЕ 2.
ПРИЛОЖЕНИЕ 3.

Список литературы
1. Распоряжение Правительства Российской Федерации от 29 дек. 2022 г. № N 4356-р Об утверждении Национальной стратегии действий в интересах женщин на 2023–2030 годы. Доступно по: https://www.consultant.ru/document/cons_doc_LAW_436691/ Ссылка активна на 16.08.2022.
2. Улумбекова Г.Э., Худова И.Ю. Оценка демографического, социального и экономического эффекта при приеме менопаузальной гормональной терапии // ОРГЗДРАВ: новости, мнения .Вестник ВШОУЗ. — 2020. — Т. 6, — №4. — С. 23-53. doi: https://doi.org/10.24411/2411-8621-2020-14002
3. Lambrinoudaki I, Armeni E, Goulis D, et al. Menopause, wellbeing and health: A care pathway from the European Menopause and Andropause Society. Maturitas. 2022;(163):1-14. doi: https://doi.org/10.1016/j.maturitas.2022.04.008
4. Адамян Л.В., Ашрафян Л.А., Андреева Е.Н., и др. Менопауза и климактерическое состояние у женщины. Клинические рекомендации. — М.: 2021. 86 c. Доступно по: https://cr.minzdrav.gov.ru/recomend/117_2. Ссылка активна на 20.10.2023
5. Harlow SD, Gass M, Hall JE, et al. Executive summary of the Stages of Reproductive Aging Workshop + 10. Menopause. 2012;19(4):387-395. doi: https://doi.org/10.1097/gme.0b013e31824d8f40
6. Drewe J, Bucher KA, Zahner C. A systematic review of non-hormonal treatments of vasomotor symptoms in climacteric and cancer patients. Springerplus. 2015;4(1):65. doi: https://doi.org/10.1186/s40064-015-0808-y
7. Schnatz PF, Romegialli A, Abrantes J, et al. The North American Menopause Society: from abstract to publication. Menopause. 2008;15(5):996-1001. doi: https://doi.org/10.1097/gme.0b013e318166f026
8. Paramsothy P, Harlow SD, Nan B, et al. Duration of the menopausal transition is longer in women with young age at onset: the multiethnic Study of Women’s Health Across the Nation. Menopause. 2017;24(2):142-149. doi: https://doi.org/10.1097/GME.0000000000000736
9. Сухих Г.Т., Сметник В.П., Андреева Е.Н., и др. Менопаузальная гормонотерапия и сохранение здоровья женщин в зрелом возрасте. Клинические рекомендации. М.: 2015. С. 8-9. Доступно по: https://www.consultant.ru/document/cons_doc_LAW_320073/. Ссылка активна на 20.10.2023
10. Schoenaker DA, Jackson CA, Rowlands JV, Mishra GD. Socioeconomic position, lifestyle factors and age at natural menopause: a systematic review and meta-analyses of studies across six continents. Int J Epidemiol. 2014;43(5):1542-1562. doi: https://doi.org/10.1093/ije/dyu094
11. Freeman EW, Sammel MD, Sanders RJ. Risk of long-term hot flashes after natural menopause: evidence from the Penn Ovarian Aging Study cohort. Menopause. 2014;21(9):924-932. doi: https://doi.org/10.1097/GME.0000000000000196
12. Costanian C, Zangiabadi S, Bahous SA, et al. Reviewing the evidence on vasomotor symptoms: the role of traditional and non-traditional factors. Climacteric. 2020;23(3):213-223. doi: https://doi.org/10.1080/13697137.2019.1711051
13. Prior JC. Progesterone for symptomatic perimenopause treatment—Progesterone politics, physiology and potential for perimenopause. Facts Views Vis Obstet Gynecol. 2011;(3):109-120.
14. Santoro N, Epperson CN, Mathews SB. Menopausal symptoms and their management. Endocrinol Metab Clin North Am. 2015;44(3):497-515. doi: https://doi.org/10.1016/j.ecl.2015.05.001
15. Мельниченко Г.А., Белая Ж.Е., Рожинская Л.Я., и др. Федеральные клинические рекомендации по диагностике, лечению и профилактике остеопороза // Проблемы Эндокринологии. — 2017. — Т. 63. — №6. — С. 392-426. doi: https://doi.org/10.14341/probl2017636392-426
16. Muka T, Oliver-Williams C, Colpani V, et al. Association of vasomotor and other menopausal symptoms with risk of cardiovascular disease: A systematic review and meta-analysis. PLoS One. 2016;11(6):e0157417. doi: https://doi.org/10.1371/journal.pone.0157417
17. Baber RJ, Panay N, Fenton A. 2016 IMS Recommendations on women’s midlife health and menopause hormone therapy. Climacteric. 2016;19(2):109-150. doi: https://doi.org/10.3109/13697137.2015.1129166
18. Hirschberg AL, Bitzer J, Cano A, et al. Topical estrogens and non-hormonal preparations for postmenopausal vulvovaginal atrophy: An EMAS clinical guide. Maturitas. 2021;(148):55-61. doi: https://doi.org/10.1016/j.maturitas.2021.04.005
19. Grundy SM. Metabolic syndrome: a multiplex cardiovascular risk factor. J Clin Endocrinol Metab. 2007;92(2):399-404. doi: https://doi.org/10.1210/jc.2006-0513
20. Hu G. Gender difference in all-cause and cardiovascular mortality related to hyperglycaemia and newly-diagnosed diabetes. Diabetologia. 2003;46(5):608-617. doi: https://doi.org/10.1007/s00125-003-1096-6
21. Vishram JK, Borglykke A, Andreasen AH, et al. Impact of age and gender on the prevalence and prognostic importance of the metabolic syndrome and its components in Europeans. The MORGAM Prospective Cohort Project [published correction appears in PLoS One. 2015;10(5):e0128848]. PLoS One. 2014;9(9):e107294. doi: https://doi.org/10.1371/journal.pone.0107294
22. Драпкина О.М., Концевая А.В., Калинина А.М., и др. Профилактика хронических неинфекционных заболеваний в Российской Федерации. Национальное руководство 2022 // Кардиоваскулярная терапия и профилактика. 2022;21(4):3235. doi: https://doi.org/10.15829/1728-8800-2022-3235
23. Cushman M. Estrogen plus progestin and risk of venous thrombosis. JAMA. 2004;292(13):1573. doi: https://doi.org/10.1001/jama.292.13.1573
24. Григорян О.Р., Андреева Е.Н. Ожирение и менопауза В кн: под ред. Г.А. Мельниченко, Н.К. Никифоровского. Ожирение у женщин — М.: Медицинское информационное агентство; 2017. С.233-268.
25. Caprio M, Antelmi A, Chetrite G, et al. Antiadipogenic effects of the mineralocorticoid receptor antagonist drospirenone: potential implications for the treatment of metabolic syndrome. Endocrinology. 2011;152(1):113-125. doi: https://doi.org/10.1210/en.2010-0674
26. Rizzo MR, Leo S, De Franciscis P, et al. Short-term effects of low-dose estrogen/drospirenone vs low-dose estrogen/dydrogesterone on glycemic fluctuations in postmenopausal women with metabolic syndrome. Age (Dordr). 2014;36(1):265-274. doi: https://doi.org/10.1007/s11357-013-9554-7
27. Дедов И.И., Шестакова М.В., Викулова О.К., и др. Эпидемиологические характеристики сахарного диабета в Российской Федерации: клинико-статистический анализ по данным регистра сахарного диабета на 01.01.2021 // Сахарный диабет. — 2021. — Т. 24. — №3. — С. 204-221. doi: https://doi.org/10.14341/DM12759
28. Manson JE, Chlebowski RT, Stefanick ML, et al. Menopausal hormone therapy and health outcomes during the intervention and extended poststopping phases of the Women’s Health Initiative randomized trials. JAMA. 2013;310(13):1353-1368. doi: https://doi.org/10.1001/jama.2013.278040
29. Salpeter SR, Walsh JM, Ormiston TM, et al. Meta-analysis: effect of hormone-replacement therapy on components of the metabolic syndrome in postmenopausal women. Diabetes Obes Metab. 2006;8(5):538-554. doi: https://doi.org/10.1111/j.1463-1326.2005.00545.x
30. Григорян О.Р. Менопаузальный синдром у женщин с cахарным диабетом // Сахарный диабет. — 2013. — Т. 16. — №3. — С. 103-108. doi: https://doi.org/10.14341/2072-0351-824
31. Mendoza N, Ramírez I, de la Viuda E, et al. Eligibility criteria for Menopausal Hormone Therapy (MHT): a position statement from a consortium of scientific societies for the use of MHT in women with medical conditions. MHT Eligibility Criteria Group. Maturitas. 2022;166(13):65-85. doi: https://doi.org/10.1016/j.maturitas.2022.08.008
32. Kim J-E, Chang J-H, Jeong M-J, et al. A systematic review and meta-analysis of effects of menopausal hormone therapy on cardiovascular diseases. Sci Rep. 2020;10(1):20631. doi: https://doi.org/10.1038/s41598-020-77534-9
33. Boardman HMP, Hartley L, Eisinga A, et al. Hormone therapy for preventing cardiovascular disease in post-menopausal women. Cochrane Database Syst Rev. 2015;2015(8). doi: https://doi.org/10.1002/14651858.CD002229.pub4
34. Vinogradova Y, Coupland C, Hippisley-Cox J. Use of hormone replacement therapy and risk of venous thromboembolism: nested case-control studies using the QResearch and CPRD databases. BMJ. 2019;2015(8):k4810. doi: https://doi.org/10.1136/bmj.k4810
35. Goldštajn MŠ, Mikuš M, Ferrari FA, et al. Effects of transdermal versus oral hormone replacement therapy in postmenopause: a systematic review. Arch Gynecol Obstet. 2022;307(6):1727-1745. doi: https://doi.org/10.1007/s00404-022-06647-5
36. Kapoor E, Kling JM, Lobo AS, Faubion SS. Menopausal hormone therapy in women with medical conditions. Best Pract Res Clin Endocrinol Metab. 2021;35(6):101578. doi: https://doi.org/10.1016/j.beem.2021.101578
37. Morris G, Talaulikar V. Hormone replacement therapy in women with history of thrombosis or a thrombophilia. Post Reprod Heal. 2023;29(1):33-41. doi: https://doi.org/10.1177/20533691221148036
38. Blondon M, Timmons AK, Baraff AJ, et al. Comparative venous thromboembolic safety of oral and transdermal postmenopausal hormone therapies among women Veterans. Menopause. 2021;28(10):1125-1129. doi: https://doi.org/10.1097/GME.0000000000001823
39. Sobel TH, Shen W. Transdermal estrogen therapy in menopausal women at increased risk for thrombotic events: a scoping review. Menopause. 2022;29(4):483-490. doi: https://doi.org/10.1097/GME.0000000000001938
40. Blondon M, Timmons AK, Baraff AJ, et al. The 2022 hormone therapy position statement of The North American Menopause Society. Menopause. 2022;29(7):767-794. doi: https://doi.org/10.1097/GME.0000000000002028
41. Dinger J, Bardenheuer K, Heinemann K. Drospirenone plus estradiol and the risk of serious cardiovascular events in postmenopausal women. Climacteric. 2016;19(4):349-356. doi: https://doi.org/10.1080/13697137.2016.1183624
42. Tepper NK, Whiteman MK, Marchbanks PA, et al. Progestin-only contraception and thromboembolism: A systematic review. Contraception. 2016;94(6):678-700. doi: https://doi.org/10.1016/j.contraception.2016.04.014
43. Mantha S, Karp R, Raghavan V, et al. Assessing the risk of venous thromboembolic events in women taking progestin-only contraception: a meta-analysis. BMJ. 2012;345(2):e4944-e4944. doi: https://doi.org/10.1136/bmj.e4944
44. Nudy M, Chinchilli VM, Foy AJ. A systematic review and meta-regression analysis to examine the ‘timing hypothesis’ of hormone replacement therapy on mortality, coronary heart disease, and stroke. IJC Hear Vasc. 2019;(22):123-131. doi: https://doi.org/10.1016/j.ijcha.2019.01.001
45. Cho L, Kaunitz AM, Faubion SS, et al. Rethinking menopausal hormone therapy: For whom, what, when, and how long? Circulation. 2023;147(7):597-610. doi: https://doi.org/10.1161/CIRCULATIONAHA.122.061559
46. LaVasseur C, Neukam S, Kartika T, et al. Hormonal therapies and venous thrombosis: Considerations for prevention and management. Res Pract Thromb Haemost. 2022;6(6):e12763. doi: https://doi.org/10.1002/rth2.12763
47. Roach RE, Lijfering WM, van Hylckama Vlieg A, et al. The risk of venous thrombosis in individuals with a history of superficial vein thrombosis and acquired venous thrombotic risk factors. Blood. 2013;122(26):4264-4269. doi: https://doi.org/10.1182/blood-2013-07-518159
48. Douketis JD, Julian JA, Crowther MA, et al. The effect of prothrombotic blood abnormalities on risk of deep vein thrombosis in users of hormone replacement therapy: a prospective case-control study. Clin Appl Thromb Hemost. 2011;17(6):E106-113. doi: https://doi.org/10.1177/1076029610387587
49. Straczek C, Oger E, Yon de Jonage-Canonico MB, et al. Estrogen and Thromboembolism Risk (ESTHER) Study Group. Prothrombotic mutations, hormone therapy, and venous thromboembolism among postmenopausal women: impact of the route of estrogen administration. Circulation. 2005;112(22):3495-3500. doi: https://doi.org/10.1161/CIRCULATIONAHA.105.565556
50. Gialeraki A, Valsami S, Pittaras T, Panayiotakopoulos G, Politou M. Oral Contraceptives and HRT Risk of Thrombosis. Clin Appl Thromb. 2018;24(2):217-225. doi: https://doi.org/10.1177/1076029616683802
51. Bezemer ID, van der Meer FJ, Eikenboom JC, et al. The value of family history as a risk indicator for venous thrombosis. Arch Intern Med. 2009;169(6):610-615. doi: https://doi.org/10.1001/archinternmed.2008.589
52. Brighouse D. Hormone replacement therapy (HRT) and anaesthesia. Br J Anaesth. 2001;86(5):709-716. doi: https://doi.org/10.1093/bja/86.5.709
53. Hulley S. Randomized trial of estrogen plus progestin for secondary prevention of coronary heart disease in postmenopausal women. JAMA. 1998;280(7):605. doi: https://doi.org/10.1001/jama.280.7.605
54. Wassertheil-Smoller S, Hendrix S, Limacher M, et al. Effect of Estrogen Plus Progestin on Stroke in Postmenopausal Women. JAMA. 2003;289(20):2673. doi: https://doi.org/10.1001/jama.289.20.2673
55. Hendrix SL, Wassertheil-Smoller S, Johnson KC, et al. Effects of Conjugated Equine Estrogen on Stroke in the Women’s Health Initiative. Circulation. 2006;113(20):2425-2434. doi: https://doi.org/10.1161/CIRCULATIONAHA.105.594077
56. Hendrix SL, Wassertheil-Smoller S, Johnson KC, et al. The 2020 genitourinary syndrome of menopause position statement of The North American Menopause Society. Menopause. 2020;27(9):976-992. doi: https://doi.org/10.1097/GME.0000000000001609
57. Nevine ID, te West NID, Day RO, et al. Estriol serum levels in new and chronic users of vaginal estriol cream: A prospective observational study. Neurourol Urodyn. 2020;39(4):1137-1144. doi: https://doi.org/10.1002/nau.24331
58. Santen RJ, Mirkin S, Bernick B, Constantine GD. Systemic estradiol levels with low-dose vaginal estrogens. Menopause. 2020;27(3):361-370. doi: https://doi.org/10.1097/GME.0000000000001463
59. Bhupathiraju SN, Grodstein F, Stampfer MJ, et al. Vaginal estrogen use and chronic disease risk in the Nurses’ Health Study. Menopause. 2019;26(6):603-610. doi: https://doi.org/10.1097/GME.0000000000001284
60. Crandall CJ, Hovey KM, Andrews CA, et al. Breast cancer, endometrial cancer, and cardiovascular events in participants who used vaginal estrogen in the Women’s Health Initiative Observational Study. Menopause. 2018;25(1):11-20. doi: https://doi.org/10.1097/GME.0000000000000956
61. Орлова Я.А., Плисюк А.Г., Долгушин Г.О., и др. Связь длительной менопаузальной гормональной терапии и показателей сосудистого и репликативного старения у женщин // Профилактическая медицина. — 2023. — Т. 26. — №7. — С. 96-102. doi: https://doi.org/10.17116/profmed20232607196
62. Draper MW, Flowers DE, Huster WJ, et al. A controlled trial of raloxifene (LY139481) HCl: impact on bone turnover and serum lipid profile in healthy postmenopausal women. J Bone Miner Res. 1996;11(6):835-842. doi: https://doi.org/10.1002/jbmr.5650110615
63. Nie G, Yang X, Wang Y, et al. The effects of menopause hormone therapy on lipid profile in postmenopausal women: A systematic review and meta-analysis. Front Pharmacol. 2022;13(1):11-20. doi: https://doi.org/10.3389/fphar.2022.850815
64. Ежов М.В., Кухарчук В.В., Сергиенко И.В., и др. Нарушения липидного обмена. Клинические рекомендации 2023 // Российский кардиологический журнал. — 2023. — Т. 28. — №5. — С. 5471. doi: https://doi.org/10.15829/1560-4071-2023-5471
65. Nordestgaard BG, Chapman MJ, Ray K, et al. Lipoprotein(a) as a cardiovascular risk factor: current status. Eur Heart J. 2010;31(23):2844-2853. doi: https://doi.org/10.1093/eurheartj/ehq386
66. van Dam-Nolen DHK, van Dijk AC, Crombag GAJC, et al. Lipoprotein(a) levels and atherosclerotic plaque characteristics in the carotid artery: The Plaque at RISK (PARISK) study. Atherosclerosis. 2021;(329):22-29. doi: https://doi.org/10.1016/j.atherosclerosis.2021.06.004
67. Stevenson JC, Chines A, Pan K, et al. A Pooled Analysis of the Effects of Conjugated Estrogens/Bazedoxifene on Lipid Parameters in Postmenopausal Women From the Selective Estrogens, Menopause, and Response to Therapy (SMART) Trials. J Clin Endocrinol Metab. 2015;100(6):2329-2338. doi: https://doi.org/10.1210/jc.2014-2649
68. Miller VT, LaRosa J, Barnabei V, et al. Effects of estrogen or estrogen/ progestin regimens on heart disease risk factors in postmenopausal women: The Postmenopausal Estrogen/Progestin Interventions (PEPI) trial. JAMA. 1995;273(3):199-208. doi: https://doi.org/10.1001/jama.1995.03520270033028
69. Binder EF, Birge SJ, Kohrt WM. Effects of endurance exercise and hormone replacement therapy on serum lipids in older women. J Am Geriatr Soc. 1996;44(3):231-236. doi: https://doi.org/10.1111/j.1532-5415.1996.tb00907.x
70. Bunyavejchevin S, Limpaphayom KK. The metabolic and bone density effects of continuous combined 17-beta estradiol and noresthisterone acetate treatments in Thai postmenopausal women: a double-blind placebo-controlled trial. J Med Assoc Thai. 2001;84(1):45-53.
71. Cayan F, Gen R, Akbay E, et al. The effect of hormone therapy and tibolone on glucose and lipid metabolism in healthy postmenopausal women. Turk Geriatr Derg. 2011;14(1)19-25. Available from: https://geriatri.dergisi.org/abstract.php?id=534
72. Cheng G, Liu J, Zhang Q, et al. Nylestriol replacement therapy in postmenopausal women. A three‐year prospective study. Int J Gynecol Obstet. 1995;48(1):137-137. doi: https://doi.org/10.1016/0020-7292(95)90284-8
73. Conard J, Basdevant A, Thomas JL, et al. Cardiovascular risk factors and combined estrogen-progestin replacement therapy: a placebo-controlled study with nomegestrol acetate and estradiol. Fertil Steril. 1995;64(5):957-962. doi: https://doi.org/10.1016/s0015-0282(16)57909-6
74. Conard J, Gompel A, Pelissier C, et al. Fibrinogen and plasminogen modifications during oral estradiol replacement therapy. Fertil Steril. 1997;68(3):449-453. doi: https://doi.org/10.1016/s0015-0282(97)00220-3
75. Davidson MH, Maki KC, Marx P, et al. Effects of continuous estrogen and estrogen-progestin replacement regimens on cardiovascular risk markers in postmenopausal women. Arch Intern Med. 2000;160(21):3315-3325. doi: https://doi.org/10.1001/archinte.160.21.3315
76. Duvernoy CS, Rose PA, Kim HM, et al. Combined continuous ethinyl estradiol/norethindrone acetate does not improve forearm blood flow in postmenopausal women at risk for cardiovascular events: a pilot study. J Womens Health (Larchmt). 2007;16(7):963-970. doi: https://doi.org/10.1089/jwh.2006.0321
77. Casanova G, dos Reis AM, Spritzer PM. Low-dose oral or non-oral hormone therapy: effects on C-reactive protein and atrial natriuretic peptide in menopause. Climacteric. 2015;18(1):86-93. doi: https://doi.org/10.3109/13697137.2014.940309
78. Haase CL, Tybjærg-Hansen A, Ali Qayyum A, et al. LCAT, HDL cholesterol and ischemic cardiovascular disease: A Mendelian randomization study of HDL cholesterol in 54,500 individuals. J Clin Endocrinol Metab. 2012;97(2):E248-E256. doi: https://doi.org/10.1210/jc.2011-1846
79. Lv C, Zhang W, Tan X, et al. The effect of tibolone treatment on lipid profile in women: A systematic review and dose-response meta-analysis of randomized controlled trials. Pharmacol Res. 2021;169(2):105612. doi: https://doi.org/10.1016/j.phrs.2021.105612
80. Anagnostis P, Galanis P, Chatzistergiou V, et al. The effect of hormone replacement therapy and tibolone on lipoprotein (a) concentrations in postmenopausal women: A systematic review and meta-analysis. Maturitas. 2017;99(2):27-36. doi: https://doi.org/10.1016/j.maturitas.2017.02.009
81. Falkeborn M, Persson I, Adami HO, et al. The risk of acute myocardial infarction after oestrogen and oestrogen-progestogen replacement. Br J Obstet Gynaecol. 1992;99(10):821-828. doi: https://doi.org/10.1111/j.1471-0528.1992.tb14414.x
82. Shufelt CL, Manson JE. Menopausal hormone therapy and cardiovascular disease: The role of formulation, dose, and route of delivery. J Clin Endocrinol Metab. 2021;106(5):1245-1254. doi: https://doi.org/10.1210/clinem/dgab042
83. Anagnostis P, Bitzer J, Cano A, et al. Menopause symptom management in women with dyslipidemias: An EMAS clinical guide. Maturitas. 2020;135(2):82-88. doi: https://doi.org/10.1016/j.maturitas.2020.03.007
84. Wenger NK, Lloyd-Jones DM, Elkind MSV, et al. Call to action for cardiovascular disease in women: epidemiology, awareness, access, and delivery of equitable health care: A presidential advisory from the american heart association. Circulation. 2022;145(23):82-88. doi: https://doi.org/10.1161/CIR.0000000000001071
85. Vogel B, Acevedo M, Appelman Y, et al. The Lancet women and cardiovascular disease Commission: reducing the global burden by 2030. Lancet. 2021;397(10292):2385-2438. doi: https://doi.org/10.1016/S0140-6736(21)00684-X
86. Reckelhoff JF. Gender differences in hypertension. Curr Opin Nephrol Hypertens. 2018;27(3):176-181. doi: https://doi.org/10.1097/MNH.0000000000000404
87. Cho L, Davis M, Elgendy I, et al. Summary of updated recommendations for primary prevention of cardiovascular disease in women. J Am Coll Cardiol. 2020;75(20):2602-2618. doi: https://doi.org/10.1016/j.jacc.2020.03.060
88. Gerdts E, Sudano I, Brouwers S, et al. Sex differences in arterial hypertension. Eur Heart J. 2022;43(46):4777-4788. doi: https://doi.org/10.1093/eurheartj/ehac470
89. Zhou B, Carrillo-Larco RM, Danaei G, et al. Worldwide trends in hypertension prevalence and progress in treatment and control from 1990 to 2019: a pooled analysis of 1201 population-representative studies with 104 million participants. Lancet. 2021;398(10304):957-980. doi: https://doi.org/10.1016/S0140-6736(21)01330-1
90. O’Keeffe LM, Simpkin AJ, Tilling K, et al. Sex-specific trajectories of measures of cardiovascular health during childhood and adolescence: A prospective cohort study. Atherosclerosis. 2018;278(10304):190-196. doi: https://doi.org/10.1016/j.atherosclerosis.2018.09.030
91. Ji H, Kim A, Ebinger JE, et al. Sex differences in blood pressure trajectories over the life course. JAMA Cardiol. 2020;5(3):255. doi: https://doi.org/10.1001/jamacardio.2019.5306
92. Maas AHEM, Rosano G, Cifkova R, et al. Cardiovascular health after menopause transition, pregnancy disorders, and other gynaecologic conditions: a consensus document from European cardiologists, gynaecologists, and endocrinologists. Eur Heart J. 2021;42(10):967-984. doi: https://doi.org/10.1093/eurheartj/ehaa1044
93. El Khoudary SR, Aggarwal B, Beckie TM, et al. Menopause transition and cardiovascular disease risk: Implications for timing of early prevention: A scientific statement from the American Heart Association. Circulation. 2020;142(25):967-984. doi: https://doi.org/10.1161/CIR.0000000000000912
94. Biglia N, Cagnacci A, Gambacciani M, et al. Vasomotor symptoms in menopause: a biomarker of cardiovascular disease risk and other chronic diseases? Climacteric. 2017;20(4):306-312. doi: https://doi.org/10.1080/13697137.2017.1315089
95. Chapman N, Ching SM, Konradi AO, et al. Arterial hypertension in women: State of the art and knowledge gaps. Hypertension. 2023;80(6):1140-1149. doi: https://doi.org/10.1161/HYPERTENSIONAHA.122.20448
96. Coutinho T. Arterial stiffness and its clinical implications in women. Can J Cardiol. 2014;30(7):756-764. doi: https://doi.org/10.1016/j.cjca.2014.03.020
97. Picone DS, Kodithuwakku V, Mayer CC, et al. Sex differences in pressure and flow waveform physiology across the life course. J Hypertens. 2022;40(12):2373-2384. doi: https://doi.org/10.1097/HJH.0000000000003283
98. Mosca L, Benjamin EJ, Berra K, et al. Effectiveness-based guidelines for the prevention of cardiovascular disease in women-2011 update: a guideline from the american heart. Circulation. 2011;123(11):1243-1262. doi: https://doi.org/10.1161/CIR.0b013e31820faaf8
99. Issa Z, Seely EW, Rahme M, et al. Effects of hormone therapy on blood pressure. Menopause. 2015;22(4):456-468. doi: https://doi.org/10.1097/GME.0000000000000322
100. Mancia(Chairperson) G, Kreutz(Co-Chair) R, Brunström M, et al. 2023 ESH Guidelines for the management of arterial hypertension the task force for the management of arterial hypertension of the European society of hypertension endorsed by the International Society of Hypertension (ISH) and the European Renal Associati. J Hypertens. 2023;20(4):306-312. doi: https://doi.org/10.1097/HJH.0000000000003480
101. Кобалава Ж.Д., Конради А.О., Недогода С.В., и др. Артериальная гипертензия у взрослых. Клинические рекомендации 2020 // Российский кардиологический журнал. — 2020. — Т. 25. — №3. — С. 3786. doi: https://doi.org/10.15829/1560-4071-2020-3-3786
102. Curb JD, Prentice RL, Bray PF, et al. Venous thrombosis and conjugated equine estrogen in women without a uterus. Arch Intern Med. 2006;166(7):772-780. doi: https://doi.org/10.1001/archinte.166.7.772
103. Blondon M, Wiggins KL, Van Hylckama Vlieg A, et al. Smoking, postmenopausal hormone therapy and the risk of venous thrombosis: a population‐based, case–control study. Br J Haematol. 2013;163(3):418-420. doi: https://doi.org/10.1111/bjh.12508
104. Li Y, Zhao D, Wang M, et al. Association of menopause with risk of carotid artery atherosclerosis. Maturitas. 2021;143(3):171-177. doi: https://doi.org/10.1016/j.maturitas.2020.10.007
105. Schreinlechner M, Noflatscher M, Reinstadler SJ, et al. Early onset of menopause is associated with increased peripheral atherosclerotic plaque volume and progression. Atherosclerosis. 2020;297(3):25-31. doi: https://doi.org/10.1016/j.atherosclerosis.2020.01.023
106. Westendorp IC, in’t Veld BA, Grobbee DE, et al. Hormone replacement therapy and peripheral arterial disease: the Rotterdam study. Arch Intern Med. 2000;160(16):2498-2502. doi: https://doi.org/10.1001/archinte.160.16.2498
107. Grady D, Herrington D, Bittner V, et al. Cardiovascular disease outcomes during 6.8 years of hormone therapy: Heart and Estrogen/progestin Replacement Study follow-up (HERS II). [Erratum in: JAMA. 2002;288(9):1064]. JAMA. 2002;288(1):49-57. doi: https://doi.org/10.1001/jama.288.1.49
108. Rockman CB, Maldonado TS, Jacobowitz GR, et al. Hormone replacement therapy is associated with a decreased prevalence of peripheral arterial disease in postmenopausal women. Ann Vasc Surg. 2012;26(3):411-418. doi: https://doi.org/10.1016/j.avsg.2011.10.012
109. Davies RS, Vohra RK, Bradbury AW, Adam DJ. The impact of hormone replacement therapy on the pathophysiology of peripheral arterial disease. Eur J Vasc Endovasc Surg. 2007;34(5):569-575. doi: https://doi.org/10.1016/j.ejvs.2007.06.002
110. Vos T, Flaxman AD, Naghavi M, et al. Years lived with disability (YLDs) for 1160 sequelae of 289 diseases and injuries 1990-2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet. 2012;380(9859):2163-2196. doi: https://doi.org/10.1016/S0140-6736(12)61729-2
111. Roth GA, Forouzanfar MH, Moran AE, et al. Demographic and epidemiologic drivers of global cardiovascular mortality. N Engl J Med. 2015;372(14):1333-1341. doi: https://doi.org/10.1056/NEJMoa1406656
112. Поляков Д.С., Фомин И.В., Беленков Ю.Н., и др. Хроническая сердечная недостаточность в Российской Федерации: что изменилось за 20 лет наблюдения? Результаты исследования ЭПОХА –ХСН // Кардиология. — 2021. — Т. 61. — №4. — С. 4-14. doi: https://doi.org/10.18087/cardio.2021.4.n1628
113. Mozaffarian D, Benjamin EJ, Go AS, et al. Heart disease and stroke statistics-2016 update: A report from the American Heart Association. Circulation. 2016;133(4):e38-e360. doi: https://doi.org/10.1161/CIR.0000000000000350
114. Appiah D, Schreiner PJ, Demerath EW, et al. Association of age at menopause with incident heart failure: A prospective cohort study and meta-analysis. J Am Heart Assoc. 2016;5(8):e003769. doi: https://doi.org/10.1161/JAHA.116.003769
115. Schierbeck LL, Rejnmark L, Tofteng CL, et al. Effect of hormone replacement therapy on cardiovascular events in recently postmenopausal women: randomised trial. BMJ. 2012;345(2):e6409-e6409. doi: https://doi.org/10.1136/bmj.e6409
116. Lindenfeld J, Ghali JK, Krause-Steinrauf HJ, et al. BEST Investigators. Hormone replacement therapy is associated with improved survival in women with advanced heart failure. J Am Coll Cardiol. 2003;42(7):1238-1245. doi: https://doi.org/10.1016/s0735-1097(03)00938-0
117. Liu L, Klein L, Eaton C, et al. Menopausal hormone therapy and risks of first hospitalized heart failure and its subtypes during the intervention and extended postintervention follow-up of the women’s health initiative randomized trials. J Card Fail. 2020;26(1):2-12. doi: https://doi.org/10.1016/j.cardfail.2019.09.006
118. Kirchhof P, Benussi S, Kotecha D, et al. ESC Scientific Document Group. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J. 2016;37(38):2893-2962. doi: https://doi.org/10.1093/eurheartj/ehw210
119. Fang MC, Singer DE, Chang Y, et al. Gender differences in the risk of ischemic stroke and peripheral embolism in atrial fibrillation: the AnTicoagulation and Risk factors In Atrial fibrillation (ATRIA) study. Circulation. 2005;112(12):1687-1691. doi: https://doi.org/10.1161/CIRCULATIONAHA.105.553438
120. Dagres N, Nieuwlaat R, Vardas PE, et al. Gender-related differences in presentation, treatment, and outcome of patients with atrial fibrillation in Europe: a report from the Euro Heart Survey on Atrial Fibrillation. J Am Coll Cardiol. 2007;49(5):572-577. doi: https://doi.org/10.1016/j.jacc.2006.10.047
121. Linde C, Bongiorni MG, Birgersdotter-Green U, et al. Sex differences in cardiac arrhythmia: a consensus document of the European Heart Rhythm Association, endorsed by the Heart Rhythm Society and Asia Pacific Heart Rhythm Society. Europace. 2018;20(10):1565-1565. doi: https://doi.org/10.1093/europace/euy067
122. Thompson LE, Maddox TM, Lei L, et al. Sex differences in the use of oral anticoagulants for atrial fibrillation: A report from the National Cardiovascular Data Registry (NCDR®) PINNACLE Registry. J Am Heart Assoc. 2017;6(7):e005801. doi: https://doi.org/10.1161/JAHA.117.005801
123. Lee J, Kim Y, Park H, et al. Clinical impact of hormone replacement therapy on atrial fibrillation in postmenopausal women: A nationwide cohort study. J Clin Med. 2021;10(23):5497. doi: https://doi.org/10.3390/jcm10235497
124. Magnussen C, Niiranen TJ, Ojeda FM, et al. Sex differences and similarities in atrial fibrillation epidemiology, risk factors, and mortality in community cohorts: Results from the BiomarCaRE Consortium (Biomarker for Cardiovascular Risk Assessment in Europe). Circulation. 2017;136(17):1588-1597. doi: https://doi.org/10.1161/CIRCULATIONAHA.117.028981
125. Perez MV, Wang PJ, Larson JC, et al. Effects of postmenopausal hormone therapy on incident atrial fibrillation: the Women’s Health Initiative randomized controlled trials. Circ Arrhythm Electrophysiol. 2012;5(6):1108-1116. doi: https://doi.org/10.1161/CIRCEP.112.972224
126. Tsai W-C, Haung Y-B, Kuo H-F, et al. Hormone replacement therapy and risk of atrial fibrillation in Taiwanese menopause women: A nationwide cohort study. Sci Rep. 2016;6(1):24132. doi: https://doi.org/10.1038/srep24132
127. Wong JA, Rexrode KM, Sandhu RK, et al. Menopausal age, postmenopausal hormone therapy and incident atrial fibrillation. Heart. 2017;103(24):1954-1961. doi: https://doi.org/10.1136/heartjnl-2016-311002.
128. Fleury MA, Clavel MA. Sex and race differences in the pathophysiology, diagnosis, treatment, and outcomes of valvular heart diseases. Can J Cardiol. 2021;37(7):980-991. doi: https://doi.org/10.1016/j.cjca.2021.02.003
Об авторах
Е. В. ШляхтоРоссия
Шляхто Евгений Владимирович, д.м.н., профессор
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Г. Т. Сухих
Россия
Сухих Геннадий Тихонович, д.м.н., профессор
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
В. Н. Серов
Россия
Серов Владимир Николаевич, д.м.н., профессор
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
И. И. Дедов
Россия
Дедов Иван Иванович, д.м.н., профессор
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Г. П. Арутюнов
Россия
Арутюнов Григорий Павлович, д.м.н., профессор
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
И. А. Сучков
Россия
Сучков Игорь Александрович, д.м.н., профессор
Рязань
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Я. А. Орлова
Россия
Орлова Яна Артуровна, д.м.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Е. Н. Андреева
Россия
Андреева Елена Николаевна, д.м.н., профессор
SPIN-код: 1239-2937
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
С. В. Юренева
Россия
Юренева Светлана Владимировна, д.м.н., профессор
SPIN-код: 3623-9149
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
И. С. Явелов
Россия
Явелов Игорь Семенович, д.м.н., профессор
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
М. И. Ярмолинская
Россия
Ярмолинская Мария Игоревна, д.м.н., профессор
SPIN-код: 3686-3605
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
С. В. Виллевальде
Россия
Виллевалде Светлана Вадимовна, д.м.н.
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
О. Р. Григорян
Россия
Григорян Ольга Рафаэльевна, д.м.н., профессор
SPIN-код: 3060-8242
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Е. Н. Дудинская
Россия
Дудинская Екатерина Наильевна, д.м.н.
SPIN-код: 6453-5835
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Е. А. Илюхин
Россия
Илюхин Евгений Аркадьевич, к.м.н.
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Н. А. Козиолова
Россия
Козиолова Наталья Андреевна, д.м.н., профессор
Пермь
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
И. В. Сергиенко
Россия
Сергиенко Игорь Владимирович, д.м.н., профессор
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
А. А. Сметник
Россия
Сметник Антонина Александровна, к.м.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Н. И. Тапильская
Россия
Тапильская Наталья Игоревна, д.м.н., профессор
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Дополнительные файлы
|
|
1. Рисунок 1.1. Классификация этапов старения репродуктивной системы женщин (STRAW+10) | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(492KB)
|
Метаданные ▾ | |
|
|
2. Приложение 2. Алгоритм принятия решения о назначении МГТ | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(361KB)
|
Метаданные ▾ | |
|
|
3. Приложение 3. Алгоритм принятия решения об отмене МГТ | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(425KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Шляхто Е.В., Сухих Г.Т., Серов В.Н., Дедов И.И., Арутюнов Г.П., Сучков И.А., Орлова Я.А., Андреева Е.Н., Юренева С.В., Явелов И.С., Ярмолинская М.И., Виллевальде С.В., Григорян О.Р., Дудинская Е.Н., Илюхин Е.А., Козиолова Н.А., Сергиенко И.В., Сметник А.А., Тапильская Н.И. Российские критерии приемлемости назначения менопаузальной гормональной терапии пациенткам с сердечно-сосудистыми и метаболическими заболеваниями. Согласительный документ РКО, РОАГ, РАЭ, ЕАТ, РАФ. Проблемы Эндокринологии. 2023;69(5):115-136. https://doi.org/10.14341/probl13394
For citation:
Shlyakhto E.V., Sukhikh G.T., Serov V.N., Dedov I.I., Arutyunov G.P., Suchkov I.A., Orlova Ya.A., Andreeva E.N., Yureneva S.V., Yavelov I.S., Yarmolinskaya M.I., Villevalde S.V., Grigoryan O.R., Dudinskaya E.N., Ilyukhin E.A., Koziolova N.A., Sergienko I.V., Smetnik A.A., Tapilskaya N.I. Russian eligibility criteria prescribing menopausal hormonal hormones therapy for patients with cardiovascular and metabolic diseases. Consensus document of the Russian Cardiological Society, Russian Society of Obstetricians and Gynecologists, Russian Association of Endocrinologists, Eurasian Association of Therapists, Association of Phlebologists of Russia. Problems of Endocrinology. 2023;69(5):115-136. (In Russ.) https://doi.org/10.14341/probl13394

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).









































.jpg)


