Перейти к:
Уровни инсулина, гликемии, резистентности к инсулину и функциональной активности β-клетки при различном образе жизни коренного жителя Арктики. Есть ли предпосылки к развитию сахарного диабета и какого?
https://doi.org/10.14341/probl13411
Аннотация
ОБОСНОВАНИЕ. Современные исследования дают основания полагать, что смена уклада жизни аборигенов Арктики приводит к утрате «адаптивного полярного метаболического типа», характеризующегося интенсификацией белкового, оптимизацией липидного и минимизацией углеводного обменов при низких концентрациях инсулина. Что удается отстоять в эпоху перемен?
ЦЕЛЬ. Оценить уровень инсулина, гликемии, инсулинорезистентности и секреторной активности β-клетки у аборигенов Арктики относительно их образа жизни.
МАТЕРИАЛЫ И МЕТОДЫ. Проведено поперечное исследование популяции аборигенов Арктики (ненцы, коми) от 22 до 60 лет. В сыворотке крови методом ИФА исследованы уровни инсулина, спектрофотометрическим — глюкозы. Рассчитаны индексы HOMA-IR и HOMA1-%β.
РЕЗУЛЬТАТЫ. Обследовано 397 человек; 89 чел. (22%) — кочующих аборигенов (КА), 44 (50%) муж.; 308 чел. (78%) — оседлых (ОА), 69 (22 %) муж. Уровень инсулина — 6,0 [3,5–11,8] мкЕд/мл — был значимо ниже у КА в сравнении с ОА — 8,3 [4,6–13,1] мкЕд/мл, р=0,006. Гликемия 4,6 [4,2–5,0] и 4,6 [4,1–5,2] ммоль/л — без различий по образу жизни. Величина HOMA-IR у КА — 1,3 [0,7–2,4] значимо ниже, чем у ОА 1,8 [0,95–2,8] усл.ед., р=0,013. Скорректированное (пол, возраст, ИМТ) ОШ наличия IR-HOMA>2 усл.ед. у ОА в 1,8 раза выше, чем у КА, ОШ=0,56; 95% ДИ: 0,33–0,96, р=0,034. Me [IQR] HOMA%β 128 [67–241] и 144 [93–236]% без значимых различий между группами. Случаев «HOMA1-%β<48,9» больше у КА: 17% против 5% у ОА, p<0,001. Скорректированные шансы наличия «HOMA1-%β<48,9» у КА в 3,5 раза выше, чем у ОА; 95% ДИ: 1,56–7,92, р=0,002. Выявлено 56 случаев гликемии ≥5,6 ммоль/л: 13,5% у КА и 14% у ОА; соотношение IR-HOMA, усл.ед /HOMA1-%β/ИМТ кг/м2 составило: 1,8/45/25,2 у КА и 3,0 /88/29,6 у ОА, p<0,001.
ЗАКЛЮЧЕНИЕ. Сохранение кочевого образа жизни способствует удержанию более низкой концентрации инсулина; при этом уровни гликемии в группах сходные. У КА это обусловлено высокой долей лиц с низкой секреторной активностью β-клетки, преимущественно мужчин; ОА — более инсулинорезистентны. Анализ случаев гликемии ≥5,6 ммоль/л подтвердил генез гипергликемии у КА, связанный с гипофункцией β-клетки с отсутствием случаев ожирения при этом; у ОА — связанный с ростом резистентности к инсулину и ожирением.
Для цитирования:
Стрелкова А.В., Бичкаева Ф.А., Власова О.С., Нестерова Е.В., Шенгоф Б.А., Грецкая Т.Б. Уровни инсулина, гликемии, резистентности к инсулину и функциональной активности β-клетки при различном образе жизни коренного жителя Арктики. Есть ли предпосылки к развитию сахарного диабета и какого? Проблемы Эндокринологии. 2024;70(5):54-69. https://doi.org/10.14341/probl13411
For citation:
Strelkova A.V., Bichkaeva F.A., Vlasova O.S., Nesterova E.V., Shengof B.A., Gretskaya T.B. Insulin level, glycemia, insulin resistance and β-cell function in relation to the lifestyle of Arctic indigenous people. Are there conditions for diabetes and which type? Problems of Endocrinology. 2024;70(5):54-69. (In Russ.) https://doi.org/10.14341/probl13411
Обоснование
Метаболическая «пандемия», активно распространяющаяся по всему миру [1][2], ассоциированная с развитием гиперинсулинемии, инсулинорезистентности, сопряженная с ожирением, дислипидемией, воспалением, стрессом эндоплазматического ретикулума, оксидативным и карбонильным стрессом [3], долгое время не затрагивала коренных жителей Арктики [4][5]. Этот феномен объяснялся способностью переключения энергетического обмена с «углеводного» типа на «жировой» и лег в основу концепции «полярного метаболического типа» [6]. Считается, что такая перестройка метаболизма лишь частично генетически детерминирована [7][8] и сформировалась в процессе онтогенеза под влиянием традиционного кочевого уклада жизни и преимущественно белково-липидного рациона питания, обеспечив, при «бережливом генотипе» (Neel, 1964 г.), возможность увеличения основного обмена на 10–33% по сравнению с жителями умеренных широт [8][9] и крайне низкую распространенность в популяции ожирения, сахарного диабета (СД) и сердечно-сосудистой патологии [4][5][7][9].
Одной из ключевых составляющих данной концепции была возможность поддержания сбалансированного энергетического баланса посредствам повышения уровня кортизола и удержания инсулина (Инс) в низких значениях референсного диапазона при сохранении популяционной тенденции к низко-нормальным уровням гликемии [6][10].
С середины прошлого века, на протяжении жизни 3–4 поколений (чрезвычайно короткий в эволюционном плане период), значительная часть коренных северян оказалась перед необходимостью адаптироваться к оседлому образу жизни и пищевому рациону, значительно отличающемуся от традиционного. Одно из основных изменений диеты связано с резким увеличением доли углеводов, потребление которых сравнялось со средними показателями по РФ (40 кг на человека в год) и стало больше, чем в Европе (36,2 кг). Только потребление сахарозы коренными жителями Арктики (как кочевниками, так и оседлыми) возросло в 2 раза (с 30 до 65 г/сут.) [8].
Произошедшие перемены обозначились на современном этапе увеличением случаев ожирения, артериальной гипертензии и сахарного диабета [4][5][8].
Полученные нами данные (2009–2018 гг.) свидетельствуют о повышении средних значений гликемии у жителей Европейской Арктики РФ [11] относительно показателей конца прошлого века [10] и созвучны с трендами эпидемиологических исследований [12][13] и Федерального регистра СД, демонстрирующих рост случаев интолерантности к глюкозе и преимущественно СД 2 типа (СД2), в том числе у жителей северных регионов [4].
В то же время анализ Федерального регистра продемонстрировал интересную особенность: «географический градиент» с более высокой распространенностью СД 1 типа (СД1) на северо-западе страны по сравнению с юго-востоком. Этот перепад сохранился и в сугубо Арктических регионах: так, в Архангельской области и Ненецком автономном округе заболеваемость СД1 — 200–240 на 100 тыс. населения, т.е. в 1,5–2 раза выше по сравнению с Якутией, Камчатским краем и Чукотским автономным округом (100–180 на 100 тыс. населения) [4].
Учитывая вышеизложенное, представляет интерес изучение параметров резистентности к инсулину совместно с показателями секреторной активности β-клетки в популяции коренных жителей Арктики РФ, еще в середине прошлого века практически не страдавших сахарным диабетом и ожирением [4-6].
Инструментами для определения инсулинорезистентности (IR) и функции β-клетки (Fβ) в популяционных исследованиях являются суррогатные индексы, валидизированные с методикой клэмпа, использующие в расчетах как правило постабсорбционные показатели гликемии и инсулинемии [14][15]. Совместная оценка инсулинорезистентности и секреторной активности β-клетки (Fβ) считается наиболее корректной [16] и не встретилась в доступной нам литературе, посвященной изучению гормональной регуляции метаболизма в популяциях аборигенов Арктики.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Оценка инсулинемии, гликемии, параметров секреторной активности β-клетки и чувствительности к инсулину у коренных жителей Арктики относительно их образа жизни.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения. Сбор данных осуществлен экспедициями ФГБУН ФИЦКИА УрО РАН Министерства науки и высшего образования Российской Федерации, г. Архангельск на территориях Арктической зоны Российской Федерации в Ненецком автономном округе (НАО, пос. Нельмин-Нос, Несь), Мезенском районе Архангельской области (пос. Совполье, Сояна, Долгощелье) и Ямало-Ненецком автономном округе (ЯНАО, пос. Сейяха, Тазовский, Гыда, Ныда, Нори, Антипаюта).
Время исследования. С февраля 2009 по апрель 2018 гг. в весенне-зимний период (декабрь–апрель).
Изучаемые популяции (одна или несколько)
Изучалась популяция коренных жителей Крайнего Севера.
Критерии включения: аборигены НАО, Мезенского района АО и ЯНАО в возрасте 22–60 лет, идентифицирующие себя, согласно анкетным данным, как ненцы и коми не менее чем в двух поколениях, не имеющие на момент проведения исследования жалоб со стороны здоровья, относящиеся к .I–III группе здоровья [17], подписавшие информированное согласие.
Критерии исключения: наличие критериев IV–V группы здоровья [17], а также лица, имеющие в анамнезе диагноз СД и иные эндокринопатии (кроме ожирения) и/или состоящие на диспансерном учете у кардиолога или эндокринолога, имеющие на момент исследования обострение любой хронической патологии, острые заболевания и беременность.
Далее были сформированы 2 группы по образу жизни (ОЖ): первая — кочующие аборигены оленеводы с традиционным кочевым укладом жизни, обследованные в период стоянок вблизи поселков (КА); вторая — оседлые (поселковые) аборигены (ОА).
Способ формирования выборки из изучаемой популяции (или нескольких выборок из нескольких изучаемых популяций)
Представлена произвольная выборка с распределением по группам в зависимости от образа жизни. Респонденты отобраны случайным образом и составили 2,2% от численности аналогичной по возрасту популяции коренного оседлого (поселкового) и кочующего населения этих территорий (согласно Всероссийской переписи 2010 г.).
Дизайн исследования
Проведено поперечное исследование. Жители населенных пунктов и кочевники в период стоянок у этих населенных пунктов были заранее проинформированы о предстоящем обследовании; прибывали на фельдшерский пункт в назначенный для обследования день утром, натощак. Все участники дали письменное согласие на участие в исследовании. Затем врачами проводился сбор анамнеза и физикальный осмотр, на основании заключения делался вывод о состоянии здоровья и соответствии критериям включения/исключения для участия в исследовании. Далее проводилось анкетирование по специально разработанной анкете и сбор биологического материала.
Методы
Всем участникам исследования было выполнено антропометрическое исследование с расчетом индекса массы тела (ИМТ) по формуле Кетле: ИМТ (кг/м2) = вес, кг/рост, м2 и последующей оценкой полученной величины по критериям ВОЗ (1997 г.).
Сбор биологического материала проводился с 08:00 до 10:00 часов строго натощак в вакутайнеры «Beckton Dickinson BP». Полученные образцы центрифугировались, сыворотка или плазма отбиралась в эппендорфы, маркировалась, подвергалась глубокой заморозке и транспортировалась в лабораторию. Иммуноферментным методом с помощью наборов «DRG Instruments Gmb H» на планшетном анализаторе для ИФА (ELISYS Uno, Human Gmb H, Германия) и фотометре StatFax 303 (США) в сыворотке крови определяли содержание инсулина (Инс, референсное значение 2,1–25 мкЕд/мл). Уровень глюкозы (Глю, референсное значение 3,9–6,1 ммоль/л) определяли спектрофотометрическим методом наборами «Chronolab AG».
Рассчитывали индексы:
-HOMA-IR (HOmeostatic Model Assessment for Insulin Resistance) оценки инсулинорезистентности по формуле HOMA-IR = Глю [ммоль/л] * Инс [мкЕд/мл] ÷ 22,5. Референсное значение — 2,0 усл.ед., результат выше предполагал наличие инсулинорезистентности [14][15];
-HOMA1-%β — показатель оценки секреторной функции β-клеток (Fβ) по формуле
HOMA1-%β = 20 * Инс [мкЕд/мл] ÷ (Глю [ммоль/л] - 3,5). Снижение показателя являлось предиктором диабета и/или нарушения толерантности к глюкозе. Индекс рассчитывался при значениях глюкозы>3,5 ммоль/л. Референсное значение 48,9 усл.ед.; результат ниже этого предполагал снижение функции β-клеток (дефицит инсулина) [16].
Статистический анализ
Статистический анализ проводился с использованием программы Statistica (v. 10.0, StatSoft, USA) и StatTech (v. 3.1.8, ООО «Статтех», Россия). Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Колмогорова. В связи с отсутствием нормального распределения у подавляющего большинства показателей количественные данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1–Q3). Категориальные данные описывались с указанием абсолютных значений и процентных долей с 95%ДИ. Сравнение двух групп по количественному показателю выполнялось с помощью U-критерия Манна-Уитни. Сравнение процентных долей при анализе четырехпольных таблиц сопряженности выполнялось с помощью критерия хи-квадрат (χ2) Пирсона (при значениях ожидаемого явления более 10) и с помощью точного критерия Фишера (при менее 10). Сравнение процентных долей при анализе многопольных таблиц сопряженности выполнялось с помощью критерия χ2 Пирсона. Направление и теснота корреляционной связи между двумя количественными показателями оценивались с помощью коэффициента ранговой корреляции Спирмена. Построение прогностической модели вероятности определенного исхода выполнялось при помощи метода логистической регрессии. Мерой определенности, указывающей на ту часть дисперсии, которая может быть объяснена с помощью логистической регрессии, служил коэффициент R² Найджелкерка. Статистически значимыми считались изменения при вероятности ошибочного принятия нулевой гипотезы р<0,05. Предполагалось включить в исследование 390–400 респондентов, что соответствует критериям репрезентативности выборки по методике определения объема выборки К.А. Отдельновой и др. [18].
Этическая экспертиза
Исследование проводилось с письменного согласия волонтеров и в соответствии с требованиями Хельсинской Декларации Всемирной Медицинской Ассоциации об этических принципах проведения медицинских исследований (2000 г.), оно было одобрено этическими комитетами (протоколы заседаний этических комитетов Института физиологии природных адаптаций УрО РАН и ФГБУН ФИЦКИА УрО РАН от 2.02.2009, 4.02.2013, 9.11.2016).
Результаты
Демографические данные и ИМТ (табл. 1)
Общее количество обследованных лиц составило 397 человек; из них 139 человек — жители НАО, 35 — Мезенского района АО и 223 волонтера из ЯНАО; 377 (95%) респондентов идентифицировали себя, согласно анкетным данным, как ненцы, 20 (5%) — как коми.
Группа КА составила 89 (22,4%) человек и поровну представлена мужчинами и женщинами. Группа ОА — 308 (77,6%), из них 239 (77,6 %) женщин. Группы не различались по возрасту: его медиана составила 43 года. Выборка была разделена на подгруппы по возрасту согласно классификации АПН СССР (Москва, 1965); статистической разницы между возрастными подгруппами также не выявлено. Медиана ИМТ 26,69 кг/м2 отвечала критерию избыточной массы тела (ИзМТ, ВОЗ, 1997 г.). При оценке показателя в зависимости от ОЖ статистически значимые различия не выявлены (p=0,669). Тенденциально (р=0,091) в группе КА отмечен более высокий процент лиц с ИзМТ, отсутствие случаев дефицита массы тела и меньше респондентов с ожирением по сравнению с ОА (табл. 1).
Таблица 1. Гендерные различия, анализ возраста и ИМТ в зависимости от образа жизни коренных жителей Крайнего Севера
Показатели | Образ жизни | р | ||
Кочующие | Оседлые | |||
n=89 (22,4 %) | n=308 (77,6 %) | <0,001* | ||
Пол | Муж. | 44 (49,4; 38,7–60,2) | 69 (22,4; 17,9–27,5) | <0,001* |
Жен. | 45 (50,6; 39,1–61,3) | 239 (77,6; 72,5–82,1) | ||
Возраст, лет Me [Q₁-Q₃], мин–мах | 42 [ 31–50] 22–59 | 43 [ 33–50] 22–60 | 0,372 | |
Возраст, шкала | 22–35 лет | 35 (39,3; 29,1–50,3) | 105 (34,1; 28,8–39,7) | 0,661 |
36–45 лет | 20 (22,5; 14,3–32,6) | 75 (24,4; 19,7–29,5) | ||
46–60 лет | 34 (38,2; 28,1–49,1) | 128 (41,6; 36,0–47,3) | ||
ИМТ, кг/м2 Me [Q₁-Q₃], мин–мах | 26,56 [ 23,74–29,48] 18,73–39,76 | 26,88 [ 23,23–30,83] 15,62–44,24 | 0,669 | |
ИМТ, шкала | <18,5 кг/м2 | 0 (0,0) | 10 (3,2; 1,6–5,9) | 0,091 |
18,5–24,9 кг/м2 | 32 (36,0; 26,1–46,8) | 110 (35,7; 30,4–41,3) | ||
25–29,9 кг/м2 | 37 (41,6; 31,2–52,5) | 96 (31,2; 26,0–36,7) | ||
≥30 кг/м2 | 20 (22,5; 14,3–32,6) | 92 (29,9; 24,8–35,3) | ||
Примечание: * — различия показателей статистически значимы (p<0,05).
Категориальные данные представлены — абс. (%; 95% ДИ).
Инсулинемия и гликемия (табл. 2)
Медиана Инс 7,67 [ 4,37–12,78] мкЕд/мл в выборке в целом соответствовала низко-нормальным значениям. В группе КА уровень Инс был значимо (р=0,006) ниже, чем в группе ОА (табл. 2). Анализ случаев с показателем вне пределов референсных значений (т.е. менее 2,0 и более 25 мкЕд/мл) не выявил статистически значимых различий между группами.
Медиана Глю 4,61 [ 4,13–5,15] ммоль/л в исследуемой популяции соответствовала среднему значению референса. При сравнении Глю в зависимости от ОЖ статистически значимых различий не установлено. В группе КА отмечен более высокий процент лиц с эугликемией за счет отсутствия случаев, соответствующих критериям недиабетической гипогликемии (<3 ммоль/л) и сахарному диабету (≥7,0 ммоль/л), но статистическая значимость по данным различиям не достигнута (табл. 2).
Корреляционный анализ не выявил статистически значимой связи между Инс и Глю в группе КА (ρ=0,194; р=0,069). В группе ОА была установлена умеренной тесноты прямая связь (ρ=0,385; р<0,001). На рис. 1 продемонстрировано отсутствие линейной зависимости уровня Инс от гликемии в группе КА и наличие в ОА.
Таблица 2. Уровни инсулина и глюкозы в зависимости от образа жизни коренных жителей Крайнего Севера
Показатели | Образ жизни | р | |
Кочующие | Оседлые | ||
n=89 (22,4 %) | n=308 (77,6%) | ||
Уровень инсулина и случаи гипо- и гиперинсулинемии | |||
Инсулин, мкЕд/мл Me [Q₁-Q₃] мин–мах | 6,04 [ 3,49–11,80] 1,5–33,22 | 8,30 [ 4,59–13,33] 1,2–54,59 | 0,006* |
Гипоинсулинемия <2,1 мкЕд/мл | 5 (5,6; 2,6–14,4) | 9 (2,9; 1,2–5,5) | 0,255 |
Гиперинсулинемия >25 мкЕд/мл | 4 (4,5; 1,9–12,9) | 22 (7,1; 5,8–12,7) | 0,374 |
Уровень гликемии и случаи нарушений углеводного обмена | |||
Глюкоза, ммоль/л Me [Q₁-Q₃] мин–мах | 4,62 [ 4,22–5,04] 3,09–6,27 | 4,61 [ 4,11–5,16] 2,71–10,24 | 0,845 |
Гипогликемия < 3,0 ммоль/л | 0 | 6 (1,9; 0,6–4,0) | 0,236 |
Эугликемия ≥ 3,0 <6,1 ммоль/л | 86 (96,6; 90,3 – 99,3) | 279 (90,6; 86,1–93,4) | |
НТГ ≥ 6,1<7,0 ммоль/л | 3 (3,4; 0,7–9,7) | 18 (5,8; 3,8–9,8) | |
СД ≥ 7,0 ммоль/л | 0 | 5 (1,6; 0,6–4,0) | |
≤ 3,5 ммоль/л** | 4 (4,5;1,2–11,1) | 22 (7,1; 4,8–11,1) | 0,374 |
≥ 5,6 ммоль/л*** | 12 (13,5; 7,2–22,4) | 44 (14,3; 10,6–18,7) | 0,848 |
Примечание: * — различия показателей статистически значимы (p<0,05). Категориальные данные представлены — абс. (%; 95% ДИ). ** Показатель представлен для понимания количества замен при расчете HOMA1-%β, с заменой***, см. табл. 3.
*** Критерий метаболического синдрома (AHA/NHBLI, 2009 г.).
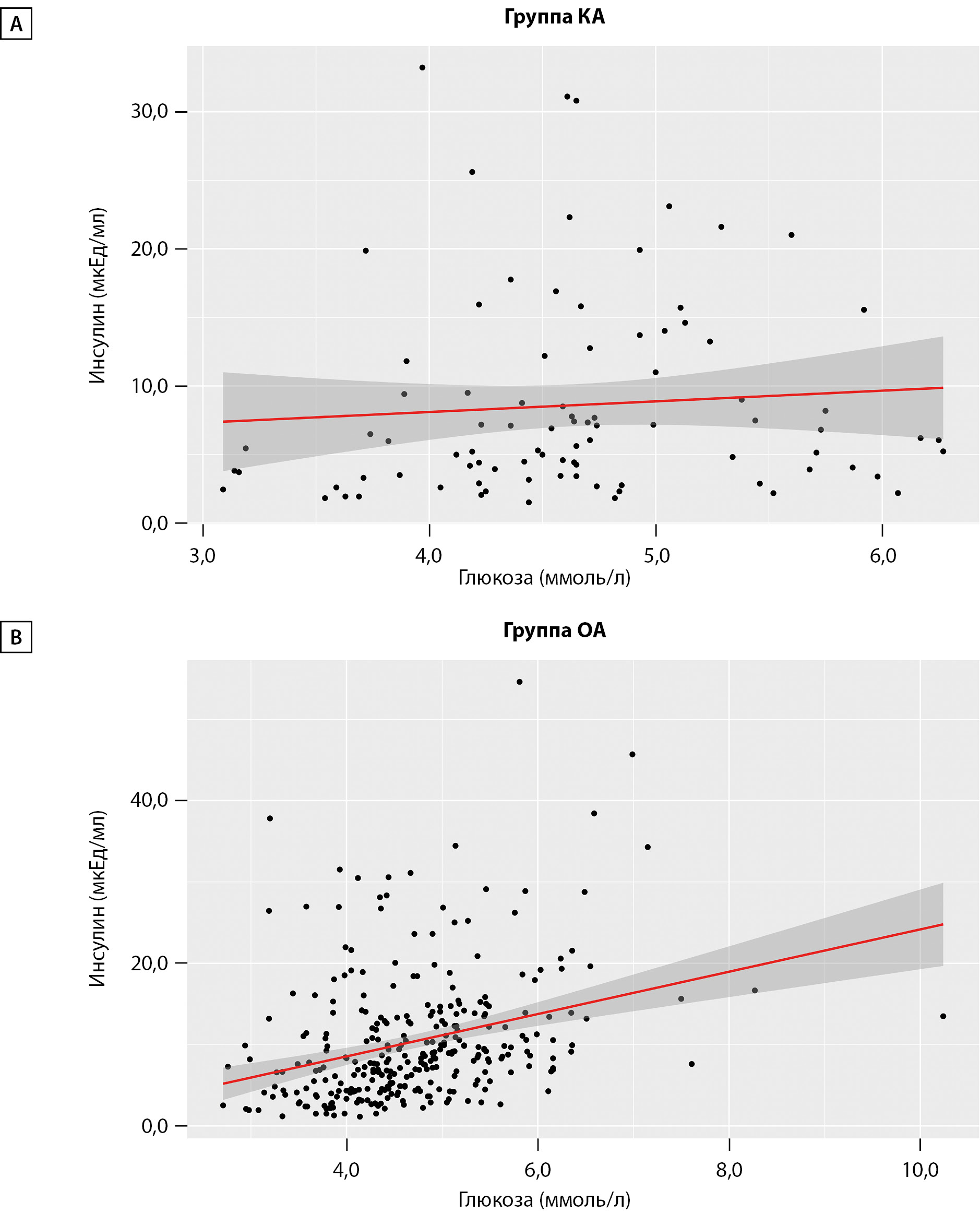
Рисунок 1. Графики, демонстрирующие отсутствие (А) и наличие (В) линейной зависимости инсулина от глюкозы у аборигенов с разным образом жизни.
Инсулинорезистентность и секреторная активность β-клетки (табл. 3, рис. 2)
Величина индекса IR-HOMA в эпидемиологических исследованиях как правило описывается значениями 75‰–90‰. Анализ IR-HOMA в зависимости от ОЖ показал меньшие значения 75‰–90‰ индекса у КА — 2, 44 и 4,38 усл.ед. в сравнении с 2,82 и 4,98 у ОА, p=0,013. Пороговое значение, определяющее наличие инсулинорезистентности, — IR-HOMA >2 усл.ед. [14] у КА соответствовало 72‰, у ОА — 55‰. Шансы наличия IR-HOMA>2 усл.ед. в группе ОА были в 2,17 (95% ДИ: 1,29–3,69) раза выше по сравнению с группой КА, р=0,012.
Нами была проведена скорректированная оценка ОШ для выбранных предикторов индекса «IR-HOMA>2» посредствам метода логистической регрессии. Многофакторная бинарная логистическая Модель (1), включившая в себя ОЖ, пол, шкалы ИМТ и возраста, была статистически значимой (p=0,026), и независимое влияние ОЖ на показатель «IR-HOMA>2» сохранилось с шансами наличия в 1,77 раза ниже у КА в сравнении с ОА. Исходя из значения коэффициента детерминации R2 модель объяснила 5,3% наблюдаемой дисперсии значения индекса «IRHOMA>2 усл.ед.», рис. 2 (А).
Далее была оценена Fβ. Медиана индекса HOMA1-%β, рассчитанная, согласно условиям использования индекса [16], только у лиц с уровнем Глю≥3,5 ммоль/л (n=371), соответствовала высоким значениям, без значимых различий между группами (p=0,163). Нами был рассчитан индекс HOMA%β «с заменой»: у 26 участников (4 КА и 22 ОА), чьи показатели Глю были ниже или равны 3,5 ммоль/л. При расчете индекса в формулу вводили значение Глю, равное 3,51 ммоль/л. Данная манипуляция позволила увидеть тенденцию (р=0,096) к более высоким значениям Fβ в группе ОА (табл. 3).
Пороговое значение, определяющее наличие гипофункции β-клетки (гипо-Fβ), составляет менее 48,9% по величине индекса HOMA1-%β [16]. Оценка доли респондентов по этому признаку показала существенные различия между группами: 16,9% у КА и 4,9% у ОА, p<0,001, т.е. шансы наличия респондентов с низкой секреторной активностью β-клетки в группе КА оказались в 4 раза выше по сравнению с группой ОА, ОШ=0,25; 95% ДИ: 0,12–0,54, p<0,001.
С помощью метода логистической регрессии, по аналогии с анализом показателя «IR-HOMA>2», была проведена скорректированная оценка ОШ для тех же предикторов показателя «HOMA1-%β<48,9». Регрессионная модель (2) сохранила значимость (p=0,007) с шансами наличия гипо-Fβ в группе КА в 3,51 раза выше по сравнению с ОА. Модель объяснила 11,6% (R2=0,116) наблюдаемой дисперсии показателя «HOMA1-%β <48,9». На рис. 2 (В) сопоставлены значения скорректированного ОШ с 95% ДИ для изучаемых факторов Модели 2.
Таблица 3. Уровни инсулинорезистентности и секреторной активности β-клетки в зависимости от образа жизни коренных жителей Крайнего Севера
Показатели | Категория — образ жизни | р | |
Кочующие | Оседлые | ||
n=89 (22,4 %) | n=308 (77,6 %) | ||
Чувствительность к инсулину | |||
IR-HOMA, усл. ед. | 1,30 [ 0,70–2,44] 0,28–6,37 | 1,82 [ 0,95–2,82] 0,17–14,19 | 0,013* |
Инсулинорезистентность | |||
IR-HOMA ≥2 усл. ед. | 26 (29,2; 20,1–39,8) | 136 (44,2; 38,5–49,9) | 0,012* |
IR-HOMA ≥2 усл. ед., мужчины | 5 (11,4; 31,7–62,1) | 34 (49,3; 37,0–61,6) | <0,001* |
IR-HOMA ≥2 усл. ед., женщины | 21 (46,7; 31,7–62,1) | 102 (42,7; 36,3–49,2) | 0,620 |
IR-HOMA ≥2 усл. ед., при гликемии ≥5,6 ммоль/л | 3 (25,0; 5,5–57,2) | 37 (84,1; 69,9–93,4) | <0,001* |
Секреторная активность β-клетки | |||
HOMA1-%β с исключением** | n=85 | n=286 | 0,163 |
128,51 [ 67,02–241,34] 16,96–1805 | 144,39 [ 93,37–236,48] 25,02–6737 | ||
HOMA1-%β, | n=89 | n=308 | 0,096 |
135,11 [ 68,44–262,98] 16,96–10880 | 150,44 [ 96,94–296,79] 25,02–75580 | ||
Гипофункция β-клетки | |||
HOMA1-%β <48,9% | 15 (16,9; 9,8–26,3) | 15 (4,9; 2,8–7,9) | <0,001* |
HOMA1-%β <48,9%, мужчины | 12 (27,3; 15,0–42,8) | 3 (4,3; 0,9–12,2) | <0,001* |
HOMA1-%β <48,9%, женщины | 3 (6,7; 1,4–18,3) | 12 (5,0; 2,6–8,6) | 0,651 |
HOMA1-%β <48,9%, при гликемии ≥5,6 ммоль/л | 8 (66,7; 34,9–90,1) | 4 (9,1; 2,5–21,7) | <0,001* |
Примечание: * — различия показателей статистически значимы (p<0,05).
Категориальные данные представлены — абс. (%; 95% ДИ). Индекс HOMA1-%β с исключением**у лиц с гликемией менее 3,51 ммоль/л. Индекс HOMA1-%β, с заменой*** (все значения гликемии ≤3,5 заменены на 3,51 ммоль/л).
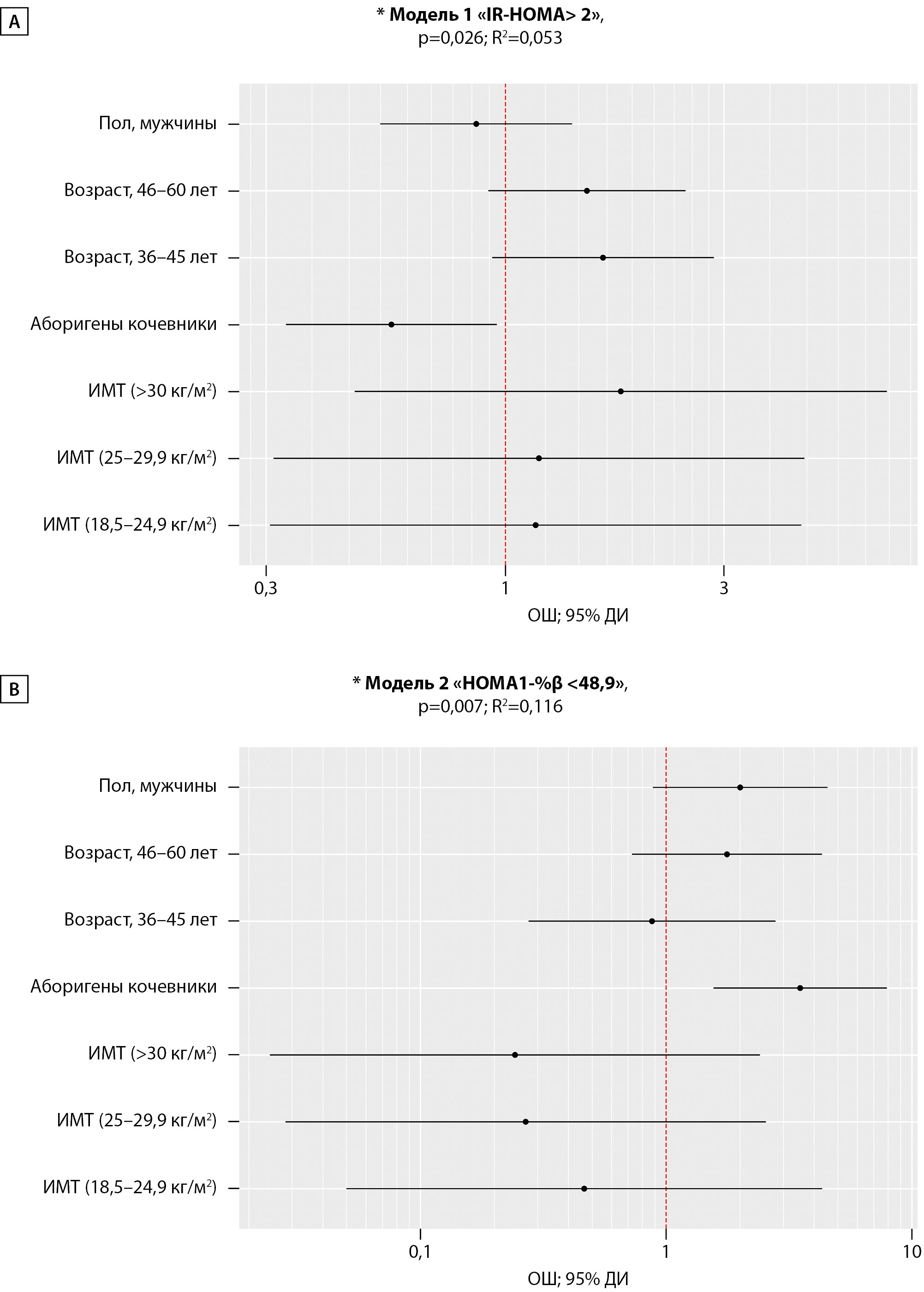
Рисунок 2. Оценка отношения шансов для предикторов (образ жизни, пол, возраст, ИМТ) показателя «IR-HOMA> 2» (А) и «HOMA1-%β <48,9» (В) у аборигенов Арктики.
Примечание: *Основные характеристики регрессионных моделей, р<0,05 — статистическая значимость и коэффициент детерминации (R2).
А — «ОЖ, кочевники», ОШ = 0,56; 95% ДИ: 0,33 – 0,96, р=0,034.
В — «ОЖ, кочевники», ОШ = 3,51; 95% ДИ: 1,56 – 7,92, р=0,002.
Инсулинорезистентность и секреторная активность β-клетки у мужчин (табл. 3, рис. 3)
И в Модели 1, и в Модели 2 отмечалось однонаправленное с предиктором «ОЖ» влияние категории «пол, мужской» на долю лиц с IR и гипо-Fβ. Поэтому далее мы оценили эти параметры у мужчин (n=113).
Медиана, 75‰ и 90‰ индекса IR-HOMA в группе мужчин кочевников составили 0,98–1,53–2,68 усл.ед. и были ниже в сравнении с 1,98–2,76–3,69 усл.ед. в группе ОА мужчин, р<0,001.
Регрессионная Модель 3 (n=113), выполненная аналогично Модели 1, но в отношении подгруппы мужчин с целью оценки ОШ изучаемых предикторов на наличие «IR-HOMA> 2», была статистически значимой (p<0,001) и исходя из значения R2 объяснила 27,2% его дисперсии (рис. 3), т.о. шансы наличия IR-HOMA>2 усл.ед. у мужчин КА были в 10 раз ниже, чем у оседлых, ОШ=0,10; 95% ДИ: 0,03–0,31, р<0,001.
Ме [IQR] «HOMA1-%β» тенденциально ниже была в группе мужчин кочевников и составила 99,67 [ 46,41–192,99] % и 130,00 [ 91,26–196,23] % в группе оседлых, р=0,054. Логистическая регрессия (Модель 4, рис. 3) характеризует шансы наличия у мужчин гипоFβ, объяснила 22% (R2=0,220, =0,014) наблюдаемой дисперсии индекса «HOMA1-%β <48,9». Скорректированное ОШ наличия гипо-Fβ у мужчин оленеводов оказалось в 8,3 раза выше относительно мужчин оседлого образа жизни (95% ДИ: 2,15–32,17, р=0,002). При этом различий в величине ИМТ между КА и ОА выявлено не было: 26,24±3,78 и 26,56±4,10 кг/м2, р=0,672 соответственно.
Ме [IQR] «HOMA1-%β» тенденциально ниже была в группе мужчин кочевников и составила 99,67 [ 46,41–192,99]%, а в группе оседлых 130,00 [ 91,26–196,23]%, р=0,054. Логистическая регрессия (Модель 4, рис. 3) характеризует шансы наличия гипоFβ у аборигенов мужчин, оказавшиеся в 8,3 раза выше в группе КА по сравнению с ОА (95% ДИ: 2,15–32,17, р=0,002). При этом различий в величине ИМТ между КА и ОА не наблюдалось: 26,24±3,78 и 26,56±4,10 кг/м2, р=0,672 соответственно. Модель 4 объяснила 22% (R2=0,220, =0,014) наблюдаемой дисперсии индекса «HOMA1-%β <48,9».
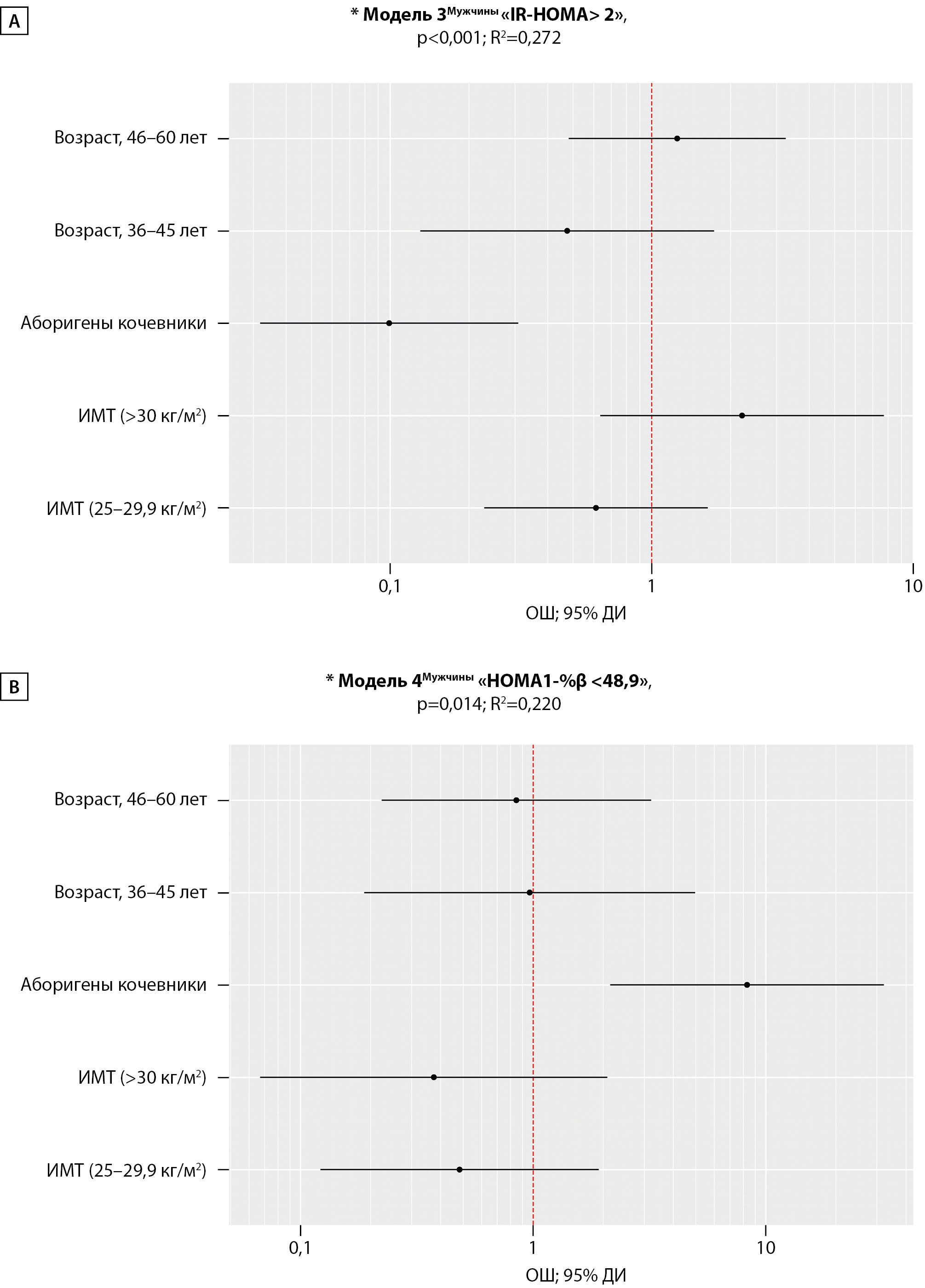
Рисунок 3. Оценка отношения шансов для предикторов (образ жизни, пол, возраст, ИМТ) показателя «IR-HOMA> 2» (А) и «HOMA1-%β <48,9» (В) среди мужчин.
Примечание: *Основные характеристики регрессионных моделей, р<0,05 — статистическая значимость и коэффициент детерминации.
А — «ОЖ, кочевники», ОШ; 95% ДИ (0,10; 0,03 – 0,31), р<0,001.
B — «ОЖ, кочевники», ОШ; 95% ДИ (8,3; 2,15 – 32,17), р=0,002.
Инсулинорезистентность и секреторная активность β-клетки у женщин (рис. 4)
Величина индекса IR-HOMA у коренных жительниц Арктики не различалась относительно ОЖ: 1,76 [ 0,88–3,28] усл.ед. в группе КА и 1,68 [ 0,90–2,88] усл.ед. в группе ОА, р=0,727. Fβ была высокая и также не различалась у КА относительно ОА; индекс HOMA1-%β составил 188,65 [ 97,57–412,79]% и 156,43 [ 98,47–365,51]%, р=0,697 соответственно.
Регрессионные Модели 5 и 6 (n=284), построенные с целью оценки ОШ изучаемых предикторов на «IR-HOMA>2» и «HOMA1-%β <48,9», не были статистически значимыми, (рис. 4). Значимое влияние на величину «IR-HOMA>2» у женщин имелось только у категории «возраст, шкала» — ОШ; 95%ДИ (2,36; 1,22–4,57), р=0,010. Скорректированные шансы наличия у них IR оказались в 2,4 раза выше в возрасте 35–45 лет вне зависимости от OЖ. Влияния изучаемых предикторов на наличие «HOMA1-%β <48,9» у женщин не выявлено.
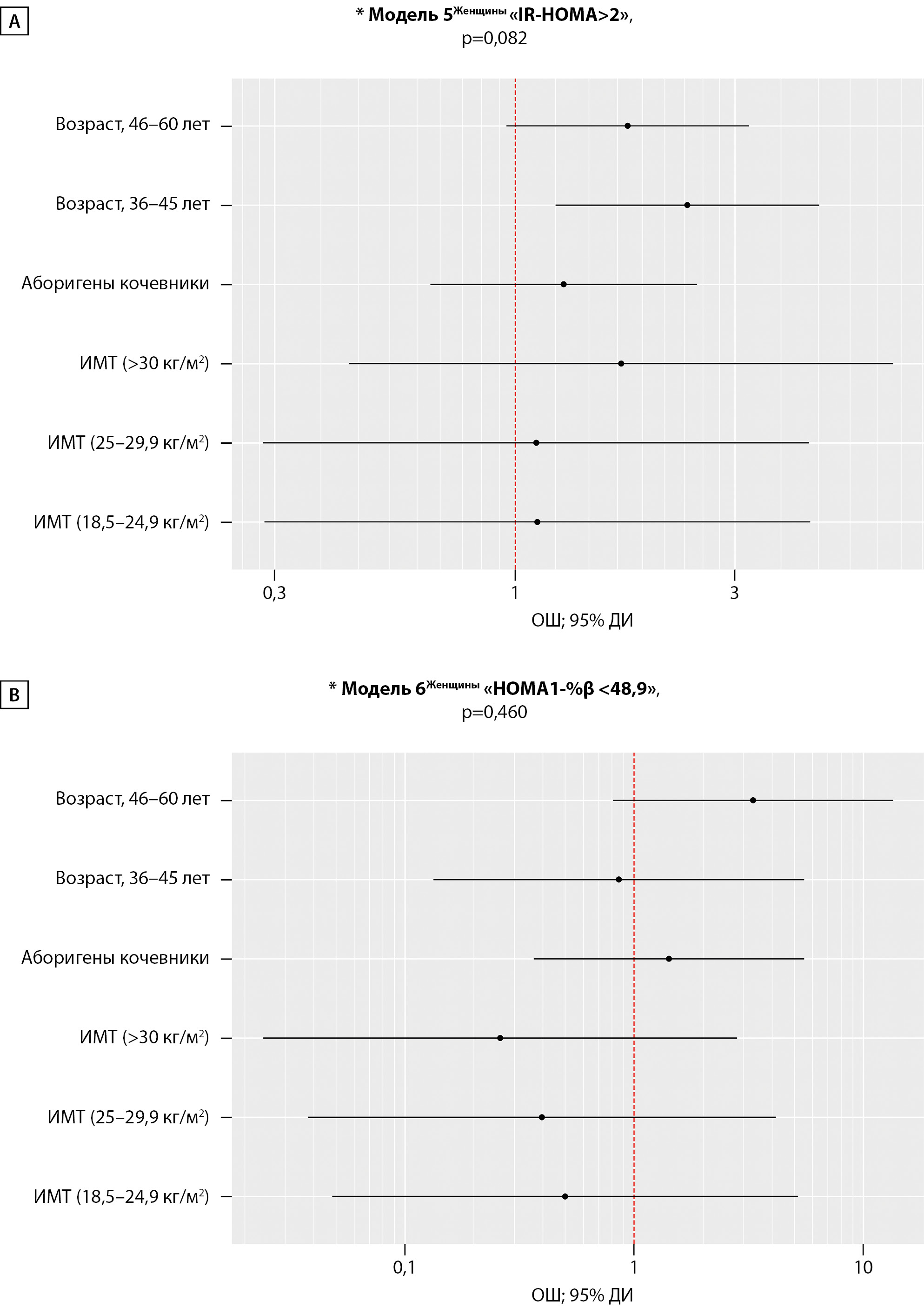
Рисунок 4. Оценка отношения шансов для предикторов (образ жизни, пол, возраст, ИМТ) показателя «IR-HOMA> 2» (А) и «HOMA1-%β <48,9» (В) среди женщин.
Примечание: *Основные характеристики регрессионных моделей, р<0,05 — статистическая значимость и коэффициент детерминации.
А — «Возраст, 35-45 лет»; ОШ; 95% ДИ (2,37; 1,22 – 4,57), р=0,010.
Инсулинорезистентность и секреторная активность β-клетки при гликемии ≥5,6 ммоль/л (рис. 5)
Последним этапом работы был анализ случаев «IR-HOMA>2» и «HOMA1-%β <48,9» при гликемии ≥5,6 ммоль/л (n=56) как одного из критериев метаболического синдрома (AHA/NHBLI, 2009 г.). Частота случаев Глю≥5,6 ммоль/л оказалась сходной с учетом численности изучаемых популяций: у КА — 12 (13,5%), в группе ОА — 44 (14,3%), табл. 2. Медиана индекса IR-HOMA у КА с Глю≥5,6 ммоль/л составила 1,57 [ 1,04–1,82] усл.ед.; у ОА значимо выше — 3,02 [ 2,27–5,70], р<0,001; как и величина индекса HOMA%β — 45,15 [ 35,36–63,92]% у КА в сравнении с ОА — 88,12 [ 67,96–146,34] %, р=0,002. Таким образом, шансы наличия IR у КА с уровнем Глю≥5,6 ммоль/л оказались в 15,86 раза ниже по сравнению с группой ОА (95% ДИ: 3,41–73,69; p<0,001). Тогда как шансы наличия гипоFβ у КА с аналогичной Глю были в 20 раз выше по сравнению с ОА (ОШ=0,05; 95% ДИ: 0,01–0,24; p<0,001).
При сравнении ИМТ (M±SD (95% ДИ)) у этих лиц выявлены значимые различия (р=0,006). В группе КА ИМТ оказался существенно ниже, чем у ОА: 25,16±2,86 (23,34–26,97) и 29,57±5,13 (28,01–31,13) кг/м2, р=0,006. У КА не было случаев ожирения у лиц с Глю≥5,6 ммоль/л, и шансы его наличия при этих условиях были в 27,33 раза ниже по сравнению ОА, (95% ДИ: 1,52–490, р<0,001), рис. 5.
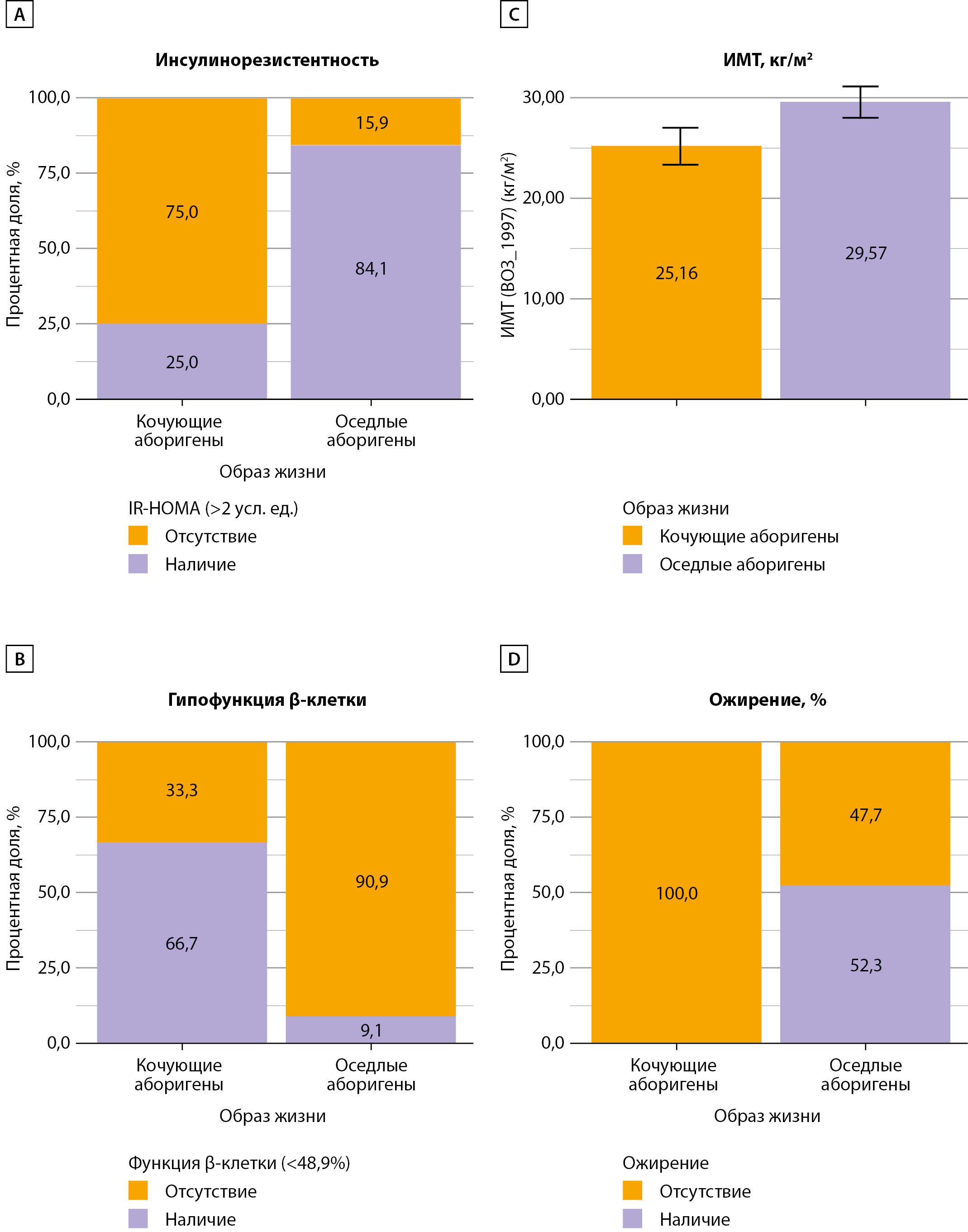
Рисунок 5. Соотношение случаев инсулинорезистентности и гипофункции β-клетки при гликемии ≥ 5,6 ммоль/л у кочующих и оседлых аборигенов с анализом ИМТ.
Примечание: А, В, С — данные представлены в %, D — M±SD.
А — «IR-HOMA> 2» усл. ед. выявлена у 3-х КА (25%) и у 37 (84,1%) ОА, p<0,001;
В — «HOMA1-%β<48,9», % – у 8 (66,7%) КА и у 4 (9,1 %) ОА, р<0,001;
С — ИМТ, кг/м2, р=0,006;
D — Отсутствие ожирения у 12 КА, наличие у 23(52,3%) из 44 ОА, %, p<0,001.
Обсуждение
Репрезентативность выборок
Выборка представлена преимущественно ненцами — древнейшей из ныне проживающих групп коренного населения Арктики. Ненцы считаются самым многочисленным малым народом России; срок обитания в Европейском Заполярье — несколько тысячелетий. Коми (зыряне) не относятся к малым народам, проживают на территории Арктики несколько столетий. Участники были отобраны случайным образом зимне-весенними экспедициями, составили 2,15% от численности, аналогичной по возрасту популяции коренного сельского оседлого и кочующего населения этих территорий (согласно Всероссийской переписи 2010 г.), что соответствует критериям репрезентативности выборки, трактуется как исследование повышенной точности, с величиной допускаемой ошибки 5% по методике определения объема выборки К.А. Отдельновой, В.И. Паниотто и N. Fox. [18]. Отсутствие равновесия по полу в группе ОА связано с нежеланием обследоваться мужчин ОА. Малочисленность КА обусловлена отдаленностью стоянок от пунктов обследования.
Сопоставление с другими публикациями
Опубликовано много работ, посвященных особенностям метаболизма, в том числе исторически минимизированному углеводному обмену у коренных жителей Арктики. Данные об уровне гликемии разнятся [9][19][20], но, как правило, свидетельствуют о том, что до эпохи «метаболической пандемии» на фоне многовекового традиционного уклада жизни показатели соответствовали 1 и 2 квартилю референсных значений, т.е. низко-нормальным [6, 10]. Некоторые исследователи отмечали, что аборигенам свойственна тенденция к гипогликемии без ее клинических проявлений [10]. Мы также выявили 6 (1,5%) случаев недиабетической гипогликемии (<3,0 ммоль/л) и только среди ОА.
Более поздние публикации сообщают о нивелировании разницы в уровне глюкозы плазмы (сыворотки) у жителей Заполярья от среднеширотной нормы, появлении и росте в популяциях ожирения и СД [4][5][12][13][21][22]. Также отмечено, что имеется цикличная трансформация метаболических процессов как минимум в рамках годичного ритма экстремальных климатогеографических факторов Крайнего Севера [23]. Поэтому в нашем исследовании мы представляем результаты только зимне-весеннего периода.
Полученные нами данные об уровне Глю 4,6 ммоль/л по медиане, равнозначные у КА и ОА, свидетельствуют, что у половины выборки показатели гликемии соответствуют порогу (>4,44 ммоль/л), при котором предполагается физиологическая реакция организма в виде повышения секреции Инс, стимуляции захвата Глю тканями, усиления гликогенеза в печени и мышцах, липогенеза в липоцитах как защита от гипергликемии [24].
Вместе с тем мы обнаружили, что кочевники в меньшей степени наращивают уровень Инс по сравнению с ОА, и демонстрируют отсутствие линейной зависимости между уровнем Глю и Инс (рис. 1А). По данным литературы, для аборигенов Арктики, сохраняющих традиционный ОЖ, характерна способность осуществлять обменные процессы при пониженной нагрузке на β-клетки [25–27]. Исследования же последних лет, тем не менее, сообщают о росте инсулинемии у аборигенов Арктики [28][29], что согласуется и с нашими данными (рис. 1Б). В нашем исследовании гиперинсулинемия отмечена у 26 (6,5%) человек, без статистической разницы между группами. Для выборки в целом характерны невысокие показатели Инс, но на 27% статистически ниже уровень Инс оказался у кочевников — 6,04 [ 3,49–11,80] мкЕд/мл при идентичной с ОА гликемии, отсутствии различий в ИМТ и возрасте.
Повышение уровня Инс в популяциях жителей Севера сопряжено с ростом резистентности к Инс и ассоциированных состояниях/заболеваниях [4][28][29]. В нашей работе мы также отмечаем, что смена уклада жизни ассоциируется с потерей чувствительности к Инс.
Однако нам не встретилось работ, посвященных анализу чувствительности к Инс с одновременной оценкой секреторных возможностей β-клетки в популяциях аборигенов Арктики. Вместе с тем доказательства не только «сдержанной» работы инсулярного аппарата, но и эпизодов «секреторного бессилия» или транзиторной стресс-обусловленной гипофункции β-клетки у жителей Крайнего Севера известны давно.
Так, в 1928 г. Р. Heinbecker [9] описал гликемию, глюкозурию и кетонемию у 7 эскимосов Канады на фоне углеводной нагрузки при традиционном питании (n=4) и после 82-часового голодания (n=3). Им была дана характеристика пищевого рациона аборигенов, показавшая существенное превалирование белково-липидного компонента: 60% (280 г) — белок, 29% (135 г) — жир и 11% (54 г) — углеводы, т.е. 2551 ккал/сут. при средней массе тела женщин 50–60 кг, мужчин 60–70 кг. При этом уровни Глю натощак у обследованных оказались выше среднеширотных ~100–120 мг/дл (5,55–6,66 ммоль/л). В ходе нагрузки Глю (2 г/кг) при привычном пищевом поведении эскимосы демонстрировали высокую толерантность к углеводам с максимальным подъемом Глю до ~140 мг/дл (7,77 ммоль/л) на первом из 4 часов теста, без сопутствующей глюкозурии, с плавной нормализацией Глю до уровней натощак и ниже ~ 80–100 мг/дл (4,44–,55 ммоль/л), но не до гипогликемии. Данные аналогичной нагрузки, но после 82-часового голодания оказалась более интересными: эскимосы, в популяциях которых до 50-х годов прошлого столетия не было случаев заболевания СД, продемонстрировали 3-кратное повышение Глю на первых часах теста (~300 мг/дл или 16,65 ммоль/л) с сопутствующей глюкозурией, сохраняющейся до 10–43 часов и более 25-часовым шлейфом гипергликемии. Были изучены уровни кетонурии, азотемии и показатели основного обмена аборигенов. Ученый сделал выводы об исключительной адаптивной способности к полному окислению жиров, высокой чувствительности к углеводам при традиционном питании с утратой толерантности к углеводам на фоне голода; «мягкой» склонности к голодному кетозу и антикетогенных эффектах белкового рациона. Он показал, что метаболизм эскимосов в состоянии покоя на 33% выше, чем у жителей средних широт. Таким образом, в 1928 г. впервые был индуцирован (острой массивной нагрузкой углеводами в условиях голодного стресса) и продемонстрирован обратимый транзиторный СД у коренного жителя Арктики. Разумное «отступление» β-клетки не явилось «поражением», т.к. сдержало развитие компенсаторной гиперинсулинемии и инсулинорезистентности с целью сохранения возможности «легкого» окисления жиров, а главное — «трудного» глицеринового и белкового глюконеогенеза.
В дальнейшем Л.Е. Панин (1978 г.), исследователь Азиатской Арктики, автор концепции «полярного метаболического типа», описал «функциональный транзиторный, экологически обусловленный диабет напряжения» у жителей Крайнего Севера, отметив в целом популяционную склонность аборигенов к низко-нормальной гликемии [6][7]. Предпосылки к развитию подобного диабета с низкими концентрациями инсулина он объяснил, в первую очередь, контринсулярным действием высоких относительно средних широт уровней стероидов надпочечников и катехоламинов, обеспечивающих термогенез [6][7]. Во-вторых, он считал, что белок аполипопротеин В (апоВ), входящий в структуру ЛПНП и ЛПОНП, уровень которых, как правило, высок у аборигенов, подавляет синтез и секрецию инсулина [7]. Третьей причиной, противостоящей развитию гиперинсулинемии и способствующей выявлению диабета, по его мнению, явилось эпизодическое снижение реабсорбции глюкозы из первичной мочи [7]. Л.Е. Панин описал феномен транзиторной глюкозурии у жителей Крайнего Севера не только в состоянии легкой гипергликемии, но и при эугликемии, и даже при низко-нормальном уровне гликемии как адаптивный механизм, способствующий поддержанию гипоинсулинемии в периоды стресса и сезонных гормонально-метаболических перестроек, т.е. при необходимости торможения гликолиза и повышении потребности в утилизации жиров в качестве основного источника энергии, задолго до понимания роли ингибиторов натрий-глюкозных ко-транспортеров (SGLT2) в терапии СД и сердечной недостаточности. Можно предположить, что коренные жители Арктики, сохраняющие низко-нормальный уровень Инс, способны к модуляции порога реабсорбции Глю в почках как защите от гиперинсулинемии. Не исключено, что «особая вовлеченность» SGLT2 в энергетический баланс может быть дополнительным ресурсом, обеспечивающим низкие кардиометаболические риски в условиях сохранения традиционного уклада жизни.
В нашем исследовании совместный анализ индексов HOMA-IR и HOMA1-%β выявил случаи «сдерживания» секреторной активности β-клетки преимущественно в группе КА мужчин. Так, 71% КА и 89% мужчин кочевников продемонстрировали отсутствие инсулинорезистентности, при этом у 17% КА и у 27% мужчин КА выявлена гипофункция β-клетки. В группе ОА, наоборот, нарастало число лиц с инсулинорезистентностью — 44% (49% мужчин, 43% женщин) при сохранении секреторной активности β-клетки у 95% респондентов вне зависимости от пола. Образ жизни стал независимым предиктором, влияющим на число случаев гипофункции β-клетки и резистентности к инсулину.
Известно, что метаболизм коренного жителя Крайнего Севера филогенетически настроен на эффективное окисление ЖК. Этому способствует приверженность к традиционному питанию и необходимость адаптации к холоду [30]. Жирные кислоты не только активно окисляются в бурой и бежевой жировой ткани, но и в мышечной. При высокой доступности ЖК они конкурируют с глюкозой и ингибируют ее утилизацию в мышцах (Randle P.J., 1964 г.). Согласно первичной гипотезе Рэндла, увеличение метаболизма жирных кислот приводит к увеличению содержания интрамитохондриального КоА, снижению соотношения (НАДН)/НАД+ с последующим ингибированием пируватдегидрогеназы. Внутриклеточное увеличение концентрации цитрата в митохондриях (и цитозоле) аллостерически ингибирует фосфофруктокиназу, контролирующую гликолиз. Последующее накопление глюкозо-6-фосфата ингибирует активность гексокиназы II, что приводит к увеличению содержания Глю в клетке, «запиранию» и снижению поглощения Глю, которая в условиях преимущественного окисления жиров может без проблем проникать в кровоток и расходоваться мозгом. Ключевым требованием этого процесса являлось низкое содержание инсулина [31]. Таким образом, Рендл описал механизм повышения уровня гликемии в крови при низком уровне инсулина в условиях преимущественного окисления жиров in vitro, а Р. Heinbecker в начале прошлого века при обследовании инуитов Канады, выявив у них на исключительно белково-жировом питании относительную гипергликемию натощак, подтвердил это in vivo [17].
Возможно, одной из причин разночтений в уровне гликемии у коренных жителей Арктики прошлого столетия может быть разница в типе, режиме приема и количестве углеводов, постепенно проникавших в рацион, и, таким образом, более отчетливая конкуренция между глюкозой и жирными кислотами за окисление в мышечной ткани, чувствительной к транзиторному повышению инсулина.
При перманентном повышении количества инсулина (модель менее чувствительного к инсулину оседлого аборигена), в ситуации доступности обилия жирных кислот, как с пищей, так и за счет абдоминального липолиза при метаболическом синдроме, а также снижении трат на поддержание термогенеза [30] (как сократительного, так и несократительного), классический цикл Рэндла нарушается. Основной эффект жирных кислот в данном случае состоит в снижении транспорта глюкозы в мышечную в клетку, что доказано уменьшением скорости накопления внутриклеточной глюкозы и гликогена с помощью 13С и 31Р ядерно-магнитной-резонансной спектроскопии [31]. В эксперименте у здоровых лиц острое увеличение СЖК, достигнутое с помощью инфузии эмульсии триглицеридов и гепарина натрия (для активации липопротеинлипазы), приводило к падению внутриклеточных концентраций глюкозы и глюкозо-6-фосфата, предшествующих падению накопления гликогена [31]. Эти результаты не столько оспаривают гипотезу Рэндла, которая предсказывает увеличение концентраций внутриклеточного глюкозо-6-фосфата как основу «снижения» чувствительности к инсулину (повышения гликемии), сколько показывают, что в условиях иного гормонального обеспечения (гиперинсулинемии) и пищевого поведения аналогичная концентрация глюкозы в крови достигается в ходе разных метаболических механизмов. Подобное снижение транспорта глюкозы наблюдают у пациентов с СД2 и у части потомков больных СД2 с нормогликемией и инсулинорезистентностью [31].
В нашем исследовании мы показали два механизма развития гипергликемии в зависимости от образа жизни: у кочевников, преимущественно мужчин (т.е. лиц с большей относительно женщин мышечной массой, и длительнее в сравнение с ОА подвергающихся холодовому воздействию [30]) — за счет торможения секреторной активности β-клетки, а у оседлых — вследствие нарастания резистентности к инсулину. Мы не можем высказываться о стойкости этих изменений в силу дизайна исследования. Однако предположить, что в ряде случаев, на фоне стресса, в том числе пищевого, инфекции и прочее, транзиторный физиологический инсулинопенический синдром может трансформироваться в перманентный, возможно.
Нами также показано, что у женщин образ жизни не стал предиктором ни низкой секреторной активности β-клетки, ни резистентности к инсулину. Зависимость отмечена от возраста, что согласуется с данными популяционных исследований [32]. Интересным, на наш взгляд, оказался факт, что 35–46-летние женщины более резистентны к инсулину, чем представительницы старшего поколения аборигенов, вне зависимости от образа жизни, что может косвенно свидетельствовать о былом метаболическом благополучии жителей Крайнего Севера и согласуется с мировыми тенденциями «омоложения» ожирения и метаболического синдрома [33].
Клиническая значимость результатов
Заключается в демонстрации двух разных механизмов формирования нарушений углеводного обмена у коренного населения Крайнего Севера. Так, у аборигенов оленеводов мужчин чаще развивается «транзиторный инсулинопенический диабет напряжения», его следует изучать в аспекте адаптации — дезадаптации и возможной трансформации в СД 1 типа; дифференцировать с СД1 (LADA). У оседлых аборигенов гипергликемия, как правило, обусловлена повышением резистентности к инсулину и требует мер по профилактике метаболического синдрома и СД2.
Ограничения исследования
Ограничением исследования была неравномерность выборки с существенным преобладанием женщин оседлого образа жизни; поэтапный сбор материала — несколькими экспедициями в течение 10 лет, отсутствие возможности использовать для анализа компьютерною версию оценки Fβ и IR модель — HOMA2 (www.OCDEM.ox.ac.uk ), недостаточная мощность выборки для выявления случаев интолерантности к глюкозе и СД.
Направления дальнейших исследований
Планируем оценить содержание проинсулина, С-пептида, лактата, пирувата, спектра жирных кислот в этой популяции и оценить их относительно характера питания аборигенов на современном этапе.
Заключение
Сохранение кочевого образа жизни способствует удержанию более низкой концентрации инсулина. Сходные уровни глюкозы в группах обусловлены у КА, преимущественно мужчин, высокой долей лиц с низкой секреторной активностью β-клетки, тогда как ОА более резистентны к инсулину. Анализ случаев с гликемией ≥5,6 ммоль/л подтвердил генез гипергликемии у КА за счет гипофункции β-клетки с отсутствием случаев ожирения; у ОА — вследствие снижения чувствительности к инсулину, ассоциированным с развитием ожирения.
Дополнительная информация
Источники финансирования. Исследование выполнено в соответствии с планом ФНИР по теме «Эндокринное обеспечение и характер питания в формировании адаптивных изменений в липидном обмене у различных групп населения Арктики на современном этапе» (гос. задание ФГБУН ФИЦКИА УрО РАН; рег. №НИОКТР 122011800399-2).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Стрелкова А.В. — концепция, дизайн, анализ и интерпретация результатов, написание статьи; Бичкаева Ф.А. — получение, анализ данных, внесение в рукопись существенной правки с целью повышения научной ценности статьи; Власова О.С. — интерпретация данных, внесение в рукопись существенной правки с целью повышения научной ценности статьи; Нестерова Е.В.— получение данных; Шенгоф Б.А. — получение данных; Грецкая Т.Б. — получение данных. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Глобальный доклад по диабету. Женева: Всемирная организация здравоохранения; 2018. Лицензия: CC BY-NC-SA 3.0 IGO
2. Дедов И.И., Шестакова М.В., Викулова О.К., и др. Сахарный диабет в Российской Федерации: динамика эпидемиологических показателей по данным Федерального регистра сахарного диабета за период 2010–2022 гг. // Сахарный диабет. — 2023. — Т. 26. — №2. — С. 104-123. doi: https://doi.org/10.14341/DM13035
3. Дедов И.И., Ткачук В.А., Гусев Н.Б., и др. Сахарный диабет 2 типа и метаболический синдром: молекулярные механизмы, ключевые сигнальные пути и определение биомишеней для новых лекарственных средств // Сахарный диабет. — 2018. — Т. 21. — №5. — С. 364-375 doi: https://doi.org/10.14341/DM9730
4. Севостьянова Е.В. Особенности липидного и углеводного метаболизма человека на Севере (литературный обзор) // Бюллетень сибирской медицины. — 2013. — Т.12. — №1. — С. 93-100 doi: https://doi.org/10.20538/1682-0363-2013-1-
5. Bjerregaard P, Young TK, Hegele RA. Low incidence of cardiovascular disease among the Inuit—what is the evidence? Atherosclerosis. 2003;166(2):351-357. doi: https://doi.org/10.1016/S0021-9150(02)00364-7
6. Сборник тезисов III Всесоюзной конференции «Адаптация человека в различных климато-географических и производственных условиях». Том 1
7. Панин Л.Е. Фундаментальные проблемы приполярной и арктической медицины // Сибирский научный медицинский журнал. — 2013. — Т. 33. — №6. — С. 5-10
8. Козлов А.И. Связанные с потреблением углеводных продуктов нутрициологические и генетические риски развития ожирения у коренных северян // Вопросы питания. — 2019. — Т. 88. — №1.— С. 5-16 doi: https://doi.org/10.24411/0042-8833-2019-10001
9. Heinbecker P. Studies on the metabolism of Eskimos. Journal of Biological Chemistry. 1928;80: 461-475 doi: https://doi.org/10.1016/S0021-9258(18)83867-4
10. Бойко Е.Р. Физико-биохимические основы жизнедеятельности человека на Севере. Екатеринбург: УрО РАН, 2005
11. Бичкаева Ф.А., Коваленко Т.Б., Бичкаев А.А., и др. Возрастные изменения уровня глюкозы, проинсулина и инсулина в крови у жителей российской Арктики // Экология человека. 2021. — №4. — С. 30-39 doi: https://doi.org/10.33396/1728-0869-2021-4-30-39
12. Rønn PF, Andersen, GS, Lauritzen T, et al. Abdominal visceral and subcutaneous adipose tissue and associations with cardiometabolic risk in Inuit, Africans and Europeans: a cross-sectional study. BMJ open. 2020;10(9): e038071. doi: https://doi.org/10.1136/bmjopen-2020-038071
13. Тихонова Н. А. и др. Анализ заболеваемости населения Арктической зоны Российской Федерации сахарным диабетом // Здоровье — основа человеческого потенциала: проблемы и пути их решения. — 2020. — Т. 15. — №. 1. — С. 624-631.
14. Matthews DR, Hosker JP, Rudenski AS, et al. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia. 1985;28(7):412-419. doi: https://doi.org/10.1007/BF00280883
15. Hermans MP, Levy JC, Morris RJ, Turner RC. Comparison of tests of beta-cell function across a range of glucose tolerance from normal to diabetes. Diabetes September. 1999;48(9):1779-1786. doi: https://doi.org/10.2337/diabetes.48.9.1779
16. Wallace TM, Levy JC, Matthews DR. Use and abuse of HOMA modeling. Diabetes care. 2004;27(6):1487-1495. doi: https://doi.org/10.2337/diacare.27.6.1487
17. Калев О.Ф., Калева Н.Г., Яшин Д.А. Качество здоровья человека // Современные проблемы науки и образования. — 2016. — №4 doi: https://doi.org/10.17513/spno.25004
18. Наркевич А.Н., Виноградов К.А. Методы определения минимально необходимого объема выборки в медицинских исследованиях // Социальные аспекты здоровья населения. — 2019. — Т. 6. — №65. — С. 10
19. Bell RR, Draper HH, Bergan JG. Sucrose, lactose, and glucose tolerance in northern Alaskan Eskimos. The American Journal of Clinical Nutrition. 1973;26(11)1185-1190. doi: https://doi.org/10.1093/ajcn/26.11.1185
20. Feldman SA, Rubenstein, AH, Ho K-J, et al. Carbohydrate and lipid metabolism in the Alaskan Arctic Eskimo. The American journal of clinical nutrition. 1975;28(6):588-594. doi: https://doi.org/10.1093/ajcn/28.6.588
21. Ebbesson SO, Risica PM, Ebbesson LO, et al. Omega-3 fatty acids improve glucose tolerance and components of the metabolic syndrome in Alaskan Eskimos: the Alaska Siberia project. International Journal of Circumpolar Health. 2005;64(4):396-408. doi: https://doi.org/10.3402/ijch.v64i4.18016
22. Boyer BB, Mohatt GV, Plaetke R, et al. Metabolic syndrome in Yup’ik Eskimos: the center for alaska native health research (CANHR) study. Obesity. 2007;15(11):2535-2540. doi: https://doi.org/10.1038/oby.2007.302
23. Кочан Т.И. Закономерности изменения показателей углеводного обмена в организме человека в зависимости от природных факторов Севера // Экология человека. — 2006. — №10. — С. 3-7
24. Переверзев В.А., Вэлком М.О., Масторакис Н., Переверзева Е.В. Нормогликемия натощак (в покое и при функциональной активности): классификация, показатели // Вестник Смоленской государственной медицинской академии. — 2015. — Т. 14. — №3. — С. 74-84
25. Schraer CD, Risica PM, Ebbesson SO, et al. Low fasting insulin levels in Eskimos compared to American Indians: are Eskimos less insulin resistant? Int J Circumpolar Health. 1999;58(4):272-280
26. Догадин С.А., Ноздрачев К.Г., Крижановская Е.В., Манчук В.Т. Содержание инсулина, С-пептида и кортизола в динамике теста толерантности к глюкозе у коренных и пришлых жителей Крайнего Севера // Проблемы эндокринологии. — 1997. — Т. 43. — №2. — С.7-10 doi: https://doi.org/10.14341/probl19974327-10
27. Рябова Т.И., Попова Т.В., Сиротин Б.З. Инсулинорезистентность у коренного (эвены, ульчи, нанайцы) и пришлого населения Хабаровского края // Дальневосточный медицинский журнал. — 2012. — №4. — С. 12-14
28. Goropashnaya AV, Herron J, Sexton M, et al. Relationships between plasma adiponectin and body fat distribution, insulin sensitivity, and plasma lipoproteins in Alaskan Yup’ik Eskimos: the Center for Alaska Native Health Research study. Metabolism. 2009;58(1):22-29. doi: https://doi.org/10.1016/j.metabol.2008.09.002
29. Потеряева О.Н., Осипова Л.П., Русских Г.С., и др. Анализ содержания инсулина, кортизола и глюкозы в сыворотке крови поселковых жителей ямало-ненецкого автономного округа // Физиология человека. — 2017. — Т. 43. — №6. — С.103-108
30. Салтыкова М.М. Основные физиологические механизмы адаптации человека к холоду // Российский физиологический журнал им. И.М. Сеченова. — 2017. — Т. 103. — №2. — С. 138-151
31. Эндокринология по Вильямсу. Сахарный диабет и нарушения углеводного обмена. Кроненберг ГМ [и др.]; пер. с англ. под ред. И.И. Дедова, Г.А. Мельниченко. — Москва: Рид Элсивер. 2010:436
32. Gayoso-Diz P, Otero-González A, Rodriguez-Alvarez MX, et al. Insulin resistance (HOMA-IR) cut-off values and the metabolic syndrome in a general adult population: effect of gender and age: EPIRCE cross-sectional study. BMC Endocr Disord. 2013;13(1):1-10. doi: https://doi.org/10.1186/1472-6823-13-47
33. Orsini F, D’Ambrosio F, Scardigno A, et al. Epidemiological Impact of Metabolic Syndrome in Overweight and Obese European Children and Adolescents: A Systematic Literature Review. Nutrients. 2023;15(18):3895. doi: https://doi.org/10.3390/nu15183895
Об авторах
А. В. СтрелковаРоссия
Стрелкова Александра Витальевна - к.м.н.; Scopus Author ID: 57205296550.
163020, Архангельск, проспект Никольский, д. 20
Конфликт интересов:
Декларирую отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Ф. А. Бичкаева
Россия
Бичкаева Фатима Артемовна - д.б.н.
Архангельск
Конфликт интересов:
Декларирую отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
О. С. Власова
Россия
Власова Ольга Сергеевна - к.б.н.
Архангельск
Конфликт интересов:
Декларирую отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Е. В. Нестерова
Россия
Нестерова Екатерина Васильевна
Архангельск
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Б. А. Шенгоф
Россия
Шенгоф Борис Александрович
Архангельск
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Т. Б. Грецкая
Россия
Грецкая Татьяна Борисовна - к.б.н.
Архангельск
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Дополнительные файлы
|
|
1. Рисунок 1. Графики, демонстрирующие отсутствие (А) и наличие (В) линейной зависимости инсулина от глюкозы у аборигенов с разным образом жизни. | |
| Тема | ||
| Тип | Research Instrument | |
Посмотреть
(311KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Оценка отношения шансов для предикторов (образ жизни, пол, возраст, ИМТ) показателя «IR-HOMA> 2» (А) и «HOMA1-%β <48,9» (В) у аборигенов Арктики. | |
| Тема | ||
| Тип | Research Instrument | |
Посмотреть
(422KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Оценка отношения шансов для предикторов (образ жизни, пол, возраст, ИМТ) показателя «IR-HOMA> 2» (А) и «HOMA1-%β <48,9» (В) среди мужчин. | |
| Тема | ||
| Тип | Research Instrument | |
Посмотреть
(384KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Оценка отношения шансов для предикторов (образ жизни, пол, возраст, ИМТ) показателя «IR-HOMA> 2» (А) и «HOMA1-%β <48,9» (В) среди женщин. | |
| Тема | ||
| Тип | Research Instrument | |
Посмотреть
(400KB)
|
Метаданные ▾ | |
|
|
5. Рисунок 5. Соотношение случаев инсулинорезистентности и гипофункции β-клетки при гликемии ≥ 5,6 ммоль/л у кочующих и оседлых аборигенов с анализом ИМТ | |
| Тема | ||
| Тип | Research Instrument | |
Посмотреть
(460KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Стрелкова А.В., Бичкаева Ф.А., Власова О.С., Нестерова Е.В., Шенгоф Б.А., Грецкая Т.Б. Уровни инсулина, гликемии, резистентности к инсулину и функциональной активности β-клетки при различном образе жизни коренного жителя Арктики. Есть ли предпосылки к развитию сахарного диабета и какого? Проблемы Эндокринологии. 2024;70(5):54-69. https://doi.org/10.14341/probl13411
For citation:
Strelkova A.V., Bichkaeva F.A., Vlasova O.S., Nesterova E.V., Shengof B.A., Gretskaya T.B. Insulin level, glycemia, insulin resistance and β-cell function in relation to the lifestyle of Arctic indigenous people. Are there conditions for diabetes and which type? Problems of Endocrinology. 2024;70(5):54-69. (In Russ.) https://doi.org/10.14341/probl13411

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).









































.jpg)


