Перейти к:
Тактика ведения первичного гиперпаратиреоза c редкой локализацией эктопированного образования околощитовидной железы
https://doi.org/10.14341/probl13425
Аннотация
Эктопическое расположение образований околощитовидных желез (ОЩЖ) у пациентов с первичным гиперпаратиреозом (ПГПТ) может затруднять проведение топической диагностики заболевания. Мы представляем клинический случай ПГПТ у пациентки 84 лет, обусловленный эктопированной аденомой ОЩЖ, локализованной позади правой внутренней яремной вены в проекции правой поднижнечелюстной слюнной железы. Отсутствие визуализации опухоли в течение длительного времени и высокий риск осложнений хирургического вмешательства требовали подбора консервативного лечения для контроля гиперкальциемии и коррекции осложнений ПГПТ. Ввиду тяжелого остеопороза и сопутствующей недостаточности витамина D к терапии деносумабом добавлен колекальциферол в насыщающих дозах под динамическим контролем показателей фосфорно-кальциевого обмена, что позволило достичь значимого снижения уровня ПТГ при сохранении нормокальциемии.
Ключевые слова
Для цитирования:
Абойшева Е.А., Авсиевич Е.С., Корчагина М.О., Дегтярев М.В., Бибик Е.Е., Бельцевич Д.Г., Пигарова Е.А., Шеремета М.С. Тактика ведения первичного гиперпаратиреоза c редкой локализацией эктопированного образования околощитовидной железы. Проблемы Эндокринологии. 2025;71(1):20-26. https://doi.org/10.14341/probl13425
For citation:
Aboisheva E.A., Avsievich E.S., Korchagina M.O., Degtyarev M.V., Bibik E.E., Beltsevich D.G., Pigarova E.A., Sheremeta M.S. Management of primary hyperparathyroidism with rare localization of ectopic adenoma parathyroid gland. Problems of Endocrinology. 2025;71(1):20-26. (In Russ.) https://doi.org/10.14341/probl13425
АКТУАЛЬНОСТЬ
Первичный гиперпаратиреоз (ПГПТ) — эндокринное заболевание, характеризующееся избыточной секрецией паратиреоидного гормона (ПТГ) при верхне-нормальном или повышенном уровне кальция крови вследствие первичной патологии околощитовидных желез (ОЩЖ). Гиперпаратиреоз относится к одной из наиболее распространенных эндокринопатий, занимая третье место после сахарного диабета (СД) и заболеваний щитовидной железы (ЩЖ). В общей популяции распространенность ПГПТ составляет в среднем около 0,86–1%. [1]. Согласно данным Российского регистра пациентов с ПГПТ, выявляемость этого заболевания в Российской Федерации составляет 1,3 на 100 тыс. населения [2].
В результате нарушения регуляции и чрезмерной секреции ПТГ одной или несколькими патологически измененными ОЩЖ происходит повышение уровня кальция (Са) крови. Это обусловлено усилением его реабсорбции в почечных канальцах, стимуляцией опосредованной остеокластами резорбции кости и увеличением почечного синтеза 1,25(OH)2D3, который в свою очередь способствует усилению всасывания Са и фосфатов в кишечнике. Классические проявления ПГПТ, как правило, выражаются в поражении костной системы и почек, при этом у пациентов наблюдаются снижение минеральной плотности костной ткани (МПК), низкоэнергетические переломы, нефролитиаз, нефрокальциноз, в ряде случаев — развитие хронической почечной недостаточности [3].
ПГПТ может быть компонентом наследственных синдромов, таких как синдромы множественных эндокринных неоплазий 1, 2А и 4 типов и синдром гиперпаратиреоза с опухолью челюсти (hyperparathyroidism-jaw tumor syndrome — HPT-JT), но чаще является изолированным спорадическим заболеванием [4].
В 80–90% наблюдений причиной спорадического ПГПТ становится солитарная аденома ОЩЖ, реже — полигландулярное поражение или изменение ткани железы злокачественного характера (в 10–15% — гиперплазия четырех ОЩЖ, в 5% — множественные аденомы и менее чем в 1% случаев — рак ОЩЖ) [5].
У человека обычно присутствует 4 парные ОЩЖ (2 верхние и 2 нижние), примерно у 10% населения эмбрионально развиваются только 2–3 железы, у 5% отмечается 5 и более ОЩЖ. Наибольшее количество ОЩЖ, по данным секционных исследований, достигает 12 [6][7].
Верхние ОЩЖ берут начало из четвертого глоточного кармана, в процессе эмбрионального развития опускаются вместе с ЩЖ и в итоге остаются возле перстнещитовидного хряща, позади ЩЖ и возвратного гортанного нерва. Нижние ОЩЖ развиваются из третьего глоточного кармана, опускаются вместе с тимусом и к моменту рождения обычно находятся вблизи нижней границы ЩЖ, впереди возвратного гортанного нерва [8][9].
При нарушении эмбриональной миграции железы могут либо чрезмерно опуститься, либо остаться на месте в области первичных зачатков. Большинство аденом ОЩЖ локализуются в типичном месте, однако в 22–35% случаев располагаются эктопически [8][10].
К возможным атипичным локализациям относятся тимус (38%), ретроэзофагеальная область (31%), ЩЖ (18%), средостение (6%) и влагалище сонной артерии (3%) [11]. Нижние ОЩЖ из-за более длинного пути миграции при эмбриональном развитии имеют большую вариабельность эктопии, чем верхние, и могут располагаться в пространстве от нижней челюсти до верхнего средостения [12][13]. В некоторых описанных случаях сообщалось о чрезвычайно редких и необычных местах локализации, таких как перикард [14].
Ввиду трудностей проведения топической диагностики и хирургического лечения, образования эктопированных ОЩЖ могут стать причиной персистирующего ПГПТ с тяжелыми клиническими проявлениями [15][16].
Мы представляем случай пациентки с длительным течением ПГПТ вследствие атипично расположенного образования ОЩЖ позади правой внутренней яремной вены на уровне правой поднижнечелюстной слюнной железы. Данный случай наглядно иллюстрирует проблему диагностики и определения тактики ведения пациентов с эктопированно расположенным образованием ОЩЖ.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
У пациентки У. впервые диагностирован ПГПТ в 2011 г. в возрасте 74 лет. В течение заболевания отмечалось развитие выраженной гиперкальциемии и остеопороза. С 2017 г. инициирована терапия деносумабом 60 мг 1 раз в полгода. Эндокринологом по месту жительства рекомендовано хирургическое лечение, однако в течение длительного периода при использовании различных методов топической диагностики (ультразвукового исследования (УЗИ), компьютерной томографии (КТ) шеи с контрастом, планарной сцинтиграфии), проводившихся в различных учреждениях, не удавалось обнаружить образование ОЩЖ.
С февраля 2021 г. для коррекции гиперкальциемии к терапии также добавлен цинакальцет 30 мг в сутки с увеличением дозы до 90 мг. Однако препарат отменили через 9 месяцев терапии из-за развития гастроинтестинальных побочных эффектов (динамика лабораторных показателей изложена в таблице 1).
Таблица 1. Результаты лабораторных исследований пациентки в амбулаторных условиях
|
Дата |
Са общий, ммоль/л (2,2–2,65) |
Са, скорректированный на альбумин, ммоль/л (2,2–2,65) |
ПТГ, пмоль/л (1,7–6,4) |
|
|
Ноябрь 2020 — Инъекция деносумаба |
||||
|
12.2020 |
3,03 |
29,5 |
||
|
02.2021 |
41,78 |
ЦИНАКАЛЬЦЕТ |
||
|
Май 2021 — Инъекция деносумаба |
||||
|
06.2021 |
2,5 |
25,5 |
||
|
09.2021 |
2,96 |
2,88 |
18,02 |
|
|
Ноябрь 2021 — Инъекция деносумаба |
||||
|
11.2021 |
2,46 |
2,38 |
134,6 |
|
В декабре 2021 г. были проведены сцинтиграфия ОЩЖ с 99mTc-технетрилом и однофотонная эмиссионная КТ, совмещенная с рентгеновской КТ (ОФЭКТ/КТ) в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России (далее — НМИЦ эндокринологии), а также мультиспиральная КТ шеи с контрастным усилением. Именно при помощи ОФЭКТ/КТ впервые было выявлено атипично высоко расположенное образование с признаками интенсивного накопления радиофармпрепарата размерами 18х11х33 мм справа, позади правой внутренней яремной вены, медиальнее m. sternocleidomastoideus на уровне правой поднижнечелюстной слюнной железы (рис. 1).
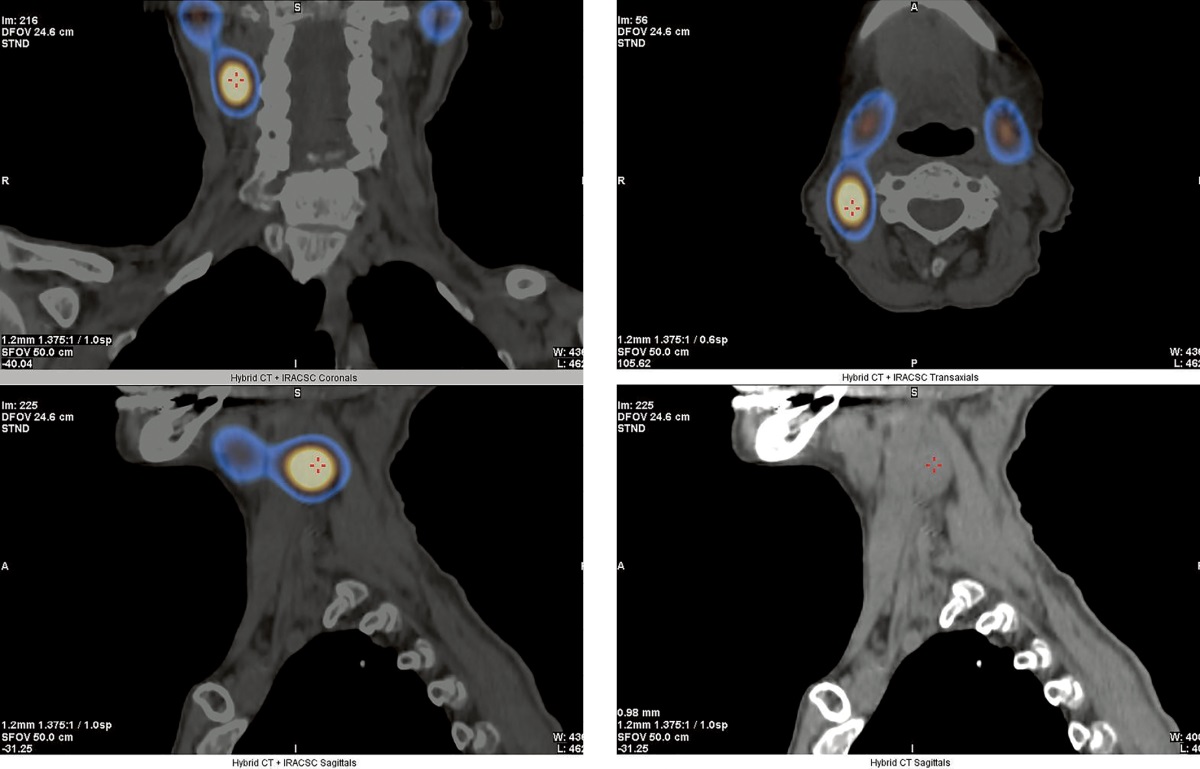
Рисунок 1. ОФЭКТ/КТ с 99mTc-технетрилом от декабря 2021 г.
Красными метками отмечено образование ОЩЖ.
Объемное образование подтверждено в ходе проведения мультиспиральной компьютерной томографии (МСКТ) шеи с контрастным усилением (рис. 2).
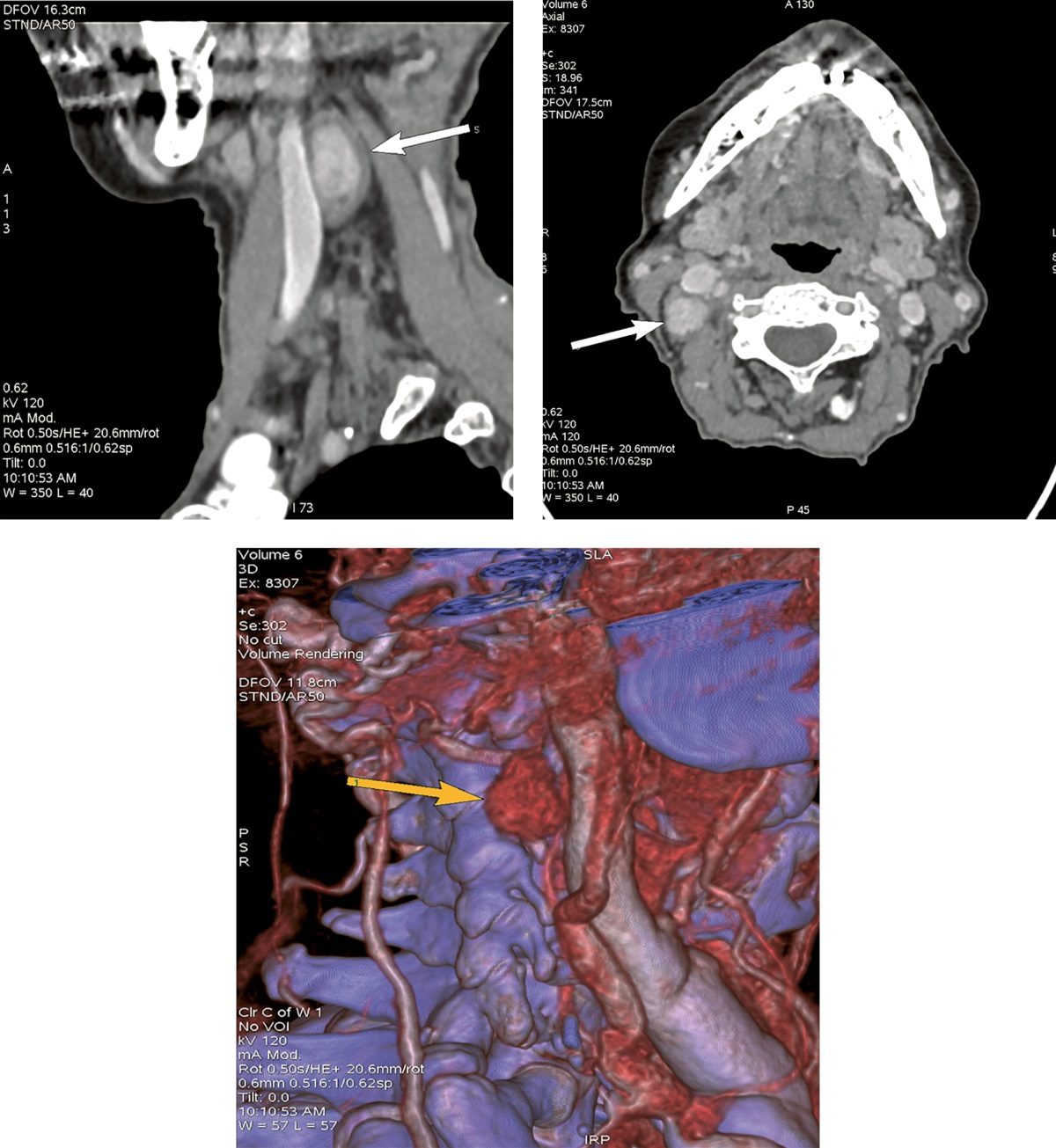
Рисунок 2. МСКТ шеи с контрастным усилением от декабря 2021 г.
Стрелками отмечено атипично расположенное образование ОЩЖ.
Пациентка была осмотрена эндокринным хирургом, при пальпации в проекции образования отмечался кашель, что могло указывать на расположение опухоли вблизи возвратного гортанного нерва.
В декабре 2021 г. в возрасте 84 лет пациентка госпитализирована в отделение патологии околощитовидных желез и нарушений минерального обмена НМИЦ эндокринологии с жалобами на снижение массы тела на 6 кг за год, слабость, боли в спине, уменьшение в росте на 8 см, периодические эпизоды повышения артериального давления до 200/100 мм рт.ст. При осмотре отмечалась сниженная масса тела — 46 кг при росте 153 см (ИМТ — 19,7 кг/м²).
По данным лабораторных исследований, на фоне инъекции деносумаба за 1 мес. до госпитализации выявлено повышение ПТГ до 1599 пг/мл (15–65) на фоне высоко-нормального уровня кальция крови (кальций общий — 2,48 ммоль/л, кальций скорректированный на альбумин — 2,40 ммоль/л). При исследовании суточной мочи выявлена гипокальциурия — 0,65 ммоль/л (2,5–8), вероятно, вследствие антирезорбтивной терапии. Фильтрационная функция почек сохранялась удовлетворительной (креатинин — 59,6 мкмоль/л, СКФ по формуле CKD-EPI — 80 мл/мин/1,73 м²).
По результатам рентгеновской денситометрии (dual-energy X-ray absorptiometry — DXA) подтвержден выраженный остеопороз: снижение МПК поясничных позвонков до -4,8 SD, лучевой кости до -4,8 SD, бедренной кости до -3,5 SD по Т-критерию. При рентгенографии грудного и поясничного отделов позвоночника компрессионных переломов не выявлено. По результатам УЗИ почек, данных за нефролитиаз, нефрокальциноз не получено.
Для оценки периоперационных рисков хирургического лечения проведена диагностика состояния сердечно-сосудистой системы. У пациентки осложненный кардиологический анамнез: в 2005 г. выполнено стентирование правой коронарной артерии, в 2018 г. перенесла инфаркт миокарда, при дальнейшем обследовании выявлен рестеноз в стенте до 50%. Для уточнения состояния больной был запланирован тредмил-тест, однако выполнить исследование не удалось по техническим причинам, ввиду чего рекомендовано стресс-ЭХО-КГ с добутамином.
В связи с наличием тяжелой сопутствующей патологии, пожилым возрастом возникла необходимость в поиске оптимального варианта консервативного лечения. С учетом недостаточности витамина D (25(ОН)D 26,6 нг/мл) и нормокальциемии, по данным биохимического анализа крови в течение госпитализации, был инициирован прием насыщающей дозы колекальциферола (7000 МЕ ежедневно в течение 6 дней). По данным контрольного анализа крови, уровень ПТГ составил 350,2 пг/мл, отмечено увеличение уровня общего кальция до 2,58 ммоль/л, показатель кальция, скорректированного на альбумин — в пределах референсных значений (2,48 ммоль/л).
Пациентке рекомендовано продолжить прием колекальциферола для достижения целевых значений уровня 25(ОН) витамина D крови, а также терапию деносумабом.
ОБСУЖДЕНИЕ
В представленном клиническом случае эктопическое расположение образования ОЩЖ привело к значимо отсроченному определению топического диагноза, необходимого для проведения паратиреоидэктомии.
Как правило, УЗИ — первый этап топической диагностики при ПГПТ. Чувствительность данного метода исследования в отношении образований ОЩЖ составляет от 55 до 87% (при солитарных образованиях достигает 91%) и снижается при сопутствующем узловом зобе. Оценка эктопированных ОЩЖ на УЗИ может быть весьма затруднена, а при некоторых локализациях — невозможна [17].
Радионуклидное исследование — второй этап визуализации образований ОЩЖ. Длительное время стандартной методикой поиска измененных ОЩЖ была двухмерная планарная сцинтиграфия, в настоящее время все чаще используется сочетание трехмерной однофотонной эмиссионной компьютерной томографии (ОФЭКТ) и гибридной технологии ОФЭКТ/КТ. Трехмерное сканирование лучше выявляет труднодоступные для диагностики аденомы эктопированных ОЩЖ и небольшие образования [18–20]. Гибридные технологии позволяют дифференцировать поражения ОЩЖ от других источников поглощения 99mTc-технетрила, включая узлы ЩЖ и шейные лимфатические узлы, а также очаги физиологического поглощения РФП [21]. Ложноположительные результаты могут возникать при многоузловом зобе, тиреоидите и лимфаденопатии. В представленном нами клиническом случае именно ОФЭКТ, совмещенная с КТ, позволила впервые обнаружить образование ОЩЖ.
В случае отсутствия четкой визуализации патологической ОЩЖ после проведения методов первой линии рекомендуется выполнение дополнительных исследований. Диагностические исследования второй линии включают в себя КТ с внутривенным (в/в) контрастированием, позитронно-эмиссионную томографию (ПЭТ) с радиофармацевтическим препаратом, совмещенную с компьютерной томографией (ПЭТ/КТ) или с магнитно-резонансной томографией (ПЭТ/МРТ), МРТ с в/в контрастированием, четырехмерную КТ (4D-КТ) [22]. В ряде работ 4D-КТ продемонстрировала более высокую чувствительность, чем сканирование с 99mTc-технетрилом и УЗИ. 4D-КТ может стать полезным методом диагностики для пациентов с полигландулярным поражением или при эктопии ОЩЖ. Основные недостатки метода — значительная лучевая нагрузка, высокая частота ложноположительных результатов, малодоступность и высокая стоимость [23][24]. ПЭТ, как правило, используется у пациентов со злокачественными образованиями ОЩЖ для оценки распространенности метастатического процесса. К преимуществам ПЭТ/КТ с 18F-холином относят более короткое время визуализации, более высокое пространственное разрешение и меньшую дозу облучения (2,8 мЗв), чем при ОФЭКТ/КТ с 99mTc-технетрилом (6,8 мЗв). Однако применение данного метода ограничено из-за высокой стоимости и низкой доступности [25][26]. Чувствительность ПЭТ/КТ с 11С-метионином при образованиях ОЩЖ может достигать 91%, ПЭТ/КТ с 18F-холином — 96% [27][28].
Другие методики, такие как селективный забор крови и интраоперационное введение 0,1% водного раствора метиленового синего в нижнюю щитовидную артерию, не получили широкого распространения [29].
У пациентов с ПГПТ для медикаментозной коррекции гиперкальциемии широкое применение получили цинакальцет, деносумаб и бисфосфонаты [18]. Терапевтическая тактика в отношении назначения препаратов витамина D часто разнится.
По данным исследований, распространенность недостаточности витамина D среди пациентов с ПГПТ выше, чем в общей популяции. Вероятно, высокий уровень ПТГ усиливает превращение 25(ОН) витамина D в активный 1,25(ОН)2 витамин D, а также приводит к инактивации витамина D посредством усиленного печеночного метаболизма [30–32].
По результатам проведенных исследований опасения относительно провокации гиперкальциемии у пациентов с ПГПТ при восполнении дефицита витамина D не оправдывались. Так, по данным двух метаанализов Shan VN и соавт. и Song A и соавт., терапия препаратами витамина D у пациентов с ПГПТ и дефицитом витамина D значительно снижает уровень ПТГ, не вызывая гиперкальциемии и гиперкальциурии [33][34]. Согласно Shan VN, частота выраженной гиперкальциемии (более 3 ммоль/л) составила всего 2,2% [34]. Стоит отметить, что в исследованиях в используемых схемах лечения наблюдались значительные различия в длительности, дозах и формах применяемых препаратов.
По данным двойного слепого рандомизированного контролируемого исследования 6-месячный курс приема колекальциферола у пациентов с ПГПТ приводил к значимому повышению уровня витамина D, снижению уровня ПТГ (на 17%), приросту МПК (на 2,5%) при стабильном уровне кальция в сыворотке крови и моче [35]. Сходные данные были получены при исследовании влияния терапии эргокальциферолом: на фоне лечения не было обнаружено значительного увеличения уровня кальция крови или соотношения кальций/креатинин в моче при незначительном снижении уровня ПТГ [36]. Необходимо отметить, что практически во всех исследованиях пациентам назначалась терапия препаратами витамина D в поддерживающей дозе [18].
В представленном нами клиническом случае планарная сцинтиграфия не позволила локализовать аденому ОЩЖ, поскольку аденома располагалась рядом с поднижнечелюстной слюнной железой и при данном методе исследования не дифференцировалась на фоне физиологического накопления 99mTc-технетрила в слюнной железе. И только объемное изображение ОФЭКТ/КТ позволило обнаружить аденому ОЩЖ. В данном клиническом случае пожилой возраст пациентки, эктопическое расположение образования, расположение опухоли ОЩЖ вблизи возвратного гортанного нерва, потенциально осложняющее хирургическую тактику, а также наличие тяжелой сопутствующей кардиоваскулярной патологии значимо повышали операционные риски. В силу отсутствия топических данных на протяжении длительного времени своевременное радикальное хирургическое лечение не представлялось возможным. Вышеуказанные факторы, а также возможность поддержания нормокальциемии на фоне медикаментозной терапии послужили причиной выбора консервативной тактики лечения пациентки.
Ввиду высоких значений ПТГ, выраженной гиперкальциемии и размера образования более 3 см в наибольшем измерении сохранялась настороженность в отношении злокачественного поражения ОЩЖ. Применение колекальциферола в насыщающей дозе позволило добиться значимого снижения ПТГ при сохранении нормокальциемии, что свидетельствует о вероятном смешанном генезе гиперпаратиреоза (первичном и вторичном на фоне недостаточности 25 ОН витамина D, терапии антирезорбтивными препаратами). В настоящее время пациентка продолжает терапию колекальциферолом в насыщающей дозе с последующим переходом на поддерживающую под динамическим контролем показателей фосфорно-кальциевого обмена.
ЗАКЛЮЧЕНИЕ
Представленный клинический случай демонстрирует сложности, возникающие при проведении топической диагностики у пациентов с атипичным расположением образований ОЩЖ. Применение современных методов инструментальной диагностики дает возможность четко установить диагноз и определить дальнейшую тактику ведения пациента, что особенно важно при эктопированных образованиях ОЩЖ. Однако стоит отметить, что в сложных клинических случаях проведение топической диагностики необходимо выполнять в специализированных медицинских учреждениях.
Проведение терапии колекальциферолом под динамическим контролем показателей фосфорно-кальциевого обмена может способствовать положительной динамике состояния у пациентов с ПГПТ, имеющих сопутствующий дефицит или недостаточность витамина D, снижение функции почек и другие состояния, способные провоцировать вторичное повышение ПТГ.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Авторы декларируют соответствие своего авторства международным критериям ICMJE. Все авторы внесли равный вклад в подготовку статьи и одобрили ее окончательный вариант.
Согласие пациента. Пациент добровольно подписал информированное согласие на публикацию персональной медицинской информации в обезличенной форме в журнале «Проблемы эндокринологии».
Список литературы
1. Мокрышева Н.Г., Ковалева Е.В., Еремкина А.К. Регистры заболеваний околощитовидных желез в Российской Федерации. Проблемы Эндокринологии. 2021;67(4):4-7. https://doi.org/10.14341/probl12803
2. Мокрышева Н.Г., Мирная С.С., Добрева Е.А., и др. Первичный гиперпаратиреоз в России по данным регистра // Проблемы эндокринологии. - 2019. - Т. 65. - №5. - С. 300-310. https://doi.org/10.14341/probl10126
3. Minisola S, Gianotti L, Bhadada S, Silverberg SJ. Classical complications of primary hyperparathyroidism. Best Pract Res Clin Endocrinol Metab. 2018;32(6):791-803. https://doi.org/10.1016/j.beem.2018.09.001
4. Dandurand K, Ali DS, Khan AA. Primary Hyperparathyroidism: A Narrative Review of Diagnosis and Medical Management. J Clin Med. 2021 Apr 9;10(8):1604. https://doi.org/10.3390/jcm10081604
5. Walker MD, Silverberg SJ. Primary hyperparathyroidism. Nat. Rev. Endocrinol. 2018;14:115-125. https://doi.org/10.1038/nrendo.2017.104
6. Taterra D, Wong LM, Vikse J et al. The Prevalence and Anatomy of Parathyroid Glands: A Meta-Analysis With Implications for Parathyroid Surgery. Langenbecks Arch Surg (2019) 404:63–70. https://doi.org/10.1007/s00423-019-01751-8
7. Hojaij F, Vanderlei F, Plopper C. et al. Parathyroid gland anatomical distribution and relation to anthropometric and demographic parameters: a cadaveric study. Anatomical Science International. 2011; 86(4), 204–212 https://doi.org/10.1007/s12565-011-0111-0;
8. Morris MA, Saboury B, Ahlman M, et al. Parathyroid Imaging: Past, Present, and Future. Front Endocrinol (Lausanne). 2022 Feb 25;12:760419. https://doi.org/10.3389/fendo.2021.760419.
9. Peissig K, Condie BG, Manley NR. Embryology of the Parathyroid Glands. Endocrinol Metab Clin North Am. 2018;47(4):733-742. https://doi.org/10.1016/j.ecl.2018.07.002
10. Khalaf SH, Sarwani AA, George SM, Al Saeed MK. Primary hyperparathyroidism caused by an ectopic parathyroid adenoma in an uncommon location: a case report. J Taibah Univ Med Sci. 2021 Mar 25;16(5):782-787. https://doi.org/10.1016/j.jtumed.2021.02.010
11. Roy M, Mazeh H, Chen H, Sippel RS. Incidence and localization of ectopic parathyroid adenomas in previously unexplored patients. World J Surg. 2013 Jan;37(1):102-6. https://doi.org/10.1007/s00268-012-1773-z.
12. Noussios G, Anagnostis P, Natsis K. Ectopic parathyroid glands and their anatomical, clinical and surgical implications. Exp Clin Endocrinol Diabetes. 2012;120:604–10. https://doi.org/10.1055/s-0032-1327628.;
13. Kuzminski SJ, Sosa JA, Hoang JK. Update in parathyroid imaging. Magn Reson Imaging Clin N Am. 2018;26:151–66. https://doi.org/10.1016/j.mric.2017.08.009.
14. Xin Y, Zhao T, Wei B, Gu H, Jin M, Shen H, Liu X, Wang J, Wang Q. Intrapericardial parathyroid carcinoma: a case report. Endocrine. 2020 Aug;69(2):456-460. https://doi.org/10.1007/s12020-020-02283-8.
15. Hartert M, Tripsky J, Huertgen M. Technique for ectopic intrathymic parathyroid adenoma: the uniportal subxiphoid approach. J Surg Case Rep. 2021 Dec 11;2021(12):rjab520. https://doi.org/10.1093/jscr/rjab520
16. Liu X, Sun L, Shao M, et al. Primary hyperparathyroidism due to ectopic parathyroid adenoma in an adolescent: a case report and review of the literature. Endocrine. 2019 Apr;64(1):38-42. https://doi.org/10.1007/s12020-019-01875-3
17. Cheatem DM, Sturgeon C. Chapter 60 – Technique of parathyroidectomy. In: Orlo HC, Quan-Yang D, Electron K. (eds) Textbook of endocrine surgery, 3rd ed. Jaypee Brothers Medical Publishers, 2016, pp. 747–755. https://doi.org/10.5005/jp/books/12798_61
18. Мокрышева Н.Г., Еремкина А.К., Мирная С.С. и др. Клинические рекомендации по первичному гиперпаратиреозу, краткая версия. Проблемы Эндокринологии. 2021;67(4):94-124. https://doi.org/10.14341/probl12801;
19. Spanu A, Schillaci O, Piras B, Madeddu G. SPECT/CT in hyperparathyroidism. Clin Transl Imaging. 2014;2:537–55. https://doi.org/10.1007/s40336-014-0089-4.;
20. Siraj QH. Radionuclide parathyroid imaging. Cham: Springer; 2020. Chapter 5, Parathyroid Scintigraphy. p. 41–60 https://doi.org/10.1007/978-3-030-17351-7
21. Gouveia S, Rodrigues D, Barros L, et al. Persistent primary hyperparathyroidism: an uncommon location for an ectopic gland--case report and review. Arq Bras Endocrinol Metabol. 2012;56(6):393-403. https://doi.org/10.1590/s0004-27302012000600009
22. Слащук К.Ю., Дегтярев М.В., Румянцев П.О., Трошина Е.А., Мельниченко Г.А. Методы визуализации околощитовидных желез при первичном гиперпаратиреозе. Обзор литературы. Эндокринная хирургия. 2019;13(4):153-174. https://doi.org/10.14341/serg12241
23. Lundstroem AK, Trolle W, Soerensen CH, Myschetzky PS. Preoperative localization of hyperfunctioning parathyroid glands with 4D-CT. Eur Arch Otorhinolaryngol. 2016;273(5):1253-1259. https://doi.org/10.1007/s00405-015-3509-9;
24. Hinson AM, Lee DR, Hobbs BA, et al. Preoperative 4D CT Localization of Nonlocalizing Parathyroid Adenomas by Ultrasound and SPECT-CT. Otolaryngol Head Neck Surg. 2015;153(5):775-778. https://doi.org/10.1177/0194599815599372
25. Treglia G, Piccardo A, Imperiale A, et al. Diagnostic performance of choline PET for detection of hyperfunctioning parathyroid glands in hyperparathyroidism: a systematic review and meta-analysis. Eur J Nucl Med Mol Imaging. 2019;46(3):751-765. https://doi.org/10.1007/s00259-018-4123-z
26. Beheshti M, Hehenwarter L, Paymani Z, et al. 18F-Fluorocholine PET/CT in the assessment of primary hyperparathyroidism compared with 99mTc-MIBI or 99mTc-tetrofosmin SPECT/CT: a prospective dual-centre study in 100 patients. Eur J Nucl Med Mol Imaging. 2018;45(10):1762-1771. https://doi.org/10.1007/s00259-018-3980-9
27. Hayakawa N, Nakamoto Y, Kurihara K, et al. A comparison between 11C-methionine PET/CT and MIBI SPECT/CT for localization of parathyroid adenomas/hyperplasia. Nucl Med Commun. 2015;36(1):53-59. https://doi.org/10.1097/MNM.0000000000000216
28. Mathey C, Keyzer C, Blocklet D, et al. 18F-Fluorocholine PET/CT Is More Sensitive Than 11C-Methionine PET/CT for the Localization of Hyperfunctioning Parathyroid Tissue in Primary Hyperparathyroidism. J Nucl Med. 2022;63(5):785-791. https://doi.org/10.2967/jnumed.121.262395
29. Scattergood S, Marsden M, Kyrimi E, et al. Combined ultrasound and Sestamibi scintigraphy provides accurate preoperative localisation for patients with primary hyperparathyroidism. Ann R Coll Surg Engl. 2019;101(2):97-102. https://doi.org/10.1308/rcsann.2018.0158
30. Boudou P, Ibrahim F, Cormier C, et al. A very high incidence of low 25 hydroxy-vitamin D serum concentration in a French population of patients with primary hyperparathyroidism. J Endocrinol Invest. 2006 Jun;29(6):511-5. https://doi.org/10.1007/BF03344140. PMID: 16840828.]
31. Walker MD, Bilezikian JP. Vitamin D and primary hyperparathyroidism: more insights into a complex relationship. Endocrine. 2017 Jan;55(1):3-5. https://doi.org/10.1007/s12020-016-1169-1
32. Dandurand K, Ali DS, Khan AA. Primary Hyperparathyroidism: A Narrative Review of Diagnosis and Medical Management. J Clin Med. 2021 Apr 9;10(8):1604. https://doi.org/10.3390/jcm10081604.
33. Song A, Zhao H, Yang Y, et al. Safety and efficacy of common vitamin D supplementation in primary hyperparathyroidism and coexistent vitamin D deficiency and insufficiency: a systematic review and meta-analysis. J Endocrinol Invest. 2021 Aug;44(8):1667-1677. https://doi.org/10.1007/s40618-020-01473-5.
34. Shah VN, Shah CS, Bhadada SK, Rao DS. Effect of 25 (OH) D replacements in patients with primary hyperparathyroidism (PHPT) and coexistent vitamin D deficiency on serum 25(OH) D, calcium and PTH levels: a meta-analysis and review of literature. Clin Endocrinol (Oxf). 2014 Jun;80(6):797-803. https://doi.org/10.1111/cen.12398
35. Rolighed L, Rejnmark L, Sikjaer T, et al. Vitamin D treatment in primary hyperparathyroidism: a randomized placebo controlled trial. J Clin Endocrinol Metab. 2014 Mar;99(3):1072-80. https://doi.org/10.1210/jc.2013-3978
36. Tucci JR. Vitamin D therapy in patients with primary hyperparathyroidism and hypovitaminosis D. Eur J Endocrinol. 2009 Jul;161(1):189-93. https://doi.org/10.1530/EJE-08-0901
Об авторах
Е. А. АбойшеваРоссия
Абойшева Елизавета Андреевна
Москва
Е. С. Авсиевич
Россия
Авсиевич Екатерина Сергеевна
Москва
М. О. Корчагина
Россия
Корчагина Мария Олеговна
117036, Москва, ул. Дм. Ульянова, д. 11
М. В. Дегтярев
Россия
Дегтярев Михаил Владимирович
Москва
Е. Е. Бибик
Россия
Бибик Екатерина Евгеньевна
Москва
Д. Г. Бельцевич
Россия
Бельцевич Дмитрий Германович, д.м.н., профессор
Москва
Е. А. Пигарова
Россия
Пигарова Екатерина Александровна, д.м.н.
Москва
М. С. Шеремета
Россия
Шеремета Марина Сергеевна, к.м.н.
Москва
Дополнительные файлы
|
|
1. Рисунок 1. ОФЭКТ/КТ с 99mTc-технетрилом от декабря 2021 г. | |
| Тема | ||
| Тип | рисунок | |
Посмотреть
(612KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. МСКТ шеи с контрастным усилением от декабря 2021 г. | |
| Тема | ||
| Тип | Прочее | |
Посмотреть
(1MB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Абойшева Е.А., Авсиевич Е.С., Корчагина М.О., Дегтярев М.В., Бибик Е.Е., Бельцевич Д.Г., Пигарова Е.А., Шеремета М.С. Тактика ведения первичного гиперпаратиреоза c редкой локализацией эктопированного образования околощитовидной железы. Проблемы Эндокринологии. 2025;71(1):20-26. https://doi.org/10.14341/probl13425
For citation:
Aboisheva E.A., Avsievich E.S., Korchagina M.O., Degtyarev M.V., Bibik E.E., Beltsevich D.G., Pigarova E.A., Sheremeta M.S. Management of primary hyperparathyroidism with rare localization of ectopic adenoma parathyroid gland. Problems of Endocrinology. 2025;71(1):20-26. (In Russ.) https://doi.org/10.14341/probl13425

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).









































.jpg)


