Перейти к:
Влияние дооперационной терапии бисфосфонатами на минеральную плотность костной ткани у пациентов с ПГПТ через год после паратиреоидэктомии
https://doi.org/10.14341/probl13574
Аннотация
ОБОСНОВАНИЕ. Основным методом лечения первичного гиперпаратиреоза (ПГПТ) является паратиреоидэктомия (ПТЭ); консервативная терапия, включая бисфосфонаты, может применяться для дооперационной коррекции гиперкальциемии, а также улучшения состояния костной ткани среди лиц, у которых операция должна быть отложена или не может быть проведена ввиду высоких периоперационных рисков. Вопрос о влиянии предоперационной терапии бисфосфонатами (БФ) на костную ткань после операции остается открытым.
ЦЕЛЬ. Изучить влияние дооперационной терапии бисфосфонатами на параметры МПК, оцениваемые при DXA и 3D-DXA, у пациентов с ПГПТ через год после радикальной ПТЭ.
МАТЕРИАЛЫ И МЕТОДЫ. Исследование проведено на базе отделения патологии околощитовидных желез и нарушений минерального обмена ФГБУ «НМИЦ эндокринологии» Минздрава России. В исследование включены 50 пациентов (2 мужчины, 48 женщин), разделенные на две группы в зависимости от наличия или отсутствия дооперационной терапии БФ. Использовались методы DXA и 3D-DXA с применением программного обеспечения 3D-Shaper Medical для оценки МПК и микроархитектоники костной ткани. Статистический анализ выполнен с использованием языка R и пакета Statistica v.13.
РЕЗУЛЬТАТЫ. На момент манифестации заболевания обе группы были сопоставимы по основным показателям кальций-фосфорного обмена, за исключением уровня бета-кросслапса, который был выше в группе без предоперационной терапии БФ (p=0,0003). Различий по параметрам DXA и 3D-DXA не определялось.
При сопоставлении групп по абсолютному приросту МПК по результатам DXA в основных отделах скелета и 3D-DXA в бедренной кости значимых различий выявлено не было. Итоговые абсолютные значения параметров 3D-DXA (включая толщину кортикального слоя в бедренной кости в целом и в ее шейке) были выше в группе без терапии, достигая, однако, лишь уровня статистической тенденции.
Также была проведена оценка динамики МПК внутри групп. У пациентов, получавших БФ, статистически значимый прирост МПК в абсолютных значениях был выявлен только в поясничном отделе позвоночника (р<0,001). По данным 3D-DXA, статистически значимо выше после ПТЭ был только объем минеральной плотности трабекулярной кости бедра в целом (р=0,001).
В группе без терапии БФ статистически значимые различия по абсолютным показателям МПК в дои послеоперационном периоде наблюдались в поясничном отделе позвоночника (р<0,001), в бедре в целом (р<0,001) и в его шейке (р=0,001). По данным 3D-DXA, статистически значимые различия были выявлены по трем из восьми проанализированных показателей: увеличились объем минеральной плотности трабекулярной кости бедра в целом (р<0,001) и в его шейке (р<0,001), а также объем минеральной плотности кортикальной кости в бедре в целом (р=0,001).
ЗАКЛЮЧЕНИЕ. Метод 3D-DXA позволяет оценить не только МПК, но и микроархитектонику кости, что важно для прогнозирования риска переломов у пациентов с ПГПТ. Исследования показали, что предоперационная терапия БФ может негативно влиять на восстановление МПК после ПТЭ, особенно в кортикальной костной ткани. Для подтверждения этих данных и уточнения влияния БФ на послеоперационное течение ПГПТ необходимы дальнейшие исследования.
Для цитирования:
Першина-Милютина А.П., Еремкина А.К., Ожималов И.Д., Хайриева А.В., Горбачева А.М., Ронжина С.В., Мокрышева Н.Г. Влияние дооперационной терапии бисфосфонатами на минеральную плотность костной ткани у пациентов с ПГПТ через год после паратиреоидэктомии. Проблемы Эндокринологии. 2025;71(4):57-70. https://doi.org/10.14341/probl13574
For citation:
Pershina-Miliutina A.P., Eremkina A.K., Ozhimalov I.D., Khairieva А.V., Gorbacheva A.M., Ronzhina S.V., Mokrysheva N.G. Effect of preoperative bisphosphonate therapy on bone mineral density in patients with primary hyperparathyroidism one year after parathyroidectomy. Problems of Endocrinology. 2025;71(4):57-70. (In Russ.) https://doi.org/10.14341/probl13574
ОБОСНОВАНИЕ
Первичный гиперпаратиреоз (ПГПТ) — эндокринное заболевание, возникающее вследствие гиперпродукции паратиреоидного гормона (ПТГ) патологически измененными околощитовидными железами (ОЩЖ), как правило, сопровождающееся повышением концентрации кальция крови. Частота ПГПТ в общей популяции составляет в среднем 0,86–1% [1]: от 0,1 (США) до 0,43% (Швеция) [2]. В российской популяции истинная распространенность ПГПТ неизвестна, что прежде всего связано с отсутствием рутинного определения кальция в сыворотке крови [3].
Избыточная концентрация ПТГ в крови приводит к активации остеокластов и интенсификации процессов костной резорбции, поэтому наиболее частым осложнением ПГПТ является снижение минеральной плотности костной ткани (МПК) вплоть до остеопороза. Наиболее распространенный метод диагностики остеопороза — двухэнергетическая рентгеновская абсорбциометрия (DXA). Определяемая при проведении DХА МПК является критерием для постановки диагноза «остеопороз». Снижение МПК по Т-критерию ≤-2,5 SD для женщин после наступления менопаузы и мужчин старше 50 лет или по Z-критерию ≤-2,0 SD для женщин до наступления менопаузы и мужчин моложе 50 лет, или наличие низкоэнергетического перелома (перелом проксимального эпифиза бедренной кости, компрессионные переломы тел позвонков) считаются основаниями для постановки диагноза. Существуют и другие методы оценки МПК, основанные на компьютерной томографии, ультразвуковом исследовании и проч., но одним из наиболее перспективных является метод 3D-моделирования костной ткани (3D-DХА), способный по данным, полученным с помощью обычной DХА, построить трехмерную реконструкцию бедренной кости и определить объемные характеристики МПК. Работы с применением данной технологии в когорте пациентов с ПГПТ пока ограничены.
В российской популяции у 62,5% пациентов с ПГПТ диагностируются костные осложнения заболевания [4], что сопровождается существенным снижением качества жизни, увеличением инвалидизации и смертности. Единственным патогенетическим лечением ПГПТ остается паратиреоидэктомия (ПТЭ) [5]. При невозможности проведения ПТЭ допустимо консервативное лечение, направленное на замедление процессов костной резорбции и снижение кальциемии. Одной из групп препаратов, применяемых в таких случаях, являются бисфосфонаты (БФ). Их особенностью является фармакокинетика — БФ имеют высокую тропность к костной ткани, поэтому период их полувыведения может достигать нескольких месяцев и даже лет [6].
Хотя радикальная ПТЭ приводит к нормализации уровня ПТГ, восстановление костной ткани занимает значительное время. В соответствии с российскими клиническими рекомендациями, в течение года после ПТЭ назначать антирезорбтивную терапию не рекомендуется. С одной стороны, это может усугубить послеоперационную гипокальциемию и способствовать вторичному гиперпаратиреозу. С другой, имеются данные о потенциальном негативном влиянии БФ на прирост МПК после операции по сравнению с пациентами без терапии [5][7]. Нерешенным остается вопрос о пролонгации терапии у пациентов, которые получали БФ до операции. Единого экспертного мнения по этому вопросу на сегодняшний день нет.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Изучить влияние дооперационной терапии бисфосфонатами на параметры МПК, оцениваемые при DXA и 3D-DXA, у пациентов с ПГПТ через год после радикальной ПТЭ.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения. Исследование было проведено на базе отделения патологии околощитовидных желез и нарушений минерального обмена ФГБУ «НМИЦ эндокринологии» Минздрава России, г. Москва.
Время исследования. В исследование включены пациенты, госпитализированные в указанное отделение в период с октября 2016 по февраль 2024 гг.
Изучаемые популяции (одна или несколько)
Критерии включения в исследование:
- возраст 18 лет и старше;
- наличие верифицированного, согласно действующим клиническим рекомендациям, ПГПТ (код по МКБ-10 – Е21.0);
- наличие комплексного лабораторно-инструментального обследования до хирургического лечения ПГПТ;
- наличие информации о медикаментозной терапии до ПТЭ;
- проведенное хирургическое лечение ПГПТ (ПТЭ) с достижением стойкой ремиссии заболевания;
- проведенная в ФГБУ «НМИЦ эндокринологии» Минздрава России не ранее, чем за год до ПТЭ, DXA;
- проведенная в ФГБУ «НМИЦ эндокринологии» Минздрава России в течение Ме 1 [ 1; 1] года после ПТЭ DXA;
- подписанное информированное добровольное согласие на участие в научном исследовании.
Критерии невключения: отсутствие информации о медикаментозной терапии до ПТЭ.
Дизайн исследования представлен на рисунке 1. Способ формирования выборки — сплошной.
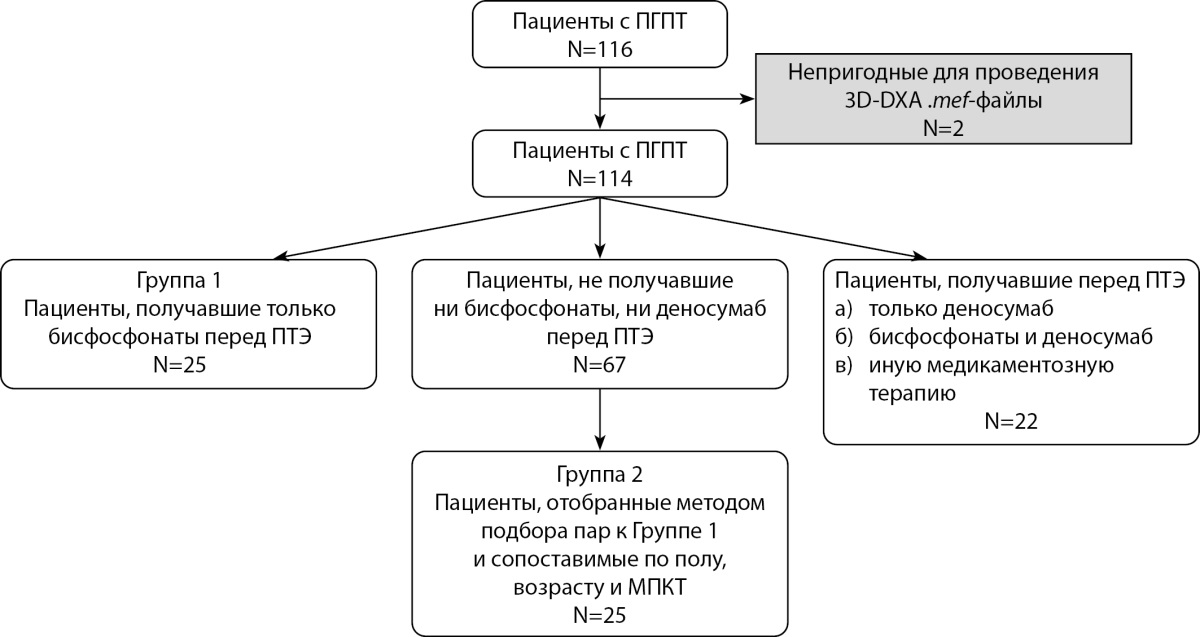
Рисунок 1. Дизайн формирования групп исследования.
В результате первичного отбора пациентов в исследуемую группу вошли 116 человек, которые далее были разбиты на 2 группы в зависимости от наличия или отсутствия дооперационной терапии БФ, где первая группа — пациенты, получающие терапию.
Дизайн исследования
Настоящее исследование носит характер одноцентрового, обсервационного, ретроспективного, динамического (первая рентгенологическая денситометрия выполнена не ранее, чем за год до ПТЭ, вторая — не ранее, чем через год после проведения ПТЭ), сравнительного двухвыборочного.
Методы
Все лабораторные исследования были выполнены на базе лаборатории ФГБУ «НМИЦ эндокринологии» Минздрава России и оценены в соответствии с локальными референсными значениями.
Оценивались следующие показатели: кальций общий, кальций ионизированный, альбумин, щелочная фосфатаза, суточная кальциурия, креатинин (на автоматическом биохимическом анализаторе ARCHITECH с8000 (Abbott, CША)), интактный ПТГ, СТХ, остеокальцин (на электрохемилюминесцентном анализаторе Cobas 6000 (Roche, Германия)), 1,25-(OH)-D (на анализаторе Liaison XL (DiaSorin, Италия)).
Скорость клубочковой фильтрации (СКФ) рассчитывалась по формуле CKD-EPI, скорректированный кальций — по формуле [Са](скорр.)=[Са](общ.)+0,8∙(4-Alb),
где
Са (скорр.) — концентрация кальция, скорректированного на альбумин (ммоль/л);
Са (общ.) — концентрация ионизированного кальция (ммоль/л);
Alb — концентрация альбумина (г/л).
Абсолютная МПК, Т- и Z-критерии определялись с помощью DXA в трех отделах скелета — в дистальном отделе лучевой кости, проксимальном отделе бедренной кости и поясничном отделе позвоночника (Lunar iDXA, GE Healthcare, Япония или Hologic Discovery, США).
Для выявления особенностей повреждения кортикального и трабекулярного компонента костной ткани использовалось новое программное обеспечение 3D-Shaper Medical (certified by BSI to ISO 13485:2016 under certificate number MD 731095; Version v2.12.1, Испания), способное создавать 3D-модели проксимального отдела бедренной кости пациента на основе метаданных, полученных после стандартного денситометрического исследования. Оценивались следующие параметры: минеральная плотность поверхности кортикальной кости (cortical surface bone mineral density — cortical sBMD; мг/см²); объем минеральной плотности кортикальной кости (cortical volumetric bone mineral density — cortical vBMD; мг/см³); толщина кортикальной кости (cortical thickness; мм); объем минеральной плотности трабекулярной кости (trabecular volumetric bone mineral density — trabecular vBMD; мг/см³).
Наличие компрессионных переломов тел позвонков устанавливалось при рентгенографии поясничного и грудного отделов позвоночника в боковой проекции (рентгенодиагностическая система Optima RF420, GE Healthcare, Япония).
Нефрокальциноз и нефролитиаз выявлялись при УЗИ почек и забрюшинного пространства (УЗИ-аппарат Aplio 500, Toshiba, Япония) или мультиспиральной КТ (компьютерный томограф GE Optima CT660, США).
ПТЭ всем пациентам была выполнена в Отделе хирургии ФГБУ «НМИЦ эндокринологии» Минздрава России. Морфологический диагноз (аденома, атипическая опухоль, карцинома, гиперплазия) устанавливался согласно классификации опухолей эндокринных органов ВОЗ 2017/2022 гг. на базе референс-центра патоморфологических и иммуногистохимических методов исследования. Радикальность ПТЭ оценивалась по нормализации или снижению концентрации ПТГ более чем на 50% в раннем послеоперационном периоде [5].
Статистический анализ
Статистический анализ проведен с использованием статистического языка программирования R (v.4.2.2) и программного пакета Statistica v.13 (TIBCO Inc., США). Описательная статистика количественных показателей представлена медианами, первым и третьим квартилями в виде Me [ Q1; Q3], качественных показателей — абсолютными и относительными частотами в виде n (%). Сравнение двух независимых групп для количественных данных выполнялось с помощью критерия Манна-Уитни, зависимых — с помощью критерия Вилкоксона. Сравнение двух независимых групп для качественных признаков выполнялось с помощью критерия Фримена-Холтона и точного двустороннего критерия Фишера, в случае бинарных признаков. Критический уровень статистической значимости при проверке статистических гипотез принят равным 0,05. При множественных сравнениях применялась поправка Бонферрони путем коррекции критического уровня значимости. Рассчитанные уровни значимости в диапазоне от критического до 0,05 описаны в качестве индикаторов статистической тенденции.
Этическая экспертиза
Протокол исследования одобрен локальным этическим комитетом ФГБУ «НМИЦ эндокринологии» Минздрава России (протокол №1 от 17.01.2018).
РЕЗУЛЬТАТЫ
В исследование были включены 50 пациентов, среди них — 2 мужчин (4%) и 48 женщин (96%). Медиана возраста на момент госпитализации в группе 1 составила 59 [ 56; 62] лет, во второй — 60 [ 55; 64] лет. Обе группы были сопоставимы по полу, возрасту на момент госпитализации, а также степени снижения МПК до операции (таблица 1, 2). Подробная характеристика показателей кальций-фосфорного обмена представлена в таблице 1. При сравнении двух групп по дооперационным лабораторным показателям статистически значимые различия были обнаружены только по уровню бета-кросслапса, который был выше в группе без предоперационной терапии БФ (1,315 [ 1,010; 1,720] нг/мл против 0,531 [ 0,305; 0,976] нг/мл, p=0,0003). Значения фосфора, ЩФ и остеокальцина были выше во второй группе, однако оставаясь на уровне статистической тенденции (табл. 1).
Таблица 1. Сравнительная характеристика исследуемых групп пациентов по анамнестическим данным и основным характеристикам ПГПТ
|
Признак |
Пациенты, принимающие бисфосфонаты перед операцией |
Пациенты, не принимающие бисфосфонаты перед операцией |
р |
|||
|
N |
Me [ Q1; Q3] / n (%) |
N |
Me [ Q1; Q3] / n (%) |
|||
|
Возраст на момент госпитализации, лет |
25 |
59 [ 56; 62] |
25 |
60 [ 55; 64] |
0,6618¹ |
|
|
Пол |
Мужской |
25 |
1 (4%) |
25 |
1 (4%) |
1,0000² |
|
Женский |
24 (96%) |
24 (96%) |
||||
|
Вес, кг |
25 |
67 [ 62; 74] |
24 |
68,5 [ 61,5; 83] |
- |
|
|
Рост, см |
25 |
158 [ 153; 164] |
24 |
161,5 [ 157; 167] |
- |
|
|
ИМТ, кг/м² |
25 |
26,22 [ 24,78; 30,02] |
24 |
26,64 [ 23,84; 31,12] |
- |
|
|
Данные лабораторных исследований до операции |
||||||
|
Са общий, ммоль/л |
25 |
2,71 [ 2,61; 2,89] |
25 |
2,77 [ 2,67; 2,86] |
0,5475¹ |
|
|
Са ион., ммоль/л |
17 |
1,26 [ 1,21; 1,35] |
17 |
1,29 [ 1,25; 1,37] |
0,2856¹ |
|
|
Са скорр., ммоль/л |
25 |
2,61 [ 2,53; 2,82] |
24 |
2,66 [ 2,575; 2,78] |
0,6818¹ |
|
|
Фосфор, ммоль/л |
25 |
0,86 [ 0,73; 0,92] |
23 |
0,93 [ 0,87; 1,04] |
0,0036¹ |
|
|
Альбумин, г/л |
25 |
44,6 [ 43,0; 47,0] |
24 |
44,5 [ 43,4; 45,85] |
0,6818¹ |
|
|
рСКФ, мл/мин/1,73 м² |
25 |
88 [ 79; 95] |
25 |
82 [ 73; 90] |
0,2179¹ |
|
|
25(ОН)D, нг/мл |
13 |
32,4 [ 20,0; 43,2] |
6 |
17,885 [ 12,5; 32,0] |
0,1740¹ |
|
|
иПТГ, пг/мл |
25 |
149,5 [ 101,3; 209,2] |
25 |
134,3 [ 110,2; 188,7] |
0,8310¹ |
|
|
Са суточной мочи, ммоль/сут |
24 |
8,4975 [ 7,3725; 11,5275] |
25 |
8,26 [ 6,47; 10,71] |
0,3524¹ |
|
|
Щелочная фосфатаза, Ед/л |
23 |
66 [ 55; 108] |
20 |
110 [ 83; 128] |
0,0144¹ |
|
|
Остеокальцин, нг/мл |
21 |
35,77 [ 21,60; 46,05] |
17 |
69,37 [ 52,33; 77,87] |
0,0017¹ |
|
|
Бета-кросслапс, нг/мл |
21 |
0,531 [ 0,305; 0,976] |
18 |
1,315 [ 1,010; 1,720] |
0,0003¹ |
|
|
Общая характеристика костных нарушений до операции |
||||||
|
Остеопороз (на основании результатов DXA и/или наличии НЭП) |
25 |
23 (92%) |
25 |
22 (88%) |
1,0000² |
|
|
Компрессионные переломы |
25 |
3 (12%) |
25 |
5 (20%) |
0,7019² |
|
|
Внепозвоночные остеопоротические переломы |
25 |
4 (16%) |
25 |
4 (16%) |
1,0000² |
|
|
Фиброзно-кистозный остеит |
25 |
2 (8%) |
25 |
1 (4%) |
1,0000² |
|
|
Нефрокальциноз/нефролитиаз |
25 |
17 (68%) |
25 |
16 (64%) |
1,0000² |
|
|
Данные лабораторного обследования после операции |
||||||
|
Са общий, ммоль/л |
24 |
2,21 [ 2,175; 2,355] |
25 |
2,27 [ 2,19; 2,34] |
0,7872¹ |
|
|
Са ион., ммоль/л |
24 |
1,12 [ 1,08; 1,18] |
25 |
1,11 [ 1,09; 1,20] |
0,7039¹ |
|
|
Са скорр., ммоль/л |
4 |
2,20 [ 2,095; 2,245] |
1 |
2,27 |
- |
|
|
иПТГ, пг/мл |
25 |
30,35 [ 12,90; 43,02] |
25 |
32,28 [ 22,43; 50,93] |
0,2859¹ |
|
|
Развитие нового НЭП после операции |
||||||
|
Новый подтвержденный перелом в течение года после операции |
13 |
1 (8%) |
14 |
1 (7%) |
1,0000² |
|
Сокращения: НЭП — низкоэнергетический перелом; иПТГ — интактный паратгормон; рСКФ — расчетная скорость клубочковой фильтрации (CКФ-EPI).
Примечания: 1 — критерий Манна-Уитни; 2 — двусторонний точный критерий Фишера.
Таблица 2. Сравнительная характеристика групп по результатам DXA до и после операции
|
Признак |
Пациенты, принимающие бисфосфонаты перед операцией |
Пациенты, не принимающие бисфосфонаты перед операцией |
р |
|||
|
N |
Me [ Q1; Q3] / n (%) |
N |
Me [ Q1; Q3] / n (%) |
|||
|
Данные DXA до операции |
||||||
|
Минимальное значение Т-критерия |
23 |
-3,3 [ -4,5; -2,7] |
23 |
-3,5 [ -4,4; -2,8] |
0,9912¹ |
|
|
Минимальное значение Z-критерия |
2 |
-3,3; -2,0 |
2 |
-3,8; -1,9 |
- |
|
|
BMD |
BMD L1-L4 |
24 |
0,913 [ 0,8495; 0,953] |
25 |
0,873 [ 0,842; 0,984] |
0,4777¹ |
|
BMD total hip |
25 |
0,812 [ 0,775; 0,844] |
25 |
0,855 [ 0,749; 0,898] |
0,3130¹ |
|
|
BMD Neck |
25 |
0,772 [ 0,718; 0,816] |
25 |
0,800 [ 0,722; 0,836] |
0,2072¹ |
|
|
BMD Radius Total |
25 |
0,478 [ 0,411; 0,530] |
24 |
0,481 [ 0,407; 0,562] |
0,6101¹ |
|
|
BMD Radius 33% |
25 |
0,619 [ 0,527; 0,651] |
24 |
0,619 [ 0,534; 0,710] |
0,6672¹ |
|
|
Данные DXA после операции |
||||||
|
Минимальное значение Т-критерия |
23 |
-3,1 [ -4,4; -2,6] |
23 |
-3 [ -4,4; -2,5] |
0,7417¹ |
|
|
Минимальное значение Z-критерия |
2 |
-3,0; -1,3 |
2 |
-3,2; -1,6 |
- |
|
|
BMD |
BMD L1-L4 |
24 |
0,9535 [ 0,877; 1,004] |
25 |
0,956 [ 0,892; 1,075] |
0,8729¹ |
|
BMD total hip |
25 |
0,843 [ 0,788; 0,878] |
25 |
0,882 [ 0,790; 0,943] |
0,0952¹ |
|
|
BMD Neck |
25 |
0,778 [ 0,754; 0,817] |
25 |
0,816 [ 0,749; 0,876] |
0,1377¹ |
|
|
BMD Radius Total |
24 |
0,4905 [ 0,424; 0,521] |
24 |
0,4975 [ 0,416; 0,5645] |
0,8934¹ |
|
|
BMD Radius 33% |
24 |
0,619 [ 0,5595; 0,665] |
24 |
0,6165 [ 0,546; 0,7005] |
0,7571¹ |
|
|
Прирост BMD |
Прирост BMD L1-L4, % |
24 |
5,4 [ 2,4; 7,65] |
25 |
6,1 [ 3,0; 10,1] |
0,3371¹ |
|
Прирост BMD total hip, % |
25 |
3,8 [ -0,4; 9,0] |
25 |
4,4 [ 1,3; 8,5] |
0,4849¹ |
|
|
Прирост BMD Neck, % |
25 |
1,5 [ -1,2; 5,3] |
25 |
3,2 [ 1,9; 7,6] |
0,1903¹ |
|
|
Прирост BMD Radius Total, % |
24 |
2,35 [ -0,8; 7,55] |
23 |
1,8 [ -1,7; 3,5] |
0,5371¹ |
|
|
Прирост BMD Radius 33%, % |
24 |
2,45 [ -1,45; 6,4] |
23 |
3,2 [ -2,1; 6,0] |
0,8900¹ |
|
Сокращения: МПК — минеральная плотность костной ткани.
Примечания: 1 — критерий Манна-Уитни; 3 — критерий Фримена-Холтона. Поправка Бонферрони: р0 = 0,05/64 = 0,0008.
Дополнительно мы проанализировали показатели кальций-фосфорного обмена в раннем послеоперационном периоде, статистически значимых различий между группами не выявлено.
При сопоставлении групп по параметрам 3D-DXA на дооперационном этапе статистически значимых различий также не определялось.
Для оценки темпов восстановления костной ткани на фоне стойкой ремиссии ПГПТ нами был рассчитан абсолютный прирост МПК по результатам DXA в основных отделах скелета и 3D-DXA в бедренной кости. В обеих группах показатели были сопоставимы. Изменения на уровне статистической тенденции были получены для параметров 3D-DXA, итоговые абсолютные значения которых были несколько выше во второй группе. Так, выше были показатели толщины кортикального слоя в бедренной кости в целом (1,78 [ 1,71; 1,84] мм против 1,90 [ 1,80; 1,96] мм, р=0,0062) и в ее шейке (1,50 [ 1,40; 1,62] мм против 1,63 [ 1,52; 1,70] мм, р=0,0130), более подробно результаты представлены в таблице 3. Пример визуализации динамических изменений МПК при 3D-DXA представлен на рис. 2.
Таблица 3. Сравнительная характеристика групп по результатам 3D-DXA до и после операции
|
Признак |
Пациенты, принимающие бисфосфонаты перед операцией |
Пациенты, не принимающие бисфосфонаты перед операцией |
р |
||
|
N |
Me [ Q1; Q3] / n (%) |
N |
Me [ Q1; Q3] / n (%) |
||
|
Данные 3D-DXA до операции |
|||||
|
Минеральная плотность поверхности кортикальной кости TH (мг/см²) |
25 |
132,01 [ 121,84; 141,21] |
25 |
139,13 [ 118,30; 149,55] |
0,5094¹ |
|
Минеральная плотность поверхности кортикальной кости FN (мг/см²) |
25 |
110,02 [ 94,31; 115,28] |
25 |
116,77 [ 104,03; 124,89] |
0,1352¹ |
|
Объем минеральной плотности трабекулярной кости TH (мг/см³) |
25 |
120,02 [ 94,73; 132,14] |
25 |
126,61 [ 107,36; 147,17] |
0,1567¹ |
|
Объем минеральной плотности трабекулярной кости FN (мг/см³) |
25 |
169,42 [ 157,69; 175,44] |
25 |
170,94 [ 134,67; 188,07] |
0,7562¹ |
|
Объем минеральной плотности кортикальной кости TH (мг/см³) |
25 |
728,55 [ 705,80; 763,64] |
25 |
730,46 [ 683,86; 777,71] |
0,9690¹ |
|
Объем минеральной плотности кортикальной кости FN (мг/см³) |
25 |
727,00 [ 693,61; 757,71] |
25 |
739,69 [ 688,79; 775,12] |
0,6695¹ |
|
Толщина кортикальной кости с ТН (мм) |
25 |
1,78 [ 1,74; 1,85] |
25 |
1,84 [ 1,76; 1,94] |
0,1352¹ |
|
Толщина кортикальной кости в FN (мм) |
25 |
1,51 [ 1,43; 1,59] |
25 |
1,59 [ 1,49; 1,69] |
0,0523¹ |
|
Данные 3D-DXA после операции |
|||||
|
Минеральная плотность поверхности кортикальной кости TH (мг/см²) |
25 |
135,94 [ 123,15; 147,07] |
25 |
140,49 [ 131,86; 157,12] |
0,1683¹ |
|
Минеральная плотность поверхности кортикальной кости FN (мг/см²) |
25 |
106,87 [ 103,72; 113,95] |
25 |
121,18 [ 106,24; 125,63] |
0,0572¹ |
|
Объем минеральной плотности трабекулярной кости TH (мг/см³) |
25 |
132,59 [ 106,23; 143,80] |
25 |
139,57 [ 126,39; 161,94] |
0,1073¹ |
|
Объем минеральной плотности трабекулярной кости FN (мг/см³) |
25 |
177,37 [ 159,89; 192,46] |
25 |
184,81 [ 153,66; 201,67] |
0,3320¹ |
|
Объем минеральной плотности кортикальной кости TH (мг/см³) |
25 |
754,30 [ 714,50; 783,87] |
25 |
731,65 [ 701,05; 786,30] |
0,7562¹ |
|
Объем минеральной плотности кортикальной кости FN (мг/см³) |
25 |
747,08 [ 700,96; 768,78] |
25 |
732,91 [ 698,32; 789,36] |
0,8462¹ |
|
Толщина кортикальной кости с ТН (мм) |
25 |
1,78 [ 1,71; 1,84] |
25 |
1,90 [ 1,80; 1,96] |
0,0062¹ |
|
Толщина кортикальной кости в FN (мм) |
25 |
1,50 [ 1,40; 1,62] |
25 |
1,63 [ 1,52; 1,70] |
0,0130¹ |
Примечания: 1 — критерий Манна-Уитни. Поправка Бонферрони: р0 = 0,05/64 = 0,0008.
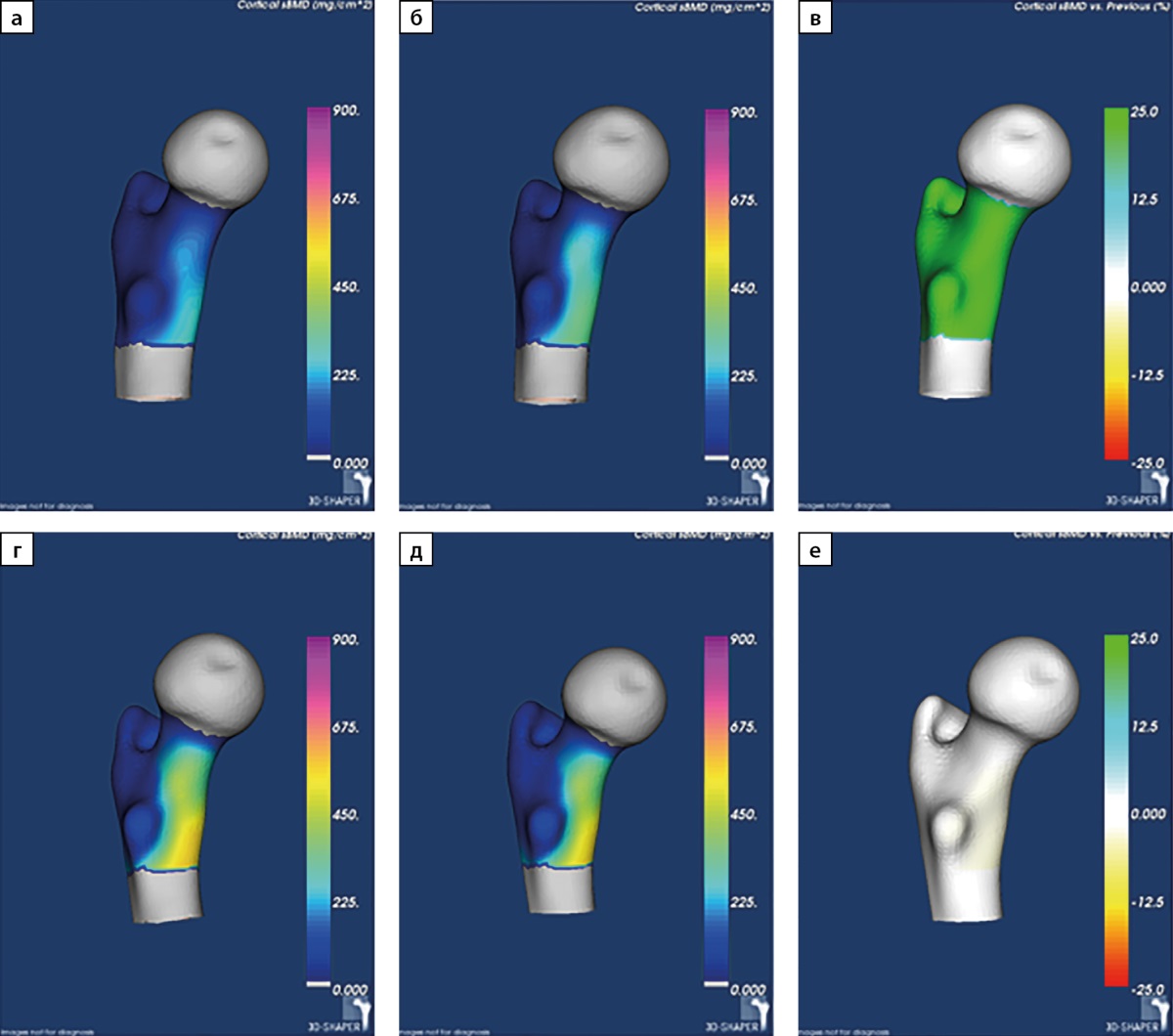
Рисунок 2. Пример визуализации минеральной плотности поверхности кортикальной кости в динамике, полученные с помощью программного обеспечения 3D-Shaper.
Примечание: а)-в) пациент из группы 1; г)-е) пациент из группы 2.а), г) визуализация минеральной плотности поверхности кортикальной кости дорсального отдела бедренной кости до ПТЭ (мг/см²); б), д) визуализация минеральной плотности поверхности кортикальной кости дорсального отдела бедренной кости после ПТЭ (мг/см²); в), е) визуализация изменения минеральной плотности поверхности кортикальной кости дорсального отдела бедренной кости до ПТЭ и после ПТЭ; изменение минеральной плотности поверхности кортикальной кости показано в виде ее прироста после ПТЭ относительно бывшей минеральной плотности поверхности кортикальной кости до ПТЭ (%).
Компрессионные переломы в послеоперационном периоде произошли у одного пациента (1/13, 8%) из группы 1 и у одного из группы 2 (1/14, 7%).
Далее мы провели анализ послеоперационных изменений внутри каждой группы. При сравнении результатов DXA у пациентов, получавших БФ до ПТЭ (табл. 4), статистически значимые различия по абсолютным значениям МПК были получены только в поясничном отделе позвоночника (0,913 [ 0,8495; 0,935] против 0,9535 [ 0,877; 1,004], р<0,001) (рис. 3), изменения в бедренной и лучевой костях находились на уровне статистической тенденции (табл. 4). По данным 3D-DXA, статистически значимые различия были выявлены лишь по объему минеральной плотности трабекулярной кости в бедре в целом (120,02 [ 94,73; 132,14] мг/см³ против 132,59 [ 106,23; 143,80] мг/см³, р=0,001) (рис. 4).
Таблица 4. Динамическая характеристика состояния костной ткани в группе 1 после ПТЭ
|
Признак |
До операции |
После операции |
p, W |
|||
|
N |
Me [ Q1; Q3] |
N |
Me [ Q1; Q3] |
|||
|
Данные DXA |
||||||
|
BMD |
BMD L1-L4 |
24 |
0,913 [ 0,8495; 0,953] |
24 |
0,9535 [ 0,877; 1,004] |
<0,001 |
|
BMD total hip |
25 |
0,812 [ 0,775; 0,844] |
25 |
0,843 [ 0,788; 0,878] |
0,008 |
|
|
BMD Neck |
25 |
0,772 [ 0,718; 0,816] |
25 |
0,778 [ 0,754; 0,817] |
0,044 |
|
|
BMD Radius Total |
25 |
0,478 [ 0,411; 0,530] |
24 |
0,4905 [ 0,424; 0,521] |
0,019 |
|
|
BMD Radius 33% |
25 |
0,619 [ 0,527; 0,651] |
24 |
0,619 [ 0,5595; 0,665] |
0,023 |
|
|
Данные 3D-DXA |
||||||
|
Минеральная плотность поверхности кортикальной кости TH (мг/см²) |
25 |
132,01 [ 121,84; 141,21] |
25 |
135,94 [ 123,15; 147,07] |
0,035 |
|
|
Минеральная плотность поверхности кортикальной кости FN (мг/см²) |
25 |
110,02 [ 94,31; 115,28] |
25 |
106,87 [ 103,72; 113,95] |
0,367 |
|
|
Объем минеральной плотности трабекулярной кости TH (мг/см³) |
25 |
120,02 [ 94,73; 132,14] |
25 |
132,59 [ 106,23; 143,80] |
0,001 |
|
|
Объем минеральной плотности трабекулярной кости FN (мг/см³) |
25 |
169,42 [ 157,69; 175,44] |
25 |
177,37 [ 159,89; 192,46] |
0,010 |
|
|
Объем минеральной плотности кортикальной кости TH (мг/см³) |
25 |
728,55 [ 705,80; 763,64] |
25 |
754,30 [ 714,50; 783,87] |
0,069 |
|
|
Объем минеральной плотности кортикальной кости FN (мг/см³) |
25 |
727,00 [ 693,61; 757,71] |
25 |
747,08 [ 700,96; 768,78] |
0,040 |
|
|
Толщина кортикальной кости с ТН (мм) |
25 |
1,78 [ 1,74; 1,85] |
25 |
1,78 [ 1,71; 1,84] |
0,581 |
|
|
Толщина кортикальной кости в FN (мм) |
25 |
1,51 [ 1,43; 1,59] |
25 |
1,50 [ 1,40; 1,62] |
0,459 |
|
Сокращения: иПТГ — интактный паратгормон.
Примечание: поправка Бонферрони: р0 = 0,05/13 = 0,0038.
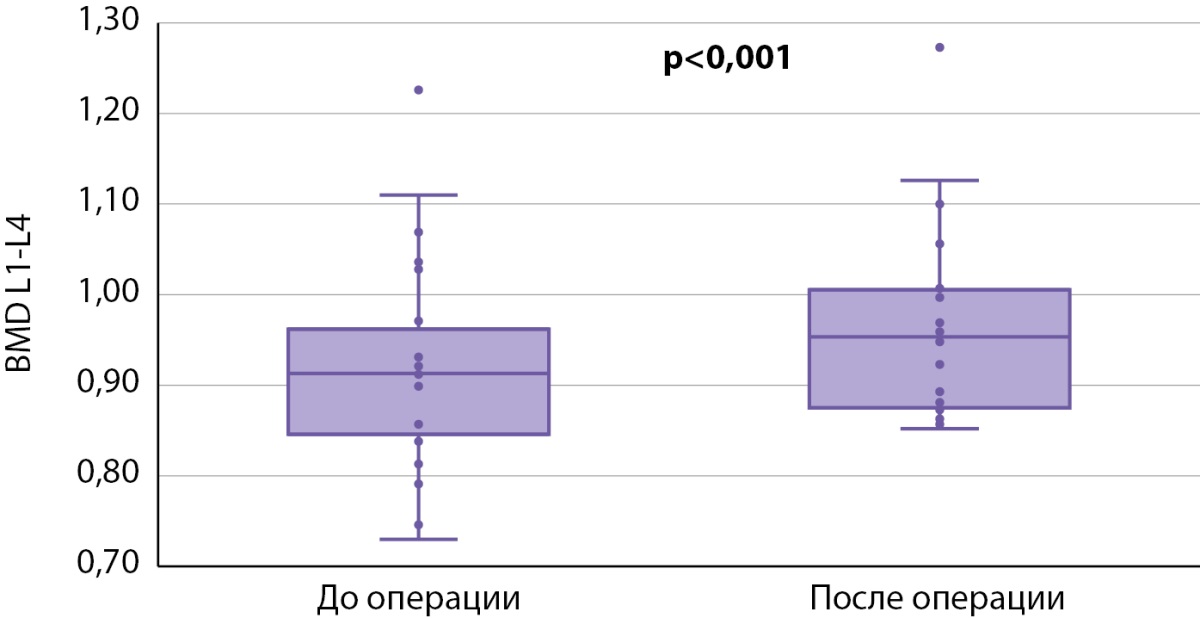
Рисунок 3. Признаки DXA, по которым обнаружены статистически значимые различия в динамике в группе 1.
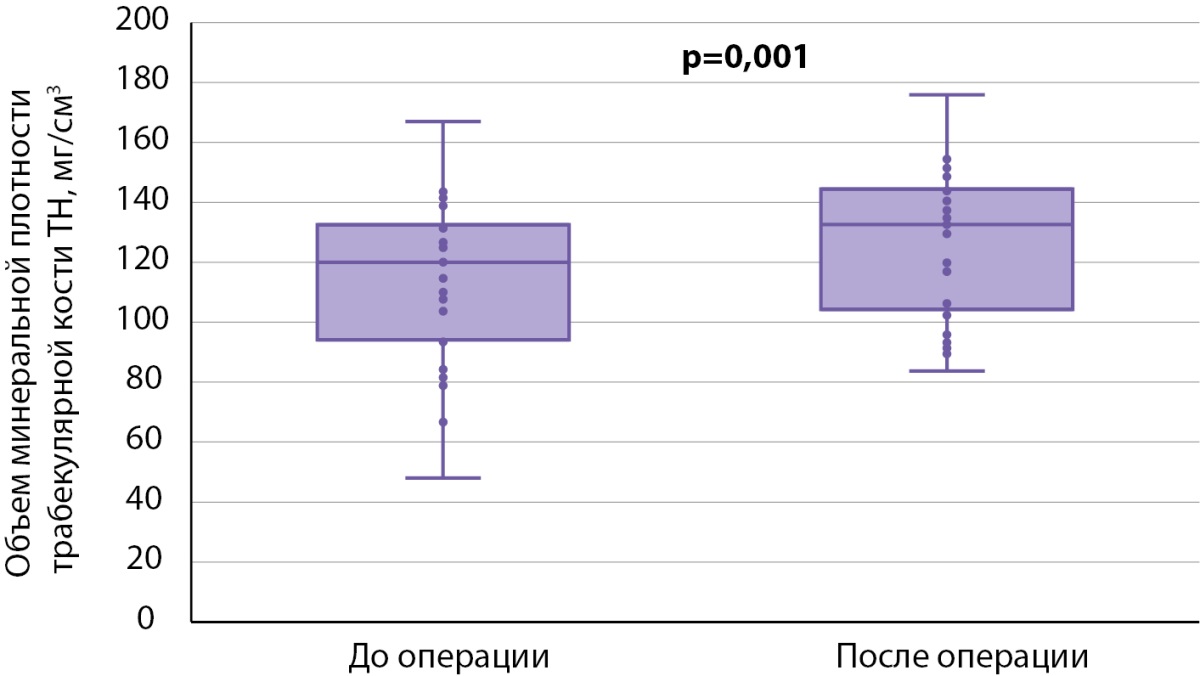
Рисунок 4. Признаки 3D-DXA, по которым обнаружены статистически значимые различия в динамике в группе 1.
При анализе до- и послеоперационных результатов DXA во второй группе (табл. 5) статистически значимые различия по абсолютным показателям МПК наблюдались в поясничном отделе (0,873 [ 0,842; 0,984] против 0,956 [ 0,892; 1,075], р<0,001), в бедре в целом (0,855 [ 0,749; 0,898] против 0,882 [ 0,790; 0,943], р<0,001) и его шейке (0,800 [ 0,722; 0,836] против 0,816 [ 0,749; 0,876], р=0,001) (рис. 5).
Таблица 5. Сравнение групп пациентов, не принимающих медикаментозную терапию перед операцией, в динамике
|
Признак |
До операции |
После операции |
p, W |
|||
|
N |
Me [ Q1; Q3] |
N |
Me [ Q1; Q3] |
|||
|
Данные DXA |
||||||
|
BMD |
BMD L1-L4 |
25 |
0,873 [ 0,842; 0,984] |
25 |
0,956 [ 0,892; 1,075] |
<0,001 |
|
BMD total hip |
25 |
0,855 [ 0,749; 0,898] |
25 |
0,882 [ 0,790; 0,943] |
<0,001 |
|
|
BMD Neck |
25 |
0,800 [ 0,722; 0,836] |
25 |
0,816 [ 0,749; 0,876] |
0,001 |
|
|
BMD Radius Total |
23 |
0,479 [ 0,407; 0,562] |
23 |
0,499 [ 0,411; 0,565] |
0,089 |
|
|
BMD Radius 33% |
23 |
0,608 [ 0,533; 0,699] |
23 |
0,634 [ 0,524; 0,704] |
0,053 |
|
|
Данные 3D-DXA |
||||||
|
Минеральная плотность поверхности кортикальной кости TH (мг/см²) |
25 |
139,13 [ 118,30; 149,55] |
25 |
140,49 [ 131,86; 157,12] |
0,001 |
|
|
Минеральная плотность поверхности кортикальной кости FN (мг/см²) |
25 |
116,77 [ 104,03; 124,89] |
25 |
121,18 [ 106,24; 125,63] |
0,021 |
|
|
Объем минеральной плотности трабекулярной кости TH (мг/см³) |
25 |
126,61 [ 107,36; 147,17] |
25 |
139,57 [ 126,39; 161,94] |
<0,001 |
|
|
Объем минеральной плотности трабекулярной кости FN (мг/см³) |
25 |
170,94 [ 134,67; 188,07] |
25 |
184,81 [ 153,66; 201,67] |
<0,001 |
|
|
Объем минеральной плотности кортикальной кости TH (мг/см³) |
25 |
730,46 [ 683,86; 777,71] |
25 |
731,65 [ 701,05; 786,30] |
0,051 |
|
|
Объем минеральной плотности кортикальной кости FN (мг/см³) |
25 |
739,69 [ 688,79; 775,12] |
25 |
732,91 [ 698,32; 789,36] |
0,135 |
|
|
Толщина кортикальной кости с ТН (мм) |
25 |
1,84 [ 1,76; 1,94] |
25 |
1,90 [ 1,80; 1,96] |
0,009 |
|
|
Толщина кортикальной кости в FN (мм) |
25 |
1,59 [ 1,49; 1,69] |
25 |
1,63 [ 1,52; 1,70] |
0,221 |
|
Сокращения: иПТГ — интактный паратгормон.
Примечание: поправка Бонферрони: р0 = 0,05/13 = 0,0038.
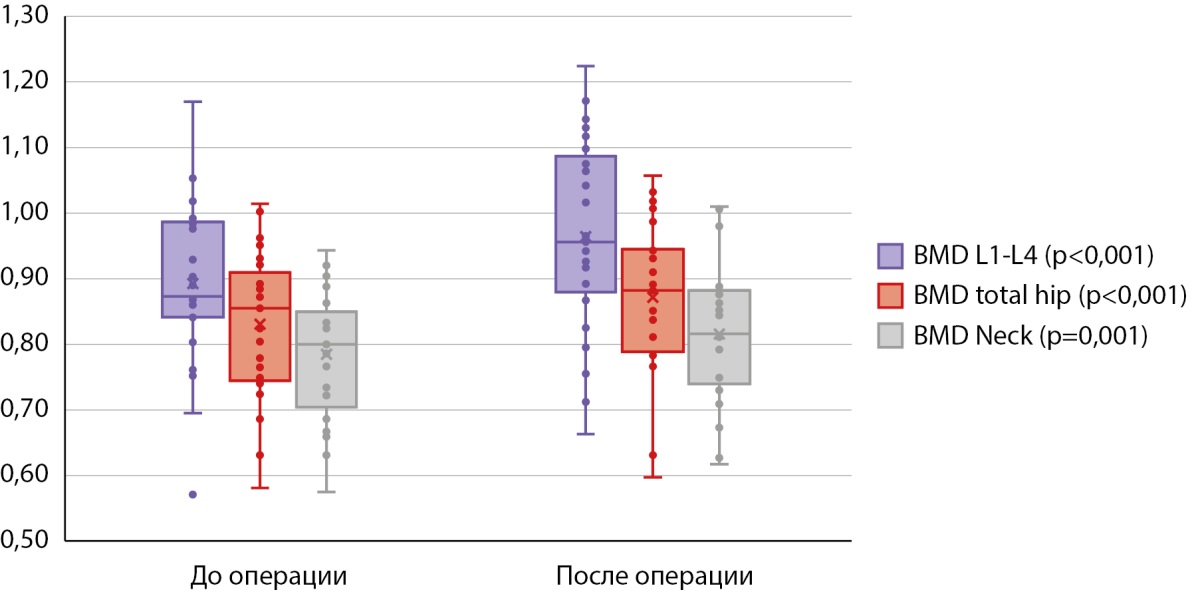
Рисунок 5. Признаки DXA, по которым обнаружены статистически значимые различия в динамике в группе 2.
По данным 3D-DXA, статистически значимые различия были выявлены по трем из восьми проанализированных показателей. Здесь так же, как и в случае с группой пациентов, принимающих бисфосфонаты в дооперационном периоде, увеличились объем минеральной плотности трабекулярной кости в бедре в целом (126,32 [ 107,36; 147,17] мг/см³ против 139,57 [ 126,39; 161,94] мг/см³, р<0,001) и его шейке (170,94 [ 134,67; 188,07] мг/см³ против 184,81 [ 153,66; 201,67] мг/см³, р<0,001) (рис. 6). Статистически значимые различия дополнительно наблюдались по минеральной плотности поверхности кортикальной кости в бедре в целом (139,13 [ 118,30; 149,55] мг/см² против 140,49 [ 131,86; 157,12] мг/см², р=0,001).
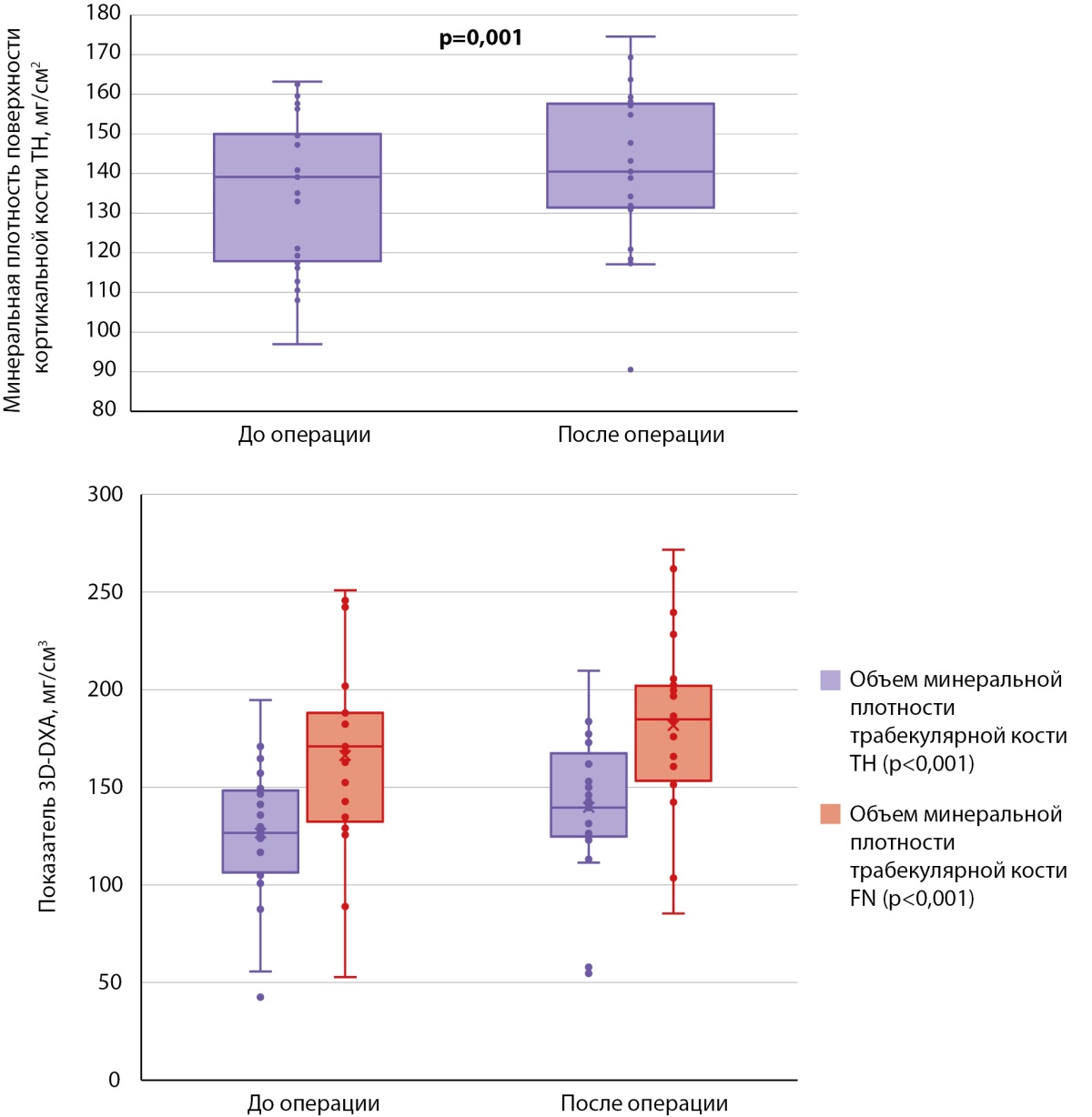
Рисунок 6. Признаки 3D-DXA, по которым обнаружены статистически значимые различия в динамике в группе 2.
ОБСУЖДЕНИЕ
Репрезентативность выборок
Набор участников проводился только в ФГБУ «НМИЦ эндокринологии» Минздрава России — экспертном учреждении, в которое направляются пациенты с тяжелым и/или нетипичным течением заболевания, что ограничивает репрезентативность полученной выборки.
Сопоставление с другими публикациями
Единственным патогенетическим методом лечения ПГПТ остается ПТЭ, при этом наличие костных осложнений заболевания в виде снижения МПК и/или наличия НЭП вынесено экспертами в качестве самостоятельного абсолютного показания к операции [5]. Многочисленные исследования подтверждают непосредственное положительное влияние удаления измененных ОЩЖ на состояние костной ткани без применения дополнительной антиостеопоротической терапии. Быстрый прирост МПК в проксимальном отделе бедренной кости и поясничном отделе позвоночника наблюдается в течение первых 1–2 лет после операции, кроме того, улучшаются значения трабекулярного костного индекса, отражающего микроархитектонику костной ткани [8][9]. Важно отметить, что данные изменения определяются и у пациентов старшей возрастной группы (>75 лет) [10]. Дальнейший прирост МПК может сохраняться на протяжении достаточно длительного периода времени (10–15 лет после ПТЭ), достигая +8% в поясничном отделе позвоночника и +5% в шейке бедренной кости относительно исходных значений. Помимо влияния на МПК, хирургическое лечение ассоциировано с достоверным снижением риска переломов. По результатам метаанализа Kongsaree N. и соавт. (73 778 человек в группе ПТЭ против 164 410 человек в группе наблюдения), хирургическое лечение приводило к достоверному снижению риска перелома в любом отделе скелета в целом (ОР 0,80; 95% ДИ, 0,74–0,86), и — отдельно — в бедренной кости (ОР, 0,63; 95% ДИ, 0,52–0,76) [11].
Антиостеопоротическая терапия у пациентов с ПГПТ остается важным инструментом для дооперационной коррекции гиперкальциемии, а также улучшает состояние костной ткани среди лиц, для которых операция должна быть отложена или не может быть проведена ввиду высоких периоперационных рисков [5]. В ряде работ продемонстрировано положительное влияние консервативной терапии (БФ и деносумаба) на МПК, а также на показатели кальций-фосфорного обмена и маркеров костного ремоделирования при бессимптомных формах ПГПТ или при невозможности проведения ПТЭ. В то же время снижения частоты новых переломов, как основного критерия эффективности антиостеопоротической терапии, не отмечалось [12][13].
Исследования по оценке комбинированного медикаментозного и хирургического лечения костных нарушений у пациентов с ПГПТ лимитированы, хотя данный вопрос крайне актуален для российской популяции. По результатам анализа Базы данных клинико-эпидемиологического мониторинга ПГПТ, в РФ примерно 1/3 пациентов (28,7%) принимают или принимали бисфосфонаты в различных режимах (преимущественно алендронат 70 мг 1 раз в неделю) [4].
Может ли данная терапия сказаться на восстановлении костной ткани после операции — открытый вопрос, требующий дополнительных исследований. Бисфосфонаты эффективно подавляют избыточную костную резорбцию благодаря высокой аффинности к кристаллам гидроксиапатита, преимущественно в местах активного ремоделирования кости, но не влияют на костный синтез. За счет такого механизма действия данные препараты способны длительно находиться в костном депо (до 10 лет). При постменопаузальном остеопорозе подавление избыточной активности остеокластов имеет преимущества, так как костное ремоделирование становится более сбалансированным [14]. Однако при ПГПТ патогенез костных нарушений иной, что в целом связано с высоким костным обменом на фоне избыточной гиперсекреции ПТГ. После ПТЭ секреция ПТГ возвращается к физиологическому «пульсовому» режиму, стимулирующему как костеобразование, так и костную резорбцию. В послеоперационном периоде оба процесса крайне важны для удаления дефектной костной ткани и замещения ее новой с достаточными прочностью и упругостью [15]. Можно предположить, что назначение БФ может мешать активному костеобразованию. Так, в исследовании PaTH, в котором изучалась эффективность рекомбинантного ПТГ в моно- или комбинированной терапии с бисфосфонатами среди пациентов с постменопаузальным остеопорозом, было выявлено значительное увеличение образования костной ткани именно в первой группе. Авторы пришли к выводу, что комбинированная терапия подавляет анаболическое влияние аналога ПТГ на костную ткань [16].
Важной характеристикой нашего исследования является сопоставимость групп по исходным значениям МПК накануне операции. Это позволило нивелировать влияние степени выраженности костных осложнений ПГПТ до операции на темпы прироста МПК после. При сравнении абсолютных показателей и процента прироста МПК в различных отделах скелета до и после ПТЭ группы оказались сопоставимы, что подтверждает положительные изменения после операции в обеих группах. В целом, это не противоречит данным Orr L.E. и соавт. [7]. Авторы провели ретроспективное когортное исследование 1737 пациентов с первичным гиперпаратиреозом, которые были разделены на 5 групп в зависимости от проводимой терапии: наблюдение, монотерапия бисфосфонатами, ПТЭ, бисфосфонаты, затем ПТЭ; ПТЭ, после бисфосфонаты. В отличие от нашего исследования сравнительный анализ по приросту МПК проводился только между группами ПТЭ и ПТЭ далее БФ, что прежде всего было связано с нехваткой данных DXA. Достоверных различий не наблюдалось, изменения МПК в бедренной кости составили +5,50%, (95% ДИ 3,39; 7,61) и + 6,30% (95% ДИ 2,53; 10,07) соответственно. Chor HJ. и соавт. также сопоставили эффективность комбинированного лечения (ПТЭ и затем БФ) по сравнению с изолированной ПТЭ. Но в отличие от предыдущей работы, Chor HJ. и cоавт. был сделан вывод, что у пациентов с остеопорозом на комбинированной терапии нет преимуществ по сравнению с пациентами, не принимавшими БФ, и напротив, данная комбинация могла препятствовать увеличению костной массы в послеоперационном периоде [17].
Важно отметить, что показатели МПК все же остаются суррогатным критерием при оценке эффективности антиостеопротической терапии. Основным критерием остается отсутствие новых НЭП. Несмотря на положительные изменения МПК, новые компрессионные переломы произошли в обеих группах, при этом частота их развития была сопоставима. Вероятно, к основной причине новых НЭП можно отнести исходно значимые изменения в костной ткани до операции и недостаточный период восстановления после нее. В исследовании Orr L.E. и соавт. ПТЭ, а также прием бисфосфонатов с последующей ПТЭ были ассоциированы со снижением риска PTX (ОР 0,55, 95% ДИ 0,35; 0,84 и ОР 0,46, 95% ДИ 0,25; 0,83 соответственно), что указывает на то, что предшествующая медикаментозная терапия не исключала положительного влияния операции. Напротив, прием БФ, инициированный после ПТЭ, не имел преимуществ в снижении риска НЭП. И более того, авторы пришли к выводу о том, что назначение БФ после операции может нивелировать положительное влияние ПТЭ на риск переломов [7]. Однако, с учетом фармакокинетики препаратов, их способности длительно сохраняться в костном депо, и таким образом влиять на ремоделирование, «временное» деление на до и после ПТЭ может быть условным.
В пользу наибольшего влияния именно операции на риск переломов выступают результаты метаанализа Kongsaree N. и соавт., включающем более 230 тыс. пациентов с ПГПТ (73 778 человек в группе ПТЭ против 164 410 человек в группе наблюдения). ПТЭ ассоциировалась с достоверным снижением риска перелома в любом отделе скелета (ОР 0,80; 95% ДИ, 0,74–0,86), а также отдельно перелома бедренной кости (ОР, 0,63; 95% ДИ, 0,52–0,76). При этом снижения риска переломов костей предплечья и позвонков не наблюдалось (переломы у 3574 и 3795 пациентов соответственно) [11].
Исследования с применением технологии 3D-DXA при ПГПТ пока немногочисленны, и в основном касались сравнительного анализа минеральных характеристик кортикального и трабекулярного компонентов между пациентами с ПГПТ и здоровыми добровольцами, а также лицами с постменопаузальным остеопорозом. Пациенты с ПГПТ ожидаемо характеризовались худшими значениями поверхностной минеральной плотности и толщины кортикальной ткани, различия по общей и трабекулярной объемной плотности были продемонстрированы только при сопоставлении с группой постменопаузального остеопороза [18][19]. Таким образом, устранение избытка ПТГ в первую очередь должно сказаться на состоянии именно кортикального компонента. В нашем исследовании у пациентов без предшествующей антиостеопоротической терапии после ПТЭ на уровне статистической тенденции отмечались более высокие значения толщины кортикального слоя в бедренной кости в целом и в его шейке, что потенциально указывает на негативное влияние бисфосфонатов на восстановление кортикального компонента после операции. Данную гипотезу поддерживают результаты, полученные нами при сопоставлении как абсолютных значений МПК, так и объемных и поверхностных характеристик внутри группы. Для пациентов с ПТЭ без приема БФ в анамнезе статистически значимые различия были обнаружены по большему числу признаков. При этом они затрагивали как абсолютные значения МПК (в поясничном отделе позвоночника, бедре в целом и шейке), так и параметры 3D-DXA (объем минеральной плотности трабекулярной кости в бедре в целом и его шейке, минеральной плотности поверхности кортикальной кости в бедре в целом).
ЗАКЛЮЧЕНИЕ
Метод 3D-DXA позволяет получить объемные данные о костной структуре, что помогает более точно оценить не только минеральную плотность, но и микроархитектонику костной ткани. Кроме того, данный метод может помочь в оценке функционального состояния костей и предсказании риска переломов, что крайне важно для пациентов с ПГПТ. Учитывая частое назначение бисфосфонатов накануне ПТЭ, актуальным остается вопрос о влиянии данной терапии на послеоперационное течение заболевания. Некоторые исследования сосредоточились на возможности назначения бисфосфонатов после хирургического вмешательства, однако основные выводы указывают на отсутствие преимуществ такого подхода и, более того, на потенциально негативное влияние на риск переломов. В настоящем исследовании впервые был проведен детальный анализ влияния предоперационной терапии бисфосфонатами на динамику показателей МПК у пациентов с ПГПТ через год после паратиреоидэктомии с использованием как DXA, так и 3D-DXA. Согласно полученным результатам восстановление МПК в группе бисфосфонатов в комбинации с ПТЭ по сравнению с изолированным хирургическим лечением протекало хуже, особенно в отношении кортикальной костной ткани. Требуются дальнейшие исследования для подтверждения полученных данных.
Направления дальнейших исследований
В дальнейшем планируется расширение выборки пациентов и увеличение срока наблюдения за пациентами.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Участие авторов. Першина-Милютина А.П. — существенный вклад в концепцию исследования, в получение, анализ данных и интерпретацию результатов, написание статьи; Еремкина А.К. — существенный вклад в дизайн исследования, в получение данных и интерпретацию результатов, написание статьи; Ожималов И.Д. — существенный вклад в получение данных, интерпретацию результатов, написание статьи; Хайриева А.В.— существенный вклад в получение данных, интерпретацию результатов; Горбачева А.М. — существенный вклад в концепцию исследования, интерпретацию результатов; Ронжина С.В. — существенный вклад в получение данных, интерпретацию результатов; Мокрышева Н.Г. — внесение в рукопись существенной (важной) правки с целью повышения научной ценности статьи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Khan AA, Hanley DA, Rizzoli R, Bollerslev J, Young JE, et al. Primary hyperparathyroidism: review and recommendations on evaluation, diagnosis, and management. A Canadian and international consensus. Osteoporos Int. 2017;28(1):1-19. doi: https://doi.org/10.1007/s00198-016-3716-2
2. Fraser WD. Hyperparathyroidism. Lancet. 2009;374(9684):145-58. doi: https://doi.org/10.1016/S0140-6736(09)60507-9
3. Мокрышева Н.Г., Мирная С.С., Добрева Е.А., Маганева И.С., Ковалева Е.В., и др. Первичный гиперпаратиреоз в России по данным регистра. // Проблемы эндокринологии. — 2019. — Т. 65. — №5. — С. 300-310. doi: https://doi.org/10.14341/probl10126
4. Mokrysheva NG, Eremkina AK, Elfimova AR, Kovaleva EV, Miliutina AP, et al. The Russian registry of primary hyperparathyroidism, latest update. Front Endocrinol (Lausanne). 2023;14:1203437. doi: https://doi.org/10.3389/fendo.2023.1203437
5. Дедов И.И., Мельниченко Г.А., Мокрышева Н.Г., Андреева Е.Н., Анциферов М.Б., и др. Проект клинических рекомендаций по диагностике и лечению первичного гиперпаратиреоза у взрослых пациентов. // Эндокринная хирургия. — 2022. — Т. 16. — №4. — С. 5-54. doi: https://doi.org/10.14341/serg12790
6. Drake MT, Clarke BL, Khosla S. Bisphosphonates: mechanism of action and role in clinical practice. Mayo Clin Proc. 2008;83(9):1032-45. doi: https://doi.org/10.4065/83.9.1032
7. Orr LE, Zhou H, Zhu CY, Haigh PI, Adams AL, Yeh MW. Skeletal effects of combined medical and surgical management of primary hyperparathyroidism. Surgery. 2020;167(1):144-148. doi: https://doi.org/10.1016/j.surg.2019.04.059
8. Eller-Vainicher C, Filopanti M, Palmieri S, Ulivieri FM, Morelli V, et al. Bone quality, as measured by trabecular bone score, in patients with primary hyperparathyroidism. Eur J Endocrinol. 2013;169(2):155-62. doi: https://doi.org/10.1530/EJE-13-0305
9. Ye Z, Silverberg SJ, Sreekanta A, Tong K, Wang Y, et al. The Efficacy and Safety of Medical and Surgical Therapy in Patients With Primary Hyperparathyroidism: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. J Bone Miner Res. 2022;37(11):2351-2372. doi: https://doi.org/10.1002/jbmr.4685
10. Hangge PT, Norain A, Butterfield RJ 3rd, Wasif N, Cronin PA, Stucky CH. Parathyroidectomy in the elderly is beneficial and safe with similar improvements in postoperative bone mineral density. Am J Surg. 2022;224(1 Pt A):147-152. doi: https://doi.org/10.1016/j.amjsurg.2022.04.031
11. Kongsaree N, Thanyajaroen T, Dechates B, Therawit P, Mahikul W, Ngaosuwan K. Skeletal Effect of Parathyroidectomy on Patients With Primary Hyperparathyroidism: A Systematic Review and Meta-Analysis. J Clin Endocrinol Metab. 2024;109(10):e1922-e1935. doi: https://doi.org/10.1210/clinem/dgae326
12. Rajput S, Dutta A, Rajender S, Mithal A, Chattopadhyay N. Efficacy of antiresorptive agents bisphosphonates and denosumab in mitigating hypercalcemia and bone loss in primary hyperparathyroidism: A systematic review and meta-analysis. Front Endocrinol (Lausanne). 2023;14:1098841. doi: https://doi.org/10.3389/fendo.2023.1098841
13. Segula D, Nikolova T, Marks E, Ranganath L, Mishra V. Long Term Outcome of Bisphosphonate Therapy in Patients with Primary Hyperparathyroidism. Int J Clin Med. 2014;05(14):829-835. doi: https://doi.org/10.4236/ijcm.2014.514111
14. Hsieh S-C, Kibret T, Hamid JS, et al. Bisphosphonates for postmenopausal osteoporosis: a network meta-analysis. Cochrane Database Syst Rev. 2023;2023(9). doi: https://doi.org/10.1002/14651858.CD015008
15. Iwanowska M, Kochman M, Szatko A, Zgliczyński W, Glinicki P. Bone Disease in Primary Hyperparathyroidism-Changes Occurring in Bone Metabolism and New Potential Treatment Strategies. Int J Mol Sci. 2024;25(21):11639. doi: https://doi.org/10.3390/ijms252111639
16. Black DM, Greenspan SL, Ensrud KE, Palermo L, McGowan JA, et al. The effects of parathyroid hormone and alendronate alone or in combination in postmenopausal osteoporosis. N Engl J Med. 2003;349(13):1207-15. doi: https://doi.org/10.1056/NEJMoa031975
17. Choe HJ, Koo BK, Yi KH, Kong SH, Kim JH, Shin CS, Chai JW, Kim SW. Skeletal effects of combined bisphosphonates treatment and parathyroidectomy in osteoporotic patients with primary hyperparathyroidism. J Bone Miner Metab. 2022;40(2):292-300. doi: https://doi.org/10.1007/s00774-021-01279-2
18. Arboiro-Pinel R, Mahíllo-Fernández I, Díaz-Curiel M. Bone Analysis Using Trabecular Bone Score and Dual-Energy X-Ray Absorptiometry-Based 3-Dimensional Modeling in Postmenopausal Women With Primary Hyperparathyroidism. Endocr Pract. 2022;28(1):83-89. doi: https://doi.org/10.1016/j.eprac.2021.08.006
19. Arboiro-Pinel R, Mahillo-Fernández I, Díaz-Curiel M. Primary Hyperparathyroidism: Assessment of the Effects of Parathyroidectomy Using Dual X-Ray Absorptiometry, Trabecular Bone Score, and Dual X-Ray Absorptiometry-Based Three-Dimensional Modeling. Endocr Pract. 2024;30(4):340-347. doi: https://doi.org/10.1016/j.eprac.2024.01.004
Об авторах
А. П. Першина-МилютинаРоссия
Першина-Милютина Анастасия Павловна
117036, Москва, ул. Дм. Ульянова, д. 11
А. К. Еремкина
Россия
Еремкина Анна Константиновна, к.м.н.
Москва
И. Д. Ожималов
Россия
Ожималов Илья Дмитриевич
Москва
А. В. Хайриева
Россия
Хайриева Ангелина Владимировна
Москва
А. М. Горбачева
Россия
Горбачева Анна Максимовна
Москва
С. В. Ронжина
Россия
Ронжина Светлана Владимировна
Москва
Н. Г. Мокрышева
Россия
Мокрышева Наталья Георгиевна, д.м.н., профессор
Москва
Дополнительные файлы
|
|
1. Рисунок 1. Дизайн формирования групп исследования. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(412KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Пример визуализации минеральной плотности поверхности кортикальной кости в динамике, полученные с помощью программного обеспечения 3D-Shaper. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(768KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Признаки DXA, по которым обнаружены статистически значимые различия в динамике в группе 1. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(152KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Признаки 3D-DXA, по которым обнаружены статистически значимые различия в динамике в группе 1. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(199KB)
|
Метаданные ▾ | |
|
|
5. Рисунок 5. Признаки DXA, по которым обнаружены статистически значимые различия в динамике в группе 2 | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(255KB)
|
Метаданные ▾ | |
|
|
6. Рисунок 6. Признаки 3D-DXA, по которым обнаружены статистически значимые различия в динамике в группе 2. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(564KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Першина-Милютина А.П., Еремкина А.К., Ожималов И.Д., Хайриева А.В., Горбачева А.М., Ронжина С.В., Мокрышева Н.Г. Влияние дооперационной терапии бисфосфонатами на минеральную плотность костной ткани у пациентов с ПГПТ через год после паратиреоидэктомии. Проблемы Эндокринологии. 2025;71(4):57-70. https://doi.org/10.14341/probl13574
For citation:
Pershina-Miliutina A.P., Eremkina A.K., Ozhimalov I.D., Khairieva А.V., Gorbacheva A.M., Ronzhina S.V., Mokrysheva N.G. Effect of preoperative bisphosphonate therapy on bone mineral density in patients with primary hyperparathyroidism one year after parathyroidectomy. Problems of Endocrinology. 2025;71(4):57-70. (In Russ.) https://doi.org/10.14341/probl13574

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).









































.jpg)


