Перейти к:
Узловой токсический зоб у детей: особенности клинической картины, морфологические варианты
https://doi.org/10.14341/probl12738
Аннотация
ОБОСНОВАНИЕ. Токсический узловой зоб (ТУЗ) — редкое заболевание, при котором причиной гипертиреоза является наличие узла или узлов, автономно секретирующих гормоны щитовидной железы. У детей и подростков данное состояние встречается крайне редко — в 5–7,5% всех случаев узлового зоба. Терапия ТУЗ направлена на купирование симптомов гипертиреоза с учетом злокачественного потенциала узлового образования. В доступной литературе отсутствуют данные о клиническом течении, сравнительных результатах цитологических и гистологических данных пациентов с ТУЗ, дебютировавшим в детском возрасте.
ЦЕЛЬ. Анализ особенностей клинического течения, сравнение результатов цитологического и гистологического исследований ТУЗ у детей и подростков.
МАТЕРИАЛЫ И МЕТОДЫ. Ретроспективное одноцентровое исследование 21 пациента с одноузловым токсическим зобом, госпитализированных в ФГБУ «НМИЦ эндокринологии» Минздрава России в период с января 2016 г. по декабрь 2019 г.
РЕЗУЛЬТАТЫ. Средний возраст на момент обследования составлял 13,9 года. У 13 пациентов (65%) отмечался манифестный тиреотоксикоз, у 7 (35%) — субклинический гипертиреоз. Больше половины детей — 57,1% (n=12) не получали тиреостатической терапии. Цитологическая картина у 11 пациентов (61,1%) соответствовала доброкачественным изменениям (узловой коллоидный зоб или аденоматозный зоб) — Bethesda II, у 4 пациентов — фолликулярной опухоли — Bethesda IV, у 4 детей исследование оказалось неинформативным. 19 пациентам (90,5%) было проведено хирургическое лечение (гемитиреоидэктомия). Фолликулярная аденома по результатам гистологического исследования встречалась у 44,4% детей с ТУЗ при доброкачественных результатах тонкоигольной аспирационной биопсии (Bethesda II) и в 50% — при выявлении фолликулярной неоплазии (Bethesda IV).
ЗАКЛЮЧЕНИЕ. Впервые в Российской Федерации проведен сравнительный анализ характеристик цитологического и гистологического исследования у детей с ТУЗ. Показательно, что только в 10,5% (n=2) случаев соответствовали цитологические и морфологические результаты. Выбор тактики радикального лечения должен учитывать высокую частоту несовпадений гистологических и морфологических исследований.
Для цитирования:
Иванникова Т.Е., Безлепкина О.Б., Абдулхабирова Ф.М., Абросимов А.Ю., Дегтярев М.В., Зубкова Н.А. Узловой токсический зоб у детей: особенности клинической картины, морфологические варианты. Проблемы Эндокринологии. 2021;67(2):102-110. https://doi.org/10.14341/probl12738
For citation:
Ivannikova T.E., Bezlepkina O.B., Abdulhabirova F.M., Abrosimov A.U., Degtyarev M.V., Zubkova N.A. Nodular toxic goiter in children: clinical features, morphological variants. Problems of Endocrinology. 2021;67(2):102-110. (In Russ.) https://doi.org/10.14341/probl12738
ОБОСНОВАНИЕ
Токсический узловой зоб (ТУЗ) характеризуется появлением в щитовидной железе (ЩЖ) автономно функционирующих тиреоцитов, что является фактором риска развития тиреотоксикоза [1]. ТУЗ как причина тиреотоксикоза впервые описан в 1913 г. американским врачом Генри Стэнли Пламмером, который выделил два варианта токсического зоба: «экзофтальмический» и «аденоматозный». В 23% случаев «аденоматозный зоб» был ассоциирован с гипертиреозом и не сопровождался развитием экзофтальма [2].
ТУЗ преимущественно встречается среди взрослого населения (чаще у лиц старше 60 лет), до 10% среди всех одноузловых образований [1], тогда как в молодом возрасте встречаемость значительно реже — 5–7,5% [3].
С наибольшей частотой ТУЗ встречается в йододефицитных регионах: среди всех причин тиреотоксикоза многоузловой токсический зоб (МТЗ) встречается в 58% случаев, а одноузловой токсический зоб — в 10% [1]. Напротив, в йодообеспеченных регионах МТЗ выявляется всего в 15–30% всех случаев тиреотоксикоза [4].
Дифференцировать диффузно-токсический зоб и ТУЗ позволяет сцинтиграфия ЩЖ, при которой активно функционирующий узел («горячий узел») накапливает радиофармпрепарат (РФП), а окружающая тиреоидная ткань находится в состоянии супрессии (рис. 1).

Рисунок 1. Активно функционирующий узел («горячий узел») по данным сцинтиграфии щитовидной железы с Тс-99м-пертехнетатом у пациента 13 лет с токсическим узловым зобом (собственное наблюдение).
В некоторых случаях автономия может носить диффузный характер за счет диссеминации автономно функционирующих участков в ЩЖ. Дополнительным критерием дифференциальной диагностики является отсутствие в сыворотке крови аутоантител к рецепторам тиреотропного гормона (АТрТТГ) при ТУЗ, в отличие от диффузно-токсического зоба (болезни Грейвса).
В настоящий момент существуют два типа радикального лечения ТУЗ — оперативное лечение и радиойодтерапия (РЙТ). Выбор тактики лечения зависит от многих причин, в том числе обусловлен возможными рисками анестезиологических пособий в случае хирургического лечения и развития гипотиреоза после проведения РЙТ [5]. У детей РЙТ при ТУЗ проводится редко в связи с потенциальной возможностью возникновения в отдаленном периоде рака ЩЖ [6]. Риск малигнизации узловых образований ЩЖ у детей может достигать 20% [5], аналогичная тенденция возможна и в случае автономно функционирующих образований [7–10].
В связи с крайне редкой встречаемостью ТУЗ ЩЖ у детей важно обобщить клинические данные детей с этим заболеванием.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Целью данного исследования является анализ особенностей клинического течения, сравнение результатов цитологического и гистологического исследований ТУЗ у детей и подростков.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения. Обследование и лечение пациентов проводилось в Институте детской эндокринологии ФГБУ «НМИЦ эндокринологии» Минздрава России.
Время исследования. В исследование включены пациенты, находившиеся в детской клинике с января 2016 г. по декабрь 2019 г.
Изучаемые популяции (одна или несколько)
Критериями включения в исследование являлись: возраст от 0 до 18 лет, наличие узлового зоба, наличие «горячего узла» по результатам сцинтиграфии, отрицательный титр АТрТТГ.
Критерии исключения: наличие диффузно-токсического зоба (болезни Грейвса), наличие узлового нетоксического зоба.
Дизайн исследования
Ретроспективное одноцентровое исследование, включающее в себя 21 пациента с одноузловым токсическим зобом. Дети проживали в различных регионах России (г. Москва — 2, по 3 ребенка из Московской и Ярославской областей, по 2 — из Тульской и Белгородской областей и по 1 ребенку из Калужской, Тверской, Рязанской, Курганской, Липецкой, Курганской областей, республик Удмуртии, Чувашии и Татарстана). Все перечисленные регионы являются регионами с легким йодным дефицитом [11–13]. В некоторых статьях авторы описывают два или более различных фрагмента исследования, которые выполняются с разными целями (что, вообще говоря, нежелательно в рамках одной статьи). В этом случае необходимо отдельно описывать дизайн каждого из фрагментов исследования.
Описание медицинского вмешательства
Всем пациентам было проведено комплексное клинико-гормональное и инструментальное обследование, включавшее в себя: сбор анамнеза жизни и заболевания, проведение ультразвукового исследования ЩЖ, определение содержания в сыворотке крови тиреотропного гормона (ТТГ), свободного тироксина (св. Т4), свободного трийодтиронина (св.Т3) и АТрТТГ, проведение тонкоигольной пункционной биопсии (ТАБ) под ультразвуковым контролем и морфологическое исследование узлового образования до и после оперативного лечения.
Методы регистрации исходов
УЗИ ЩЖ проводилось на аппарате Тoshiba Aplio 500 линейным датчиком PLT-1204ВХ с диапазоном частот 7–18 МГц. Исследование выполнялось в стандартном положении пациента лежа на спине с запрокинутой головой и подложенным под плечи валиком. Сканирование ЩЖ осуществлялось в В-режиме и с применением режима цветового допплеровского картирования (ЦДК). Производилось измерение трех размеров обеих долей ЩЖ (длина, ширина и переднезадний размер), объем ЩЖ вычислялся по формуле J. Brunn (1981 г.):
[ширина правой доли (см) × длина правой доли (см) × толщина правой доли (см) + ширина левой доли (см) × длина левой доли (см) × толщина левой доли (см)] × 0,479.
Оценивались структура ЩЖ, степень эхогенности, васкуляризация, наличие узловых образований (заведующая отделением — к.м.н. Т.В. Солдатова).
Исследование гормонов в сыворотке крови проводилось в лаборатории гормонального анализа ФГБУ «НМИЦ эндокринологии» Минздрава России (заведующая лабораторией Л.В. Никанкина). Лабораторные исследования были выполнены на автоматическом иммунохемилюминесцентном анализаторе ARCHITECT i2000sr (ABBOTT).
С целью сравнения лабораторных данных, выполненных в ФГБУ «НМИЦ эндокринологии» Минздрава России и по месту жительства, проводился пересчет уровней ТТГ, св.Т4 и св.Т3 в пмоль/л с помощью калькулятора пересчета единиц измерения анализов: https://www.slimhauz.ru/stoimost/analizy/kalkulyator_analizov.
Сцинтиграфия ЩЖ проводилась в отделе радионуклидной диагностики и терапии, осуществлялась на гамма-камерах ОФЭКТ Discovery NM630 и ОФЭКТ-КТ Discovery NM/CT670 (руководитель отдела — д.м.н. П.О. Румянцев) ФГБУ «НМИЦ эндокринологии» Минздрава России с применением 99mTc-пертехнетата.
Необходимая для исследования доза РФП рассчитывалась индивидуально с помощью калькулятора вводимой активности PedDose в [МБк] и [мКи] (https://www.eanm.org/publications/dosage-calculator).
Сцинтиграфия проводилась через 15–20 мин после внутривенного введения РФП в положении пациента лежа на спине, детектор гамма-камеры располагался максимально близко над шеей. Время исследования 10 мин. Затем врачом-радиологом на рабочей станции Xeleris (GI) проводилась оценка функционального состояния ЩЖ визуально и с помощью рассчитываемого программой индекса захвата РФП ЩЖ.
ТАБ узловых образований ЩЖ проводилась под контролем УЗИ с использованием иглы для внутримышечных инъекций диаметром 0,7 мм в положении больного лежа на спине с запрокинутой головой (без применения анестезиологического пособия). Цитологическое исследование пунктатов, окрашенных по Маю–Грюнвальду–Гимзе, проводилось в отделе фундаментальной патоморфологии (заведующий — д.м.н. А.Ю. Абросимов). Заключение цитологических исследований проводилось в соответствии с критериями классификации цитопатологии ЩЖ Bethesda (2009, 2017) [14].
Гистологическое исследование ткани ЩЖ, полученной в результате оперативного лечения (19 пациентов), проводилось в отделении фундаментальной патоморфологии. Тканевые образцы фиксировали 10% раствором формалина в течение 24 ч и заключали в парафиновые блоки по стандартной методике. Из парафиновых блоков готовили срезы толщиной 5 мкм, которые депарафинировали, обезвоживали и окрашивали гематоксилином и эозином по стандартной методике. Просмотр цитологических и гистологических стеклопрепаратов осуществлялся на микроскопах Leica/Nikon/Zeiss с увеличением 1×10, 1×20, 1×40, 1×100.
Этическая экспертиза
Проведение данного исследования одобрено локальным этическим комитетом по этике ФГБУ «НМИЦ эндокринологии» МЗ РФ (протокол № 3 от 26.02.2020 г.).
Статистическая обработка
Размер выборки предварительно не рассчитывался. Статистическая обработка материала проводилась с использованием программ Microsoft Office Excel 2010 и статистического пакета STATISTIСA (StatSoft, США). При нормальном распределении количественного признака данные представлены в виде среднего значения и стандартной ошибки среднего: M±SEM, если не указано другого. При отличном от нормального распределении количественного признака данные представлены в виде медианы значения и его интерквартильного размаха: Me (25; 75 перцентили), если не указано другого.
Для сравнения двух групп по количественным признакам рассчитывался критерий Стьюдента для параметрических выборок, для непараметрических — применялся тест Манна–Уитни. Взаимосвязь между двумя показателями оценивалась с использованием корреляционного анализа методом Спирмена. Для всех статистических методов значение р<0,05 считалось статистически значимым
Нежелательные явления
В ходе исследования нежелательных явлений зафиксировано не было.
РЕЗУЛЬТАТЫ
Объекты (участники) исследования
За четырехлетний период (2016–2019) в круглосуточном стационаре детской клиники ФГБУ «НМИЦ эндокринологии» Минздрава России были обследованы 166 детей с одноузловым зобом, у 12,6% из них (n=21) был диагностирован одноузловой токсический зоб.
Основные результаты исследования
В данной статье проанализированы данные 21 ребенка (5 мальчиков, 16 девочек) с одноузловым токсическим зобом. Возраст на момент обследования в ФГБУ «НМИЦ эндокринологии» Минздрава России составил от 6,9 до 17,9 года (13,9±2,9 года).
Средний возраст детей на момент манифестации заболевания составлял 12,9±2,7 года. Следует отметить, что более чем в половине случаев (52,4%, 11/21) узловой токсический зоб протекал без явных клинических симптомов, и узел в ЩЖ был выявлен «случайно» на профилактическом осмотре. Однако при углубленном анализе анамнестических данных у каждого третьего ребенка (36,4%, 4/11) имелись такие жалобы, как слабость (25%), повышенная утомляемость (25%), тахикардия (25%), раздражительность (50%), нарушения сна (50%). Родители остальных детей (n=10) активно обратились к педиатру с жалобами на увеличение «объема шеи» и деформацию ее контуров. В половине случаев (5/10) зоб был единственной жалобой, у другой половины имелись жалобы на слабость (54,5%), повышенную раздражительность (45,5%), плаксивость (18,2%), чувство нехватки воздуха (18,2%), нарушения сна (9%), ощущение сердцебиения (27,3%).
Таким образом, в дебюте заболевания у 52,4% пациентов (11/21) узловой зоб был выявлен при проведении профилактических осмотров, у 23,8% — (5/21) единственной жалобой при обращении к педиатру было «увеличение объема шеи», и только каждого четвертого ребенка (23,8% (5/21)) беспокоили не только «увеличение шеи», но и специфические для тиреотоксикоза жалобы. При гормональном обследовании по месту жительства у 38,1% детей (n=8) выявлен субклинический гипертиреоз, у большинства детей (61,9%, n=13) — манифестный тиреотоксикоз. Обращает на себя внимание тот факт, что у пациентов с манифестным тиреотоксикозом объем узловых образований был достоверно выше по сравнению с пациентами с субклиническим тиреотоксикозом. При отсутствии отличий уровней св.Т4 у пациентов с манифестным тиреотоксикозом достоверно повышены уровни св.Т3 и снижен уровень ТТГ, что диктует необходимость обязательного определения уровня св.Т3 у пациентов с узловыми образованиями ЩЖ (табл. 1).
Таблица 1. Лабораторно-инструментальные данные пациентов при первичном обследовании по месту жительства
|
Тиреоидный статус |
Возраст, лет |
ТТГ, мМЕ/л (0,43–4,2) |
св.Т4, пмоль/л (10,1–17,9) |
св.Т3, пмоль/л (2,8–6,3) |
АТрТТГ, МЕ/л (0–1,75) |
Объем ЩЖ, см3 |
Объем узла, см3 |
|
Субклинический тиреотоксикоз (n=8) |
12,8±1,5 |
0,07 |
12,7 |
4,2 [ 4,1; 4,6 ] |
0,3 |
14,9 [ 9,9; 19,4 ] |
2,59 [ 0,54; 4,5 ] |
|
Манифестный тиреотоксикоз (n=13) |
12,7±3,3 |
0,01 [ 0,008; 0,02 ] |
19,7 [ 14,9; 27,0 ] |
8,3 [ 7,1; 10,7 ] |
0,3 |
17,0 [ 9,8; 25,1 ] |
8,3 [ 4,7; 10,9 ] |
|
р |
р=0,93 |
р=0,015 |
p=0,09 |
р=0,0005 |
р=0,585 |
р=0,021 |
Корреляционный анализ выявил умеренную обратную корреляционную зависимость между объемом узла и уровнем св.Т3 (р=-0,39).
Таким образом, в дебюте заболевания у детей с ТУЗ степень выраженности тиреотоксикоза может быть различной, однако в случаях манифестного тиреотоксикоза объем узла был достоверно больше, чем у пациентов с субклиническим тиреотоксикозом.
Все дети в течение первого года после диагностики узлового зоба были направлены для дополнительного обследования в ФГБУ «НМИЦ эндокринологии» Минздрава России. Медиана стажа динамики наблюдения составила 0,34 года [ 0,2; 1,06 ]. Средний возраст детей (n=21) при поступлении в детскую клинику составлял 13,7±2,9 года. Более половины детей — 57,1% (n=12) не получали тиреостатической терапии, остальные дети (n=9) получали тиамазол (Ме 0,205 мг/кг [ 0,15; 0,31 ]). Медиана длительности терапии составила 1,5 мес [0,87; 2,63]. У пациентов на терапии достигнута клинико-лабораторная компенсация. Показатели гормонального статуса у пациентов без лечения в среднем соответствовали субклиническому тиреотоксикозу. Из 12 пациентов, не получавших лечение, у 8 пациентов сохранялся субклинический гипертиреоз, у 4 пациентов — манифестный тиреотоксикоз (табл. 2).
У 8 пациентов (38%) по результатам УЗИ ЩЖ выявлена повышенная васкуляризация в объемном образовании (рис. 2).

Рисунок 2. Продольное изображение узлового образования в режиме энергетического допплеровского картирования у пациента 12 лет с токсическим узловым зобом (собственное наблюдение).
С диагностической целью всем пациентам (n=21) была проведена сцинтиграфия ЩЖ, по результатам которой у всех пациентов был выявлен «горячий узел».
ТАБ была выполнена 19 из 21 детей: цитологическая картина у 9 пациентов (47,3%) соответствовала доброкачественным изменениями (узловой коллоидный зоб или аденоматозный зоб) — Bethesda II, у 4 пациентов (21,0%) — фолликулярной опухоли — Bethesda IV, у 3 детей исследование оказалось неинформативным. По техническим причинам ТАБ не была проведена 3 пациентам.
Двум пациентам проведена РЙТ; в обоих случаях цитологическая картина соответствовала Bethesda II. Объем ЩЖ составил 10,8 и 7,1 см3, а объем узловых образований — 4,5 и 2,4 см3 соответственно (TIRADS 2). В обоих случаях РЙТ была проведена в связи с небольшим размером узла и настойчивым желанием родителей.
19 пациентам (90,5%) было проведено хирургическое лечение (гемитиреоидэктомия): 18 пациентам в условиях ФГБУ «НМИЦ эндокринологии» Минздрава России, 1 пациенту по месту жительства. По результатам морфологического исследования послеоперационного материала у 11 детей (57,8%) диагностирован активно пролиферирующий коллоидный зоб (рис. 3a, b, c, 4), у 8 (42,1%) — фолликулярная аденома ЩЖ (рис. 5a, b, 6a, b).

Рисунок 3 а, b, c. Цитограмма узлового коллоидного активно пролиферирующего зоба с формированием фолликулярных и трабекулярных структур и вакуолей резорбции коллоида (b, c), окраска азур-эозин, увеличение 40х (а), 100 х (b, c) (собственное наблюдение).

Рисунок 4. Узловой активно пролиферирующий зоб с варьированием формы и размера фолликулов, очагом кровоизлияния и скоплением гемосидерофагов, окраска гематоксилин-эозин, увеличение 20х (собственное наблюдение).
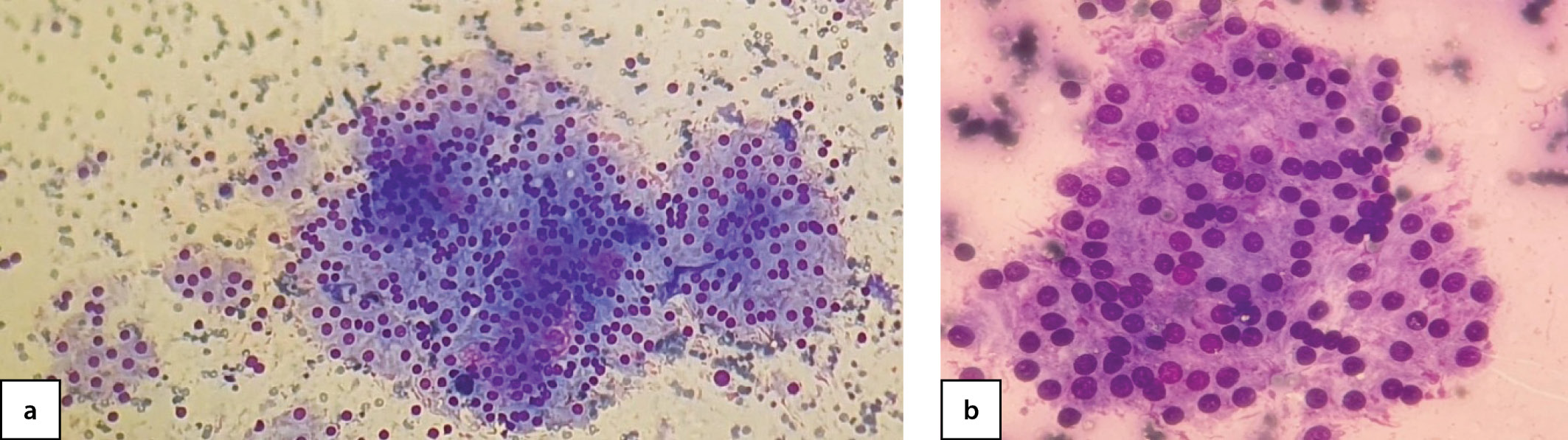
Рисунок 5 а, b. Цитограмма активно пролиферирующего (аденоматозного) зоба, окраска азур-эозин, увеличение 10х (а), 100х (b) (собственное наблюдение).

Рисунок 6 а, b. Узловой микрофолликулярный коллоидный зоб с очагами сосочковой пролиферации фолликулярного эпителия, окраска гематоксилин-эозин, увеличение 20х (a), 40х (b) (собственное наблюдение).
Обращает на себя внимание тот факт, что фолликулярная аденома выявлялась как у пациентов с Bethesda IV (2/4), так и у пациентов с установленным на дооперационном этапе доброкачественным заключением — Bethesda II (4/11), в 1 случае фолликулярная аденома обнаружена у пациента без предварительно проведенной ТАБ. У остальных пациентов гистологическая картина соответствовала активно пролиферирующему, коллоидному в разной степени зобу (табл. 3).
Таким образом, фолликулярная аденома по результатам гистологического исследования встречалась у 41,7% детей с ТУЗ при неинформативных и доброкачественных результатах ТАБ (Bethesda I–II) и в 50% случаев соответствовала выявленной на дооперационном этапе фолликулярной неоплазии (Bethesda IV).
Катамнестический мониторинг 14 пациентов показал, что у 10 пациентов в течение года после радикального лечения сохранялся эутиреоз, у 4 развился гипотиреоз, потребовавший назначения заместительной терапии.
Таблица 2. Данные динамического наблюдения у пациентов в зависимости от терапии
|
n |
Возраст |
ТТГ, мМЕ/л (0,43–4,2) |
св.Т4, пмоль/л (10,1–17,9) |
св.Т3, пмоль/л (2,8–6,3) |
Объем ЩЖ, см3 |
Объем узла, см3 |
|
|
Тиреостатическая терапия |
9 |
12,6±3,8 |
1,79 [ 0,034; 9,904 ] |
10,4 [ 8,93; 11,2 ] |
4,6 [ 3,96; 5,23 ] |
18,7 [ 13,5; 28,3 ] |
9,9 [ 7,2; 17,2 ] |
|
Без терапии |
12 |
14,8±1,9 |
0,02 [ 0,002; 0,394 ] |
13,2 [ 10,87; 14,33 ] |
6,1 [ 5,3; 7,1 ] |
11,6 [ 10,6; 20,95 ] |
6,8 [ 3,6; 12,5 ] |
|
р |
р=0,145 |
р=0,028 |
р=0,086 |
р=0,004 |
р=0,37 |
р=0,39 |
Таблица 3. Соотношение цитологической и морфологической картины у детей с токсическим узловым зобом
|
Результаты ТАБ (n=18) |
n |
Результаты гистологии (n=19) |
|
|
фолликулярная аденома |
активно пролиферирующий зоб |
||
|
Bethesda I |
3 |
1 |
2 |
|
Bethesda II |
9 |
4 |
5 |
|
Bethesda IV |
4 |
2 |
2 |
|
Не проводилась |
3 |
1 |
2 |
|
Всего |
19 |
8 |
11 |
ОБСУЖДЕНИЕ
Репрезентативность выборок
По литературным данным, распространенность ТУЗ у взрослых составляет 10–32% [1][15], у детей данные единичны [3].
В отечественной литературе понятия «токсический зоб» и «функциональная автономия щитовидной железы» часто являются синонимами [16]. В зарубежных источниках используется термин «токсический узловой зоб» [17]
ТУЗ у детей в дебюте заболевания может протекать как с жалобами, подозрительными в отношении тиреотоксикоза, так и без них (субклинический тиреотоксикоз).
В нашей группе у 76,2% детей основным клиническим симптомом было увеличение «объема шеи», специфические жалобы отмечались у 42,9% пациентов. При обследовании у 61,9% детей — повышение хотя бы одного из двух тиреоидных гормонов. Отрицательный титр АТрТТГ и данные сцинтиграфии ЩЖ позволили достоверно дифференцировать аутоиммунный и деструктивный тиреотоксикоз у всех обследуемых нами пациентов.
Отечественные авторы определяют следующие стадии функциональной автономии ЩЖ: компенсированная (эутиреоз), субкомпенсированная (субклинический гипертиреоз) и декомпенсированная (манифестный гипертиреоз) [1].
В серии описанных нами случаев на момент постановки диагноза 38,1% пациентов — в состоянии субклинического тиреотоксикоза, 61,9% — в состоянии манифестного тиреотоксикоза. У всех пациентов отмечался отрицательный титр АТрТТГ.
Клиническая значимость результатов
Единственным дооперационным методом оценки структурных изменений и установления цитологических параметров образований в ЩЖ является ТАБ, особенно при размерах узловых образований более 1 см. ТАБ является обязательной в первую очередь для оценки злокачественного потенциала узлового образования ЩЖ.
Цитологическое исследование пунктата узлового образования ЩЖ не позволяет надежно дифференцировать доброкачественную опухоль — фолликулярную аденому — от рака ЩЖ. Достоверно диагностировать потенциал злокачественности новообразований возможно только на основании послеоперационного гистологического исследования. У взрослых пациентов результаты ТАБ, свидетельствующие о фолликулярной неоплазии или подозрении на фолликулярную неоплазию (Bethesda IV), в 15–30% случаев в конечном итоге оказываются злокачественными образованиями [18], в детской практике описано до 58% злокачественных новообразований [19][20].
В большинстве случаев ТУЗ — это доброкачественное образование с низким риском малигнизации [9]. Однако в связи с риском более агрессивного течения рака ЩЖ в детском возрасте гистологическое исследование помогает обнаружить случайную опухоль, расположенную в гиперфункционирующем узле. J.J. Smith и соавт. [21] и Y. Senyurek Giles [22] показали, что при токсическом одноузловом зобе у взрослых в 12–18,3% случаев узлы оказались злокачественными. M. Niedziela и соавт. [15] оценили риск малигнизации при ТУЗ у детей (n=31), злокачественный процесс обнаружен в 29% случаев. По данным исследования Croom и соавт. [23], у детей и подростков риск малигнизации при ТУЗ отмечался в 11,3%.
В нашей серии наблюдений прооперировано 19 детей (гемитиреоидэктомия), ни в одном случае злокачественных образований и фолликулярных опухолей неопределенного риска злокачественности выявлено не было. При этом медиана стажа наблюдения от момента манифестации до момента радикального лечения — 0,34 года [ 0,2; 1,06 ].
По результатам нашей работы совпадение цитологического и гистологического результатов наблюдалось у 60% пациентов: при Bethesda II — в 55,6%, при Bethesda IV— 50%.
Следует отметить, что в нашей работе у каждого третьего ребенка (36,4%) при цитологическом заключении Bethesda I–II результаты послеоперационной гистологии свидетельствовали о фолликулярной аденоме (у 4 из 11 детей).
Несмотря на проведение гемитиреоидэктомии, после проведения оперативного лечения в течение последующих 3 мес у 15,7% пациентов развился послеоперационный гипотиреоз, потребовавший назначения заместительной терапии. После проведения РЙТ у 1 пациента сохраняется эутиреоз, второму ребенку потребовалось назначение заместительной гормональной терапии.
ЗАКЛЮЧЕНИЕ
ТУЗ в детском возрасте — редкое заболевание. Консервативная терапия при данном заболевании направлена на купирование симптомов гипертиреоза.
Полученные нами на небольшой группе пациентов данные только в 10,5% случаев (2 пациента) выявили соответствие результатов цитологических и морфологических результатов.
Ни в одном случае не было обнаружено злокачественное образование или образование неопределенного риска злокачественности. Данное обследование было проведено у пациентов детского возраста с малым стажем динамического наблюдения.
РЙТ может быть рассмотрена в качестве радикального метода лечения ТУЗ у детей и подростков при отсутствии признаков злокачественного роста узлового образования.
Список литературы
1. Егорычева Е.К. Рецептор тиреотропного гормона гипофиза при функциональной автономии щитовидной железы: Дисс. … канд. мед. наук. — М.; 2007.
2. Miller JM. Plummer’s Disease. Med Clin North Am. 1975;59(5):1203-1216. doi: https://doi.org/10.1016/S0025-7125(16)31968-X
3. Hodax JK, Reinert SE, Quintos JB. Autonomously functioning thyroid nodules in patients <21 years of age: the rhode island hospital experience from 2003-2013. Endocrine Practice. 2016;22(3):328-337. doi: https://doi.org/10.4158/EP15905.OR
4. Aghini-Lombardi F. The Spectrum of Thyroid Disorders in an Iodine-Deficient Community: The Pescopagano Survey. J Clin Endocrinol Metab. 1999;84(2):561-566. doi: https://doi.org/10.1210/jc.84.2.561
5. Goldstein R, Hart IR. Follow-up of Solitary Autonomous Thyroid Nodules Treated with 131I. N Engl J Med. 1983;309(24):1473-1476. doi: https://doi.org/10.1056/NEJM198312153092401
6. Wondisford F, Radovick S. Clinical Management of Thyroid Disease. Saunders; 2009. 440 p.
7. Wong CKM, Wheeler MH. Thyroid Nodules: Rational Management. World J Surg. 2000;24(8):934-941. doi: https://doi.org/10.1007/s002680010175
8. Gharib H. Changing concepts in the diagnosis and management of thyroid nodules. Endocrinol Metab Clin North Am. 1997;26(4):777-800. doi: https://doi.org/10.1016/S0889-8529(05)70282-6
9. Erdoğan MF, Anil C, Özer D, et al. Is it useful to routinely biopsy hot nodules in iodine deficient areas? J Endocrinol Invest. 2003;26(2):128-131. doi: https://doi.org/10.1007/BF03345140
10. Falk SA. Surgical treatment of hyperthyroidism / In: Falk SA, editor. Thyroid disease. New York: Lippincott-Raven; 1997. P. 319-340.
11. Алферова В.И., Мустафина С.В., Рымар О.Д. Йодная обеспеченность в России и мире: что мы имеем на 2019 год? // Клиническая и экспериментальная тиреоидология. — 2019. — Т. 15. — №2. — С. 73-82. doi: https://doi.org/10.14341/ket10353
12. Трошина Е.А., Платонова Н.М., Абдулхабирова Ф.М., Герасимов Г.А. Йододефицитные заболевания в Российской Федерации: время принятия решений / Под. ред. И.И. Дедова, Г.А. Мельниченко. М.; 2012.
13. Йододефицитные заболевания у детей и подростов: диагностика, лечение, профилактика. Научно-практическая программа. М.: Международный фонд охраны здоровья матери и ребенка; 2005. 48 с.
14. Russ G, Bonnema SJ, Erdogan MF, et al. The Bethesda System for Reporting Thyroid Cytopathology. Boston, MA: Springer US; 2010. doi: https://doi.org/10.1007/978-0-387-87666-5
15. Niedziela M, Breborowicz D, Trejster E, Korman E. Hot Nodules in Children and Adolescents in Western Poland from 1996 to 2000: Clinical Analysis of 31 Patients. J Pediatr Endocrinol Metab. 2002;15(6). doi: https://doi.org/10.1515/JPEM.2002.15.6.823
16. Дедов И.И., Мельниченко Г.А. Эндокринология. Национальное руководство. М.:ГЭОТАР-Медиа; 2021. С. 616-624.
17. Nygaard B, Faber J, Veje A, et al. Transition of Nodular Toxic Goiter to Autoimmune Hyperthyroidism Triggered by 131I Therapy. Thyroid. 1999;9(5):477-481. doi: https://doi.org/10.1089/thy.1999.9.477
18. Baloch ZW, LiVolsi VA, Asa SL, et al. Diagnostic terminology and morphologic criteria for cytologic diagnosis of thyroid lesions: A synopsis of the National Cancer Institute Thyroid Fine-Needle Aspiration State of the Science Conference. Diagn Cytopathol. 2008;36(6):425-437. doi: https://doi.org/10.1002/dc.20830
19. Smith M, Pantanowitz L, Khalbuss WE, et al. Indeterminate Pediatric Thyroid Fine Needle Aspirations: A Study of 68 Cases. Acta Cytol. 2013;57(4):341-348. doi: https://doi.org/10.1159/000351029
20. Monaco SE, Pantanowitz L, Khalbuss WE, et al. Cytomorphological and molecular genetic findings in pediatric thyroid fine-needle aspiration. Cancer Cytopathol. 2012. doi: https://doi.org/10.1002/cncy.21199
21. Smith JJ, Chen X, Schneider DF, et al. Toxic Nodular Goiter and Cancer: A Compelling Case for Thyroidectomy. Ann Surg Oncol. 2013;20(4):1336-1340. doi: https://doi.org/10.1245/s10434-012-2725-4
22. Giles (Senyurek) Y, Fatih T, Harika B, et al. The risk factors for malignancy in surgically treated patients for Graves’ disease, toxic multinodular goiter, and toxic adenoma. Surgery. 2008;144(6):1028-1037. doi: https://doi.org/10.1016/j.surg.2008.08.022
23. Thomas CG, Croom RD. Current Management of the Patient with Autonomously Functioning Nodular Goiter. Surg Clin North Am. 1987;67(2):315-328. doi: https://doi.org/10.1016/S0039-6109(16)44186-1
Об авторах
Т. Е. ИванниковаРоссия
Иванникова Татьяна Евгеньевна
117036, Москва, ул. Дм. Ульянова, д. 11
eLibrary SPIN: 8933-5723
О. Б. Безлепкина
Россия
Безлепкина Ольга Борисовна, д.м.н., профессор
eLibrary SPIN: 3884-0945
Москва
Ф. М. Абдулхабирова
Россия
Абдулхабирова Фатима Магомедовна, к.м.н.
eLibrary SPIN: 2462-1115
Москва
А. Ю. Абросимов
Россия
Абросимов Александр Юрьевич, д.м.н., профессор
eLibrary SPIN: 4089-9502
Москва
М. В. Дегтярев
Россия
Дегтярев Михаил Владимирович
eLibrary SPIN-код: 7725-7831
Москва
Н. А. Зубкова
Россия
Зубкова Наталья Анатольевна, к.м.н.
eLibrary SPIN: 5064-9992
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Иванникова Т.Е., Безлепкина О.Б., Абдулхабирова Ф.М., Абросимов А.Ю., Дегтярев М.В., Зубкова Н.А. Узловой токсический зоб у детей: особенности клинической картины, морфологические варианты. Проблемы Эндокринологии. 2021;67(2):102-110. https://doi.org/10.14341/probl12738
For citation:
Ivannikova T.E., Bezlepkina O.B., Abdulhabirova F.M., Abrosimov A.U., Degtyarev M.V., Zubkova N.A. Nodular toxic goiter in children: clinical features, morphological variants. Problems of Endocrinology. 2021;67(2):102-110. (In Russ.) https://doi.org/10.14341/probl12738

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).









































.jpg)


