Перейти к:
Описание клинических случаев нарушений формирования пола 46,XY, обусловленных мутацией в гене DHH. Роль сигнального пути DHH в формировании пола
https://doi.org/10.14341/probl12757
Аннотация
Мутации в гене DHH являются крайне редкой причиной возникновения нарушений формирования пола (НФП) 46,XY. В статье описываются клинические наблюдения двух неродственных пациенток с дисгенезией гонад 46,XY и правильным женским фенотипом. Благодаря применению метода секвенирования нового поколения (NGS) у обеих выявлена одинаковая биаллельная вариантная замена c.419T>G в гене DHH. Учитывая данные литературы о роли DHH в формировании нервной системы, установление генетической причины заболевания позволило в обоих случаях диагностировать минифасцикулярную полинейропатию на доклиническом этапе. Таким образом, приведенные нами клинические случаи демонстрируют ценность использования NGS, позволяющего одновременно анализировать широкий спектр генов-кандидатов при НФП и диагностировать сопутствующие заболевания до развития клинической картины. Это первые описания пациентов с мутациями в гене DHH в российской популяции.
Ключевые слова
Для цитирования:
Калинченко Н.Ю., Батырова З.К., Кострова И.Б., Колодкина А.А., Уварова Е.В., Кумыкова З.Х., Асатурова А.В., Хабас Г.Н., Тюльпаков А.Н. Описание клинических случаев нарушений формирования пола 46,XY, обусловленных мутацией в гене DHH. Роль сигнального пути DHH в формировании пола. Проблемы Эндокринологии. 2021;67(3):73-77. https://doi.org/10.14341/probl12757
For citation:
Kalinchenko N.Y., Batyrova Z.K., Kostrova I.B., Kolodkina A.A., Uvarova E.N., Kumykova Z.Kh., Asaturova A.V., Khabas G.N., Tiulpakov A.N. Clinical Findings in Two patients with DSD 46XY caused by new variant of the Desert Hedgehog Gene and review of the literature of the role of DHH signaling pathway in sex development. Problems of Endocrinology. 2021;67(3):73-77. (In Russ.) https://doi.org/10.14341/probl12757
АКТУАЛЬНОСТЬ
Нарушения формирования пола (НФП) 46,XY — гетерогенная группа состояний, при которых наблюдается несоответствие строения наружных и/или внутренних половых органов хромосомному мужскому полу 46,XY. Одной из причин возникновения НФП 46,XY является нарушение закладки гонад или их дифференцировки (дисгенезия гонад — ДГ).
Началом к активному изучению механизмов возникновения ДГ послужило открытие в 1990 г. гена SRY, картированного на Y-хромосоме, как ключевого фактора развития яичка из бипотенциальной гонады [1]. Позже было показано, что SRY запускает каскад активации транскрипционных факторов, участвующих в развитии яичка, таких как SOX9, GATA4, ZFPM2, NR5A1, WT1, DHH, CBX2, ATRX, MAP3K1, FGF9 и другие, нарушения функции которых также будут приводить к ДГ.
Учитывая редкость данных состояний, описание каждого случая ДГ является уникальным, т.к. изучение нарушений функционирования данных транскрипционных белков, приводящих к ДГ 46,XY, помогает понять механизмы формирования пола и объяснить значительную фенотипическую вариабельность среди данной группы пациентов. Ниже мы приводим первые в России клинические описания ДГ 46,XY, обусловленные мутацией в гене DHH.
МАТЕРИАЛЫ И МЕТОДЫ
Пациентам проводилось комплексное обследование, включающее: оценку строения наружных половых органов, ультразвуковое исследование (УЗИ) малого таза, паховых каналов, исследование гормонального статуса — уровней лютеинизирующего, фолликулостимулирующего, антимюллерова гормонов (ЛГ, ФСГ, АМГ), тестостерона, эстрадиола, проведение электромиографии.
Молекулярно-генетический анализ проводился в лаборатории отделения наследственных эндокринопатий ФГБУ «НМИЦ эндокринологии» Минздрава России. Геномную ДНК выделяли из лейкоцитов периферический крови стандартным методом (набор Pure Link, Genomic DNA Mini Kit, Life Technologies, США). Для молекулярно-генетического анализа применялся метод секвенирования нового поколения — NGS (Next Generation Sequencing). Использовалась разработанная в отделении наследственных эндокринопатий ФГБУ «НМИЦ эндокринологии» Минздрава России панель праймеров для мультиплексной полимеразной цепной реакции (ПЦР) и секвенирования с применением технологии Ion Ampliseq™ Custom DNA Panel (Life Technologies, США). Панель праймеров «Нарушения формирования пола» охватывает кодирующие области следующих генов: AKR1C2, AKR1C4, AMH, AMHR2, AR, ARX, ATRX, CBX2, CYB5A, CYP11A1, CYP17A1, DHCR7, DHH, EMX2, ESR2, FGD1, FGF9, FGFR2, FKBP4, FOXF2, FOXL2, HOXA13, HSD17B3, HSD3B2, ICK, LHCGR, LHX1, LHX9, MAMLD1, MAP3K1, MID1, NR0B1, NR5A1, POR, PTGDS, SOX9, SRD5A2, SRY, STAR, SUPT3H, TSPYL1, WNT4, WT1, ZFPM2. Подготовка библиотек проводилась в соответствии с рекомендациями производителей. Секвенирование осуществлялось на полупроводниковом секвенаторе PGM (Ion Torrent, Thermo Scientific, США) или Illumina MiSeq (Illumina, США). Биоинформатическая обработка результатов секвенирования проводилась с помощью программных модулей Torrent Suite 4.2.1 (Ion Torrent, Life Technologies, США) или Genome Analysis ToolKit (GATK) ver. 4.1.2.0 (Broad Institute, Cambridge, MA, USA). Для аннотирования вариантов нуклеотидной последовательности использовался пакет программ ANNOVAR ver. 2018Apr16. После анализа полученных данных проводилось подтверждение полученных мутаций на секвенаторе Genetic Analyzer Model 3130 (Life Technologies, США). Оценка патогенности вариантов нуклеотидной последовательности проводилась согласно международным и российским рекомендациям [2][3]. Нумерация кодирующей последовательности гена DHH дана по референсу NM_021044 (http://www.ncbi.nlm.nih.gov/ genbank).
Клиническое наблюдение №1.
Больная У., 14 лет обратилась в связи с задержкой развития вторичных половых признаков и отсутствием визуализации внутренних половых органов по данным инструментальных исследований (УЗИ малого таза и магнитно-резонансная томография (МРТ) малого таза).
Из анамнеза известно, что родители девочки — аварцы, близкородственный брак отрицают. Девочка — единственный ребенок в семье.
При физикальном осмотре половое развитие соответствовало стадии 1 по Таннеру (P1B1). Наружные половые органы сформированы по женскому типу, уретра расположена типично, гимен бахромчатый. Влагалище заканчивается слепо, глубиной до 3,5 см. При ректальном осмотре: тело матки и придатки не пальпируются.
По данным гормонального профиля выявлен гипергонадотропный гипогонадизм: ЛГ — 77,8 МЕ/л (5,5–9,4), ФСГ — 170 МЕ/л (5,1–9,8), эстрадиол — <73,4 пмоль/л (261–394), АМГ — 2,4 нмоль/л (1–10,6). Остальные гормональные показатели были в пределах нормативных значений. Определен кариотип 46,XY.
По данным МРТ матка и яичники в типичном месте не визуализированы, а в паховых каналах с обеих сторон обнаружены гонады (тестикулы?).
Установлен клинический диагноз: Нарушение формирования пола, 46,XY. Выполнены лапароскопия, двустороннее удаление дисгенетичных гонад.
По данным гистологического исследования: гонады с обеих сторон представлены тканью яичка, в которой все трубочки замещены клетками Сертоли, придаток яичка справа обычного строения, в тазовых смывах группы клеток мезотелия (рис. 1).
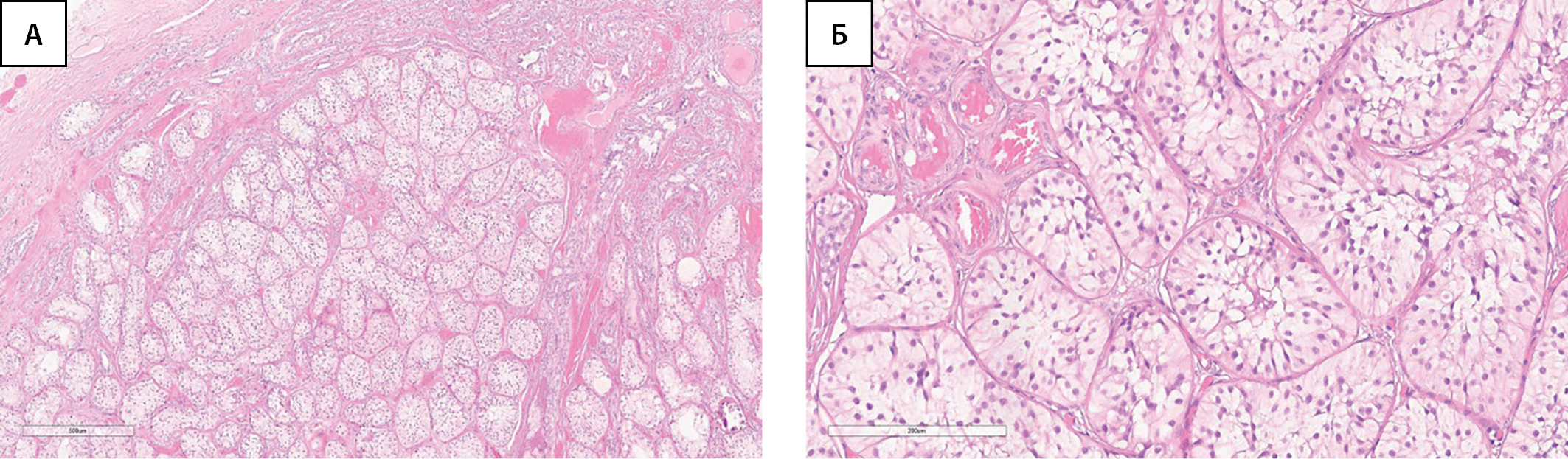
Рисунок 1. Ткань яичка (без признаков неопластических изменений).
А — окраска гематоксилином и эозином, х40. Б. — окраска гематоксилином и эозином, х200.
Для уточнения генеза заболевания проведено NGS, по результатам которого в гене DHH выявлен гомозиготный вариант c.419T>G:p.L140R, ранее не описанный, вероятно патогенный.
Учитывая данные литературы [4] о сочетании НФП с минифасцикулярной полинейропатией (МФПНП) при мутациях в DHH, несмотря на отсутствие клинических проявлений нейропатии, проведена электронейромиография (ЭНМГ), по данным которой выявлены признаки генерализованного симметричного умеренно выраженного аксонально-демиелинизирующего поражения моторных и сенсорных волокон периферических нервов верхних и нижних конечностей. Изменения более выражены в нижних конечностях (дистальные моторные и сенсорные ответы получены не были).
Девочке назначена заместительная гормональная терапия и рекомендовано наблюдение и ведение неврологом.
Клиническое наблюдение №2.
Больная Ч., фенотипическая девочка, впервые обратилась с жалобами на задержку полового развития в возрасте 14 лет. Из анамнеза известно, что родители пациентки аварцы по национальности и являются родственниками во втором поколении. При осмотре телосложение пропорциональное, стигмы дисэмбриогенеза отсутствовали, половой статус по Таннеру: В1, P2, половые органы сформированы правильно, по женскому типу. В гормональном профиле выявлено значительное повышение гонадотропинов: ЛГ — 21 МЕ/л (0,03–3,9), ФСГ — 74 МЕ/л (0,68–6,7), на фоне низко-нормального уровня эстрадиола — 41,3 пмоль/л (40–240), АМГ — 0,1 нмоль/л (1,6–10,0), все другие тропные и стероидные гормоны определялись в пределах референсных значений. При УЗИ и МРТ органов малого таза: гонады ни в малом тазу, ни в паховых каналах не определялись, матка не визуализировалась, определялась дистальная часть влагалища. Определен кариотип 46,XY.
На основании проведенного обследования установлен диагноз «Нарушение формирования пола 46,XY, чистая ДГ». Пациентке проведена диагностическая лапароскопия, в ходе которой удалены маточные трубы с обеих сторон, дисгенетичные гонады. По данным гистологического исследования: «две гонады представлены примитивными семенными канатиками, функциональная активность отсутствует, герминативные клетки не просматриваются, данных за онкологический процесс не получено».
Для уточнения генеза заболевания проведено NGS, по результатам которого в гене DHH выявлен гомозиготный вариант c.419T>G:p.L140R, ранее не описанный, вероятно патогенный. Родители пациентки оказались гетерозиготными носителями выявленной мутации.
Пациентке проведена ЭНМГ, в ходе которой выявлены изменения, аналогичные случаю 1: признаки генерализованного симметричного умеренно выраженного аксонально-демиелинизирующего поражения моторных и сенсорных волокон периферических нервов верхних и нижних конечностей, выраженное сенсорное нарушение срединных, икроножных и правого глубокого малоберцового нервов аксонального характера, подтверждающее наличие генерализованной нейропатии. Таким образом, несмотря на отсутствие каких-либо жалоб, ассоциированных с нейропатией, у пациентки на доклиническом уровне установлено наличие МФПНП. Рекомендовано наблюдение невропатологом.
ОБСУЖДЕНИЕ
Высококонсервативное семейство белков Hedgehog — это группа сигнальных молекул, играющих центральную роль в развитии и регуляции процессов эмбрио- и морфогенеза. У млекопитающих обнаружены три гомолога полипептида Hedgehog: Desert (Dhh), Indian (Ihh) и Sonic (Shh). Shh участвует в формировании конечностей, закладке нервной трубки. Ihh регулирует развитие хондроцитов, формирование скелета. Dhh играет ключевую роль в развитии гонад. Показано, что у мышей Dhh начинает продуцироваться клетками Сертоли с 11,5 дней внутриутробного развития, через короткий промежуток времени после инициации экспрессии Sry (sex-determining region of the Y chromosome) [5]. SRY индуцирует активацию транскрипционных факторов, определяющих специализацию клеток бипотенциальной гонады в сторону яичка, в том числе появление первых, специфичных для яичка функционально активных клеток Сертоли. Секретируемый клетками Сертоли DHH связывается с рецептором PTCH1, расположенным на предшественниках фетальных клеток Лейдига, запуская сигнальный путь hedgehog, который приводит к специализации стероидогенных клеток и активации экспрессии гена NR5A1 (кодирующего стероидогенный фактор 1 — SF1). Последний является ключевым регулятором стероидогенеза в гонадах. Также DHH регулирует дифференцировку перитубулярных миоидных клеток и формирование семенных канатиков [6][7]. В эксперименте на мышах показано, что самцы с нокаутом гена Dhh -/- имеют женский фенотип и слепо заканчивающееся влагалище, тогда как самки Dhh -/- фертильны [8]. Данное исследование демонстрирует эксклюзивную роль Dhh в дифференцировке яичка и отсутствие его влияния на формирование женской репродуктивной системы. Интересно, что, помимо важной роли в развитии мужской репродуктивной системы, Dhh принимает участие в формировании периневральной трубки и в развитии оболочек периферической нервной системы у лиц обоих полов.
У человека ген DHH (12q12-q13) состоит из 3 экзонов и кодирует белок из 396 аминокислотных остатков [9]. ДГ 46,XY вследствие патологических вариантных замен в гене DHH является редким аутосомно-рецессивным заболеванием. К настоящему времени в литературе описано не более 20 случаев. Фенотип описанных пациентов варьировал от правильного женского строения наружных половых органов до мошоночной формы гипоспадии, в большинстве случаев дериваты мюллеровых протоков отсутствовали. В 5 случаях в удаленных гонадах по данным гистологии имелись признаки малигнизации [10][11].
Впервые в 1999 г. Umehara F. и соавт. [4] описали 46-летнюю женщину со смешанной формой ДГ 46,XY в сочетании с МФПНП, обусловленной гомозиготной миссенс-мутацией в гене DHH. Позже были описаны пациенты без МФПНП и с различными вариантами ДГ (чистая ДГ, смешанная ДГ). Среди описанных случаев патологические замены в гене DHH располагались во всех трех экзонах, без какой-либо преимущественной локализации [10–12].
Исключительная роль DHH у человека в дифференцировке бипотенциальной гонады только при кариотипе 46,XY продемонстрирована Baldinotti F. и соавт. [13] при описании семейного варианта гомозиготной мутации c.554C>A, приводящей к стоп-кодону p.Ser185* в гене DHH. При наличии аналогичных гомозиготных мутаций у двух сестер с кариотипами 46,XY и 46,XX и подтвержденной у обеих МФПНП ДГ диагностирована только у сестры c кариотипом 46,XY, тогда как у сестры с кариотипом 46,XX нарушения репродуктивной функции отсутствовали.
В ряде последних научных публикаций обсуждается роль гетерозиготных вариантных замен в гене DHH при наличии у мужчин изолированной азооспремии, двустороннего крипторхизма или гипоспадии. Так, Mehta и соавт. [14] при анализе 125 нефертильных мужчин с астенозооспермией обнаружили в 6,6% случаев синонимичную замену c. 543C>T (p.His181His) в гене DHH и вставку G c.1156insG (p.Arg385fs) у пациента с двусторонним крипторхизмом и азооспермией. В работе Ayers и соавт. [10] описаны гетерозиготные замены в гене DHH среди пациентов с гипоспадией. Авторами предполагается наличие у данных пациентов дополнительных вариантов в интронных областях (что будет укладываться в рецессивный характер заболевания) либо наличие вариабельной пенетрантности или дополнительных неустановленных изменений в других генах, участвующих в сигнальном пути DHH [10].
В представленных нами описаниях 2 пациентов с женским фенотипом при кариотипе 46,XY выявлен ранее не описанный биаллельный вариант c.419T>G, приводящий к замене неполярной гидрофобной аминокислоты лейцина на полярную гидрофильную аминокислоту аргинин (p.L140R). Данная мутация определена как вероятно патогенная [2][3]. Более того, у обоих пациентов установлено наличие МФПНП по данным ЭМНГ, что косвенно подтверждает нарушения в функции DHH у наших пациентов.
Факт обнаружения одинаковой гомозиготной мутации у двух пациенток из разных семей, в которых оба родителя аварцы, позволяет предполагать наличие «эффекта основателя» для данной вариантной замены. Полученные данные позволят проводить медико-генетическое консультирование при планировании семьи и оценке рисков рождения детей с ДГ вследствие патологической вариантной замены в гене DHH.
ЗАКЛЮЧЕНИЕ
Таким образом, впервые в России нами представлено описание случаев НФП 46,XY, обусловленных биаллельной мутацией в гене DHH. Данные наблюдения подчеркивают диагностическую ценность NGS, позволяющего одновременно анализировать широкий спектр генов-кандидатов при НФП, а также расширяют наши представления о механизмах дифференцировки тестикулярной ткани и патогенезе ДГ.
Список литературы
1. Sinclair AH, Berta P, Palmer MS, et al. A gene from the human sex-determining region encodes a protein with homology to a conserved DNA-binding motif. Nature. 1990;346(6281):240-244. doi: https://doi.org/10.1038/346240a0
2. Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology. Genet Med. 2015;17(5):405-423. doi: https://doi.org/10.1038/gim.2015.30
3. Рыжкова О.П., Кардымон О.Л., Прохорчук Е.Б., и др. Руководство по интерпретации данных последовательности ДНК человека, полученных методами массового параллельного секвенирования (MPS) (редакция 2018, версия 2) // Медицинская генетика. — 2019. — Т. 18. — №2. — С. 3-23. doi: https://doi.org/10.25557/2073-7998.2019.02.3-23
4. Umehara F, Yamaguchi N, Kodama D, et al. Polyneuropathy with minifascicle formation in a patient with 46XY mixed gonadal dysgenesis. Acta Neuropathol. 1999;98(3):309-312. doi: https://doi.org/10.1007/s004010051085
5. Bitgood MJ, McMahon AP. Hedgehog and Bmp genes are coexpressed at many diverse sites of cell-cell interaction in the mouse embryo. Dev Biol. 1995;172(1):126-138. doi: https://doi.org/10.1006/dbio.1995.0010
6. Yao HH-C. Desert Hedgehog/Patched 1 signaling specifies fetal Leydig cell fate in testis organogenesis. Genes Dev. 2002;16(11):1433-1440. doi: https://doi.org/10.1101/gad.981202
7. Clark AM, Garland KK, Russell LD. Desert hedgehog (Dhh) Gene Is Required in the Mouse Testis for Formation of Adult-Type Leydig Cells and Normal Development of Peritubular Cells and Seminiferous Tubules. Biol Reprod. 2000;63(6):1825-1838. doi: https://doi.org/10.1095/biolreprod63.6.1825
8. Franco HL, Yao HHC. Sex and hedgehog: roles of genes in the hedgehog signaling pathway in mammalian sexual differentiation. Chromosom Res. 2012;20(1):247-258. doi: https://doi.org/10.1007/s10577-011-9254-z
9. Tate G, Satoh H, Endo Y, Mitsuya T. Assignment of Desert Hedgehog (DHH) to Human Chromosome Bands 12q12–>q13.1 by in Situ Hybridization. Cytogenetics and Cell Genetics. 2000;88(1-2):93-94. doi: https://doi.org/10.1159/000015495
10. Ayers K, van den Bergen J, Robevska G, et al. Functional analysis of novel desert hedgehog gene variants improves the clinical interpretation of genomic data and provides a more accurate diagnosis for patients with 46,XY differences of sex development. J Med Genet. 2019;56(7):434-443. doi: https://doi.org/10.1136/jmedgenet-2018-105893
11. Canto P, Söderlund D, Reyes E, Méndez JP. Mutations in the Desert hedgehog (DHH) Gene in Patients with 46,XY Complete Pure Gonadal Dysgenesis. J Clin Endocrinol Metab. 2004;89(9):4480-4483. doi: https://doi.org/10.1210/jc.2004-0863
12. Akter H, Hossain MS, Dity NJ, et al. Whole exome sequencing uncovered highly penetrant recessive mutations for a spectrum of rare genetic pediatric diseases in Bangladesh. npj Genomic Med. 2021;6(1):14. doi: https://doi.org/10.1038/s41525-021-00173-0
13. Baldinotti F, Cavallaro T, Dati E, et al. Novel Familial Variant of the Desert Hedgehog Gene: Clinical Findings in Two Sisters with 46,XY Gonadal Dysgenesis or 46,XX Karyotype and Literature Review. Horm Res Paediatr. 2018;89(3):141-149. doi: https://doi.org/10.1159/000485507
14. Mehta P, Singh P, Gupta NJ, et al. Mutations in the desert hedgehog (DHH) gene in the disorders of sexual differentiation and male infertility. J Assist Reprod Genet. March 2021. doi: https://doi.org/10.1007/s10815-021-02140-1
Об авторах
Н. Ю. КалинченкоРоссия
Калинченко Наталья Юрьевна - кандидат медицинских наук, ведущий научный сотрудник.
117036, Москва, ул. Дм. Ульянова, д. 11.
eLibrary SPIN: 6727-9653
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
З. К. Батырова
Россия
Батырова Залина Кимовна - кандидат медицинских наук, старший научный сотрудник 2-го гинекологического отделения.
Москва.
eLibrary SPIN: 7226-1949
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
И. Б. Кострова
Россия
Кострова Ирина Борисовна - заведующая эндокринологическим отделением.
Москва.
eLibrary SPIN: 9224-7047
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
А. А. Колодкина
Россия
Колодкина Анна Александровна - кандидат медицинских наук, и.о. заведующего отделением наследственных эндокринопатий.
117036, Москва, ул. Дм. Ульянова, д. 11.
eLibrary SPIN: 6705-6630
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Е. В. Уварова
Россия
Уварова Елена Витальевна - член-корреспондент РАН, доктор медицинских наук, профессор, заведующий 2-м гинекологическим отделением (гинекологии детского и юношеского возраста) НМИЦАГиП им. академика В.И. Кулакова Минздрава России, президент Межрегиональной общественной организации «Объединение детских и подростковых гинекологов»..
Москва.
eLibrary SPIN: 1264-1293
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
З. Х. Кумыкова
Россия
Кумыкова Заира Хасановна - кандидат медицинских наук, старший научный сотрудник 2-го гинекологического отделения (гинекологии детского и юношеского возраста).
Москва.
eLibrary SPIN: 4346-6183
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
А. В. Асатурова
Россия
Асатурова Александра Вячеславовна - доктор медицинских наук, заведующий отделением патоморфологии.
Москва.
eLibrary SPIN: 8585-1446
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Г. Н. Хабас
Россия
Хабас Григорий Николаевич - кандидат медицинских наук заведующий отделением инновационной онкологии и гинекологии .
Москва.
eLibrary SPIN: 1264-1293
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
А. Н. Тюльпаков
Россия
Тюльпаков Анатолий Николаевич - доктор медицинских наук, заведующий кафедры генетики эндокринных болезней.
117036, Москва, ул. Дм. Ульянова, д. 11.
eLibrary SPIN: 8396-1798
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Дополнительные файлы
|
|
1. Рисунок 1. Ткань яичка (без признаков неопластических изменений). А — окраска гематоксилином и эозином, х40. Б. — окраска гематоксилином и эозином, х200. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(1MB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Калинченко Н.Ю., Батырова З.К., Кострова И.Б., Колодкина А.А., Уварова Е.В., Кумыкова З.Х., Асатурова А.В., Хабас Г.Н., Тюльпаков А.Н. Описание клинических случаев нарушений формирования пола 46,XY, обусловленных мутацией в гене DHH. Роль сигнального пути DHH в формировании пола. Проблемы Эндокринологии. 2021;67(3):73-77. https://doi.org/10.14341/probl12757
For citation:
Kalinchenko N.Y., Batyrova Z.K., Kostrova I.B., Kolodkina A.A., Uvarova E.N., Kumykova Z.Kh., Asaturova A.V., Khabas G.N., Tiulpakov A.N. Clinical Findings in Two patients with DSD 46XY caused by new variant of the Desert Hedgehog Gene and review of the literature of the role of DHH signaling pathway in sex development. Problems of Endocrinology. 2021;67(3):73-77. (In Russ.) https://doi.org/10.14341/probl12757

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).








































.jpg)


