Перейти к:
Допубертатная гинекомастия в дебюте синдрома наследственной предрасположенности к опухолям (описание клинических случаев)
https://doi.org/10.14341/probl13239
Аннотация
Синдром Пейтца–Егерса (Peutz–Jeghers Syndrome, PJS) относится к синдромам наследственной предрасположенности к опухолям и обусловлен патологическими вариантами гена STK11, приводящими к нарушению синтеза белка серин/треонинкиназы 11, выполняющего роль опухолевого супрессора.
Клиническим проявлением синдрома является сочетание гамартоматозного полипоза желудочно-кишечного тракта и характерной кожно-слизистой гиперпигментации. Также для данного заболевания характерен высокий риск развития желудочно-кишечных и внекишечных новообразований, в том числе доброкачественных или злокачественных опухолей репродуктивной системы.
Одним из первых проявлений заболевания у пациентов мужского пола может быть допубертатная гинекомастия, связанная с крупноклеточными кальцифицирующими опухолями яичек из клеток Сертоли, экспрессирующими ароматазу. В отличие от пубертатной гинекомастии, допубертатная встречается крайне редко, и в ее основе часто лежат патологические причины. Своевременное установление точного диагноза пациентам с допубертатной гинекомастией, в том числе синдрома Пейтца–Егерса, определяет как тактику ведения гинекомастии, так и протоколы наблюдения за развитием других компонентов заболевания в будущем.
В статье представлено описание двух пациентов с допубертатной гинекомастией на фоне синдрома Пейтца–Егерса с разными молекулярно-генетическими дефектами: в одном случае связанной с дупликацией участка гена STK11, в другом — с микроделецией короткого плеча 19 хромосомы, содержащего данный ген.
Ключевые слова
Для цитирования:
Карева М.А., Созаева Л.С., Чугунов И.С., Петеркова В.А., Михалина С.Д. Допубертатная гинекомастия в дебюте синдрома наследственной предрасположенности к опухолям (описание клинических случаев). Проблемы Эндокринологии. 2023;69(4):101-106. https://doi.org/10.14341/probl13239
For citation:
Kareva M.A., Sozaeva L.S., Chugunov I.S., Peterkova V.A., Mikhalina S.D. Prepubertal gynecomastia at the debut of hereditary tumors predisposition syndrome (clinical case reports). Problems of Endocrinology. 2023;69(4):101-106. (In Russ.) https://doi.org/10.14341/probl13239
АКТУАЛЬНОСТЬ
Гинекомастия — это, как правило, доброкачественная пролиферация ткани молочных желез у представителей мужского пола, возникающая вследствие дисбаланса между действием эстрогенов, стимулирующих рост ткани молочных желез, и блокирующим действием андрогенов. В детском возрасте в подавляющем большинстве случаев гинекомастия имеет физиологический характер и возникает в грудном возрасте и у подростков в период пубертата [1]. Пубертатная гинекомастия возникает, по разным данным, у 20–70% мальчиков-подростков и проходит самостоятельно примерно через 6 мес, в некоторых случаях может персистировать до 1–2 лет, редко она может сохраняться и требовать хирургической коррекции в косметических целях [2]. Возникновение допубертатной гинекомастии (у детей старше года и до начала полового развития) является крайне редким явлением и требует тщательного обследования для исключения патологических причин. Признаками патологической гинекомастии у мальчиков являются [3]:
- возникновение гинекомастии не в неонатальном и не в пубертатном периоде (допубертатная гинекомастия);
- быстрая прогрессия гинекомаcтии;
- увеличение ткани молочных желез в диаметре более 4 см;
- быстропрогрессирующее и преждевременное появление признаков гиперандрогении (увеличение полового члена, эрекции, появление лобкового оволосения).
Причинами допубертатной гинекомастии могут являться [3]:
- опухоли яичек: опухоли из клеток Лейдига и Сертоли, герминативные опухоли — как спорадические, так и в рамках наследственных синдромов;
- герминативные ХГЧ-секретирующие опухоли различной локализации;
- феминизирующие опухоли надпочечников;
- синдром избытка ароматазы (синдром семейной гинекомастии);
- врожденная дисфункция коры надпочечников.
Опухоли яичек, приводящие к избыточной секреции эстрогенов, могут развиваться самостоятельно, но также могут возникать при наследственных опухолевых синдромах, таких как синдром Пейтца–Егерса и Карни-комплекс [4].
Синдром Пейтца–Егерса (Peutz–Jeghers Syndrome, PJS) — редкое наследственное заболевание, для которого характерно развитие множественных желудочно-кишечных и внекишечных новообразований.
Достоверной информации о распространенности синдрома Пейтца–Егерса в настоящее время нет — частота случаев варьируется от 1 на 8 300 до 1 на 280 000 человек [5].
Впервые обратил внимание на наследственную природу данного синдрома J. Peutz в 1921 г. во время наблюдений за голландской семьей с полипозом желудочно-кишечного тракта. Однако только в 1949 г. H. Jeghers и соавт. описали 10 случаев данного синдрома как отдельное заболевание и выделили характерную триаду: полипоз желудочно-кишечного тракта (ЖКТ), пигментные пятна на коже и слизистых оболочках и наследственный характер заболевания [6].
В основе синдрома лежат мутации гена STK11, который расположен на коротком плече 19 хромосомы и кодирует фермент серин/треонинкиназу 11, относящийся к семейству супрессоров опухолей. В норме данный фермент фосфорилирует 5’АМФ-активируемую протеинкиназу, которая впоследствии запускает каскад реакций, приводящих к подавлению активности регулятора клеточных процессов mTOR, в результате чего происходит остановка роста и пролиферации клеток [7].
Варианты гена (нонсенс- и миссенс-мутации, небольшие делеции/инсерции, большие делеции) приводят к нарушению структуры или сокращению длины кодируемого белка и утрате им киназной активности, что, в свою очередь, увеличивает скорость метаболизма и деление опухолевых клеток, секрецию опухолевых цитокинов и приводит к развитию новообразований [8].
Синдром наследуется по аутосомно-доминантному типу. Риск возникновения заболевания одинаков для мужчин и женщин.
Согласно современным клиническим рекомендациям, установить синдром Пейтца–Егерса можно при наличии любых двух из следующих признаков:
- два и более гамартоматозных полипа ЖКТ типа Пейтца–Егерса (типа PJS);
- кожно-слизистая гиперпигментация рта, губ, носа, глаз, гениталий или пальцев;
- отягощенный наследственный анамнез по синдрому Пейтца–Егерса.
Полипы ЖКТ типа PJS (гамартоматозные полипы PJS-типа) являются особым типом гамартоматозных полипов ЖКТ, которые гистопатологически характеризуются отчетливыми пересекающимися пучками гладких мышц с характерным ветвящимся (ветвистым деревом) видом по всей собственной пластинке [9].
Чаще всего первым признаком заболевания является характерная гиперпигментация слизистых оболочек и кожи, которая обычно проявляется в детском возрасте и предшествует возникновению симптомов, связанных с образованием гамартоматозных полипов ЖКТ. Учитывая риски поражения ЖКТ, такие пациенты требуют тщательного наблюдения у гастроэнтеролога и проведения регулярного обследования с целью своевременного выявления и удаления полипов ЖКТ, что снижает риск злокачественных новообразований и осложнений в виде инвагинации кишечника и кишечной непроходимости. Исходный скрининг ЖКТ должен включать эндоскопию верхних отделов ЖКТ (эзофагогастродуоденоскопию), видеокапсульную эндоскопию и колоноскопию, начиная с восьмилетнего возраста. Последующий интервал скрининга основывается на результатах исходного обследования [10].
Помимо гамартоматозных полипов, у данных пациентов выше риск развития некоторых других опухолей, в том числе злокачественных: рак поджелудочной железы, рак груди, злокачественные опухоли матки и яичников [11].
Однако, помимо перечисленных клинических проявлений, не менее важным является эндокринная составляющая синдрома Пейтца–Егерса — для мальчиков характерны крупноклеточные кальцифицирующие опухоли яичек из клеток Сертоли, неопластические клетки которых экспрессируют ароматазу, что приводит к повышению уровня эстрогенов и развитию гинекомастии, ускорению линейного роста и прогрессии костного возраста [12]; для девочек — эстроген-секретирующие опухоли яичников, которые приводят к развитию преждевременного полового развития по изосексуальному типу [13].
В случае ранней диагностики синдрома и верной тактики ведения таких пациентов продолжительность жизни может достигать 80 лет. Причинами смерти могут быть как последствия полипоза ЖКТ — инвагинация кишечника, желудочно-кишечное кровотечение, так и онкологический процесс (прогноз таких пациентов зависит от вида злокачественного новообразования) [11].
Необходимо отметить, что гинекомастия может быть одним из первых клинических проявлений синдрома, за исключением характерной гиперпигментации слизистых оболочек и кожи, возникающих в раннем возрасте, и являться одной из причин первого обращения пациентов за медицинской помощью [12].
В статье представлено описание двух мальчиков, у которых единственными клиническими проявлениями на момент обследования были характерная кожно-слизистая гиперпигментация и гинекомастия.
ОПИСАНИЕ СЛУЧАЯ
Пациент С., 4,7 года, поступил в ФГБУ «НМИЦ эндокринологии» МЗ РФ впервые с жалобами на увеличение грудных желез и их болезненность.
Из анамнеза известно, что увеличение грудных желез отмечалось с возраста 3 лет с одновременным появлением темно-синих пятен на коже нижней губы. В возрасте 4 лет мальчик впервые осмотрен детским эндокринологом по месту жительства: рост 116 см, вес — 22 кг, SDS роста +2,5, отмечалась двусторонняя гинекомастия. Половые органы были сформированы правильно, по мужскому типу, стадия полового развития Таннер 1, яички в мошонке по 4 мл.
В гормональном профиле отмечались допубертатные уровни гонадотропинов (лютеинизирующий гормон (ЛГ) — менее 0,09 мМЕ/мл, фолликулостимулирующий гормон (ФСГ) — менее 0,07 мМЕ/мл) и половых гормонов (эстрадиол — менее 37 пмоль/л, тестостерон — 0,17 нмоль/л). По результатам рентгенографии кистей костный возраст несколько опережал паспортный и соответствовал 5,3 годам. При ультразвуковом исследовании органов мошонки отмечалось двустороннее увеличение яичек — объем правого яичка 1,7 см³, объем левого яичка 1,9 см³. Проведена проба с аналогом гонадотропин-рилизинг-гормона — данных за гонадотропинзависимое преждевременное половое развитие не получено (максимальный уровень ЛГ составил 0,29 МЕд/л через 4 ч после начала пробы). С целью уточнения диагноза и решения вопроса о дальнейшей тактике ведения, была рекомендована госпитализация в ФГБУ «НМИЦ эндокринологии».
При осмотре на момент поступления обращали на себя внимание умеренная высокорослость (рост 118,8 см, SDS +2,83, вес 24,3 кг, ИМТ 17,2 кг/м², SDS ИМТ +1,32), а также темно-синие пигментные пятна на коже и слизистой нижней губы, увеличение грудных желез с обеих сторон. Половые органы сформированы правильно по мужскому типу, стадия полового развития — Таннер 1, объем яичек по орхидометру Прадера соответствовал 4 мл с обеих сторон. В гормональном профиле при допубертатных уровнях гонадотропинов (ЛГ 0,21 Ед/л (0–1,5), ФСГ 0,6 Ед/л (0–2)) и тестостерона (0,17 нмоль/л (0,24–0,69)) отмечалось повышение уровня эстрадиола до 84,4 (0–47) пмоль/л. Костный возраст значимо опережал паспортный и соответствовал 7,1 годам. По результатам ультразвукового исследования мошонки отмечалось увеличение размеров яичек: объем правого яичка 1,9 мл, левого яичка — 1,8 мл (рис. 1).

Рисунок 1. УЗИ органов мошонки пациента С. в возрасте 4,7 года.
Из наследственного анамнеза известно, что у матери пациента имеется полипоз ЖКТ (полип двенадцатиперстной кишки, множественные полипы тощей кишки, полип нисходящей ободочной кишки).
Учитывая отягощенный наследственный анамнез по полипозу ЖКТ, наличие темно-синих пятен на коже нижней губы и допубертатную гинекомастию, установлен синдром Пейтца–Егерса. Выполнено молекулярно-генетическое исследование, по результатам которого в 5-м экзоне гена STK11 выявлен гетерозиготный вариант c.646dup:p.S216Ffs*50 (не описан; патогенный (согласно классификации ACMG)). После получения результатов молекулярно-генетического исследования пробанда матери пациента было также проведено исследование гена STK11, по результатам которого выявлен аналогичный генетический вариант.
Учитывая диагноз, наличие у пациента истинной гинекомастии на фоне повышенного уровня эстрадиола при допубертатных гонадотропинах, увеличение объема яичек расценено как гиперплазия клеток Сертоли, экспрессирующих ароматазу.
В связи с наличием гиперэстрогенемии с целью замедления скорости закрытия зон роста и улучшения прогнозируемого роста по решению консилиума пациенту была рекомендована инициация антиэстрогенной терапии блокатором ароматазы III поколения — анастрозолом в дозе 1 мг/сут.
При повторном обследовании пациента через 1 год отмечалась положительная динамика в виде уменьшения выраженности гинекомастии и снижения уровня эстрадиола (53,6 пмоль/л). Однако на этом фоне сохранялись высокие темпы роста и прогрессия костного возраста (по TW20 — 8,3 лет), что, вероятнее всего, было связано с малой продолжительностью терапии анастрозолом. Также при УЗИ органов мошонки выявлены эхографические признаки микрокальцификатов в обоих яичках, которые не визуализировались при первичном обследовании (рис. 2). Было рекомендовано продолжить терапию блокаторами ароматазы. Также ребенку рекомендовано проведение гастро- и колоноскопии в возрасте 8 лет.
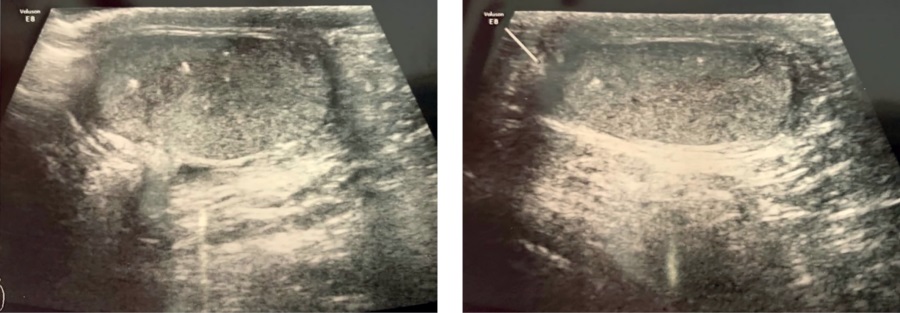
Рисунок 2. УЗИ органов мошонки пациента С. в возрасте 6 лет.
Пациент Ф., 7 лет, госпитализирован в ФГБУ «НМИЦ эндокринологии» МЗ РФ впервые с жалобами на увеличение грудных желез, водянку яичка справа, кальцинаты в яичках по результатам УЗИ.
Из анамнеза известно, что в возрасте 2 мес в связи с наличием стигм дизэмбриогенеза (эмбриональная грыжа, дисгенезия мозолистого тела по данным МРТ головного мозга) выполнен хромосомный микроматричный анализ, по данным которого выявлена микроделеция короткого плеча 19 хромосомы с позиции 352288 до позиции 1434508, в зону которой также попадает ген STK11.
С 5 лет у мальчика отмечалось увеличение грудных желез, с выраженной прогрессией после 6,5 лет. При обследовании по месту жительства в возрасте 6,5 лет в гормональном профиле на фоне допубертатных гонадотропинов (ЛГ 0,12 мМЕд/мл, ФСГ 0,08 мМЕд/мл) и тестостерона (0,14 нмоль/л) отмечалось повышение уровня эстрадиола (44,1 пмоль/л). По результатам рентгенографии кистей костный возраст опережал паспортный и соответствовал 7 годам. При ультразвуковом исследовании органов мошонки отмечались признаки водянки правого яичка, множественные кальцинаты, преимущественно в правом яичке. Была проведена проба с аналогом гонадотропин-рилизинг-гормона — данных за гонадотропинзависимое преждевременное половое развитие не получено (максимальный уровень ЛГ составил 0.53 мМЕд/мл).
С целью уточнения диагноза и решения вопроса о дальнейшей тактике ведения, была рекомендована госпитализация в ФГБУ «НМИЦ эндокринологии».
При осмотре на момент поступления: рост 120,8 см, SDS роста +0,09, вес: 21,5 кг, SDS ИМТ -0,62. Отмечались темно-синие пигментные пятна на носу, щеках и губах, увеличение грудных желез с обеих сторон, рост остистых волос на спине, готическое небо, широкая щель между 1-м и 2-м пальцами. Половые органы были сформированы правильно по мужскому типу, стадия полового развития по Таннер 1, яички в мошонке, объем яичек по орхидометру Прадера соответствовал справа 3 мл, слева 4 мл. Также справа были признаки водянки.
В гормональном профиле отмечалось повышение уровня эстрадиола — 128,48 пмоль/л (0–47) при допубертатных уровнях ЛГ — 0,216 Ед/л (0–1,5), ФСГ — 0,66 Ед/л (0–2), тестостерона 0,176 нмоль/л (0,24–0,69). Костный возраст несколько опережал паспортный и соответствовал 8,6 годам. По результатам ультразвукового исследования мошонки объем правого яичка 1,5 мл, левого яичка — 1,5 мл, эхографические признаки микрокальцификатов в обоих яичках, очаговых изменений в правом яичке, водянки оболочек правого яичка (рис. 3).
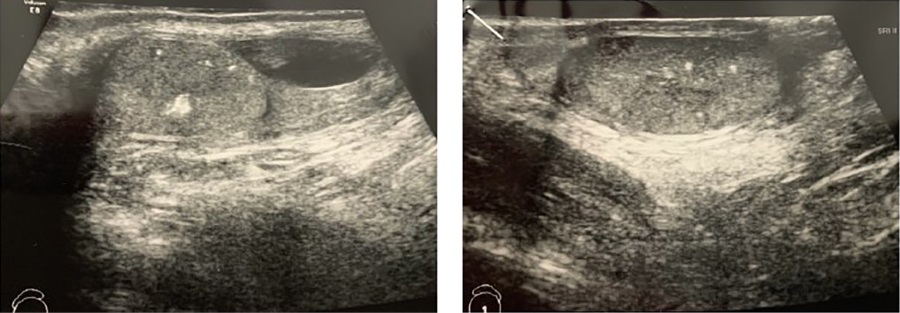
Рисунок 3. УЗИ органов мошонки пациента Ф.
Синдром Пейтца–Егерса у данного пациента не вызывал сомнений в связи с наличием типичных клинических проявлений и результатов молекулярно-генетического исследования.
Наличие у пациента стигм эмбриогенеза объясняется микроделецией с выпадением не только гена STK11, но также генов: THEG, C2CD4C, SHC2, MADCAM1, CDC34, GZMM, BSG, HCN2, POLRMT, FGF22, FSTL3, PALM, AZU1, PRTN3, ELANE, CFD, MED16, KISS1R, ARID3A, GRIN3B, C19orf66, CNN2, ABCA7, HMHA1, POLR2E, GPX4, ATP5D, MIND, CIRBP, EFNA2, NDUFS7, GAMT, DAZAP1. Учитывая делецию данных генов и возможное развитие пороков внутренних органов, пациенту дополнительно был проведен скрининг возможных аномалий, по результатам которого данных за патологию сердца, почек не получено.
Учитывая наличие гиперэстрогенемии, с патогенетической целью по решению консилиума пациенту была рекомендована инициация антиэстрогенной терапии блокатором ароматазы III поколения — анастрозолом в дозе 1 мг/сут. При обследовании пациента через 1 год отмечалась положительная динамика в виде снижения уровня эстрадиола до 63 пмоль/л и отсутствия прогрессии костного возраста. Пациент был направлен в специализированное гастроэнтерологическое отделение для проведения капсульной колоноскопии и гастроэзофагодуоденоскопии.
ОБСУЖДЕНИЕ
Допубертатная гинекомастия встречается крайне редко, в отличие от неонатальной и пубертатной гинекомастии, которые развиваются более чем у половины мальчиков. Причины препубертатной гинекомастии можно разделить на спорадические опухоли и наследственные синдромы.
К спорадическим опухолям относятся ХГЧ-секретирующие опухоли как гонадной, так и внегонадной локализации, феминизирующие опухоли яичек (из клеток Лейдига и Сертоли) и надпочечников. К наследственным синдромам относятся: синдром Пейтца–Егерса, Карни-комплекс, синдром избытка ароматазы [14].
Наиболее частым эндокринным проявлением при синдроме Пейтца-Егерса у мальчиков являются крупноклеточные кальцифицирующие опухоли яичек из клеток Сертоли, неопластические клетки которых экспрессируют ароматазу, что приводит к гинекомастии, ускорению линейного роста и прогрессии костного возраста. При ультразвуковой диагностике чаще всего отмечается двустороннее увеличение объема яичек с визуализацией микрокальцинатов в виде «рождественской елки», однако, по данным литературы, также может отмечаться двустороннее увеличение размера яичек без микрокальцинатов [4].
В данной статье были представлены два клинических случая пациентов с синдромом Пейтца–Егерса. У обоих пациентов были выявлены компоненты данного синдрома — характерная кожно-слизистая гиперпигментация и изменения яичек, наиболее вероятно соответствующие Сертоли-клеточным опухолям яичек, а также проявления, связанные с гиперэстрогенемией — гинекомастия, ускорение темпов линейного роста и опережение костного возраста.
Надо отметить, что пациенты отличаются фенотипически, что связано не только с возможным полиморфизмом проявлений этого заболевания, но и с тем, что у первого пациента была мутация только в гене STK11, а у второго имеет место микроделеционный синдром в связи с делецией гена STK11 и еще 33 генов, попадающих в зону делеции.
В связи с неясным злокачественным потенциалом данных опухолей единой тактики ведения пациентов, имеющих Сертоли-клеточные опухоли, нет. В литературе описаны случаи, где отдавали предпочтение двусторонней орхиэктомии, принимая во внимание возможный инвазивный рост данных опухолей. Однако, учитывая низкий риск злокачественной трансформации опухолей полового канатика, в случае диагностики кальцифицирующих образований яичка в допубертатном возрасте в настоящее время отдают предпочтение консервативной тактике ведения с целью сохранения сперматогенеза и возможности развития самостоятельного полового созревания. В качестве консервативного лечения используют блокаторы ароматазы III поколения с целью снижения уровня эстрогенов и тщательное наблюдение за размерами и характеристиками опухолей яичек при помощи УЗИ [12].
При лечении наших пациентов также была выбрана консервативная тактика ведения — обоим мальчикам назначена терапия ингибиторами ароматазы с положительным эффектом в виде снижения уровня эстрогенов. Пациенты продолжают наблюдаться эндокринологами, онкологами и гастроэнтерологами.
Учитывая то, что гинекомастия при данном синдроме является одним из первых значимых компонентов, такие пациенты в первую очередь могут обращаться к педиатрам и эндокринологам. Установление точного диагноза и причины гинекомастии крайне важно для детей с синдромом Пейтца–Егерса, так как позволит не только выбрать адекватную тактику лечения данного проявления, но и своевременно начать скрининговое обследование, принимая во внимание возможность развития у пациентов множественных опухолей других локализаций, тем самым улучшив качество и продолжительность их жизни.
ЗАКЛЮЧЕНИЕ
Синдром Пейтца–Егерса — редкое наследственное заболевание, которое можно заподозрить на основании отягощенного наследственного анамнеза и характерных клинических проявлений (гиперпигментация слизистых оболочек и кожи, полипоз ЖКТ). Одним из ранних компонентов синдрома являются крупноклеточные кальцифицирующие опухоли яичек, экспрессирующие ароматазу, которые могут возникать в детстве, что делает необходимым включение синдрома Пейтца–Егерса в спектр причин для дифференциальной диагностики у мальчиков с гинекомастией в допубертатном возрасте. Установление диагноза необходимо для комплексного междисциплинарного подхода к данной группе пациентов, а также для проведения медико-генетического консультирования семьи и выбора оптимальной программы наблюдения за пациентами.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Молекулярно-генетическое исследование выполнено при финансовой поддержке фонда поддержки и развития филантропии «КАФ».
Конфликт интересов. Все авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Карева М.А., Созаева Л.С., Чугунов И.С., Петеркова В.А., Михалина С.Д. — концепция и дизайн исследования, сбор материала, анализ полученных данных, написание текста. Все авторы внесли значимый вклад в подготовку статьи, прочли и одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Согласие пациента. Законные представители пациентов подписали информированное согласие на публикацию персональной медицинской информации в журнале «Проблемы эндокринологии» в обезличенной форме.
Список литературы
1. Mahoney CP. Adolescent gynecomastia. Differential diagnosis and management. Pediatr Clin North Am. 1990;37(6):1389-1404. doi: https://doi.org/10.1016/s0031-3955(16)37016-x
2. Mieritz MG, Rakêt LL, Hagen CP, et al. A longitudinal study of growth, sex steroids, and IGF-1 in boys with physiological gynecomastia. J Clin Endocrinol Metab. 2015;100(10):3752-3759. doi: https://doi.org/10.1210/jc.2015-2836
3. Ma NS, Geffner ME. Gynecomastia in prepubertal and pubertal men. Curr Opin Pediatr. 2008;20(4):465-470. doi: https://doi.org/10.1097/MOP.0b013e328305e415
4. Gourgari E, Saloustros E, Stratakis CA. Largecell calcifying Sertoli cell tumors of the testes in pediatrics. Curr Opin Pediatr. 2012;24(4):518-522. doi: https://doi.org/10.1097/MOP.0b013e328355a279
5. Lindor NM, McMaster ML, Lindor CJ, et al. Concise handbook of familial cancer susceptibility syndromes — second edition. JNCI Monographs. 2008;2008(38):3-93. doi: https://doi.org/10.1093/jncimonographs/lgn001
6. Jeghers H, McKusick VA, Katz KH. Generalized Intestinal polyposis and melanin spots of the oral mucosa, lips and digits: A syndrome of diagnostic significance. N Engl J Med. 1949;241(25):993-1005. doi: https://doi.org/10.1056/NEJM194912222412501
7. Mihaylova MM, Shaw RJ. The AMPK signalling pathway coordinates cell growth, autophagy and metabolism. Nat Cell Biol. 2011;13(9):1016-1023. doi: https://doi.org/10.1038/ncb2329
8. Schumacher V. STK11 genotyping and cancer risk in Peutz-Jeghers syndrome. J Med Genet. 2005;42(5):428-435. doi: https://doi.org/10.1136/jmg.2004.026294
9. Beggs AD, Latchford AR, Vasen HFA, et al. Peutz-Jeghers syndrome: a systematic review and recommendations for management. Gut. 2010;59(7):975-986. doi: https://doi.org/10.1136/gut.2009.198499
10. Boland CR, Idos GE, Durno C, et al. Diagnosis and management of cancer risk in the gastrointestinal hamartomatous polyposis syndromes: Recommendations from the US multi-society task force on colorectal cancer. Gastroenterology. 2022;162(7):2063-2085. doi: https://doi.org/10.1053/j.gastro.2022.02.021
11. van Lier MGF, Wagner A, Mathus-Vliegen EMH, et al. High cancer risk in Peutz–Jeghers syndrome: A systematic review and surveillance recommendations. Am J Gastroenterol. 2010;105(6):1258-1264. doi: https://doi.org/10.1038/ajg.2009.725
12. Lefevre H, Bouvattier C, Lahlou N, et al. Prepubertal gynecomastia in Peutz-Jeghers syndrome: incomplete penetrance in a familial case and management with an aromatase inhibitor. Eur J Endocrinol. 2006;154(2):221-227. doi: https://doi.org/10.1530/eje.1.02085
13. Young RH, Dickersin GR, Scully RE. A distinctive ovarian sex cord-stromal tumor causing sexual precocity in the PeutzJeghers syndrome. Am J Surg Pathol. 1983;7(3):233-243. doi: https://doi.org/10.1097/00000478-198304000-00002
14. Laimon W, El-Hawary A, Aboelenin H, et al. Prepubertal gynecomastia is not always idiopathic: case series and review of the literature. Eur J Pediatr. 2021;180(3):977-982. doi: https://doi.org/10.1007/s00431-020-03799-x
Об авторах
М. А. КареваРоссия
Карева Мария Андреевна, д.м.н.
Россия, 117036, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
нет
Л. С. Созаева
Россия
Созаева Лейла Салиховна, к.м.н.
Россия, 117036, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
нет
И. С. Чугунов
Россия
Чугунов Игорь Сергеевич, к.м.н.
Россия, 117036, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
нет
В. А. Петеркова
Россия
Петеркова Валентина Александровна, д.м.н., профессор, академик РАН
Россия, 117036, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
нет
С. Д. Михалина
Россия
Михалина Софья Дмитриевна, врач-детский эндокринолог, сотрудник детского отделения наследственных заболеваний и эндокринопатий раннего возраста
Россия, 117036, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
нет
Дополнительные файлы
|
|
1. Рисунок 1. УЗИ органов мошонки пациента С. в возрасте 4,7 года. | |
| Тема | ||
| Тип | Прочее | |
Посмотреть
(219KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. УЗИ органов мошонки пациента С. в возрасте 6 лет. | |
| Тема | ||
| Тип | Прочее | |
Посмотреть
(230KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. УЗИ органов мошонки пациента Ф. | |
| Тема | ||
| Тип | Прочее | |
Посмотреть
(239KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Карева М.А., Созаева Л.С., Чугунов И.С., Петеркова В.А., Михалина С.Д. Допубертатная гинекомастия в дебюте синдрома наследственной предрасположенности к опухолям (описание клинических случаев). Проблемы Эндокринологии. 2023;69(4):101-106. https://doi.org/10.14341/probl13239
For citation:
Kareva M.A., Sozaeva L.S., Chugunov I.S., Peterkova V.A., Mikhalina S.D. Prepubertal gynecomastia at the debut of hereditary tumors predisposition syndrome (clinical case reports). Problems of Endocrinology. 2023;69(4):101-106. (In Russ.) https://doi.org/10.14341/probl13239

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).









































.jpg)


