Перейти к:
Эффективность лечения агонистами рецептора глюкагоноподобного пептида-1 азиатских пациентов с сахарным диабетом типа 2
https://doi.org/10.14341/probl13245
Аннотация
ОБОСНОВАНИЕ. Прогнозируемый рост числа пациентов с сахарным диабетом типа 2 (СД2) через два десятилетия на 68% и особенности патофизиологического течения заболевания являются важнейшими факторами для выработки оптимальной тактики лечения заболевания у азиатского населения. На сегодняшний день известно, что дисфункция β-клеток является доминирующей в патогенезе СД2 у азиатов. В ряде азиатских стран инкретиннаправленная терапия является ведущей.
ЦЕЛЬ. Проведение анализа работ, посвященных изучению особенностей секреции глюкагоноподобного пептида-1 (ГПП-1) и результатов клинических исследований препаратов класса агонистов рецепторов ГПП-1 (арГПП-1), а также оценка их эффективности лечения у азиатского населения с СД2.
МАТЕРИАЛЫ И МЕТОДЫ. Обзор исследований, посвященных патофизиологическим аспектам секреции ГПП-1 и оценке эффективности терапии препаратами арГПП-1, зарегистрированными и применяющимися в реальной клинической практике в азиатских регионах.
РЕЗУЛЬТАТЫ. Ряд исследований в азиатских странах показал, что уровни интактного ГПП-1 были значительно ниже как у пациентов с СД2, так и у здоровых добровольцев из Японии; а также на стадии нарушенной толерантности к глюкозе. Предполагается, что причиной снижения уровня ГПП-1 является, или нарушение его секреции в кишечнике, или ускоренный процессинг дипептидилпептидазой 4-го типа, или их сочетание. Большая эффективность лечения арГПП-1 в достижении гликемического контроля у азиатских пациентов с СД2 представлена Kim Y.G. и соавт. в метаанализе 15 рандомизированных контролируемых исследований, снижение уровня гликированного гемоглобина (HbA1c) на фоне лечения арГПП-1 в среднем составило -1,16% в исследованиях с преобладанием азиатских пациентов и -0,83% — неазиатских. В клинической программе PIONEER-9 были получены подобные результаты, пероральный семаглутид более выраженно влиял на гликемический контроль у японских пациентов. Так, среднее изменение HbA1c составило в дозе 3 мг -1,1%, 7 мг — -1,5%, 14 мг — -1,7%; тогда как в исследовании PIONEER-1 в глобальной популяции среднее изменение HbA1c составило при лечении в дозе 3 мг -0,6%, в дозе 7 мг — -0,9% и в дозе 14 мг — -1,1%. Исследование PIONEER-10 позволило сделать выводы о хорошей переносимости перорального семаглутида японскими пациентами с СД2. Пероральный семаглутид снижал уровень HbA1c (доза 14 мг) и массу тела (дозы 7 и 14 мг) более значимо в сравнении с дулаглутидом в дозе 0,75 мг. Результаты объединенного анализа оценки арГПП-1 длительного действия показали более существенное снижение риска сердечно-сосудистых событий в азиатской субпопуляции.
ЗАКЛЮЧЕНИЕ. Представленные результаты исследований позволяют предположить преимущества в выраженности гликемического контроля, а также в снижении относительных рисков сердечно-сосудистых событий при лечении арГПП-1 в азиатской популяции, что требует дальнейших углубленных исследований и имеет значение для оптимальной тактики ведения пациентов с СД2.
Ключевые слова
Для цитирования:
Хамнуева Л.Ю., Андреева Л.С. Эффективность лечения агонистами рецептора глюкагоноподобного пептида-1 азиатских пациентов с сахарным диабетом типа 2. Проблемы Эндокринологии. 2023;69(2):38-46. https://doi.org/10.14341/probl13245
For citation:
Khamnueva L.Yu., Andreeva L.S. Efficacy of treatment with glucagon-like peptide receptor agonists-1 in Asian patients with type 2 diabetes mellitus. Problems of Endocrinology. 2023;69(2):38-46. (In Russ.) https://doi.org/10.14341/probl13245
Сахарный диабет (СД) относится к категории социально значимых неинфекционных заболеваний; распространенность СД отличается эпидемическими темпами роста. По последним данным Международной федерации диабета (International Diabetes Federation, IDF), во всем мире количество пациентов с СД достигает 537 млн человек, из которых около половины проживают в Азии [1]. Ожидается, что к 2045 г. в мире количество пациентов с СД возрастет на 46%, в том числе в регионе Юго-Восточной Азии предполагаемый прирост составит 68%, в регионе Средней Азии и Северной Африки — 87% [1]. Тенденция к росту случаев СД за последние 20 лет отмечается во многих азиатских странах. Абсолютное большинство публикаций о клиническом течении, патогенетических особенностях СД 2 типа (СД2), результатах проведенных исследований среди азиатского населения представлено авторами из Восточной Азии (Китай, Япония, Корея). Клинические характеристики пациентов с СД2 из Восточной Азии отличаются от таковых у пациентов европейского происхождения; так, у них СД2 развивается при более низком индексе массы тела и в более молодом возрасте [2]. Возникает необходимость изучения факторов, лежащих в основе этих межэтнических различий. Следует отметить, что СД2 у пациентов из Восточной Азии характеризуется в первую очередь постпрандиальной дисфункцией β-клеток [3–5]. У пациентов с СД2 этого региона отмечаются более низкие показатели инсулиногенного ответа β-клеток и инсулинорезистентности [3][6][7]. Поэтому патофизиологические различия в проявлении заболевания имеют решающее значение для соответствующих профилактических и терапевтических подходов. Ранее, из-за сниженной функции β-клеток, средства, стимулирующие секрецию инсулина, — секретагоги, сульфонилмочевина и глиниды использовались в качестве предпочтительных препаратов для лечения СД2 у населения Японии и других народов Восточной Азии. В последнее время терапия на основе инкретинов — ингибиторов дипептидилпептидазы-4 (иДПП-4) и агонистов рецептора глюкагоноподобного пептида-1 (арГПП-1) стала широкодоступной для лечения СД2. Эти препараты инкретиннаправленной терапии улучшают функцию β-клеток за счет глюкозозависимого механизма действия, в связи с чем нивелируются такие риски нежелательных явлений, как гипогликемия или набор массы тела, свойственные ранее упомянутым секретагогам [8]. В регионе Восточной Азии уже к 2015 г. более 70% всех пациентов с СД2 получали иДПП-4 или арГПП-1; из них около 60% не принимали лекарственные препараты ранее, т.е. препараты этой группы были назначены как первая линия сахароснижающей терапии [9].
При проведении исследований действия инкретиновых гормонов для изучения их секреции и процессинга in vivo важно измерять уровень не только интактных (ответственных за эндокринное действие), но и общих (сумма интактных и расщепленных при помощи ДПП-4) форм [10][11]. Показано, что азиаты, особенно выходцы из Восточной Азии, как правило, демонстрируют более низкие уровни интактного ГПП-1, независимо от того, здоровы они или имеют СД2 [12][13]. Предполагается, что низкие уровни интактного ГПП-1 можно объяснить или нарушением его секреции из кишечника, или ускоренным процессингом ДПП-4, или сочетанным действием этих факторов. Поскольку, с одной стороны, пиковые концентрации ГПП-1 адекватно возрастают в ответ на стимуляцию глюкозой у исследуемых, в то время как уровень интактного ГПП-1 остается низким, что может свидетельствовать об усиленной активности ДПП-4. С другой стороны, существует зависимость секреции ГПП-1 от объема пищи и ее состава, в связи с чем возможна роль диетических особенностей в отношении описанного феномена у представителей азиатской популяции [13–15]. Например, систематический обзор (2012 г.) показал, что потребление белого риса несколько раз в неделю увеличивало риск развития СД2 в западных странах на 12%, в то время как среди представителей азиатской популяции, для которых рис является неотъемлемым компонентом ежедневного рациона, ассоциированный риск развития СД2 был значительно выше — 55% [16]. Эти результаты согласуются с другими исследованиями, которые показали, что у азиатов гликемический ответ на одни и те же продукты был выше, чем у представителей европеоидной расы [17–19].
Вызывает интерес исследование пациентов этнической группы «хань» из Китая. По результатам орального глюкозотолерантного теста (ОГТТ) были выделены группы с изолированной нарушенной гликемией натощак (НГН, n=98), нарушенной толерантностью к глюкозе (НТГ, n=101), НГН+НТГ (n=104) и впервые диагностированным СД (n=105), контрольную группу составили пациенты без СД (n=123) соответствующего возраста и пола. Результаты исследования показали снижение общего ГПП-1 натощак в группах НГН+НТГ и впервые диагностированного СД, более чем в 2 раза, в сравнении с контрольной группой (р<0,005). После нагрузки 75 г глюкозы через 2 ч общие концентрации ГПП-1 были значимо ниже в группах НГН+НТГ (22,24±16,7 пмоль/л) и впервые диагностированного СД (16,49±14,11 пмоль/л), по сравнению с контрольной группой (35,39±15,40 пмоль/л, р<0,005). Ценность обсуждаемого исследования возрастает в связи с тем, что пациенты не получали какой-либо сахароснижающей терапии, которая могла бы изменить уровни ГПП-1. Показано, что у лиц с НГН+НТГ и впервые диагностированным СД уже регистрировалось значительное нарушение секреции ГПП-1, которое сопровождалось значительной гипергликемией через 2 ч после приема глюкозы. Исследователи считают, что полученные ими результаты предоставляют ценную информацию о возможностях профилактики и лечения китайских пациентов с СД2 [20]. Похожие результаты получили Yabe D. и соавт., которые показали, что уровень ГПП-1 как натощак, так и после стандартного приема пищи был значительно ниже, при этом интактный уровень ГПП-1 натощак был снижен и у больных СД2, и у здоровых японцев [13]. Ожидаемо, что, по данным ряда исследований, терапия на основе ГПП-1 была более эффективной у японских пациентов с СД2, чем у других этнических групп, что свидетельствует о более глубоком дефиците ГПП-1 у японских пациентов с СД2 [21–23].
В контексте имеющихся сведений о нарушенной секреции ГПП-1 у лиц азиатской популяции представляют интерес результаты следующих метаанализов. Так, Kim Y.G. и соавт. опубликовали результаты метаанализа 55 исследований длительностью не менее 12 нед, в котором провели сравнение гипогликемической эффективности ингибиторов ДПП-4 у азиатских и неазиатских пациентов с СД2. Лучшую эффективность иДПП-4 показали в исследованиях с участием ≥50% участников из Азии, среднее снижение HbA1c достигло 0,92%; в исследованиях с <50% азиатских участников среднее снижение HbA1c составило 0,65%. Разница в снижении HbA1c между группами составила 0,26%, p<0,001 (рис. 1).
Вероятность достижения целевого уровня HbA1c <7,0% на фоне применения иДПП-4 в сравнении с контролем была выше в исследованиях с большей представленностью (≥50%) участников из Азии, чем в исследованиях с меньшим числом (<50%) азиатских участников соответственно) [24].
Эти же исследователи провели метаанализ 15 рандомизированных контролируемых исследований длительностью 12 нед и более с преобладанием азиатов (≥50% участников из Азии) и исследований без преобладания азиатов (<50% участников из Азии). Целью исследований явилось сравнение снижения уровня HbA1с, в качестве оценки эффективности аналогов ГПП-1 у азиатов и неазиатов с СД2. Снижение HbA1c на фоне лечения аналогами ГПП-1 в среднем составило -1,16% в азиатских исследованиях и -0,83% — в неазиатских. Разница между группами составила -0,32% (95% ДИ -0,64–-0,01; p=0,04). Относительный риск (ОР) с 95% ДИ достижения целевого уровня HbA1c ≤7,0%, как правило, был выше в исследованиях, в которых преобладали азиатские страны [ОР 5,7 (3,8, 8,7)], чем в исследованиях, в которых преобладали неазиатские страны [ОР 2,8 (2,4, 3,3)]. Изменения массы тела были одинаковыми между двумя группами. Гипогликемия, как правило, чаще встречалась в исследованиях с преобладанием азиатов [ОР 2,8 (2,3, 3,5)], чем в исследованиях, в которых не преобладали азиаты [ОР 1,5 (1,2, 1,8)], но тяжелая гипогликемия была очень редкой в обеих группах [25]. Таким образом, препараты инкретинового ряда (иДПП-4 и арГПП-1) снижали уровень HbA1c в большей степени в исследованиях с преобладанием азиатского населения [25].
В 2019 г. Kang Y.M. и соавт. опубликовали результаты объединенного анализа оценки сердечно-сосудистых эффектов арГПП-1 длительного действия с особым акцентом на азиатскую субпопуляцию [26]. Три многоцентровых рандомизированных двойных слепых плацебо-контролируемых исследования сердечно-сосудистых исходов (CVOT) арГПП-1 длительного действия были включены в комбинированный анализ: исследование лираглутида LEADER [27], исследование семаглутида SUSTAIN-6 [28] и исследование EXSCEL еженедельного приема эксенатида [29]. Во всех трех CVOT первичным исходом было неблагоприятное сердечно-сосудистое событие (MACE), включавшее сердечно-сосудистую смерть, нефатальный инфаркт миокарда и нефатальный инсульт. Существенное снижение риска в сравнении с другими этническими группами наблюдалось у азиатов (ОР, 0,35; 95% ДИ 0,09–1,32); подгрупповой анализ подтвердил существенное различие по эффекту на MACE между представителями различных рас (р<0,001) (табл. 1) [26].
К аналогичным результатам, подтвердившим лучший прогноз в отношении сердечно-сосудистых исходов у азиатов, пришли Lee M.Y. и соавт. в 2021 г. Исследователи провели метаанализ оценок суммарного отношения рисков (HR) в зависимости от расы по результатам CVOT-исследований ингибиторов глюкозо-натриевых транспортеров 2 типа и арГПП-1. В шести исследованиях арГПП-1 с участием 4195 азиатов и 37 530 европеоидов, MACE составил 0,68 (0,53, 0,84) и 0,87 (0,81, 0,94) соответственно (p=0,03). Авторы считают, что у азиатов очевидна более выраженная польза от терапии арГПП-1 по сравнению с европеоидами, и предполагают необходимость проведения большего количества исследований в азиатских странах для дальнейшего изучения и проверки эффективности арГПП-1 (рис. 2) [30].
Несмотря на то что достаточно хорошо изучены механизмы, лежащие в основе кардиопротективного эффекта арГПП-1, остаются неясными причины, объясняющие различия сердечно-сосудистых эффектов в зависимости от расы. Исследователями обсуждаются следующие аспекты: во-первых, потенциальные метаболические последствия, вызванные более низкими общими и стимулированными уровнями ГПП-1 у азиатов, которые могли быть компенсированы введением экзогенного арГПП-1 с оказанием более значимых эффектов ГПП-1 на организм, в том числе на сердечно-сосудистую систему; во-вторых, за счет особенностей стимуляции рецепторов ГПП-1 у азиатских субъектов, что приводит к более выраженной гипогликемической активности. Наблюдаемая у жителей Восточной Азии более выраженная дисфункция β-клеток, генетические факторы, иной состав пищи могут привести и к другому ответу на введение инкретина [31]. Поскольку у азиатов развитие и течение СД2 происходит при меньшей средней массе тела, объем для распределения препаратов также ниже, в связи с чем при сопоставимых дозировках препаратов азиатские пациенты подвергаются воздействию более высокого уровня арГПП-1 в организме. Все вышеупомянутые аспекты могут в какой-то степени объяснить дополнительную сердечно-сосудистую пользу от арГПП-1, однако их фактическая связь с этнической принадлежностью, а также другие возможные механизмы более выраженного снижения частоты сердечно-сосудистых событий на фоне применения арГПП-1 в азиатских популяциях заслуживают дальнейшего изучения и специальных испытаний в конкретных популяциях [26].
Одним из наиболее эффективных современных представителей арГПП-1 является семаглутид. Он имеет 94% гомологии в последовательности с нативным человеческим ГПП-1; три структурных отличия пролонгируют его период полувыведения примерно до 1 нед, не снижая связывания с его рецепторами ГПП-1 [32].
В клинической программе SUSTAIN семаглутид для подкожного введения демонстрировал у пациентов с СД2 устойчивый гликемический контроль и потерю веса по сравнению с различными препаратами [33][34]. В 30-недельном исследовании SUSTAIN China, проведенном в китайской популяции, семаглутид демонстрировал более высокую эффективность в сравнении с ингибитором ДПП-4 — ситаглиптином. В исследование были включены около 70% (605/868) пациентов из Китая, остальные пациенты являлись представителями четырех других азиатских стран, включая Республику Корея. Обе дозы семаглутида (0,5 мг и 1 мг) превосходили ситаглиптин 100 мг в снижении HbA1c и массы тела через 30 нед лечения. Целевого уровня HbA1c <7,0% достигли 71% пациентов, получавших семаглутид в дозе 0,5 мг в неделю и 82% — 1 мг в неделю, по сравнению с 45% на терапии ситаглиптином 100 мг. Большая доля, 35 и 55%, пациентов в группах семаглутида 0,5 и 1,0 мг соответственно достигли клинически значимой потери веса на 5% и более, что является важным фактором в лечении СД2, связанным с множеством благоприятных физиологических эффектов, включая в том числе улучшение гликемического контроля [35]. Семаглутид также представлен в форме для приема внутрь, что делает его первым и пока единственным препаратом пептидной природы, а следовательно, и единственным арГПП-1, применяемым в таблетированной форме. Для защиты семаглутида от ферментативного расщепления и облегчения его всасывания в желудке после перорального приема был использован усилитель абсорбции N- (8-[2-гидроксибензоил]амино)каприлат натрия (SNAC) [36]. SNAC уменьшает всасывание семаглутида за счет повышения рН локальной среды (защита от протеолитической деградации) и использования пассивного трансцеллюлярного пути проникновения через клеточные мембраны (повышение липофильности комплекса) [37].
До разработки семаглутида для перорального применения все арГПП-1 вводили путем инъекции. Основываясь на опыте применения инсулина, можно предполагать, что инъекционный способ введения может препятствовать использованию этих препаратов. Так, наиболее частыми проблемами для 32,6% врачей и 56% пациентов, получающих арГПП-1, было названо «предпочтение ими пероральных лекарственных средств, нежели инъекций» [38, 39]. В 2021 г. Igarashi A. и соавт. представили данные онлайн-опроса среди японских пациентов с СД2 и HbA1c ≥7,0%, получающих пероральные сахароснижающие препараты и не получавших ранее инъекционную терапию. Для проведения исследования были созданы гипотетические профили терапии с использованием имеющихся данных прямых испытаний в Японии перорального приема семаглутида (7 и 14 мг), инъекционного дулаглутида (0,75 мг) и инъекционного лираглутида (0,9 мг). По мнению респондентов, самыми значимыми пунктами лечения были способ и частота введения (49,1%), затем риск тошноты (30,8%), изменение веса (11,3%) и изменение уровня HbA1с (8,8%). Респондентами было отдано предпочтение пероральному семаглутиду 7 и 14 мг: форме семаглутида 7 мг отдавалось предпочтение перед дулаглутидом (91,0% респондентов) и лираглутидом (89,4%); форма семаглутида 14 мг была предпочтительнее дулаглутида (на 88,2%) и лираглутида (на 94,4%). Готовность инициировать лечение также была выше для перорально вводимых препаратов, подобных семаглутиду: 62,4% в дозе 7 мг и 64,0% в дозе 14 мг в сравнении с 13,6% и 11,0% при формах, подобных инъекционным арГПП-1. Авторы пришли к выводу, что японские пациенты с СД2, по-видимому, предпочитают пероральные формы арГПП-1 инъекционным формам арГПП-1, и способ введения, вероятно, является наиболее важным фактором в этом решении [40].
Эти выводы подтверждает исследование качества жизни, связанного со здоровьем (HRQoL), в исследовании PIONEER-10. Оценка проводилась с использованием специфического для Японии опросника качества жизни (DTR-QoL) при терапии СД. Опросник содержит 29 пунктов для оценки влияния лечения диабета на качество жизни HRQoL в четырех разделах: нагрузка на социальную и повседневную деятельность, беспокойство и неудовлетворенность лечением, гипогликемия, удовлетворенность лечением. Результаты показали, что именно пероральное введение семаглутида в дозах 7 и 14 мг улучшило качество жизни пациентов, измеренное с помощью специального японского инструментария DTR-QoL по сравнению с дулаглутидом в дозе 0,75 мг на 52-й неделе. Таким образом, пероральный прием семаглутида может помочь большему числу пациентов с неконтролируемым СД2 получить терапию арГПП-1 за счет преодоления барьеров, связанных с инъекционной терапией [41].
Ранее уже обсуждалось, что патофизиология СД2 в азиатской отличается от таковой в европейской популяции [31], что, по мнению Araki E. и соавт., обуславливает необходимость более углубленного изучения ответа на лечение СД2 у азиатских пациентов. В международную клиническую программу исследования перорального семаглутида — PIONEER-1, -3, -4 и -8 — включались пациенты из Японии. Araki E. и соавт. провели субанализ в отношении результатов лечения пероральным семаглутидом 7 и 14 мг у данных пациентов и представили следующие результаты: снижение уровня HbA1c по сравнению с исходным уровнем у японских пациентов составило от 1,0 до 1,2% и от 1,4 до 1,7%; снижение массы тела составило от 1,0 до 2,7% и от 3,7 до 4,7% соответственно. Снижение уровня HbA1c и массы тела, как правило, было выше, чем в группах сравнения (плацебо, ситаглиптин 100 мг, лираглутид 1,8 мг в дополнение к инсулину). Как и ожидалось, основными нежелательными явлениями были события, связанные с желудочно-кишечным трактом, чаще всего включающие тошноту, диарею и запор. Исследователи пришли к выводу, что пероральный семаглутид эффективен и хорошо переносится японскими пациентами с СД2. В то же время при рассмотрении результатов для японских пациентов следует отметить, что это были гипотез-генерирующие анализы подгрупп глобальных исследований, которые не были исходно определены в дизайне исследования. Исследования не обладали достаточной мощностью, чтобы продемонстрировать статистическое различие в пользу японской популяции, так как было включено относительно небольшое количество японских пациентов (PIONEER-1: по всему миру — 703 пациента и Япония — 116; PIONEER-3: 1864 и 207; PIONEER-4: 711 и 75; PIONEER 8: 731 и 194 соответственно). В этой связи описанные результаты следует рассматривать только как ориентировочные [42].
В исследование PIONEER-10 были включены пациенты из Японии в возрасте 20 лет и старше с неконтролируемым CД2. Они были рандомизированы для приема семаглутида перорально 1 раз в сутки в дозе 3, 7 или 14 мг или дулаглутида подкожно 1 раз в неделю в дозе 0,75 мг в течение 52 нед в качестве дополнения к основному лечению. Дулаглутид назначался в максимально одобренной в Японии дозе 0,75 мг в неделю. Первичной конечной точкой было количество нежелательных явлений, возникших на фоне лечения в течение 57 нед. Вторичные конечные точки включали среднее изменение по сравнению с исходным уровнем HbA1c и массу тела через 52 нед. Было обследовано 492 пациента, 458 из которых были рандомизированы в группу перорального приема семаглутида 3 мг (n=131), 7 мг (n=132) или 14 мг (n=130) или дулаглутида 0,75 мг (n=65). Завершили исследование 98% пациентов. Нежелательные явления возникли у 77% пациентов, принимавших перорально семаглутид в дозе 3 мг, у 80% — семаглутид в дозе 7 мг, у 85% — семаглутид в дозе 14 мг и у 82% пациентов, получавших дулаглутид. Наиболее частыми нежелательными явлениями были инфекции и желудочно-кишечные расстройства. О случаях смерти или тяжелых гипогликемических случаях не сообщалось. Среднее снижение HbA1c от исходного уровня (8,3%) к 52-й неделе достигло: при пероральном приеме семаглутида 3 мг — 0,9%; 7 мг — 1,4%, 14 мг — 1,7% и при приеме дулаглутида — 1,4%; разница в лечении составила 0,3% для семаглутида перорально в дозе 14 мг по сравнению с дулаглутидом 0,75 мг (p=0,0170). Среднее изменение массы тела от исходного уровня (72,1 кг) к 52-й неделе составило: при пероральном приеме семаглутида 3 мг — 0,0 кг, 7 мг — 0,9 кг; 14 мг — 1,6 кг и при приеме дулаглутида масса тела увеличилась на 1,0 кг (разница в лечении составила -2,6 кг для перорального семаглутида 14 мг по сравнению с дулаглутидом; p<0,0001). Результаты проведенного исследования позволили сделать выводы о хорошей переносимости перорального семаглутида японскими пациентами с СД2. Пероральный семаглутид значительно снижал HbA1c (доза 14 мг) и массу тела (дозы 7 и 14 мг) по сравнению с еженедельным подкожным введением 0,75 мг дулаглутида к 52-й неделе (рис. 3) [43].
В этом же 2020 г. были опубликованы результаты исследования PIONEER 9 — 52-недельного рандомизированного контролируемого исследования фазы 2/3а, проведенного в 16 центрах в Японии. Исследование PIONEER-9 было направлено на оценку дозозависимого влияния перорального семаглутида и сравнение эффективности и безопасности перорального семаглутида с плацебо и подкожным арГПП-1 у пациентов с СД2 в Японии. Пациенты были рандомизированы в группу перорального приема семаглутида 3 мг (n=49), 7 мг (n=49) или 14 мг (n=48) или плацебо (n=49) или лираглутида 0,9 мг (n=48). Наибольшие изменения HbA1c от исходного уровня (в среднем 8,2%) наблюдались к 26-й неделе (первичная конечная точка) и были зависимы от получаемых доз перорального семаглутида (в дозе 3 мг среднее изменение HbA1c -1,1%, 7 мг -1,5%, и 14 мг -1,7%; для плацебо -0,1% и для лираглутида 0,9 мг -1,4%). Расчетная разница HbA1c в сравнении с лираглутидом 0,9 мг составили 0,3% (p=0,0799) для перорального приема семаглутида 3 мг; для 7 мг -0,1% (р=0,394) и для 14 мг -0,3 % (p=0,0272). Наиболее частым классом нежелательных явлений при пероральном приеме семаглутида явились назофарингит, а также желудочно-кишечные явления, преимущественно легкой или средней степени тяжести: наиболее распространенным проявлением являлся запор, возникая у 10–13% пациентов при пероральном приеме семаглутида, у 6% — плацебо и у 19% — при приеме лираглутида 0,9 мг [44]. В исследовании PIONEER-9 пероральный семаглутид более выраженно влиял на гликемический контроль у японских пациентов, чем в международном исследовании PIONEER-1 в глобальной популяции, в котором также оценивалась эффективность пероральной монотерапии семаглутидом. В исследовании PIONEER-1 в глобальной популяции к 26-й неделе терапии пероральным семаглутидом с поправкой на плацебо среднее изменение HbA1c составило в дозе 3 мг -0,6%, в дозе 7 мг -0,9% и в дозе 14 мг -1,1%; в PIONEER-9 — в дозе 3 мг -1,1%, 7 мг -1,5%, 14 мг -1,7% соответственно (рис. 4) [44][45]. Таким образом, японские пациенты могут быть более восприимчивы к гликемическому эффекту агонистов рецептора ГПП-1, чем другие популяции [44].
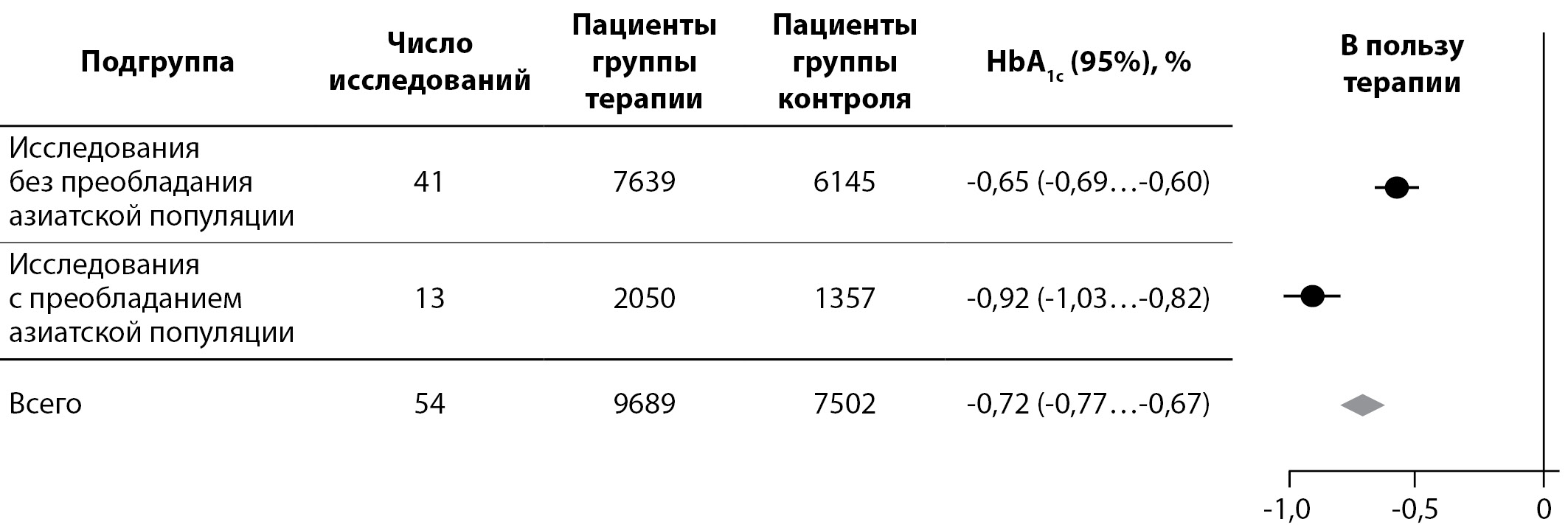
Рисунок 1. Снижение уровня HbA1c на терапии иДПП-4 в исследованиях с >50% или <50% представленностью пациентов из Азии.
Таблица 1. Подгрупповой анализ риска MACE в зависимости от расы
Раса | Исследование | Группа терапии арГПП-1 | Плацебо | ОР | 95% ДИ | ||||
Cобытий | Всего | Частота, % | Cобытий | Всего | Частота, % | ||||
Европеоидная | All | 1,270 | 10,554 | 12 | 1,373 | 10,595 | 13 | 0,92 | 0,84–1,01 |
LEADER | 494 | 3,616 | 13,7 | 543 | 3,622 | 15 | 0,91 | 0,81–1,03 | |
SUSTAIN-6 | 93 | 1,384 | 6,7 | 118 | 1,352 | 8,7 | 0,77 | 0,59–1,01 | |
EXSCEL | 683 | 5,554 | 12,3 | 712 | 5,621 | 12,7 | 0,97 | 0,87–1,08 | |
Негроидная | All | 95 | 920 | 10,3 | 128 | 956 | 13,4 | 0,78 | 0,60–0,99 |
LEADER | 47 | 370 | 12,7 | 59 | 407 | 14,5 | 0,88 | 0,60–1,29 | |
SUSTAIN-6 | 5 | 108 | 4,6 | 7 | 113 | 6,2 | 0,75 | 0,24–2,35 | |
EXSCEL | 43 | 442 | 9,7 | 62 | 436 | 14,2 | 0,68 | 0,46–1,01 | |
Азиатская | All | 72 | 1,281 | 5,6 | 147 | 1,344 | 10,9 | 0,35 | 0,09–1,32 |
LEADER | 4 | 435 | 0,9 | 56 | 465 | 12,0 | 0,08 | 0,03–0,21 | |
SUSTAIN-6 | 8 | 121 | 6,6 | 17 | 152 | 11,2 | 0,59 | 0,26–1,37 | |
EXSCEL | 60 | 725 | 8,3 | 74 | 727 | 10,2 | 0,81 | 0,58–1,14 | |
Другая | All | 82 | 879 | 9,3 | 96 | 819 | 11,7 | 0,78 | 0,59–1,03 |
LEADER | 27 | 211 | 12,8 | 36 | 178 | 20,2 | 0,63 | 0,38–1,04 | |
SUSTAIN-6 | 2 | 35 | 5,7 | 4 | 32 | 12,5 | 0,46 | 0,08–2,50 | |
EXSCEL | 53 | 633 | 8,4 | 56 | 609 | 9,2 | 0,91 | 0,63–1,33 | |

Рисунок 2. Диаграмма отношения риска MACE в различных CVOT-исследованиях арГПП-1 в зависимости от расы.

Рисунок 3. Динамика HbA1c в подгруппах применения перорального семаглутида и дулаглутида в исследовании PIONEER-10.
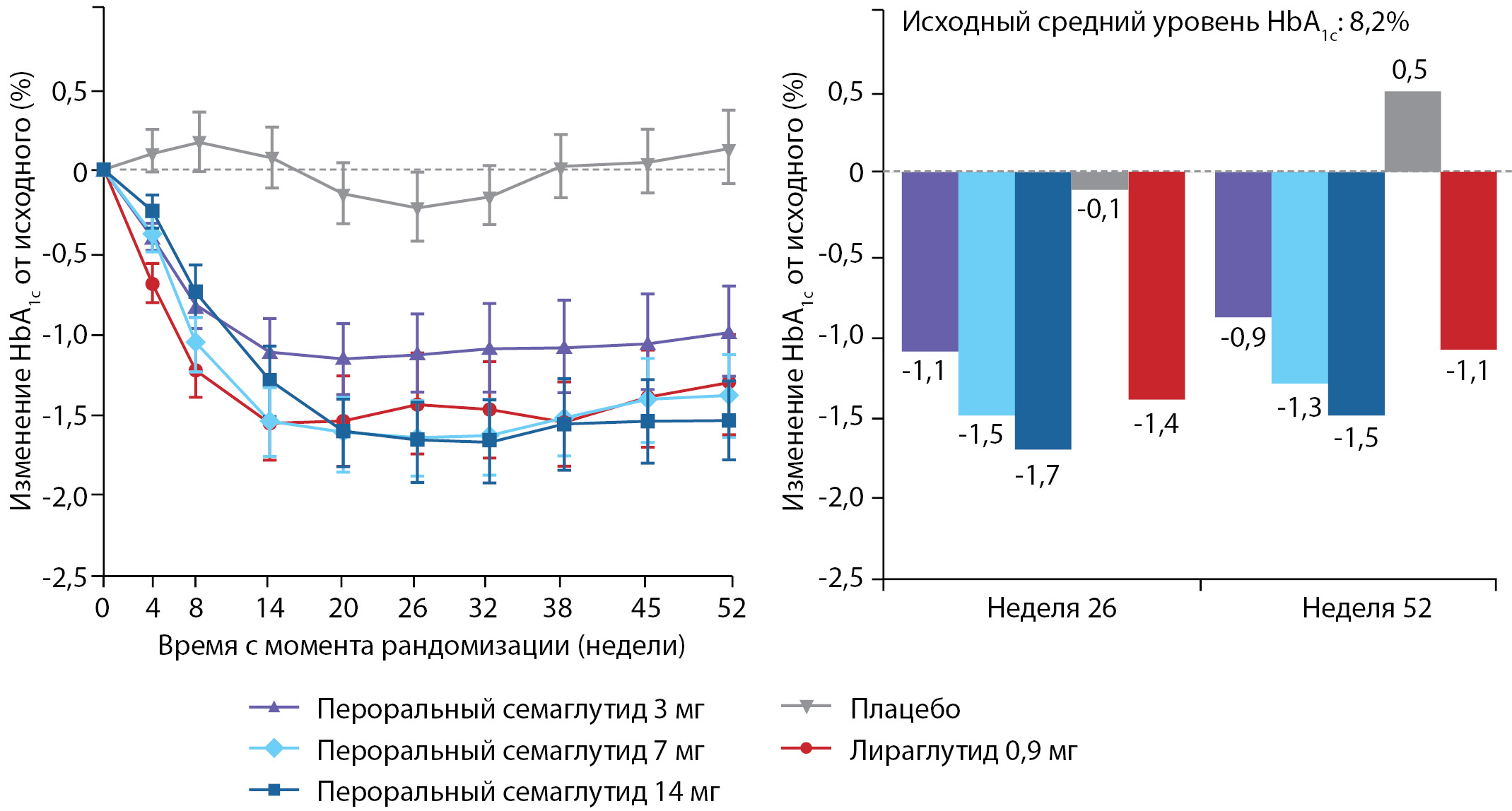
Рисунок 4. Динамика HbA1c в подгруппах применения монотерапии пероральным семаглутидом и лираглутидом в исследовании PIONEER-9.
ЗАКЛЮЧЕНИЕ
Анализ литературы свидетельствует, что имеются этнические различия в уровне интактного и стимулированного ГПП-1 в азиатской и неазиатской популяции. Вероятно, более низкий уровень ГПП-1 у азиатов может играть значимую роль в развитии и течении СД2, усугубляя дисфункцию β-клеток как ведущего патогенетического звена. Результаты крупных исследований эффективности арГПП-1, перорального семаглутида в частности, показывают достижение лучшего гликемического контроля в группах с преобладанием азиатов. Благоприятная тенденция сердечно-сосудистых исходов в отношении азиатской популяции, несомненно, должна быть подтверждена будущими специально спланированными исследованиями с учетом этнической принадлежности пациентов. Имеющиеся на сегодняшний день результаты исследований арГПП-1 длительного действия позволяют предположить, что эта группа препаратов может быть предпочтительным выбором для азиатских пациентов с СД2, особенно с установленными сердечно-сосудистыми заболеваниями в условиях реальной клинической практики.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Хамнуева Л.Ю. — главный (существенный) вклад в концепцию работы, получение, анализ данных, интерпретацию результатов; написание статьи; одобрение финальной версии рукописи; согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы; Андреева Л.С. — анализ данных, интерпретация результатов; внесение в рукопись существенной правки с целью повышения научной ценности статьи; одобрение финальной версии рукописи; согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. IDF Diabetes Atlas, 10th edition. Brussels: International Diabetes Federation; 2021 [cited 19/04/2023]. Available from: https://www.diabetesatlas.org/en
2. Yoon K-H, Lee J-H, Kim J-W, et al. Epidemic obesity and type 2 diabetes in Asia. Lancet. 2006;368(9548):1681-1688. doi: https://doi.org/10.1016/S0140-6736(06)69703-1
3. Fukushima M, Suzuki H, Seino Y. Insulin secretion capacity in the development from normal glucose tolerance to type 2 diabetes. Diabetes Res Clin Pract. 2004;66(S1):S37-43. doi: https://doi.org/10.1016/j.diabres.2003.11.024
4. Chan JC, Malik V, Jia W, et al. Diabetes in Asia: epidemiology, risk factors, and pathophysiology. JAMA. 2009;301(20):2129-2140. doi: https://doi.org/10.1001/jama.2009.726
5. Ma RC, Chan JC. Type 2 diabetes in East Asians: similarities and differences with populations in Europe and the United States. Ann N Y Acad Sci. 2013;1281(1):64-91. doi: https://doi.org/10.1111/nyas.12098
6. Fukushima M, Usami M, Ikeda M, et al. Insulin secretion and insulin sensitivity at different stages of glucose tolerance: a cross-sectional study of Japanese type 2 diabetes. Metabolism. 2004;53(7):831-835. doi: https://doi.org/10.1016/j.metabol.2004.02.012
7. Kadowaki T, Miyake Y, Hagura R, et al. Risk factors for worsening to diabetes in subjects with impaired glucose tolerance. Diabetologia. 1984;26(1):44-49. doi: https://doi.org/10.1007/BF00252262
8. Yabe D, Kuwata H, Iwasaki M, Seino Y. Why are incretin-based therapies more efficient in East Asians? Perspectives from the pathophysiology of type 2 diabetes and East Asian dietary habits. EMJ Diabetes. 2015;3(1):57-65. doi: https://doi.org/10.33590/emjdiabet/10312637
9. Yabe D, Seino Y, Fukushima M, et al. β cell dysfunction versus insulin resistance in the pathogenesis of type 2 diabetes in East Asians. Curr Diab Rep. 2015;15(6):602. doi: https://doi.org/10.1007/s11892-015-0602-9
10. Deacon CF, Nauck MA, Meier J, et al. Degradation of endogenous and exogenous gastric inhibitory polypeptide in healthy and in type 2 diabetic subjects as revealed using a new assay for the intact peptide. J Clin Endocrinol Metab. 2000;85(10):3575-3581. doi: https://doi.org/10.1210/jcem.85.10.6855
11. Vilsbøll T, Krarup T, Sonne J, et al. Incretin secretion in relation to meal size and body weight in healthy subjects and people with type 1 and type 2 diabetes mellitus. J Clin Endocrinol Metab. 2003;88(6):2706-2713. doi: https://doi.org/10.1210/jc.2002-021873
12. Zhang F, Tang X, Cao H, et al. Impaired secretion of total glucagon-like peptide-1 in people with impaired fasting glucose combined impaired glucose tolerance. Int J Med Sci. 2012;9(7):574-581. doi: https://doi.org/10.7150/ijms.4128
13. Yabe D, Kuroe A, Lee S, et al. Little enhancement of meal-induced glucagon-like peptide 1 secretion in Japanese: comparison of type 2 diabetes patients and healthy controls. J Diabetes Investig. 2010;1(1-2):56-59. doi: https://doi.org/10.1111/j.2040-1124.2010.00010.x
14. Carr RD, Larsen MO, Winzell MS, et al. Incretin and islet hormonal responses to fat and protein ingestion in healthy men. Am J Physiol Endocrinol Metab. 2008;295(4):E779-784. doi: https://doi.org/10.1152/ajpendo.90233.2008
15. Juntunen KS, Niskanen LK, Liukkonen KH, et al. Postprandial glucose, insulin, and incretin responses to grain products in healthy subjects. Am J Clin Nutr. 2002;75(2):254-262. doi: https://doi.org/10.1093/ajcn/75.2.254
16. Hu EA, Pan A, Malik V, Sun Q. White rice consumption and risk of type 2 diabetes: meta-analysis and systematic review. BMJ. 2012;344(3):e1454-e1454. doi: https://doi.org/10.1136/bmj.e1454
17. Nanri A, Mizoue T, Noda M, et al. Japan Public Health Center-based Prospective Study Group. Rice intake and type 2 diabetes in Japanese men and women: the Japan Public Health Center-based Prospective Study. Am J Clin Nutr. 2010;92(6):1468-1477. doi: https://doi.org/10.3945/ajcn.2010.29512
18. Villegas R, Liu S, Gao YT, et al. Prospective study of dietary carbohydrates, glycemic index, glycemic load, and incidence of type 2 diabetes mellitus in middle-aged Chinese women. Arch Intern Med. 2007;167(21):2310-2316. doi: https://doi.org/10.1001/archinte.167.21.2310
19. Henry CJ, Lightowler HJ, Newens K, et al. Glycaemic index of common foods tested in the UK and India. Br J Nutr. 2008;99(4):840-845. doi: https://doi.org/10.1017/S0007114507831801
20. Zhang F, Tang X, Cao H, et al. Impaired secretion of total glucagon-like peptide-1 in people with impaired fasting glucose combined impaired glucose tolerance. Int J Med Sci. 2012;9(7):574-581. doi: https://doi.org/10.7150/ijms.4128
21. Amori RE, Lau J, Pittas AG. Efficacy and safety of incretin therapy in type 2 diabetes: systematic review and meta‐analysis. JAMA. 2007;298(2):194-206. doi: https://doi.org/10.1001/jama.298.2.194
22. Kikuchi M, Abe N, Kato M, et al. Vildagliptin dose‐dependently improves glycemic control in Japanese patients with type 2 diabetes mellitus. Diabetes Res Clin Pract. 2009;83(2):233-240. doi: https://doi.org/10.1016/j.diabres.2008.10.006
23. Nonaka K, Kakikawa T, Sato A, et al. Efficacy and safety of sitagliptin monotherapy in Japanese patients with type 2 diabetes. Diabetes Res Clin Pract. 2008;79(2):291-298. doi: https://doi.org/10.1016/j.diabres.2007.08.021
24. Kim YG, Hahn S, Oh TJ, et al. Differences in the glucose-lowering efficacy of dipeptidyl peptidase-4 inhibitors between Asians and non-Asians: a systematic review and meta-analysis. Diabetologia. 2013;56(4):696-708. doi: https://doi.org/10.1007/s00125-012-2827-3
25. Kim YG, Hahn S, Oh TJ, et al. Differences in the HbA1c-lowering efficacy of glucagon-like peptide-1 analogues between Asians and non-Asians: a systematic review and meta-analysis. Diabetes Obes Metab. 2014;16(10):900-909. doi: https://doi.org/10.1111/dom.12293
26. Kang YM, Cho YK, Lee J, et al. Asian subpopulations may exhibit greater cardiovascular benefit from long-acting glucagon-like peptide 1 receptor agonists: a meta-analysis of cardiovascular outcome trials. Diabetes Metab J. 2019;43(4):410-421. doi: https://doi.org/10.4093/dmj.2018.0070
27. Álvarez-Villalobos NA, Treviño-Alvarez AM, González-González JG. Liraglutide and cardiovascular outcomes in type 2 diabetes. N Engl J Med. 2016;375(18):1797-1798. doi: https://doi.org/10.1056/NEJMc1611289
28. Marso SP, Bain SC, Consoli A, et al. SUSTAIN-6 Investigators. Semaglutide and cardiovascular outcomes in patients with type 2 diabetes. N Engl J Med. 2016;375(19):1834-1844. doi: https://doi.org/10.1056/NEJMoa1607141
29. Bethel MA, Patel RA, Merrill P, et al. EXSCEL Study Group. Cardiovascular outcomes with glucagon-like peptide-1 receptor agonists in patients with type 2 diabetes: a meta-analysis. Lancet Diabetes Endocrinol. 2018;6(2):105-113. doi: https://doi.org/10.1016/S2213-8587(17)30412-6
30. Lee MMY, Ghouri N, McGuire DK, et al. Meta-analyses of results from randomized outcome trials comparing cardiovascular effects of SGLT-2 is and GLP-1R as in Asian versus white patients with and without type 2 diabetes. Diabetes Care. 2021;44(5):1236-1241. doi: https://doi.org/10.2337/dc20-3007
31. Cho YM. Incretin physiology and pathophysiology from an Asian perspective. J Diabetes Investig. 2015;6(5):495-507. doi: https://doi.org/10.1111/jdi.12305
32. Lau J, Bloch P, Schäffer L, et al. Discovery of the Once-Weekly Glucagon-Like Peptide-1 (GLP-1) Analogue Semaglutide. J Med Chem. 2015;58(18):7370-7380. doi: 10.1021/acs.jmedchem.5b00726
33. Aroda VR, Ahmann A, Cariou B, et al. Comparative efficacy, safety, and cardiovascular outcomes with once-weekly subcutaneous semaglutide in the treatment of type 2 diabetes: Insights from the SUSTAIN 1-7 trials. Diabetes Metab. 2019;45(5):409-418. doi: https://doi.org/10.1016/j.diabet.2018.12.001
34. Ahrén B, Masmiquel L, Kumar H, et al. Efficacy and safety of once-weekly semaglutide versus once-daily sitagliptin as an add-on to metformin, thiazolidinediones, or both, in patients with type 2 diabetes (SUSTAIN 2): a 56-week, double-blind, phase 3a, randomised trial. Lancet Diabetes Endocrinol. 2017;5(5):341-354. doi: https://doi.org/10.1016/S2213-8587(17)30092-x
35. Li Y Ji L, Dong X, Li Y, et al. Efficacy and safety of once-weekly semaglutide versus once-daily sitagliptin as add-on to metformin in patients with type 2 diabetes in SUSTAIN China: A 30-week, double-blind, phase 3a, randomized trial. Diabetes Obes Metab. 2021;23(2):404-414. doi: https://doi.org/10.1111/dom.14232
36. Buckley ST, Bækdal TA, Vegge A, et al. Transcellular stomach absorption of a derivatized glucagon-like peptide-1 receptor agonist. Sci Transl Med. 2018;10(467):e1454-e1454. doi: https://doi.org/10.1126/scitranslmed.aar7047
37. Twarog C, Fattah S, Heade J, et al. Intestinal permeation enhancers for oral delivery of macromolecules: A Comparison between Salcaprozate Sodium (SNAC) and Sodium Caprate (C10). Pharmaceutics. 2019;11(2):78. doi: https://doi.org/10.3390/pharmaceutics11020078
38. Harashima SI, Nishimura A, Inagaki N. Attitudes of patients and physicians to insulin therapy in Japan: an analysis of the global attitude of patients and physicians in insulin therapy study. Expert Opin Pharmacother. 2017;18(1):5-11. doi: https://doi.org/10.1080/14656566.2016.1260547
39. Sikirica M, Martin A, Wood R, et al. Reasons for discontinuation of GLP1 receptor agonists: data from a real-world cross-sectional survey of physicians and their patients with type 2 diabetes. Diabetes, Metab Syndr Obes Targets Ther. 2017;(467):403-412. doi: https://doi.org/10.2147/DMSO.S141235
40. Igarashi A, Bekker Hansen B, Langer J, et al. Preference for oral and injectable GLP-1 RA therapy profiles in japanese patients with type 2 diabetes: a discrete choice experiment. Adv Ther. 2021;38(1):721-738. doi: https://doi.org/10.1007/s12325-020-01561-1
41. Ishii H, Hansen BB, Langer J, et al. Effect of orally administered semaglutide versus dulaglutide on diabetes-related quality of life in japanese patients with type 2 diabetes: the PIONEER 10 randomized, active-controlled trial. Diabetes Ther. 2021;12(2):613-623. doi: https://doi.org/10.1007/s13300-020-00985-w
42. Araki E, Terauchi Y, Watada H, et al. Efficacy and safety of oral semaglutide in Japanese patients with type 2 diabetes: A post hoc subgroup analysis of the PIONEER 1, 3, 4 and 8 trials. Diabetes Obes Metab. 2021;23(12):2785-2794. doi: https://doi.org/10.1111/dom.14536
43. Yabe D, Nakamura J, Kaneto H, et al. PIONEER 10 Investigators. Safety and efficacy of oral semaglutide versus dulaglutide in Japanese patients with type 2 diabetes (PIONEER 10): an open-label, randomised, active-controlled, phase 3a trial. Lancet Diabetes Endocrinol. 2020;8(5):392-406. doi: https://doi.org/10.1016/S2213-8587(20)30074-7
44. Yamada Y, Katagiri H, Hamamoto Y, et al. PIONEER 9 investigators. Dose-response, efficacy, and safety of oral semaglutide monotherapy in Japanese patients with type 2 diabetes (PIONEER 9): a 52-week, phase 2/3a, randomised, controlled trial. Lancet Diabetes Endocrinol. 2020;8(5):377-391. doi: https://doi.org/10.1016/S2213-8587(20)30075-9
45. Aroda VR, Rosenstock J, Terauchi Y, et al. PIONEER 1 Investigators. PIONEER 1: randomized clinical trial of the efficacy and safety of oral semaglutide monotherapy in comparison with placebo in patients with type 2 diabetes. Diabetes Care. 2019;42(9):1724-1732. doi: https://doi.org/10.2337/dc19-0749
Об авторах
Л. Ю. ХамнуеваРоссия
Хамнуева Лариса Юрьевна - доктор медицинских наук, профессор.
664003, Иркутск, ул. Красного Восстания, д. 1
ResearcherID: AAH-2681-2019
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Л. С. Андреева
Россия
Андреева Лариса Сергеевна - кандидат медицинских наук.
Иркутск
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Дополнительные файлы
|
|
1. Рисунок 1. Снижение уровня HbA1c на терапии иДПП-4 в исследованиях с >50% или <50% представленностью пациентов из Азии. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(165KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Диаграмма отношения риска MACE в различных CVOT исследованиях арГПП-1 в зависимости от расы. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(277KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Динамика HbA1c в подгруппах применения перорального семаглутида и дулаглутида в исследовании PIONEER 10. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(248KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Динамика HbA1c в подгруппах применения монотерапии пероральным семаглутидом и лираглутидом в исследовании PIONEER 9. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(169KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Хамнуева Л.Ю., Андреева Л.С. Эффективность лечения агонистами рецептора глюкагоноподобного пептида-1 азиатских пациентов с сахарным диабетом типа 2. Проблемы Эндокринологии. 2023;69(2):38-46. https://doi.org/10.14341/probl13245
For citation:
Khamnueva L.Yu., Andreeva L.S. Efficacy of treatment with glucagon-like peptide receptor agonists-1 in Asian patients with type 2 diabetes mellitus. Problems of Endocrinology. 2023;69(2):38-46. (In Russ.) https://doi.org/10.14341/probl13245

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).









































.jpg)


