Клиническая эндокринология
ЦЕЛЬ. Проанализировать диагностические возможности метода двустороннего селективного забора крови из нижних каменистых синусов (НКС) в различных модификациях в дифференциальной диагностике АКТГ-зависимого эндогенного гиперкортицизма, а также определить чувствительность и специфичность методов топической диагностики в визуализации АКТГ-продуцирующих нейроэндокринных опухолей (НЭО).
МАТЕРИАЛЫ И МЕТОДЫ. Проведено одноцентровое одномоментное диагностическое исследование с ретроспективным анализом данных. В исследование включены пациенты с АКТГ-зависимым эндогенным гиперкортицизмом без визуализации аденомы гипофиза на МРТ или с аденомами размерами менее 6 мм. Всем пациентам выполнен селективный забор крови из НКС с введением десмопрессина в качестве стимуляционного агента, оценкой градиента пролактина и расчетом АКТГ/пролактин-нормализованного отношения или без него. Топическая диагностика АКТГ-продуцирующей опухоли включала проведение МРТ гипофиза, мультиспиральной компьютерной томографии (МСКТ) внутренних органов с контрастным усилением и/или планарной сцинтиграфии и однофотонной эмиссионной компьютерной томографии, совмещенной с компьютерной томографией (ОФЭКТ/КТ) с 99mTc-тектротидом. Диагноз верифицировался по результатам иммуногистохимического исследования или достижения ремиссии болезни Иценко–Кушинга (БИК) после нейрохирургического лечения. Статистическая обработка данных осуществлялась при помощи пакета статистических программ IBM SPSS Statistics 23 (SPSS. Inc, Chicago, IL, USA). Доверительные интервалы рассчитывались с помощью онлайн-калькулятора JavaStat.
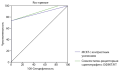
РЕЗУЛЬТАТЫ. Выполнено 230 селективных заборов у 228 пациентов (166 женщин, 62 мужчин), верифицировано 178 больных с БИК и 50 — с АКТГ-эктопированным синдромом. Результативность катетеризации НКС составила 96,9%. Чувствительность селективного забора крови из НКС без расчета АКТГ/пролактин-нормализованного отношения (n=70) составила 95,9% (95% ДИ 86,3–98,9), специфичность — 92% (95% ДИ 75,0–97,8), для метода селективного забора крови с дополнительным определением АКТГ/пролактин-нормализованного отношения (n=51) — 97,3% (95% ДИ 86,2–99,5) и 93,8% (95% ДИ 71,7–98,9) соответственно. Применение метода МРТ для данной выборки пациентов в верификации БИК имеет чувствительность 60,2% (95% ДИ 52,6–67,5) и специфичность 59,2% (95% ДИ 44,2–73,0). МСКТ имеет чувствительность 74% (95% ДИ 59,7–85,4), специфичность 100% (95% ДИ 97,95–100). Для сцинтиграфии с ОФЭКТ/КТ в визуализации АКТГ-продуцирующих НЭО чувствительность составила 73,3% (95% ДИ 44,9–92,2), специфичность — 100% (95% ДИ 95,3–100).
ЗАКЛЮЧЕНИЕ. Метод двустороннего селективного забора крови из НКС со стимуляцией десмопрессином и определением концентрации пролактина для контроля положения катетера, а также дополнительным расчетом АКТГ/ пролактин-нормализованного отношения является оптимальным методом дифференциальной диагностики АКТГ-зависимого эндогенного гиперкортицизма. Пациенты с верифицированным АКТГ-эктопированным синдромом по результатам селективного забора крови должны быть дополнительно направлены на сцинтиграфию с ОФЭКТ/КТ с 99mTc-тектротидом и МСКТ для установления локализации НЭО.
ОБОСНОВАНИЕ. Амиодарон-индуцированный тиреотоксикоз 2 типа остается серьезной проблемой эндокринологии и кардиологии. В связи с увеличением продолжительности жизни населения увеличивается распространенность нарушений ритма сердца, по поводу которых назначается амиодарон. Развитие тиреотоксикоза усугубляет имеющуюся у пациентов сердечно-сосудистую патологию: приводит к прогрессированию дисфункции левого желудочка, рецидивам нарушений ритма, увеличивая риск неблагоприятных исходов. Тактика дальнейшего ведения пациентов сложна: необходимо решить вопрос об отмене либо продолжении приема антиаритмика, необходимого пациенту с нарушением ритма сердца в анамнезе, а также грамотной терапии возникшей патологии щитовидной железы. Пероральные глюкокортикоиды являются препаратами первой линии для лечения пациентов с умеренным и тяжелым течением амиодарон-индуцированного тиреотоксикоза 2 типа. Несмотря на появление клинических рекомендаций, мнения по поводу тактики ведения пациентов разнятся как среди кардиологов, так и среди эндокринологов. Зачастую пациентам одновременно с глюкокортикоидами назначаются тиреостатические препараты, хотя это назначение не имеет патогенетических оснований.
ЦЕЛЬ. Оценить эффективность различных вариантов терапии у пациентов с амиодарон-индуцированным тиреотоксикозом 2 типа.
МАТЕРИАЛЫ И МЕТОДЫ. В ретроспективное исследование включены 38 пациентов (20 мужчин и 18 женщин в возрасте от 35 до 85 лет) с амиодарон-индуцированным тиреотоксикозом 2 типа. Всем пациентам проводились анализ анамнестических, антропометрических данных, комплексная лабораторно-инструментальная диагностика. По вариантам терапии ретроспективно сформированы 3 группы: без терапии (n=19), получавшие глюкокортикоиды (n=11) и комбинацию глюкокортикоидов и тиреостатиков (n=8). Срок наблюдения составил 6–18 мес, включая период лечения. Эффективность лечения в группах оценивалась по времени достижения эутиреоза на фоне терапии глюкокортикоидами и длительности тиреотоксикоза; проводился поиск потенциальных предикторов отсроченного ответа на терапию глюкокортикоидами и длительного течения тиреотоксикоза.
РЕЗУЛЬТАТЫ. Средний возраст составил 62,0 [52,9; 66,3] года. Достоверное снижение уровня свободного тироксина наблюдалось через 1 мес от начала терапии в обеих группах: с 38,1 [32,1; 58,4] до 23,4 [19,6; 29,3] пмоль/л (р<0,001) в группе, получавшей глюкокортикоиды; с 73,9 [42,2; 75,6] до 39,3 [22,4; 47,2] пмоль/л (р<0,001) в группе комбинированной терапии. Время достижения эутиреоза было большим в группе комбинированной терапии (р=0,047), не зависело от дозы (р=0,338) и длительности приема тиамазола (р=0,911), отсроченность ответа на терапию коррелировала с возрастом (ρ=-0,857; p=0,007) и временным интервалом от возникновения клинической симптоматики тиреотоксикоза до назначения глюкокортикоидов (ρ=0,881; p<0,001).
ЗАКЛЮЧЕНИЕ. Полученные результаты демонстрируют зависимость терапевтического ответа на глюкокортикоиды от возраста пациента и времени их назначения относительно длительности тиреотоксикоза, нецелесообразность дополнительного применения тиреостатических препаратов при амиодарон-индуцированном тиреотоксикозе 2 типа.
Возрастные изменения оказывают большое влияние на регуляцию водно-электролитного гомеостаза в организме, который управляется сложным взаимодействием факторов окружающей среды, питьевым поведением, секрецией ряда гормонов и гормоноподобных веществ, а также иннервацией и функциональным состоянием почек. Хорошо известно, что изменения, которые являются частью физиологического старения, лежат в основе нарушений водно-электролитного баланса, что усугубляется наличием возраст-ассоциированных заболеваний, приемом лекарственных препаратов или рядом внешних факторов, таких как неполноценное питание, потребление жидкости, наличие деменции. В данном обзоре рассмотрены данные литературы по влиянию нормального старения на развитие патологии водно-натриевого баланса, включая дегидратацию пациентов старческого возраста, гипонатриемию, гипернатриемию, изменения секреции антидиуретического гормона и активности элементов ренин-ангиотензин-альдостероновой системы.
Патологические изменения в работе почек приводят к нарушению поддержания гомеостаза внутренней среды организма. По мере снижения скорости клубочковой фильтрации и нарастания уремии уменьшается метаболизм, изменяются процессы транспортировки и связывания с клетками-мишенями многочисленных биологически активных веществ, в том числе гормонов гипофиза. В статье представлен обзор нарушений функции гипофиза у пациентов с терминальной стадией хронической болезни почек (тХБП) и обсуждены патогенетические механизмы их формирования. Особое внимание уделено оценке изменений концентрации гормонов гипофиза у пациентов, получающих заместительную почечную терапию (ЗПТ). Так, тХБП приводит к повышению уровня пролактина, лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ). Концентрации соматотропного гормона (СТГ), инсулиноподобного фактора роста-1 (ИФР-1), тиреотропного гормона (ТТГ), адренокортикотропного гормона (АКТГ) и вазопрессина могут оставаться в пределах нормальных значений или повышаться в данной группе больных. Проведение ЗПТ не снижает уровни пролактина, ЛГ, ФСГ, в то же время концентрации СТГ, ИФР-1, ТТГ имеют тенденцию к нормализации. Содержание АКТГ и вазопрессина может оставаться без изменений или уменьшаться. Трансплантация почки в большинстве случаев корректирует описанные нарушения. В целом устранение гормональных изменений способно улучшить клинический исход и качество жизни пациентов, страдающих тХБП.
Болезнь Иценко–Кушинга — это редкое тяжелое нейроэндокринное заболевание, обусловленное хронической гиперпродукцией адренокортикотропного гормона опухолью гипофиза. Высокие концентрации уровня кортизола в крови при эндогенном гиперкортицизме оказывают иммуносупрессивное и противовоспалительное действие, так же как и терапия системными глюкокортикостероидами. Это может способствовать снижению активности имеющихся у пациента сопутствующих аутоиммунных воспалительных заболеваний. С другой стороны, снижение уровня кортизола на фоне лечения болезни Иценко–Кушинга может быть ассоциировано с реактивацией иммунной системы, что увеличивает риск рецидива или дебюта различных аутоиммунных заболеваний. Мы приводим собственный клинический случай, демонстрирующий сложности диагностики эндогенного гиперкортицизма у пациентки молодого возраста и последующее развитие саркоидоза, возникшего после успешного оперативного лечения болезни Иценко–Кушинга.
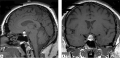
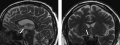
За последние годы наблюдается значительный рост распространенности аутоиммунных эндокринопатий, которые, как известно, поражают различные органы эндокринной системы, включая гипофиз. Гипофизит — это общий термин, используемый для описания любой формы селлярного и супраселлярного воспаления, которое приводит к структурным изменениям в гипоталамо-гипофизарной области и проявляется различной степенью гипопитуитаризма. На сегодняшний день выделяют первичный — возникает вследствие аутоиммунного поражения непосредственно гипофиза и вторичный — вследствие наличия системного аутоиммунного заболевания — гипофизит. Независимо от этиологии у пациентов с гипофизитом возникают различные признаки и симптомы, вызванные воспалительным процессом в области гипофиза. МРТ в настоящее время является лучшим неинвазивным инструментальным методом для диагностики гипопитуитаризма, однако подтвердить диагноз можно только по данным гистологического исследования ткани гипофиза, что требует оперативного вмешательства, которое не всегда целесообразно. В представляемой статье нами описан пациент с МРТ-признаками гипофизита при отсутствии характерной клинической симптоматики.
Основной метод лечения пролактин-секретирующих аденом гипофиза — терапия агонистами дофамина, в большинстве случаев позволяющая нормализовать уровень пролактина и уменьшить размеры аденомы. Однако значительная часть пациентов — около 20% неудовлетворительно реагируют даже на высокие дозы агонистов дофамина, что обусловлено резистентностью к терапии. Одной из причин развития резистентности к стандартному лечению является наличие ряда фармакодинамических характеристик. Клинические проявления персистирующей гиперпролактинемии обусловлены двумя патологическими факторами: гормональной гиперпродукцией и масс-эффектом аденомы гипофиза.
Предотвращение необратимых изменений возможно только при своевременном выявлении резистентности и определении оптимального персонализированного алгоритма лечения. Нами описан клинический случай опухолевой гиперпролактинемии, резистентной к терапии агонистами дофамина. Назначение комбинированного лечения тамоксифеном и агонистами дофамина позволило достичь улучшения состояния здоровья пациентки, нормопролактинемии и уменьшения размеров аденомы гипофиза. Гиперпролактинемия, обусловленная пролактин-секретирующей аденомой гипофиза, и ассоциированные с ней патологические проявления представляют собой значимую проблему, неблагоприятно влияющую на качество жизни отдельного пациента и демографическую ситуацию в целом. Это подчеркивает важность изучения причин и выявления предикторов резистентности. Результаты проводимого исследования, иллюстрированные клиническим примером, представлены в настоящей работе.
ОБОСНОВАНИЕ. Синдром множественных эндокринных неоплазий 1 типа (МЭН-1) — редкое аутосомно-доминантное заболевание, обусловленное мутациями в гене MEN1, кодирующем белок менин. Этот синдром характеризуется возникновением опухолей околощитовидных желез, гастроэнтеропанкреатических нейроэндокринных опухолей, аденом гипофиза, а также других эндокринных и неэндокринных опухолей. Если пациент с МЭН-1 фенотипом не имеет мутаций в гене MEN1, то такое состояние рассматривается как фенокопия синдрома (фМЭН-1). Возможной причиной этих изменений могут быть изменения в эпигенетической регуляции, в частности в экспрессии микроРНК, которые могут влиять на сигнальные пути менина.
ЦЕЛЬ. Определить циркулирующие микроРНК, различно экспрессирующиеся в плазме крови у пациентов с генетически подтвержденным синдромом МЭН-1, его фенокопиями и контролем.
МАТЕРИАЛЫ И МЕТОДЫ. Выполнено одноцентровое исследование типа «случай-контроль». Проведена оценка экспрессии микроРНК в плазме крови пациентов с генетически подтвержденным синдромом МЭН-1 (гМЭН-1), фМЭН-1 и относительно здорового контроля. Забор крови проводился натощак, образцы цельной крови однократно центрифугировались и хранились при температуре -80°С. Выделение тотальной РНК проводили с помощью набора miRNeasy Mini Kit с QIAcube. Библиотеки готовили с помощью набора QIAseq miRNA Library Kit в соответствии с инструкцией производителя. Секвенирование циркулирующих микроРНК проводили на Illumina NextSeq 500 (Illumina). Последующую обработку данных проводили с помощью биоинформационного алгоритма DESeq2.
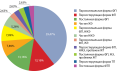
РЕЗУЛЬТАТЫ. Всего в исследование были включены в группу гМЭН-1 — 21 пациент, в группу фМЭН-1 — 11 пациентов, в группу контроля — 12 относительно здоровых добровольцев. Медиана возраста в группе гМЭН-1 составила 38,0 лет [34,0; 41,0]; в группе фМЭН-1 — 59,0 [51,0; 60,0]; в группе контроля — 59,5 [51,5; 62,5]. Все группы не отличались по полу (р=0,739) и индексу массы тела (р=0,116). Группа гМЭН-1 отличалась по возрасту от пациентов фМЭН-1 и контрольной группы (p<0,001). В результате высокопроизводительного секвенирования было получено 25 различно экспрессирующихся микроРНК в группах гМЭН-1 и фМЭН-1 (21 микроРНК с повышенной экспрессией, 4 — с пониженной). При сравнении образцов от групп фМЭН-1 и относительно здорового контроля выявлено 10 различно экспрессирующихся микроРНК: 5 — с повышенной экспрессией в группе фМЭН-1 по сравнению с контрольной группой, 5 — с пониженной. В группах гМЭН-1 и контроля обнаружено 26 различно экспрессирующихся микроРНК: 24 с повышенной экспрессией в группе гМЭН-1 по сравнению с контролем, 2 — с пониженной. Для дальнейшей валидации результатов методом RT-qPCR были отобраны наиболее отличающиеся по экспрессии микроРНК среди групп (в группах гМЭН-1 и фМЭН-1 — miR-3613-5p, miR-335-5p, miR-32-5p, miR-425-3p, miR-25-5p, miR-576-5p, miR-215-5p, miR-30a-3p, miR-141-3p, miR-760, miR-501-3p; в группах гМЭН-1 и контроля — miR-1976, miR-144-5p miR-532-3p, miR-375; а также в группах фМЭН-1 и контроля — miR-944, miR-191-5p, miR-98-5p).
ЗАКЛЮЧЕНИЕ. В ходе пилотного исследования методом высокопроизводительного секвенирования обнаружены микроРНК, экспрессия которых может отличаться у пациентов с гМЭН-1, фМЭН-1 и контролем. Полученные результаты нуждаются в валидации при помощи другого метода оценки экспрессии микроРНК на большей выборке пациентов.
Нарушения углеводного обмена
В 2021 г. исполнилось 100 лет со дня открытия инсулина — события, навсегда изменившего жизнь людей с сахарным диабетом. Сегодня пациенты во всем мире ежедневно сталкиваются с чудом инсулинотерапии. Болезнь, от которой в 1920 г. дети и подростки умирали в течение 2 лет, превратилась в болезнь, которую можно контролировать и прожить с ней долгую продуктивную жизнь. За прошедший век великое открытие Бантинга, Беста и Коллипа навсегда изменило мир и спасло миллионы жизней. Данный обзор посвящен истории создания инсулина и его дальнейшего усовершенствования: от момента открытия до наших дней. Рассматриваются различные поколения инсулина: от животных до современных ультракоротких и базальных аналогов. Завершается статья кратким обзором современных направлений развития новых способов доставки и разработки новых молекул инсулина. За последнее столетие инсулинотерапия шагнула далеко вперед, что существенно улучшило качество жизни наших пациентов. Но исследования активно продолжаются, в том числе в области альтернативных способов доставки инсулина, которые являются более удобными для пациента, а также в области разработок «умных» молекул, которые будут обладать глюкозозависимым действием.
Детская эндокринология
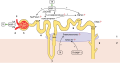
Врожденная дисфункция коры надпочечников (ВДКН) — группа аутосомно-рецессивных заболеваний, требующих пожизненной заместительной терапии глюкокортикоидами (ГК). Недостаточность терапии ГК приводит к преждевременному половому развитию у мальчиков, гетеросексуальному развитию у девочек, ускоренному костному созреванию и низкому конечному росту. В подростковом возрасте недостаточность терапии ГК является причиной нарушения становления менструального цикла у девочек и развития опухолевых образований яичек у мальчиков, в конечном счете — снижения репродуктивного потенциала у лиц обоих полов. С другой стороны, передозировка ГК приводит к медикаментозному синдрому Иценко–Кушинга. С целью подбора адекватных доз ГК в детском и подростковом возрасте необходимы многократные определения концентраций 17-гидроксипрогестерона, андростендиона и тестостерона плазмы крови, а следовательно — многократные заборы венозной крови. Процедура забора крови зачастую вызывает «стрессорную реакцию» у маленьких пациентов, влияя на полученные гормональные результаты, требует специально обученного медицинского персонала. В связи с этим разработка и внедрение неинвазивного метода определения стероидного профиля чрезвычайно важны при мониторинге терапии ГК у детей. Помимо этого, используемый в настоящее время иммунофлюоресцентный анализ не позволяет исследовать другие надпочечниковые стероиды, обладает высокой погрешностью за счет «перекрестной реакции» близких по строению стероидов, что завышает полученные результаты. В отличие от иммуноферментного анализа, метод жидкостной хроматографии и тандемной масс-спектрометрии более предпочтителен, так как обладает большей специфичностью и точностью. Представленный в литературном обзоре неинвазивный метод определения стероидного профиля в слюне, предлагаемой в качестве альтернативного субстрата, способен нивелировать вышеназванные недостатки, упростить и сделать более точным подбор терапии ГК у пациентов с ВДКН, что особенно важно в детском возрасте.
Множественная эндокринная неоплазия 2B типа (МЭН 2B) является редким вариантом наследственных опухолевых синдромов, обусловленным герминальными мутациями в гене протоонкогена RET. Одним из компонентов синдрома являются множественные невриномы, раннему выявлению которых не всегда уделяется должное внимание. Нами представлено описание случая МЭН 2B, манифестировавшего в первые месяцы жизни проявлениями ганглионейроматоза кишечника. Заболевание дебютировало хроническими запорами, в том числе с эпизодами кишечной непроходимости, потребовавшими повторных хирургических вмешательств. МЭН 2B был заподозрен в возрасте 15 лет. На момент диагностики отмечалось повышение уровня кальцитонина в сыворотке (1041 пг/мл, норма <9,5 пг/мл), а также определялся узел в щитовидной железе (1,3×1,0×1,2 см, TIRADS 5), в последующем верифицированный как новообразование из C-клеток. При ДНК-диагностике в гене RET выявлен типичный для МЭН 2B патогенный вариант p.Met918Thr. Данных за феохромоцитому на момент обследовании не получено. Пациенту проведена тиреоидэктомия с лимфаденэктомией. Обсуждаются трудности ранней диагностики спорадических случаев МЭН 2В в связи с неспецифичностью гастроинтестинальных проявлений заболевания.
Репродуктивная эндокринология
ОБОСНОВАНИЕ. В 2025 г. исполняется 100 лет со времени публикации первого в мире описания необычного симптомокомплекса, по современным данным, обусловленного геномными аномалиями и дисгенезией гонад с исходом в гипергонадотропный гипогонадизм, — синдрома Тернера. Тотальный эстрогенный дефицит запускает у пациенток комбинацию сочетанной патологии, что, в свою очередь, указывает на необходимость персонализированной оценки маркеров репликативного клеточного старения у данной категории пациенток.
ЦЕЛЬ. Изучить особенности маркеров репликативного клеточного старения (длина теломер лейкоцитов) и биохимических показателей (липидный профиль, кальциево-фосфорный обмен, функциональная активность щитовидной железы, маркеры цитолиза и холестаза, углеводный обмен, азотистый обмен, электролиты, фолликулостимулирующий гормон (ФСГ)) у женщин с синдромом Тернера.
МАТЕРИАЛЫ И МЕТОДЫ. Исследование проведено на базе ФГБУ «НМИЦ эндокринологии» Минздрава России совместно с МНОЦ «МГУ им. М.В. Ломоносова» в период с 10.01.2021 г. по 01.08.2022 г. В одномоментном сравнительном исследовании приняли участие 26 женщин (13–40 лет) с неятрогенным гипергонадотропным гипогонадизмом в исходе синдрома Тернера (45,X0; 45,X/46,XX; 45,X/46,X,r(X)), 26 женщин с преждевременной недостаточностью яичников (ПНЯ) (18–39 лет) и 24 здоровые женщины репродуктивного возраста (15–49 лет). Пациенткам проведен лабораторный генетический (длина теломер лейкоцитов), биохимический анализы крови (гликемия венозной плазмы натощак, мочевина, креатинин, общий/прямой билирубин, аланинаминотрансфераза, аспартатаминотрансфераза, гамма-глутамилтранспептидаза, триглицериды, общий холестерин (ХС), ХС липопротеидов высокой и низкой плотности, общий/ионизированный кальций, фосфор, витамин D, натрий/калий/хлориды, ФСГ, гликированный гемоглобин). Экстракция ДНК — набором Qiagen DNA blood mini kit (Германия). Антропометрическое исследование — длина тела, масса тела. Оценка длины теломер лейкоцитов — методом полимеразной цепной реакции в реальном времени (алгоритм Flowfish). Программа IBM SPSS Statistics (version 26,0 for Windows).
РЕЗУЛЬТАТЫ. 1. Женщины с синдромом Тернера имеют достоверно более низкую среднюю длину теломер (8,22 кБ [6,63–9,30]), чем пациентки с ПНЯ (10,34 кБ [8,41–13,08]), p<0,001, и здоровые пациентки репродуктивного возраста (10,77 кБ [9,95–13,16], р>0,05).
- Длина теломер прямо и статистически достоверно коррелирует с длительностью приема менопаузальной гормональной терапии у женщин с ПНЯ (ρ=505; p<0,001).
- Пациентки с синдромом Тернера имеют более выраженную склонность к дефициту нативной формы витамина D (р<0,001), дислипидемии (р=0,01); повышению лабораторных показателей холестаза, цитолиза, уровней фосфора и ФСГ (р<0,001).
ЗАКЛЮЧЕНИЕ. Синдром Тернера является серьезным генетическим заболеванием, приводящим не только к первичному бесплодию, но и снижению качества/продолжительности жизни.
В статье представлены данные о взаимосвязи патогенетических механизмов развития нарушений менструального цикла функционального и органического происхождения с психическими расстройствами с точки зрения психосоматической концепции. Согласно последней, функциональные нарушения менструального цикла рассматриваются как психосоматические, при которых гинекологическая патология развивается вследствие психопатологических расстройств. Ярким примером такого заболевания является функциональная гипоталамическая аменорея. При этом эндокринопатии, такие как синдром поликистозных яичников и преждевременная недостаточность яичников, также можно рассматривать в парадигме психосоматических нарушений овариальной функции, обусловленных высокой распространенностью тревожных и депрессивных расстройств в этой когорте больных. В данном обзоре подчеркивается важность междисциплинарного сотрудничества гинеколога и психиатра для максимально эффективной репродуктивной реабилитации пациенток с аменореей. Поиск литературы проводили в отечественных (eLibrary, CyberLeninka.ru) и международных (PubMed, Cochrane Library) базах данных на русском и английском языках. Приоритетным являлся свободный доступ к полному тексту статей. Выбор источников был приоритетен периодом с 2018 по 2023 гг. Однако с учетом недостаточной изученности выбранной темы выбор источников датировался с 1985 г.

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).
ISSN 2308-1430 (Online)









































.jpg)


