Редакционная статья
ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России гордится не только своими достижениями в области персонализированного подхода к обследованию и лечению пациентов в соответствии с принципами доказательной медицины, использованием современных технологий диагностики и лечения, но и богатейшей историей подготовки научных и лечебных кадров. Центр на протяжении многих лет привлекает лучших и наиболее талантливых выпускников высших медицинских учреждений, становясь alma mater для молодых врачей — эндокринологов, детских эндокринологов и диетологов. Специалисты, выпускники НМИЦ эндокринологии, вносят значительный вклад в развитие медицины, проводя исследования, создавая инновационные методы лечения и помогая пациентам не только в нашей стране, но и за ее пределами. Однако ГНЦ РФ ФГБУ «НМИЦ эндокринологии» знаменит не только своим качественным и всесторонним обучением, но и опытным, преданным своему делу преподавательским составом, дающим обучающимся уникальные возможности для профессионального роста. Целью данной статьи является отражение наиболее важных вех в развитии образования в НМИЦ эндокринологии, которое начало свое становление более века назад, в тяжелейший для нашей страны переходный период.
Клиническая эндокринология
ОБОСНОВАНИЕ. Амиодарон занимает ведущую позицию в аритмологической практике в профилактике и купировании различных нарушений ритма сердца. Амиодарон — индуцированный тиреотоксикоз 2 типа — нередкое осложнение терапии препаратом, наиболее сложный вид дисфункции щитовидной железы как по тяжести клинических проявлений, так и с точки зрения понимания механизмов патогенеза, возможности дифференциальной диагностики и обеспечения эффективного лечения. В связи с увеличивающейся продолжительностью жизни населения, соответствующим ростом частоты нарушений ритма сердца проблема не теряет актуальности. Выявление предикторов, оценка и прогнозирование индивидуального риска развития данной патологии щитовидной железы — необходимость в повседневной клинической практике для принятия взвешенного решения при назначении антиаритмика, определении алгоритма дальнейшего динамического наблюдения пациента.
ЦЕЛЬ. Оценить структуру амиодарон-индуцированной дисфункции щитовидной железы, распространенность, сроки и предикторы развития амиодарон-индуцированного тиреотоксикоза 2 типа в проспективном когортном исследовании.
МАТЕРИАЛЫ И МЕТОДЫ. В исследовании приняли участие 124 пациента без нарушения функции щитовидной железы, впервые получившие терапию амиодароном. Оценка функционального состояния щитовидной железы производилась исходно, после назначения препарата первые 3 месяца 1 раз в месяц, в дальнейшем — каждые 3 месяца. Период наблюдения в среднем составил от 12 до 24 месяцев. Завершение наблюдения происходило при развитии амиодарон-индуцированной дисфункции щитовидной железы или отказе пациента от дальнейшего участия в исследовании. Для дифференциальной диагностики типа амиодарон-индуцированного тиреотоксикоза проводилось определение уровня антител к рецептору тиреотропного гормона, ультразвуковое исследование с доплерографией и сцинтиграфия щитовидной железы с пертехнетатом технеция. Оценивались вид и частота дисфункции щитовидной железы, время возникновения и предикторы амиодарон-индуцированного тиреотоксикоза 2 типа.
РЕЗУЛЬТАТЫ. Структура амиодарон-индуцированной дисфункции щитовидной железы была представлена: в 19,3% (n=24) гипотиреозом, в 1,6% (n=2) тиреотоксикозом 1 типа, в 23,4% (n=29) тиреотоксикозом 2 типа. Медиана времени его развития составила 92,0 [69,0; 116,0] недель; средний срок бессобытийной выживаемости — 150,2±12,6 недель (95% ДИ: 125,5–175,0), медиана — 144±21,7 недель (95% ДИ: 101,4–186,6). Основными предикторами амиодарон-индуцированного тиреотоксикоза 2 типа являлись: возраст (ОШ=0,931, 95% ДИ: 0,895–0,968, р<0,001), ИМТ (ОШ=0,859, 95% ДИ: 0,762–0,967, р=0,012), время от начала терапии (ОШ=1,023, 95% ДИ: 1,008–1,038, р=0,003). Возраст ≤60 лет сопряжен с увеличением риска возникновения дисфункции в 2,4 раза (ОШ=2,352, 95% ДИ: 1,053–5,253, р=0,037), ИМТ≤26,6 кг/м2 — в 2,3 раза (ОШ=2,301, 95% ДИ: 1,025–5,165, р=0,043).
ЗАКЛЮЧЕНИЕ. Полученные результаты позволяют персонализировано оценить риск развития амиодарон-индуцированного тиреотоксикоза 2 типа и определить адекватную тактику ведения пациента.
За последние годы проводится большое количество исследований по изучению молекулярно-генетических аномалий в АКТГ-секретирующих опухолях гипофиза. В данном обзоре представлен комплексный анализ результатов исследований полного экзома (герминальные и соматические мутации, хромосомные аномалии в кортикотропиномах, развившихся в составе наследственных синдромов МЭН 1, 2, 4, DICER1, комплекс Карни и пр., и изолированных опухолях соответственно) и транскриптома (специфичные профили экспрессии генов гормонально активных и неактивных кортикотропином, регуляция клеточных циклов и сигнальных путей). Современные технологии (секвенирование следующего поколения — NGS) позволяют изучить состояние микроРНКома, ДНК метилома. Таким образом, показан широкий спектр фундаментальных исследований, результаты которых позволяют определить и осмыслить ключевые, ранее известные и новые механизмы патогенеза и биомаркеры кортикотропином. Дана характеристика наиболее перспективным молекулярно-генетическим факторам, которые возможно использовать в клинической практике для скрининга и более ранней диагностики наследственных синдромов и изолированных кортикотропином, дифференциальной диагностики различных форм эндогенного гиперкортицизма, чувствительности к уже существующим и потенциальным видам терапии и персонализированного определения исхода болезни Иценко-Кушинга.
Поступательное совершенствование классификации с использованием современных аналитических методов является важнейшим инструментом для развития прецизионного и персонализированного подходов к лечению аденом гипофиза. В последние годы эндокринологи стали свидетелями эволюционных изменений, произошедших в гистопатологической идентификации новообразований гипофиза, открывающих новые возможности для изучения туморогенеза и прогнозирования биологического поведения.
В работе рассмотрены исторические аспекты поэтапного совершенствования классификации аденом гипофиза, а также новая международная классификация ВОЗ (2022 г.), согласно которой аденомы гипофиза включены в список нейроэндокринных образований (ГипНЭО), чтобы отразить биологическую агрессивность некоторых неметастатических гипофизарных аденом. Представлены клинические характеристики аденом гипофиза, а также перечень гистологических подтипов агрессивных нейроэндокринных опухолей гипофиза, отличающихся высоким потенциалом инвазивного роста, повышенным риском рецидивирования и негативным клиническим прогнозом.
Обсуждается целесообразность смены дефиниции «аденома гипофиза» на «нейроэндокринную опухоль гипофиза». Подчеркивается, что внедрение в отечественную клиническую практику унифицированного клинико-лабораторного и морфологического протокола поможет обеспечить сопоставимые сравнительные наблюдения по прогнозу заболевания и эффективности вторичной терапии, а также способствовать адекватной курации потенциально агрессивных ГипНЭО.
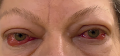
По современным представлениям, эндокринная офтальмопатия (ЭОП) — самостоятельное прогрессирующее аутоиммунное заболевание органа зрения, тесно связанное с аутоиммунной патологией щитовидной железы (ЩЖ), (код МКБ – H06.2, экзофтальм при нарушениях функции щитовидной железы Е05.0). Лечение ЭОП представляет собой длительный поэтапный процесс, включающий иммуносупрессивную терапию, лучевую терапию орбит, хирургическое лечение.
ЭОП — мультидисциплинарная проблема. Пациент с клиникой тиреотоксикоза и симптомами ЭОП будет госпитализирован в эндокринологическую клинику для нормализации тиреоидных гормонов и лечения осложнений тиреотоксикоза, где одновременно под наблюдением офтальмолога будет проводиться диагностика и лечение ЭОП. Командная работа очень важна, т.к. эффективность лечения ЭОП будет зависеть от быстроты достижения стойкого эутиреоидного состояния, точности определения активности и тяжести ЭОП, наличия осложнений, требующих оперативного лечения.
В развитии ЭОП выделяют две основные фазы. В первой фазе активного воспаления происходит нарастание симптомов ЭОП, затем следует фаза плато, когда симптомы активности сохраняются, но не прогрессируют, затем симптомы регрессируют, и процесс становится неактивным, при этом могут сохраняться зрительные нарушения и косметические дефекты. Определение активности ЭОП очень важно с клинической точки зрения, т.к. от активности процесса зависит выбор лечения и тактика ведения пациента.
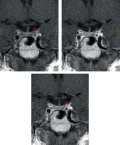
Описан клинический случай этапного лечения ЭОП, осложненной оптической нейропатией и глазодвигательными нарушениями, резистентной к иммуносупрессивной терапии глюкокортикоидами и потребовавшей глубокой латеральной декомпрессии орбит, у пациентки с болезнью Грейвса.
Эндогенный гиперкортицизм (ЭГ) — это тяжелый симптомокомплекс, вызываемый избытком глюкокортикоидов в организме. В соответствии с этиологией выделяют АКТГ-зависимый и АКТГ-независимый варианты, которые, согласно литературе, встречаются в 70–80% и 20–30% случаев соответственно. Редкой причиной АКТГ-зависимого эндогенного гиперкортицизма является АКТГ-эктопированный синдром (АКТГ-ЭС) (около 15–20% случаев). АКТГ-ЭС — синдром гиперпродукции адренокортикотропного гормона (АКТГ) нейроэндокринными опухолями внегипофизарного происхождения. АКТГ могут секретировать различные опухоли: бронхолегочный карциноид, мелкоклеточный рак легкого, реже — карциноид тимуса, островковоклеточные опухоли и карциноид поджелудочной железы, медуллярный рак щитовидной железы, карциноидные опухоли кишечника, яичников, а также феохромоцитома (ФХЦ).
В данной публикации представлен клинический случай редко выявляемой паранеопластической продукции АКТГ феохромоцитомой. Пациентка имела клинические проявления гиперкортицизма, в связи с чем обратилась в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России. В ходе обследования подтвержден синдром Кушинга (СК), при мультиспиральной компьютерной томографии (МСКТ) брюшной полости выявлено объемное образование левого надпочечника. Дополнительное обследование зафиксировало многократное повышение уровня метилированных производных катехоламинов в моче. Впоследствии больной была проведена левосторонняя адреналэктомия. Диагноз «Феохромоцитома» подтвержден морфологически, иммуногистохимическое исследование продемонстрировало интенсивную экспрессию хромогранина А и АКТГ-клетками опухоли.
Болезни костной и жировой ткани
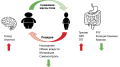
Ключевая проблема при лечении пациентов с ожирением — отсутствие долгосрочного результата, достигнутого при снижении массы тела. С одной стороны, это объясняется низкой комплаентностью пациентов и отсутствием самоконтроля в питании и физической активности, с другой — многочисленными физиологическими механизмами, не поддающимися осознанному контролю. Текущие исследования показывают, что попытки снижения массы тела стимулируют активацию адаптационных биологических механизмов, препятствующих дальнейшему ее снижению.
Несмотря на существующее множество методов лечения, лишь небольшое число пациентов способны достичь значимого (хотя бы 5–7%) снижения массы тела и поддерживать результат в дальнейшем. В большинстве случаев наблюдается возврат к исходным параметрам в среднем за 3–5 лет. Изучение механизмов, способствующих обратному набору массы тела, требует детального изучения для определения новых эффективных стратегий лечения ожирения.
В обзоре литературы представлены результаты современных исследований взаимосвязи центральных, периферических и поведенческих патогенетических механизмов, приводящих к рецидиву ожирения, а также предложения по будущим стратегиям их решения.
Детская эндокринология
ОБОСНОВАНИЕ. Первичный гиперпаратиреоз (ПГПТ) — эндокринное заболевание, характеризующееся избыточной секрецией паратиреоидного гормона (ПТГ) при верхне-нормальном или повышенном уровне кальция крови вследствие первичной патологии околощитовидных желез (ОЩЖ). ПГПТ является редкой патологией для детей, распространенность составляет 2–5:100 000 детского населения. В связи с неспецифичностью клинических проявлений в дебюте (тошнота, рвота, боли в животе, эмоциональная лабильность) заболевание может длительное время оставаться не диагностированным.
ЦЕЛЬ. Изучить особенности течения и молекулярно-генетическую основу первичного гиперпаратиреоза у детей.
МАТЕРИАЛЫ И МЕТОДЫ. Ретроспективное наблюдательное исследование 49 пациентов с диагнозом «Первичный гиперпаратиреоз». Всем проведено комплексное лабораторно-инструментальное и молекулярно-генетическое исследование в Институте детской эндокринологии ФГБУ «НМИЦ эндокринологии» Минздрава России в период 2014–2022 гг.
РЕЗУЛЬТАТЫ. Первые клинические симптомы ПГПТ отмечались в возрасте 13,8 года [10,6; 15,2], среди которых наиболее часто встречались утомляемость, головные боли, диспепсия, боли в нижних конечностях, переломы. Возраст постановки диагноза составил 15,81 года [13,1; 16,8], у всех детей выявлен высокий уровень ПТГ, общего и ионизированного кальция, при этом гипофосфатемия была у 93,9% пациентов (n=46), гиперкальциурия у 43% (n=21). У 5 из 49 пациентов (10,2%) выявлена эктопия ОЩЖ: 3 пациента — интратиреоидное расположение ОЩЖ и 2 пациента — эктопия в средостении. При проведении молекулярно-генетического исследования патогенные варианты выявлены у 32,7% пациентов (n=16, ДИ (21; 47)), наиболее часто встречались мутации в гене MEN1 (n=11). У 3 пациентов выявлены патогенные варианты в гене CDC73, в 2 случаях — в гене RET. Прооперировано 39 пациентов, аденома ОЩЖ выявлена в 84,6% случаев (n=33), гиперплазия — в 7,7% (n=3), атипическая аденома — в 5,1% (n=2), карцинома — в 5,1% случаев (n=2).
ЗАКЛЮЧЕНИЕ. В работе представлены особенности течения и результаты молекулярно-генетического исследования ПГПТ у детей. Данная выборка является самой крупной среди опубликованных в Российской Федерации.
ОБОСНОВАНИЕ. Х-сцепленная адренолейкодистрофия (Х-АЛД) — тяжелое нейродегенеративное заболевание, встречается с частотой 1:17000 новорожденных мальчиков. Надпочечниковая недостаточность (НН), входящая в структуру Х-АЛД и встречающаяся у 70–80% пациентов, является жизнеугрожающим состоянием без своевременно назначенного лечения. Прогрессирующий характер адренолейкодистрофии, возможность присоединения НН в течение всего периода заболевания, отсутствие предиктивного фактора развития эндокринных нарушений диктует необходимость всестороннего изучения надпочечниковой недостаточности при данном заболевании.
ЦЕЛЬ. Изучить особенности диагностики и лечения надпочечниковой недостаточности при Х-АЛД.
МАТЕРИАЛЫ И МЕТОДЫ. Ретроспективное наблюдательное сравнительное исследование диагностики и течения заболевания проведено у 66 пациентов мужского пола с генетически подтвержденным диагнозом «Х-сцепленная адренолейкодистрофия» и имевших надпочечниковую недостаточность как компонент Х-АЛД, находившихся на обследовании и лечении в Институте детской эндокринологии ФГБУ «НМИЦ эндокринологии» Минздрава России, МГНЦ им. акад. Н.П. Бочкова, РДКБ ФГАОУ ВО «РНИМУ им. Н.И. Пирогова» в 2010–2022 гг.
РЕЗУЛЬТАТЫ. Медиана возраста манифестации Х-АЛД составила 6,6 года [4,7; 11,1]. Самый ранний возраст установления диагноза НН — 1,5 года на доклинической стадии и 1 год 8 месяцев с клиническими проявлениями. Наследственный анамнез отягощен у 39,4% пациентов, у 15,1% (10/66 пациентов) заболевание установлено на доклинической стадии. У 59,1% (n=66) установлена церебральная форма заболевания (цАЛД), у 16,6% адреномиелонейропатия (АМН), у 24,2% изолированная надпочечниковая недостаточность (ИНН). Возраст установления НН в группе пациентов с АМН (15,6 года) статистически значимо отличался от установления НН у пациентов с цАЛД (7,4 года, р=0,001) и ИНН (5,6 года, р=0,000). Уровень ренина исследован у 22,7% при манифестации НН (15/66 пациентов), дефицит минералкортикоидов был установлен у 7 человек. Минералокортикоидную терапию назначали одновременно с глюкокортикоидной у пациентов с цАЛД, у пациентов с АМН и ИНН добавляли к терапии через 11 и 7 месяцев соответственно (различия между пациентами в группах с АМН и ИНН статистически не значимы). Комбинированную заместительную терапию получает 41% пациентов с цАЛД, 54,5% пациентов с АМН, 60% пациентов с ИНН.
ЗАКЛЮЧЕНИЕ. Все пациенты с установленным диагнозом Х-АЛД должны находиться под наблюдением эндокринолога на протяжении всей жизни для своевременной диагностики надпочечниковой недостаточности. Важно оценивать уровень ренина при манифестации НН и при динамическом наблюдении для диагностики минералокортикоидной недостаточности и назначения терапии.
Для исключения Х-АЛД необходимо обследовать всех пациентов мужского пола с надпочечниковой недостаточностью независимо от возраста манифестации.
Необходимо тщательное обследование родственников пациентов для выявления Х-АЛД на доклиническом этапе.
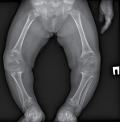
Задержка роста более 2 SD ниже среднего популяционного или предполагаемого семейного целевого роста классифицируется как низкорослость и может быть клиническим проявлением большого числа заболеваний. Использование в последние годы новейших методик молекулярно-генетического анализа позволило лучше понять патогенез наследственных форм низкорослости. Одними из недавно открытых механизмов развития данной патологии являются гетерозиготные патогенные варианты в гене RPL13, ассоциированные со спондилоэпиметафизарной дисплазией (СЭД) тип Исидора-Туте. Характерными фенотипическими особенностями для данной формы являются нормальные показатели роста при рождении, выраженная постнатальная задержка роста, платиспондилия, эпифизарные дефекты проксимального отдела бедренной кости, coxa vara, genu varum. В настоящем исследовании представлены клинико-рентгенологические характеристики первого в Российской Федерации пациента со СЭД, вызванной мутацией в гене RPL13.
Репродуктивная эндокринология
ОБОСНОВАНИЕ. Предполагается, что наличие хронического иммуновоспалительного ревматического заболевания (ИВРЗ) может быть фактором, увеличивающим вероятность развития синдрома гипогонадизма, и наоборот — наличие некомпенсированного дефицита тестостерона может предрасполагать к большему риску развития или более тяжелому течению ИВРЗ.
ЦЕЛЬ. Изучить частоту гипогонадизма у мужчин с ревматоидным артритом (РА) и оценить его влияние на течение РА и сопутствующие заболевания.
МАТЕРИАЛЫ И МЕТОДЫ. В одномоментное сплошное исследование включено 170 мужчин с РА, находившихся на стационарном лечении в ФГБНУ НИИР им. В.А. Насоновой. Пациентам выполнено определение уровня общего тестостерона с последующим разделением на подгруппы с нормальным (>12 нмоль/л) и сниженным его уровнем. Проведено межгрупповое сравнение по основным показателям, используемым в клинической ревматологической практике для оценки стадии, активности и других медико-демографических характеристик РА, а также по состоянию пуринового и углеводного обменов. Был выполнен корреляционный анализ между уровнем общего тестостерона и некоторыми клинико-лабораторными показателями.
РЕЗУЛЬТАТЫ. Частота выявленного дефицита тестостерона в исследуемой группе составила 24,1%. Были отмечены значимые корреляционные связи между уровнем общего тестостерона и индексом массы тела (ИМТ) (r=-0,29), уровнем мочевой кислоты крови (r=-0,19) и С-реактивного белка (r=-0,18). Пациенты с гипогонадизмом по сравнению с группой с нормальным уровнем тестостерона характеризовались более высокими индексом массы тела (29,3±5,6 vs 26,3±4,0 кг/м2; p<0,001), уровнем глюкозы (6,95±7,85 ммоль/л vs 5,42±1,13 ммоль/л; p=0,034) и мочевой кислоты (354,6±110,7 vs 317,5±84,8 мкмоль/л; p=0,03) крови. Кроме того, пациенты с гипогонадизмом чаще страдали ожирением (41,6% vs 15,7%; p=0,001) и сахарным диабетом (21,6% vs 10,2%; p=0,075) без статистически значимой разницы, а также имели более высокий показатель СОЭ (46,5±42,2 vs 31,0±30,9 мм/ч; p=0,012). Отмечена более частая встречаемость анемии при гипогонадизме (32,4% vs 16,7%; p=0,041).
ЗАКЛЮЧЕНИЕ. Уровень тестостерона и наличие гипогонадизма не были связаны со стадией и активностью РА, однако дефицит тестостерона сопровождался более частым развитием избыточной массы тела и ожирения, и ухудшением пуринового и углеводного обменов.

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).
ISSN 2308-1430 (Online)











































.jpg)


